果胶酶是指能够将复合果胶降解为半乳糖醛酸分子的酶复合体,其中聚半乳糖醛酸酶(polygalacturonase,PG)、果胶酯酶(pectin esterase,PE)和果胶裂解酶(pectin lyase,PL)是果胶酶重要的组成部分[1-3],该酶在细菌、真菌和植物细胞中分布广泛。目前,果胶酶在棉纤维纺织加工和生物洗涤[4]、植物纤维沤麻[5]、废水处理[6]、油脂提取[7]等工业过程中均得到了广泛的应用[8]。在食品领域,果胶酶也是一种重要的功能性酶制剂,其在咖啡和茶叶发酵、果汁澄清[9]及产量提升等方面均有应用。果胶酶主要采用微生物发酵的方式进行生产,微生物法生产果胶酶是一种颇具潜力且高效的途径,尤其是霉菌中的曲霉属、青霉属均是果胶酶的主要生产菌种。
根据酶活作用温度的差异性,微生物产生的果胶酶可大致分为常温果胶酶(30~40 ℃)、低温果胶酶(10~30 ℃)、耐高温果胶酶(40~60 ℃)。近期的研究表明,从黑曲霉[10-12]、疣孢青霉[13]、囊酵母[14]、芽孢杆菌[15-17]、尖孢镰刀菌[18]等微生物中发酵提取得到的多数为常温果胶酶,而对于低温、耐高温果胶酶方面的研究则较少。在酱香型白酒酿造体系中,酱香型白酒高温大曲的发酵温度最高可达65 ℃,使得大曲中富集了多种嗜热微生物,这些高温微生物会在大曲发酵阶段代谢产生大量以淀粉酶、蛋白酶、纤维素酶、果胶酶为代表的耐热性水解酶系,从而有效促进大分子原料的降解[19-20],因此以酱香大曲中具有嗜热特性的菌株为目标,针对性的开展耐高温果胶酶资源的开发不失为一种有效的策略。吕秀红[21]从果树下的土壤中筛选出一株产果胶酶的芽孢杆菌ZJ1407,并对其培养条件进行优化后,其所产果胶酶酶活为737.61 U/mL,最适温度为55 ℃。ZHANG G等[22]从雪茄包装纸中分离出芽孢杆菌CAS-MEI-2-33,对该菌产果胶酶的培养基和发酵条件进行了优化后果胶酶活性为1 370 U/mL,最适温度为40 ℃;GUPTA S等[23]通过响应面优化枯草芽孢杆菌产果胶酶的发酵培养基,其果胶酶产量提高了2倍,最适反应温度为35 ℃。刘连成等[24]从高温堆肥中分离到一株高产碱性果胶酶的菌株芽孢杆菌DS-3,该菌株所产碱性果胶酶的适宜温度范围为60~70 ℃,并具有较高的耐热性。
本研究以酱香型白酒高温大曲为对象,筛选出产耐高温果胶酶菌株,结合菌落形态学观察、生理生化试验及分子生物学技术对其进行鉴定,并进行产酶条件优化及酶学性质研究。旨在为耐高温果胶酶的进一步开发应用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 高温大曲来源
酱香型白酒高温大曲:贵州某酒厂。本研究所用酱香型白酒高温大曲是取粉碎混匀后待投料的陈曲粉(高温制曲后,经6个月的存储),并于4 ℃条件下保存待用[25]。
1.1.2 化学试剂
桔皮粉、柚子皮粉、葡萄皮粉、橙子皮粉:市售桔子、柚子、葡萄、橙子分别剥皮后烘干并粉碎,随后过40目筛;果胶:阿拉丁试剂(上海)有限公司;D-半乳糖醛酸、制霉菌素、新生霉素、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS):北京索莱宝科技有限公司;其余试剂均为国产分析纯。
1.1.3 培养基
菌株分离培养基[26]:果胶10 g/L,蛋白胨1.5 g/L,磷酸氢二钾4 g/L,磷酸二氢钾2 g/L,硫酸铵4 g/L,七水合硫酸镁0.5 g/L,琼脂20 g/L,新生霉素0.02 g/L,制霉菌素0.02 g/L,121 ℃灭菌20 min备用。
菌株纯化培养基[26]:果胶10 g/L,葡萄糖3 g/L,蛋白胨1.5 g/L,硫酸铵4 g/L,酵母膏2 g/L,磷酸氢二钾4 g/L,磷酸二氢钾2 g/L,七水合硫酸镁0.5 g/L,琼脂20 g/L,121 ℃灭菌20 min备用。
果胶刚果红培养基[26]:果胶10 g/L,刚果红0.2 g/L,蛋白胨1.5 g/L,磷酸氢二钾4 g/L,磷酸二氢钾2 g/L,硫酸铵4 g/L,七水合硫酸镁0.5 g/L,琼脂20 g/L,121 ℃灭菌20 min备用。
菌株活化培养基[25]:采用国际链霉菌计划(international streptomyces project,ISP)2培养基:青岛高科技工业园海博生物技术有限公司。
种子液培养基[27]:葡萄糖10 g/L,蛋白胨4 g/L,酵母膏4 g/L,酵母浸粉4 g/L,磷酸氢二钾4 g/L,磷酸二氢钾2 g/L,七水合硫酸镁0.5 g/L,121 ℃灭菌20 min备用。
产酶培养基[26]:果胶10 g/L,桔皮粉5 g/L,葡萄糖10 g/L,蛋白胨4 g/L,磷酸氢二钾4 g/L,磷酸二氢钾2 g/L,七水合硫酸镁0.5 g/L,121 ℃灭菌20 min备用。
1.2 仪器与设备
VLBL00D1酶标仪:赛默飞世尔科技公司;MF4显微分析、菌落计算筛选、抑菌圈联用仪:杭州讯数科技有限公司;CJ-20超净工作台、DY-200B恒温摇床、SPX-250BⅢ生化培养箱、DK-98-Ⅱ电热恒温水浴锅:天津市泰斯特仪器有限公司;LDZX-30KBS立式高压蒸汽灭菌锅、101-2A电热鼓风干燥箱、JE502电子天平:上海沪春计量仪器有限公司;2720 thermal cycler聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:美国Applied Biosystems公司;FR980凝胶成像仪:上海复日科技仪器有限公司。
1.3 实验方法
1.3.1 产果胶酶菌株的分离筛选
初筛[26]:称取10 g酱香型白酒高温大曲粉于90 mL无菌生理盐水中,振荡均匀后得到菌悬液视为10-1浓度,分别吸取1 mL菌悬液以10倍为稀释单位进行稀释,逐次稀释到10-2、10-3、10-4、10-5倍,并从不同稀释倍数的菌悬液中各取0.2 mL涂布接种于分离筛选培养皿上,各做3个平行,于45 ℃恒温培养箱中倒置培养进行高温放线菌菌株的分离筛选;待筛选平板上长出单菌落后,根据《伯杰氏细菌鉴定手册》[28]中对高温放线菌特征的描述,挑取目标菌落使用纯化培养基上进行三区划线分离直至得到单一菌落,通过形态特征观察去除重复菌株。
复筛[29]:采用平板透明圈法,将初筛得到的产果胶酶菌株活化,接种于灭菌处理后的果胶刚果红培养基中,45 ℃培养3 d,以游标卡尺分别测量菌落直径(d)和透明圈直径(D),计算D/d值,筛选D/d值大的菌株。
菌株保藏[25]:将筛选菌株接种于ISP2培养基斜面保藏培养基上,于4 ℃条件下进行菌种保藏,用于短期内所进行的相关研究工作。
1.3.2 产果胶酶菌株的鉴定
将分离出的产果胶酶菌株分别接种于ISP2培养基上,于45 ℃恒温培养箱中培养5 d后分别从菌落形状、基内菌丝、气生菌丝颜色及可溶性色素产生情况等方面观察并记录结果,并结合《伯杰氏细菌鉴定手册》完成菌株的形态学鉴定。对分离筛选菌株设计明胶液化、碳源利用、牛奶凝固与胨化、淀粉水解、硝酸盐还原等生理生化实验[28]。
通过细菌基因组提取试剂盒提取目标菌株基因组脱氧核糖核酸(deoxyribonucleic acid,DNA),具体操作步骤参见试剂盒说明书。同时分别采用细菌16S rDNA正向引物Primer A(5'-AGAGTTTGATCCTGGCTCAG-3')和反向引物Primer B(5'-AAGGAGGTGATCCAGCCGCA-3')进行扩增。PCR扩增体系(25 μL):2 μL DNA模板,12.5 μL PCR Mix预混液,上下游引物各1 μL,ddH2O 8.5 μL;PCR扩增条件为:95 ℃预变性5 min,95 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,共30个循环;最终72 ℃修复延伸10 min。纯化后的菌株基因组DNA采用0.8%的琼脂糖电泳后在凝胶成像仪上对DNA提取效果进行检测;扩增产物检测后送由生工生物工程(上海)股份有限公司完成测序。测序结果运用美国国家生物技术信息中心(national center for biotechnology information,NCBI)数据库基本局部比对搜索工具(basic local alignment search tool,BLAST)(http://www.ncbi.nlm.nih.gov/blast)进行序列比对,选取序列比对结果相似度较高、同源性较高的典型菌株的16S rDNA基因序列为参比,利用MEGA7.0软件进行多序列比对,选用邻接(neighbor-joining,NJ)法构建筛选菌株的系统发育树,确定筛选菌株的分类学地位。
1.3.3 产果胶酶菌株生长温度范围以及最适生长温度
将分离筛选的产果胶酶菌株于45 ℃、150 r/min条件下扩培36 h后,得到种子培养液,点种于ISP2培养基上,分别置于30 ℃、37 ℃、45 ℃、50 ℃、55 ℃、60 ℃温度条件下培养48 h后,通过观察形成菌落的生长状况,确定产果胶酶菌株生长温度范围以及最适生长温度[28]。
1.3.4 果胶酶酶活力测定
将分离筛选的产果胶酶菌株于45 ℃、150 r/min条件下扩培36 h后,得到种子培养液,按3%的接种量将种子液接种于发酵培养基中发酵36 h得到发酵液,在将发酵液用0.45 μL的过滤膜进行过滤后得到粗酶液[26]。
采用DNS法[26]对粗酶液中果胶酶的酶活力进行测定。果胶酶活力的定义[26]:在50 ℃,pH 5.0反应条件下,1 mL酶液每分钟水解果胶底物生成1 μg半乳糖醛酸的能力定义为1个酶活力单位(U/mL)。
1.3.5 产酶条件的优化
初始发酵培养基:果胶10 g/L,磷酸氢二钾4 g/L,磷酸二氢钾2 g/L,七水合硫酸镁0.5 g/L,初始发酵条件:45 ℃、180 r/min,接种量6%,装液量50 mL/250 mL。
发酵时间的确定:分别在45 ℃、180 r/min条件下培养72 h,分别于12 h、18 h、24 h、30 h、36 h、42 h、48 h、54 h、60 h、66 h、72 h,以果胶酶酶活力为评价指标,考察不同发酵时间对菌株发酵产果胶酶的影响,每组3个平行。
发酵温度的确定:调整发酵温度分别为35 ℃、40 ℃、45 ℃、50 ℃、55 ℃、60 ℃,以果胶酶酶活力为评价指标,考察不同发酵温度对菌株发酵产果胶酶的影响,每组3个平行。
装液量的确定:分别调整发酵培养基的装液量为30 mL/250 mL、40 mL/250 mL、50 mL/250 mL、60 mL/250 mL、70 mL/250 mL,以果胶酶酶活力为评价指标,考察不同装液量对菌株发酵产果胶酶的影响,每组3个平行。
接种量的确定:分别调整接种量为2.5%、5.0%、7.5%、10.0%、12.5%,以果胶酶酶活力为评价指标,考察不同的接种量对菌株发酵产果胶酶的影响,每组3个平行。
氮源及最佳氮源添加量的确定:分别添加1%的乙酸铵、硫酸铵、氯化铵、酵母粉、蛋白胨、牛肉膏作为唯一氮源,以果胶酶酶活力为评价指标,分别确定最佳有机氮源与无机氮源。以0.5%、1.0%、1.5%、2.0%、2.5%添加量的最佳有机氮源与无机氮源进行试验,分别确定最佳有机氮源及无机氮源的添加量,每组3个平行。
碳源及最佳碳源添加量的确定:在初始产酶培养基中分别添加1%的蔗糖、可溶性淀粉、麦芽糖、葡萄糖、糊精为唯一碳源,同样培养条件下,以果胶酶酶活力为评价指标,确定最佳碳源。以6%、7%、8%、9%、10%添加量的最佳碳源进行发酵产酶试验,确定最佳碳源的添加量,每组3个平行。
1.3.6 菌株产果胶酶酶学性质
(1)粗提酶的制备
取最佳发酵产酶条件下的菌株发酵液,8 000 r/min离心20 min后,取上清液。将20%饱和(NH4)2SO4溶液按1∶1比例加入上清液中,搅拌均匀后于4 ℃静置24 h,8 000 r/min离心30 min,取上清液,再将80%饱和(NH4)2SO4溶液按1∶1比例加入上清液中,搅拌均匀后在4 ℃条件下静置24 h,8 000 r/min离心30 min,倒掉上清液,低温干燥至恒质量,取出粉碎,过100目筛后即得果胶酶粗酶粉。
(2)不同温度对果胶粗酶的影响
称取果胶酶粗酶粉1.0g,复溶于100mLpH为7.4Tris-HCl溶液中,分别在40 ℃、50 ℃、60 ℃、70 ℃、80 ℃条件下水浴30 min后测其酶活,以最适反应温度下的酶活值定义为100%,计算相对酶活,每组3个平行,确定粗酶的最适反应温度。
(3)不同pH对果胶粗酶的影响
用0.1 mol/L的HCl溶液将Tris-HCl溶液调至pH 3、4、5、6、7,再称取粗酶粉1.0 g复溶于100 mL不同pH的Tris-HCl溶液中,于酶最适温度下水浴30 min后测其酶活值,以最适反应pH下的酶活值定义为100%,计算相对酶活,每组3个平行,确定粗酶的最适反应pH。
(4)果胶酶的热稳定性
称取果胶酶粗酶粉1.0 g,复溶于100 mL上述最适pH的Tris-HCl溶液中,于40 ℃、45 ℃、50 ℃、55 ℃、60 ℃、65 ℃、70 ℃下水浴2 h,每隔30 min取样并测定其酶活,以水浴0 min时的酶活值定义为100%,计算相对酶活,每组3个平行,探究其热稳定性。
(5)金属离子对果胶酶的影响
配制10 mg/mL果胶酶的Tris-HCl溶液,分别添加不同金属离子(Na+、Fe2+、Fe3+、Mg2+、Zn2+、K+、Ca2+、Mn2+)于该溶液中,使其浓度为2 mmol/L,测定其酶活,每组3个平行。
(6)酶促反应动力学方程
分别称取0.2 g、0.4 g、0.6 g、0.8 g、1.0 g果胶,溶于100 mL蒸馏水中,得到反应底物质量浓度为2 mg/mL、4 mg/mL、6 mg/mL、8 mg/mL、10 mg/mL,以DNS法测定酶促反应所产生还原糖的量来计算酶促反应初速度,根据Lineweaver-Burk双倒数作图法计算该粗提酶分解果胶底物的米氏常数(Km)和最大反应速度(Vmax)。
1.3.7 数据处理
每组实验重复测定3次,利用MEGA7.0软件绘制菌株FBKL4.013的系统发育树,单因素方差分析采用SPSS Statistics25软件,使用Origin 2017软件进行制图。
2 结果与分析
2.1 产果胶酶菌种的筛选
由表1可知,用平板透明圈法,从酱香型白酒高温大曲中共筛选出8株透明圈较明显的菌株(编号为FBKL4.013(X-13)、X-03、X-04、X-05、X-06、X-12、X-16、X-18),其中菌株FBKL4.013的D/d值最大为3.26,表明该菌株可能具有良好的产果胶酶的能力。因此,选择菌株FBKL4.013为目标开展后续的实验。
表1 筛选菌株的菌落和透明圈直径测定结果
Table 1 Determination results of colony and transparent circle diameters of screened strains

2.2 菌株FBKL4.013的鉴定
2.2.1 形态特征观察
菌株FKBL4.013扫描电镜观察结果见图1。由图1A可知,菌株FKBL4.013菌落中间隆起、有较多褶皱,呈白色、菊花状。由图1B可知,菌丝体两侧着生有圆球形的分生孢子,其中有分支的孢子梗长度较短,菌丝体呈细长棒状,以成串孢子为特征,分生孢子接着于菌丝体上,紧密的分布在菌丝体两侧上。
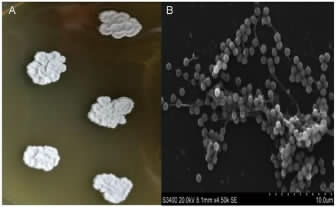
图1 菌株FBKL 4.013菌落(A)及细胞(B)形态
Fig.1 Colonies (A) and cell (B) morphologies of strain FBKL 4.013
2.2.2 生理生化实验
菌株FBKL4.013生理生化实验结果见表2。
表2 菌株FBKL4.013生理生化实验结果
Table 2 Results of physiological and biochemical experiments of strain FBKL 4.013
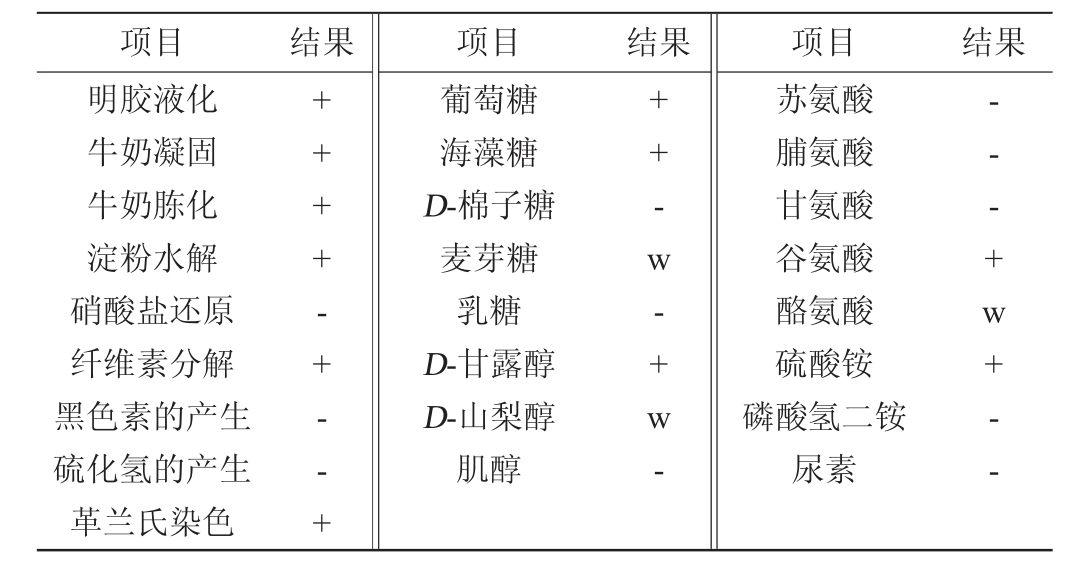
注:“+”表示反应结果呈阳性;“-”表示反应结果呈阴性;“w”表示反应结果呈弱阳性。
由表2可知,菌株FBKL4.013为革兰氏阳性菌,可以液化明胶,使牛奶凝固及胨化;还能利用多种碳源,如淀粉、纤维素、葡萄糖、海藻糖、D-甘露醇等,但不能利用乳糖和D-棉子糖,这表明该菌株具有广泛的可发酵碳水化合物来源,有较强的碳源适应性;同时,菌株FBKL4.013能够利用的氮源有硫酸铵、谷氨酸、酪氨酸等。
2.2.3 分子生物学鉴定
利用MEGA7.0软件基于16S rDNA基因序列构建系统发育树,结果见图2。由图2可知,菌株FBKL4.013与高温放线糖莱斯菌(Laceyella sacchari)EU430566聚类在同一分支上,结合菌株FBKL4.013形态学观察、生理生化实验和分子生物学鉴定结果,鉴定菌株FBKL4.013为高温放线糖莱斯菌(Laceyella sacchari)。
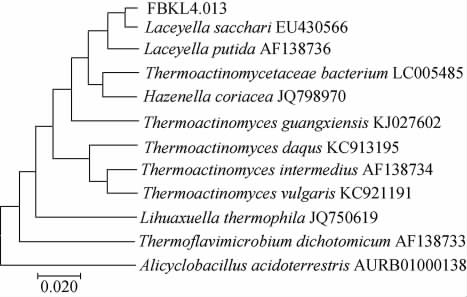
图2 菌株FBKL4.013基于16S rDNA基因序列的系统发育树
Fig.2 Phylogenetic tree of strain FBKL4.013 based on16S rDNA gene sequence
2.3 菌株FBKL4.013生长温度范围
菌株FBKL4.013在不同温度下的生长状况见表3。由表3可知,该菌株在50 ℃条件下生长最旺盛,在30 ℃条件下不生长,在37 ℃条件下生长缓慢,在45 ℃、55条件下正常生长,在50 ℃条件下生长良好,在60 ℃的高温条件下仍能进行缓慢生长。表明菌株FBKL4.013能够适应高温环境。
表3 菌株FBKL4.013生长温度范围
Table 3 Growth temperature range of strain FBKL4.013
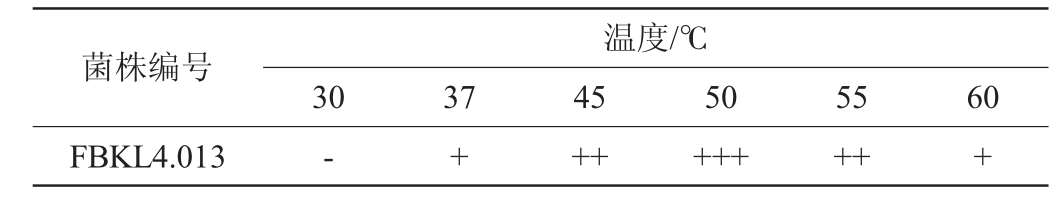
注:“+++”表示生长良好;“++”表示正常生长,“+”表示生长缓慢;“-”表示不生长。
2.4 菌株产酶条件优化
2.4.1 培养时间的影响
不同培养时间对菌株FBKL4.013产果胶酶活的影响,结果见图3。由图3可知,当培养时间在6~54 h范围内增加,果胶酶酶活随之增高;当培养时间为54 h时,果胶酶酶活最大,为2 565.43 U/mL;当培养时间>54 h之后,果胶酶酶活随之下降。因此,最适培养时间为54 h。
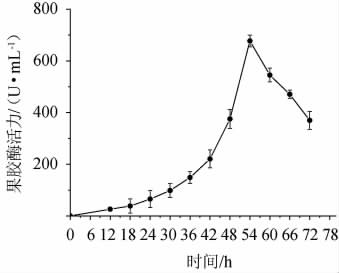
图3 培养时间对果胶酶活力的影响
Fig.3 Effects of culture time on pectinase activities
2.4.2 培养温度的影响
不同培养温度对菌株FBKL4.013产果胶酶活的影响,结果见图4。由图4可知,当培养温度在35~50 ℃范围内时,随着温度升高,酶活力呈上升趋势;当培养温度为50 ℃时,酶活最高,为1 623.37 U/mL;当培养温度>50 ℃之后,酶活值随温度升高而降低。因此,最适培养温度为50 ℃。
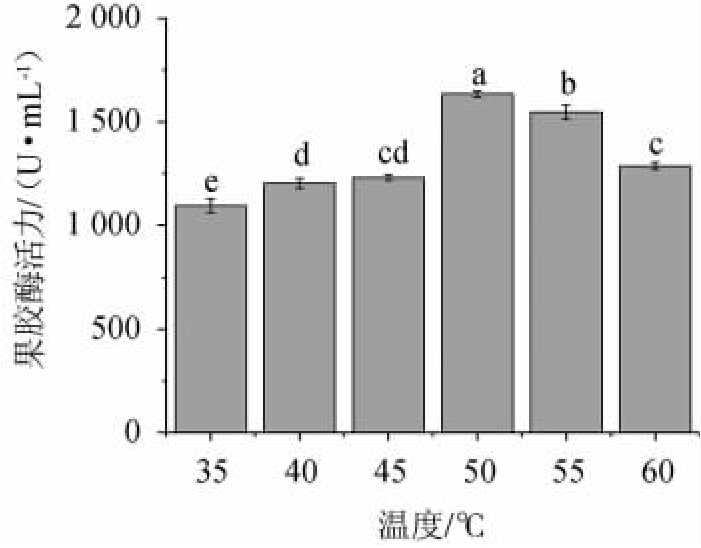
图4 培养温度对果胶酶活力的影响
Fig.4 Effects of culture temperature on pectinase activities
不同字母代表组间差异显著(P<0.05)。下同。
2.4.3 装液量的影响
不同装液量对菌株FBKL4.013产果胶酶活的影响,结果见图5。由图5可知,当装液量为30~40 mL/250 mL时,果胶酶活力随着装液量的增加而增高;当装液量为40 mL/250 mL时,酶活最高,为1 956.48 U/mL;当装液量>40 mL/250 mL之后,果胶酶活力随着装液量的增加而降低。因此,最适装液量为40 mL/250 mL。
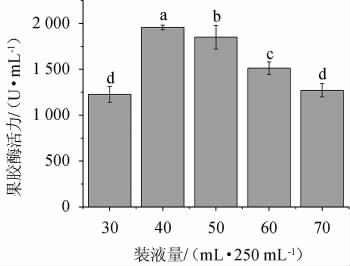
图5 装液量对果胶酶活力的影响
Fig.5 Effect of loading volume on pectinase activities
2.4.4 接种量的影响
不同接种量对菌株FBKL4.013产果胶酶活的影响,结果见图6。由图6可知,接种量为2.5%~10.0%时,果胶酶活力随接种量的增大而增大;当接种量为10.0%时,酶活最高为2 565.43 U/mL;当接种量>10.0%之后,果胶酶活力随接种量的增大而下降。因此,最适接种量为10.0%。
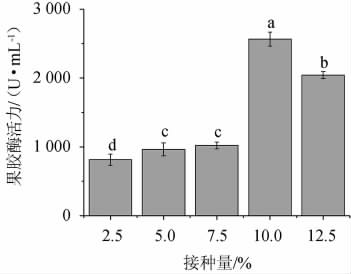
图6 接种量对果胶酶活力的影响
Fig.6 Effect of inoculum on pectinase activities
2.4.5 氮源及最佳氮源添加量的影响
分别考察添加量均为1%的乙酸铵、硫酸铵、氯化铵、酵母粉、蛋白胨、牛肉膏作为唯一氮源对菌株FBKL4.013产果胶酶活的影响,结果见图7A。由图7A可知,酵母粉和硫酸铵作为唯一氮源,菌株FBKL4.013产果胶酶活最大,分别为1 320.74 U/mL、1 298.79 U/mL。因此,选择酵母粉和硫酸铵为复合氮源。分别考察添加量为0.5%、1.0%、1.5%、2.0%、2.5%的酵母粉和硫酸铵对菌株FBKL4.013产果胶酶活的影响,结果见图7B和7C。由图7B和7C可知,酵母粉添加量为1.0%时,其果胶酶酶活最高,为1 429.70 U/mL,硫酸铵添加量为2.0%时,其果胶酶酶活最高,为1 586.55 U/mL。因此,最适酵母粉添加量为1.0%,最适硫酸铵添加量为2.0%。
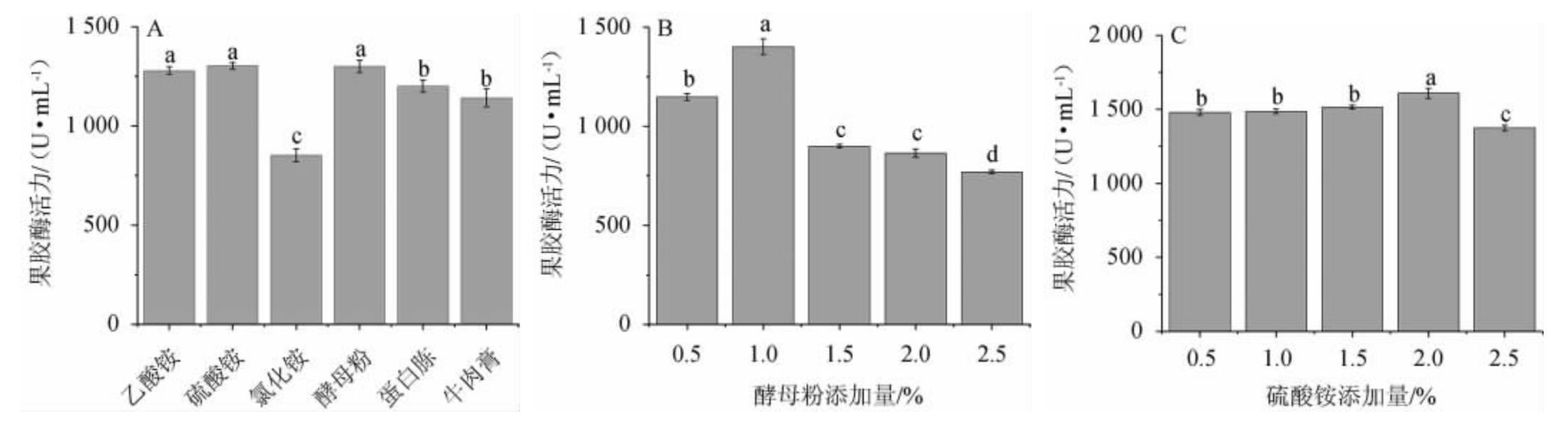
图7 氮源(A)及酵母粉(B)和硫酸铵(C)添加量对果胶酶活力的影响
Fig.7 Effect of nitrogen sources (A),yeast powder (B) and ammonium sulfate (C) addition on pectinase activities
2.4.6 碳源及最佳碳源添加量的影响
分别考察添加量均为1%的蔗糖、可溶性淀粉、麦芽糖、葡萄糖、糊精作为唯一碳源对菌株FBKL4.013产果胶酶活的影响,结果见图8A。由图8A可知,不同种类的碳源对菌株FBKL4.006产果胶酶的影响存在差异,可溶性淀粉、蔗糖、麦芽糖与葡萄糖均可提升菌体产酶活力,其中以可溶性淀粉最为明显,测定的果胶酶酶活为1 170.23 U/mL。选择可溶性淀粉为菌株FBKL4.006发酵产果胶酶的最优碳源。分别考察添加量为6%、7%、8%、9%、10%的可溶性淀粉作为碳源对菌株FBKL4.013产果胶酶活的影响,结果见图8B。由图8B可知,可溶性淀粉添加量为6%~8%时,果胶酶酶随之增高;可溶性淀粉添加量为8%时,其酶活值最高,为1 349.90 U/mL;果胶酶酶活>8%之后,果胶酶酶随之下降。因此,最适可溶性淀粉添加量为8%。
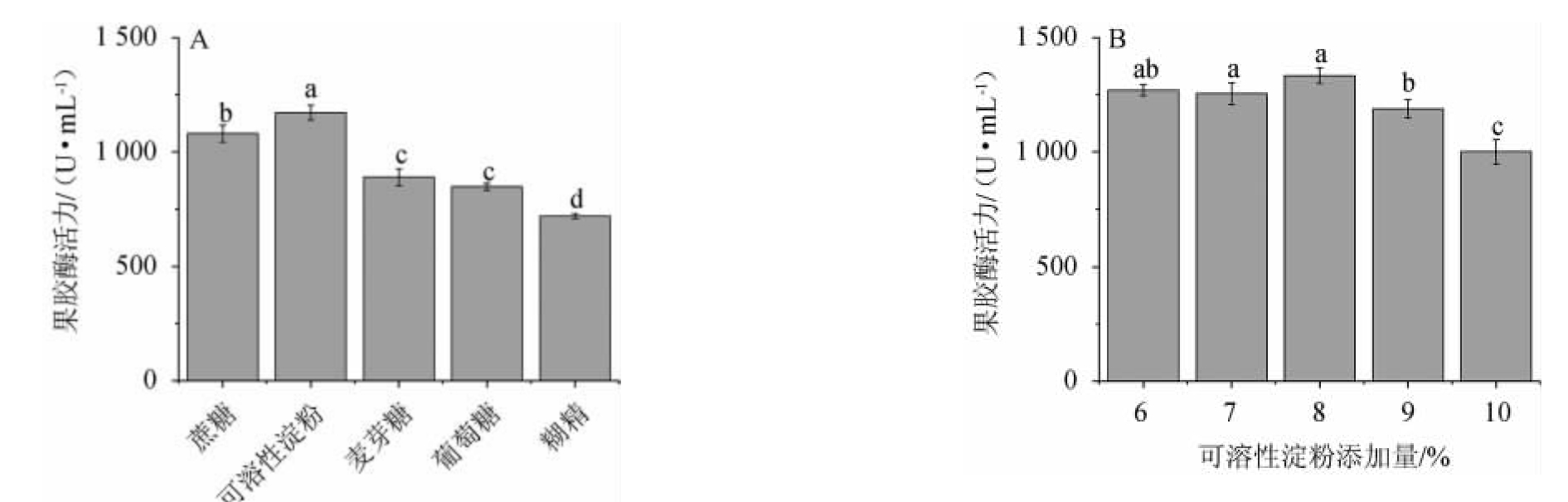
图8 碳源(A)及可溶性淀粉添加量(B)对果胶酶活力的影响
Fig.8 Effect of carbon sources (A) and soluble starch addition (B) on pectinase activities
2.5 果胶酶粗酶酶学性质
2.5.1 温度、pH、耐热性及金属离子对果胶酶酶活的影响
温度、pH及金属离子对果胶酶酶活的影响,结果见图9。由图9A可知,菌株FBKL4.013产果胶酶的相对酶活随温度在40~70 ℃范围内逐渐增高;在温度70 ℃时相对酶活最高,为100%;在温度高于70 ℃之后,相对酶活有所下降。因此,果胶酶最适温度为70 ℃。由图9B可知,菌株FBKL4.013产果胶酶的相对酶活随pH值在3~5范围内逐渐增高;在pH值为5时,相对酶活最高,为100%;在pH值>5之后,相对酶活有所下降。因此,果胶酶最适pH值为5。由图9C可知,菌株FBKL4.013产果胶酶的相对酶活在40 ℃、45 ℃、50 ℃、55 ℃、60 ℃、65 ℃、70 ℃条件下保温120 min后果胶酶的残留酶活分别为53.77%、52.45%、57.73%、55.46%、45.36%、31.36%、29.04%。结果表明,该果胶酶具有一定的耐热性。由图9D可知,Na+、Mg2+、Zn2+、K+对该果胶酶酶活具有促进作用,其中Na+的促进作用最明显,而Fe2+、Fe3+、Ca2+、Mn2+对果胶酶酶活均具有抑制作用,其中Fe2+抑制作用最明显。
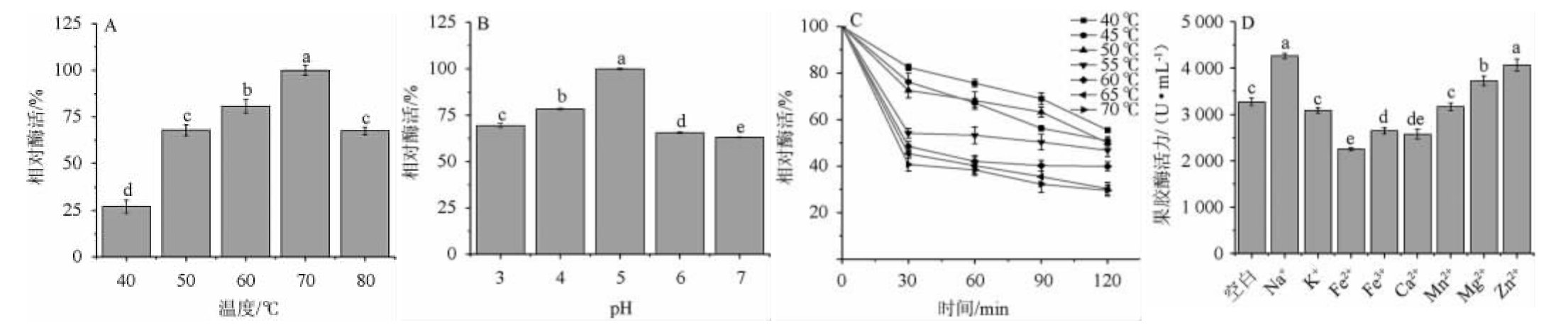
图9 温度(A),pH值(B),耐热性(C)及金属离子(D)对菌株FBKL4.013产果胶酶的影响
Fig.9 Effects of on temperature (A),pH (B),heat resistance (C) and metal ion (D) on pectinase activities produced by strain FBKL4.013
2.5.2 果胶酶酶促反应动力学方程的建立
根据Lineweaver-Burk双倒数作图法制作双倒数曲线见图10。由图10可知,得到果胶酶酶促反应动力学方程为:y=15.788 4x+1.8596,相关系数R2=0.998 4,说明曲线拟合良好,由该回归方程计算可得菌株所产果胶酶粗提酶的表观米氏常数(Km)、最大反应速率(Vm)分别为8.40 mg/mL、0.53 mg/(mL·h)。

图10 菌株FBKL4.013产果胶酶的Lineweaver-Burk曲线
Fig.10 Lineweaver-Burk curve of pectinase produced by strain FBKL4.013
3 结论
本研究筛选得到1株产耐高温果胶酶菌株FBKL4.013,经鉴定菌株FBKL4.013高温放线糖莱斯菌(Laceyella sacchari)。最佳产酶条件为培养温度50 ℃,培养时间54 h,装液量40 mL/250 mL,接种量10%,酵母粉和硫酸铵添加量分别为1.0%、2.0%,可溶性淀粉添加量为%。在此优化条件下,菌株FBKL4.013产果胶酶活力达到2 565.43 U/mL,比优化前提高了3.79倍。菌株FBKL4.013产果胶酶具有较好的耐高温特性,其酶动力学米氏常数(Km)和最大反应速度(Vm)值分别为8.40 mg/mL和0.53 mg/(mL·h)。
[1]URUNCUOGLU S,ALBA K,MORRIS G A,et al.Influence of cations,pH and dispersed phases on pectin emulsification properties[J].Curr Res Food Sci,2021,4(6):398-404.
[2]WIKIERA A,GRABACKA M,BYCZYNSKI L,et al.Enzymatically extracted apple pectin possesses antioxidant and antitumor activity[J].Molecules,2021,26(5):1434.
[3]LIN W,XU X,LV R,et al.Differential proteomics reveals main determinants for the improved pectinase activity in UV-mutagenized Aspergillus niger strain[J].Biotechnol Lett,2021,43(4):909-918.
[4]李浩,高楠.酶领生物洗涤未来——更清洁,更环保,更可持续的商业发展[J].中国洗涤用品工业,2021,5(2):49-55.
[5]黄静,郭运玲,孔华,等.碱性果胶酶对菠萝叶纤维脱胶工艺的影响[C]//中国热带作物学会2016年学术年会论文集.海口:中国热带农业科学院热带生物技术研究所,2016:3-7.
[6]王方园,盛贻林.果胶酶降解柑桔罐头生产废水中果胶的研究[J].工业水处理,2008,28(1):47-50.
[7]魏松丽,张丽霞,芦鑫,等.混料设计优化生物酶解提取花生油脂体复合酶配比[J].中国油脂,2019(3):25-29.
[8]REHMAN H U,NAWAZ M A,PERVEZ S,et al.Encapsulation of pectinase within polyacrylamide gel:characterization of its catalytic properties for continuous industrial uses[J].Heliyon,2020,6(8):e04578.
[9]GENGATHARAN A,DYKES G,CHOO W S.Betacyanins from Hylocereus polyrhizus:pectinase-assisted extraction and application as a natural food colourant in ice cream[J].J Food Sci Technol,2021,58(4): 1401-10.
[10]GOVINDARAJI P K,VUPPU S.Characterisation of pectin and optimization of pectinase enzyme from novel Streptomyces fumigatiscleroticus VIT-SP4 for drug delivery and concrete crack-healing applications: An eco-friendly approach[J].Saudi J Biol Sci,2020,27(12):3529-3540.
[11]HUSSEIN M A,EL-SAID A H M,YASSEIN A S.Mycobiota associated with strawberry fruits,their mycotoxin potential and pectinase activity[J].Mycology,2020,11(2):158-166.
[12]姜立春,杨彩萍,陈佩瑶,等.果胶降解菌的筛选、鉴定及发酵产酶条件优化[J].绵阳师范学院学报,2020,39(8):5-12.
[13]贺兆伟,奚家勤,李玉娥,等.产果胶酶疣孢青霉菌株TS63-9发酵条件优化及其在烟草中的应用[J].湖北农业科学,2017,56(4):86-90.
[14]平文祥,赵丹,宋刚,等.果胶酶产生菌HDYM-02发酵条件的研究[J].大庆师范学院学报,2010,30(3):115-118.
[15]ZHANG G,LI S,XU Y,et al.Production of alkaline pectinase: a case study investigating the use of tobacco stalk with the newly isolated strain Bacillus tequilensis CAS-MEI-2-33[J].BMC Biotechnol,2019,19(1):45.
[16]徐鹏,王大红,陈亚欣,等.一株大麻脱胶菌株的分离鉴定及其产果胶酶发酵培养基的优化[J].中国麻业科学,2019,41(3):122-129.
[17]白兰芳,高慧,刘明启,等.产果胶酶枯草芽孢杆菌的鉴定、发酵条件优化及产物酶学性质的研究[J].中国畜牧杂志,2011,47(19):63-68.
[18]尹乐斌,雷志明,孔彦卓,等.一株高产果胶酶的真菌分离鉴定及酶学特性[J].中国酿造,2017,36(2):93-97.
[19]GUO F,LI X,ZHAO J,et al.Optimizing culture conditions by statistical approach to enhance production of pectinase from Bacillus sp.Y1[J].Biomed Res Int,2019:8146948.
[20]吴翔,陈强,徐丽华,等.一株降解纤维素的高温放线菌的筛选及其产酶条件研究[J].农业环境科学学报,2007,26(B03):101-104.
[21]吕秀红.产耐热型酸性果胶酶菌株的筛选、发酵条件优化及酶学性质的研究[D].杭州:浙江工商大学,2016.
[22]ZHANG G,LI S,XU Y,et al.Production of alkaline pectinase:a case study investigating the use of tobacco stalk with the newly isolated strain Bacillus tequilensis CAS-MEI-2-33[J].Bmc Biotechnol,2019,19(1):45-51.
[23]GUPTA S,KAPOOR M,SHARMA K K,et al.Production and recovery of an alkaline exo-polygalacturonase from Bacillus subtilis RCK under solid-state fermentation using statistical approach[J].Bioresource Technol,2008,99(5):937-945.
[24]刘连成,陆正清.高温碱性果胶酶产生菌的筛选及部分酶学特性研究[J].食品工业科技,2010,31(10):235-238.
[25]李豆南,黄魏,王晓丹,等.酱香型大曲中高温放线菌的筛选及风味成分分析[J].食品科学,2018,39(6):171-176.
[26]杨斯超.产低温果胶酶酵母菌的筛选,产酶条件优化及酶学性质表征[D].长春:吉林大学,2019.
[27]李豆南,王晓丹,罗小叶,等.酱香大曲中链霉菌菌株FBKL4.005全基因组测序及序列分析[J].食品科学,2018,39(14):206-212.
[28]布坎南R E.伯杰氏细菌鉴定手册[M].北京:科学出版社,1984:1183-1207.
[29]蓝丽精.高产果胶酶菌株的筛选,发酵条件优化及其应用的研究[D].杭州:浙江师范大学,2012.