高级醇是指那些含有三个以上碳原子的一元醇类物质的总称,包括正丙醇、异丁醇、异戊醇等,大多微生物产高级醇的代谢途径主要有两条,即合成代谢途径和埃里希途径[1],高级醇也是酒精饮料中重要的香气成分和风味物质之一,适量的高级醇具有协调酒体风味的功能,但当酒体中高级醇过量时,会带来“杂醇油味”和苦味,饮用后会引起“上头”,“恶心”等不良反应[2-3]。所以严格控制高级醇的含量成了提升酒质的重要手段,目前控制高级醇的方法主要包括了工艺控制[4-5]、精馏分离[6-7]、材料吸附[8-9]、低产高级醇微生物的选育与改造等[10-11],相比于前几种方法,低产高级醇微生物的选育与改造具有能从源头解决酿造酒、蒸馏酒中高级醇含量过多的问题。
其中低产高级醇微生物的选育主要是针对酿造酒的种类进行定向选育,如刘学强等[12]以葡萄汁为培养基筛选出低产高级醇,适合葡萄酒酿造的酵母菌株。吴丹丽等[13]以蒸煮后的大米为培养基筛选出低产尿素和高级醇,适合黄酒酿造的酵母菌株。而低产高级醇微生物的改造主要是对高级醇产生过程中的上游基因进行敲除,如编码转氨酶的BAT基因,或者对下游基因进行过表达,如编码醇乙酰转移酶的ATF基因[14-15]。
由于异丁醇、异戊醇对酒体风味和品格的影响最为明显,而这两种成分在大部分高粱酒中均有含量过高的问题[16-17],所以通过筛选低产高级醇微生物的手段来控制酒体中的高级醇含量是必要的。本研究旨在于筛选以酿酒高粱为唯一原料、产酒性能不受影响且低产异丁醇、异戊醇的酵母菌株,为其后续在酿造领域的应用提供理论指导。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与菌株
酒醅及酿造用曲:湖北某酒厂;东北高粱:市售;酿酒酵母(Saccharomyces cerevisiae)DZ:安琪酵母有限公司。
1.1.2 试剂
乙醇、正丙醇、异丁醇、异戊醇、叔戊醇(均为色谱纯):上海麦克林生化科技有限公司;葡萄糖(分析纯)、蛋白胨、酵母浸粉(均为生化试剂)、正己酸、乳酸、乙酸(均为分析纯):国药集团化学试剂有限公司;热稳定α-淀粉酶(4万U/g)、糖化酶(10万U/g):上海源叶生物科技有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基:葡萄糖20.0 g、酵母浸粉10.0 g、蛋白胨20.0 g、水1 000 mL,pH自然,在固体培养基中加入2%琼脂,115 ℃灭菌20 min。
上层培养基:2,3,5-三苯基氯化四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)0.5 g,葡萄糖5 g,琼脂15 g,水1 000 mL,pH中性,115 ℃灭菌20 min。
高粱酶解培养基[18]:高粱粉与水按照料液比1∶4(g∶mL)混合、添加热稳定α-淀粉酶(12 U/g淀粉)90 ℃条件下糊化1 h、冷却至55 ℃添加糖化酶(150 U/g淀粉),55 ℃条件下糖化2 h,四层纱布过滤、8 000 r/min离心5 min收集上清,补水至1 000 mL,调整糖度为12°Bx,115 ℃灭菌20 min。
发酵培养基:糖度为15°Bx的高粱酶解培养基。
生长培养基:糖度为10°Bx的高粱酶解培养基。
1.2 仪器与设备
7820A气相色谱仪(gas chromatograph,GC)、7890B-5977B气相色谱-质谱联用仪(gas chromatography-mass spectrometer,GC-MS):美国安捷伦科技有限公司;TGL-16C台式离心机:上海安亭科学仪器厂;UV-1600PC紫外可见分光光度计:艾万拓威达优尔国际贸易(上海)有限公司;SBA-40D生物传感仪:济南研科仪器有限公司。
1.3 方法
1.3.1 酵母菌株的分离
准确称取10.0 g样品加入装有90 mL无菌水的锥形瓶中30 ℃振荡30 min,双层无菌纱布过滤,梯度稀释后取浓度为10-3菌悬液100 μL,在添加有氯霉素的YEPD平板中涂布,待长出酵母单菌落后采用平板划线法纯化至少两次,挑取一环在YEPD液体培养基中以30 ℃、180 r/min振荡培养24 h,保藏。
1.3.2 酵母菌株的初筛
(1)TTC实验预筛产乙醇菌株:将每一个YEPD平板平均分为6个区,吸取0.5 μL菌液点在固体平板中,30 ℃倒置培养2 d后,倒入TTC上层培养基使菌落完全被覆盖,30 ℃避光保存2~3 h,观察菌落颜色变化,选择颜色较深的菌株作为复筛的出发菌株。
(2)预筛菌株液态发酵实验:将对照菌株DZ和预筛菌株的三级种子按照5%接种量,分别接种到高粱酶解培养基,30 ℃、180 r/min培养12 h后改为静置培养,每隔12 h称质量1次,单次间隔质量损失小于0.2 g时认为发酵结束。发酵液在8 000 r/min条件下离心10 min取上清测定酒精度及高级醇含量。
1.3.3 低产高级醇高耐受性酵母的复筛
(1)耐受性实验:按照2%的接种量,接种至YEPD液体培养基中,设置各菌株的培养条件为:培养温度18 ℃、22 ℃、26 ℃、30 ℃、34 ℃、38 ℃、42 ℃;糖度5°Bx、10°Bx、15°Bx、20°Bx、25°Bx、30°Bx、35°Bx;乙醇体积分数1%、3%、5%、7%、9%、11%、13%;乳酸体积分数0、1%、2%、3%、4%、5%;乙酸体积分数0、1‰、2‰、3‰、4‰、5‰;己酸体积分数0、0.2‰、0.4‰、0.6‰、0.8‰、1.0‰条件下的生长情况,以OD600nm为评价指标,选出耐受性高,生长稳定的酵母菌株。
(2)挥发性代谢产物分析:分别培养耐受性试验得到的高耐受菌株种子液,采用血球计数板计数,而后接入发酵培养基中(装液量100 mL/250 mL锥形瓶),保证接种后细胞个数在106~107之间,30 ℃、180 r/min培养至稳定期,后以同样的温度静置培养4 d,参考文献[19]的方法,采取顶空-固相微萃取法提取挥发性风味化合物并采用气相色谱-质谱联用仪(gas chromatography-mass spectrometer,GC-MS)检测。
1.3.4 菌株生长曲线的测定
菌株活化后,接种2%到生长培养基中,在波长600 nm处,每隔2 h测定复筛菌株的OD600nm值,绘制菌株生长曲线。
1.3.5 分子生物学鉴定
将复筛得到的菌株送至华大基因科技有限公司进行18S rRNA基因测序,测序结果置于美国国家生物技术信息中心(national center for biotechnology information,NCBI)数据库中进行比对,选取模式菌株中同源性较高的基因序列,采用MEGA11.0构建系统发育树。
1.3.6 复筛菌株发酵特性研究
培养F11菌株种子液,按照5%接种量接至发酵培养基中,采取以下三种不同的培养方式进行培养,A:30 ℃静置培养,B:30 ℃、180 r/min振荡培养,C:30 ℃、180 r/min培养至稳定期后转入30 ℃静置培养,期间每8 h取一次样,离心后取上清检测高级醇、乙醇和葡萄糖含量,探究上述物质在发酵过程中的变化规律。
1.3.7 分析检测
(1)理化指标检测
还原糖的测定:采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法[20];乙醇、葡萄糖的测定:采用生物传感仪测定[21];酒精度的测定:采用蒸馏法[22]。
(2)高级醇的测定
顶空样品前处理:准确移取高粱汁发酵液上清8 mL于30 mL顶空瓶中,称取3 g氯化钠,加入磁子,封口,转速为400 r/min,60 ℃平衡10 min;吸附40 min。萃取完成后,取出萃取纤维插入进样口解吸1 min,进样口温度为260 ℃。
气相色谱分析条件CP-WAX57CB色谱柱(50 m×0.25 mm×0.20 μm),氢火焰离子化检测器,载气:高纯氮气(N2),进样口温度:220 ℃,分流比10∶1,升温程序:35 ℃保持3 min,以4 ℃/min升至60 ℃,再以6 ℃/min升至110 ℃保持1 min,20 ℃/min升至220 ℃保持5 min。进样量:0.1 μL。
1.3.8 数据处理
采用Excel 2016、GraphPad Prism 8软件进行数据处理分析,采用MEGA 11.0软件构建系统发育树。
2 结果与分析
2.1 酵母菌株的预筛选
TTC作为一种显色剂,可与乙醇反应并呈现红色,在本实验中,菌落红色越深则证明该酵母产乙醇能力越强[23]。从酿造用曲及酒醅中分离得到60株酵母菌株,TTC法预筛选结果见表1。结果表明,菌株G11、G12、F12等13株菌落颜色相对较深,选择这14株菌作为初筛出发菌株进行液态发酵,验证产乙醇及产高级醇能力。
表1 TTC法显色结果
Fig.1 Color rendering results by TTC method
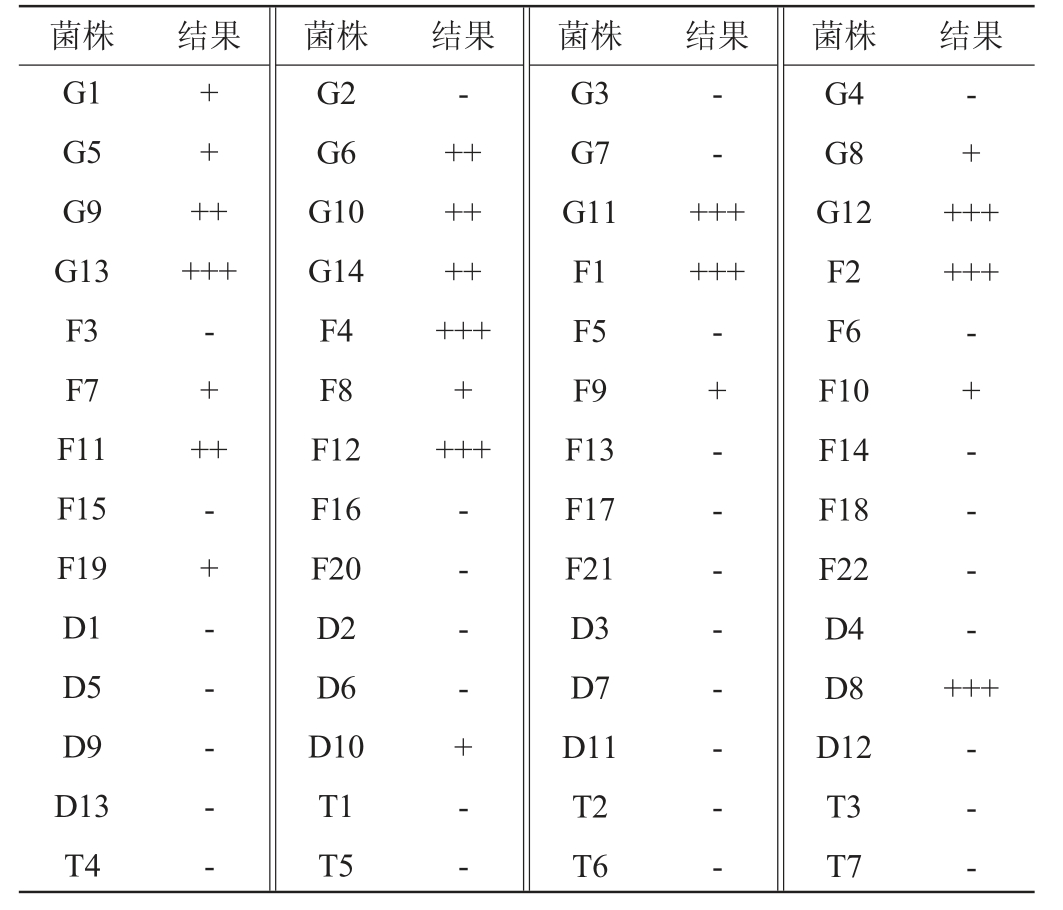
注:“-”表示显色结果不明显、“+”表示显色结果较明显、“++”表示显色结果明显、“+++”表示显色结果非常明显”。
2.2 低产高级醇酵母的筛选
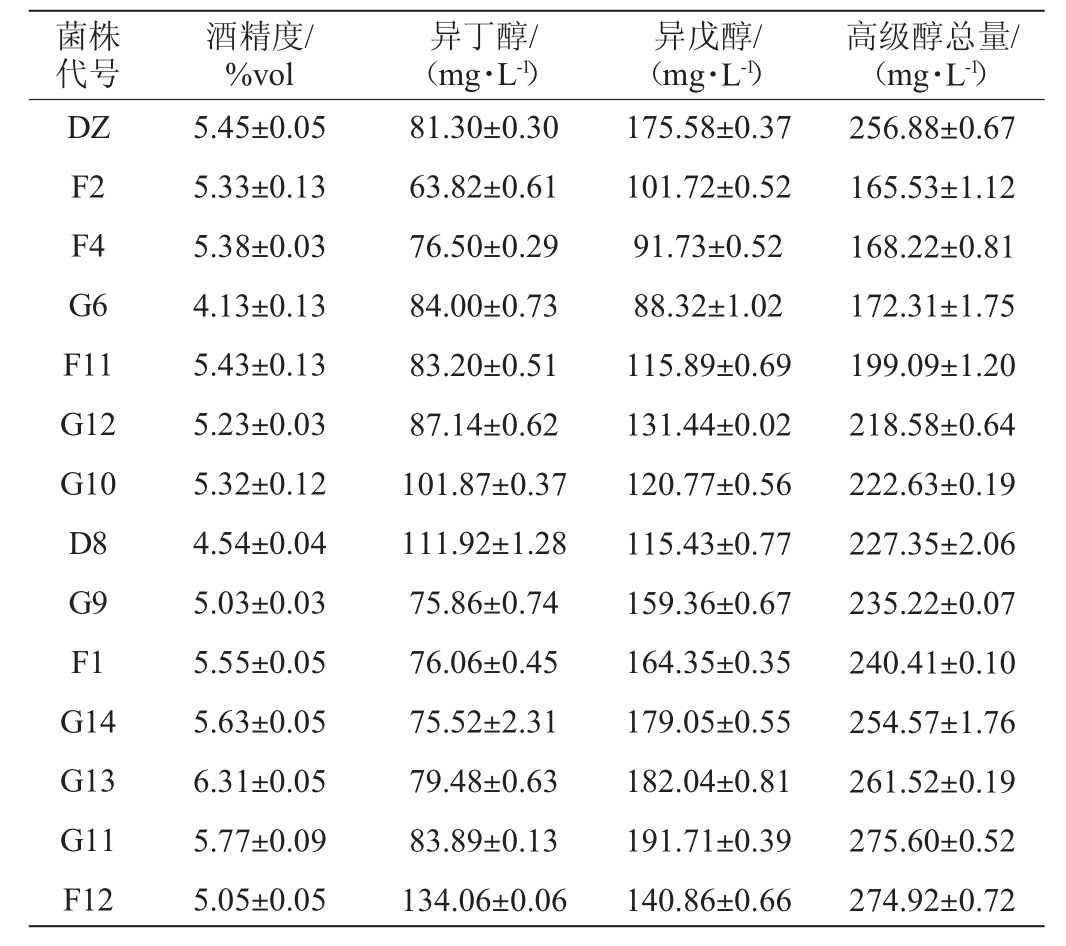
对预筛选得到的13株酵母菌株和对照菌株DZ分别进行液态发酵并测定各菌株发酵性能,结果见表2。由表2可知,菌株F2、F4、G6、F11的两种高级醇产量比对照菌株DZ分别低35.56%、34.51%、32.92%、22.50%,超过了20%,且明显低于其他菌株,后续选择这四株菌作为高耐受出发菌株。
表2 各菌株发酵过程主要参数
Table 2 Main parameters of fermentation process of each strain
2.3 高耐受性酵母菌株的复筛
将初筛得的四株菌接种于不同理化环境的YEPD培养基中培养,考察不同条件对OD600nm值的影响,结果见图1。由图1可知,这四株菌对糖、温度的耐受性大致相同,在糖度为10°Bx的培养基中细胞浓度较高,在此糖度下有利于酵母细胞的大量增殖,温度范围在30~38 ℃时吸光度值相差不大,当达到42 ℃时吸光度值出现了明显的下降,表明了该菌株培养温度不宜高于38 ℃。菌株F4、F2对乙醇、乙酸、乳酸、己酸的耐受能力较差,菌株G6、F11耐受性最好,在培养基中有机酸的含量相对较高时,相比其他四株菌,这两株都表现出了更强的耐受能力,表明它们更能适应发酵后期有机酸积累而带来的不利影响。
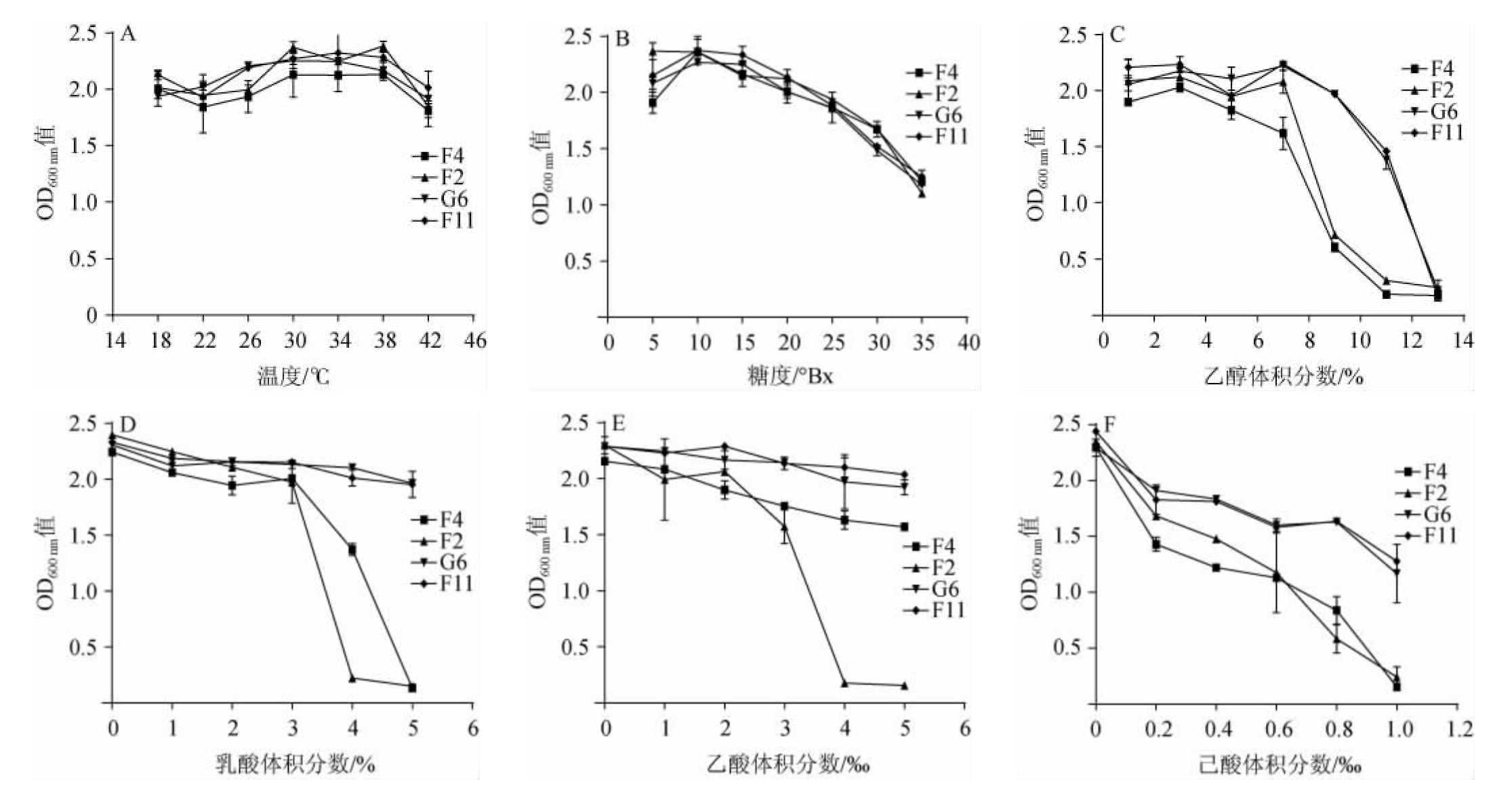
图1 不同条件下初筛菌株的耐受性测定结果
Fig.1 Determination results of tolerance of the preliminary screening strains under different conditions
在耐受性实验的基础上对菌株G6、F11进行挥发性代谢产物分析。菌株G6及F11发酵液中挥发性成分的相对含量测定结果见表3。由表3可知,菌株G6主要的挥发性代谢产物有34种,其中酯类物质7种占比9.75%、醇类5种占比50%、醛类4种占比2.50%、酸类9种占比19.64%、酚类2种占比1.36%、其他类7种占比10.01%。菌株F11主要的挥发性代谢产物有33种,其中酯类物质7种占比11.52%、醇类4种占比51.48%、醛类4种占比8.17%、酸类9种占比22.99%、酚类3种占比1.33%、其他类6种占比4.50%。
表3 菌株G6和F11发酵液中挥发性成分的相对含量
Table 3 Relative contents of volatile components in fermentation broth of strains G6 and F11

续表
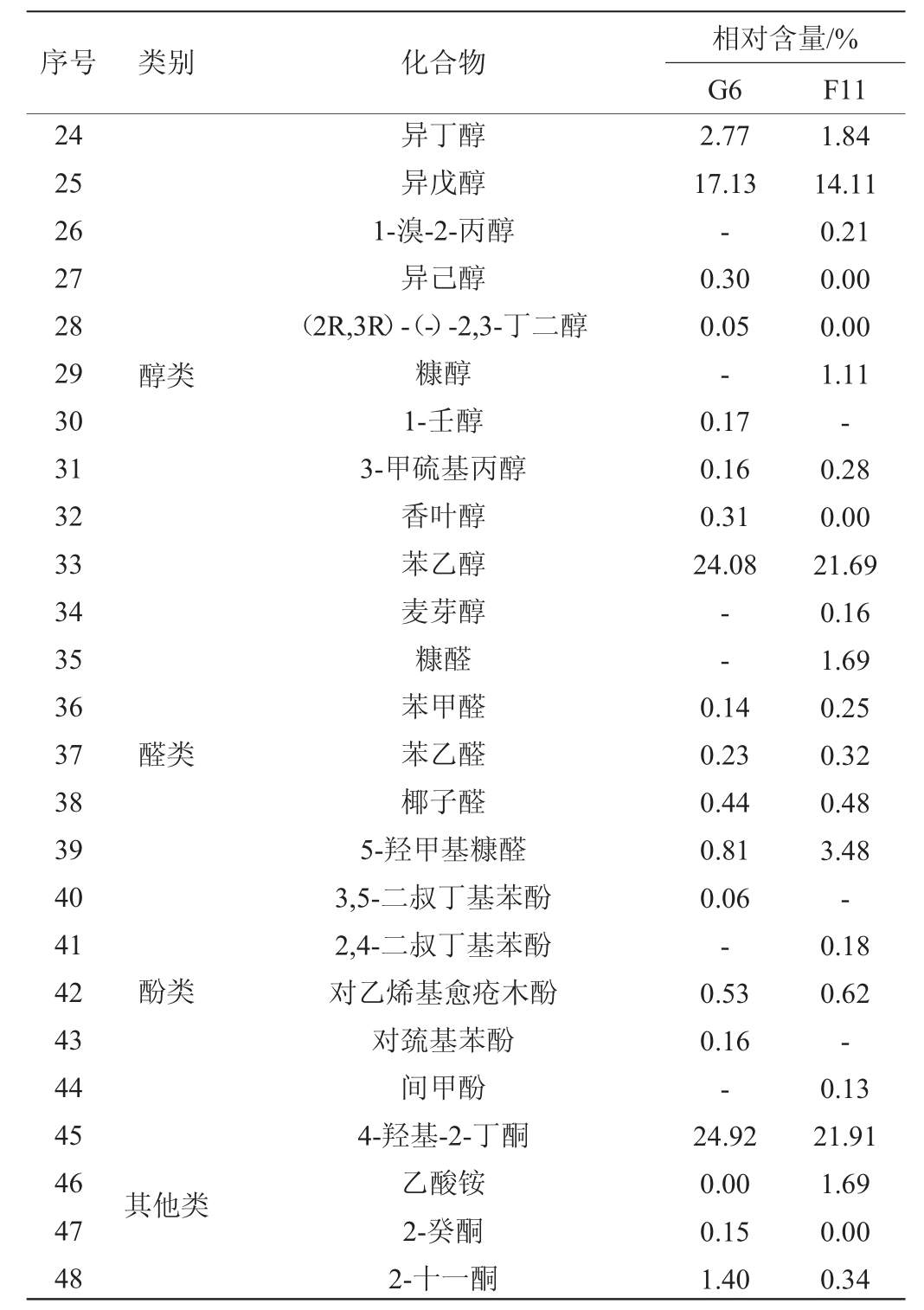
续表
注:“-”表示未检出。
酯类、醇类、酸类、醛类等挥发性化合物含量及比例关系决定了酒体的质量、香型、风味和品格[24],菌株G6的酯、醇、酸、醛类化合物占挥发物总量的81.89%,而菌株F11占比为84.16%,结合这两株菌产乙醇和高级醇的能力,菌株F11更适合白酒酿造等应用环境。
2.4 菌株F11生长曲线的测定结果
菌株F11的生长曲线如图2。由图2可知,吸光度值随培养时间的延长而增大,在生长培养基中菌株F11延滞期短,采用该培养基能缩短菌体培养时间,使菌体数快速达到峰值,提高培养效率的同时也便于后续接种扩大培养或发酵。此外菌株F11在培养至8 h时进入对数生长中期,培养至18 h时进入稳定期,28 h后吸光度值有所下降,进入衰退期。
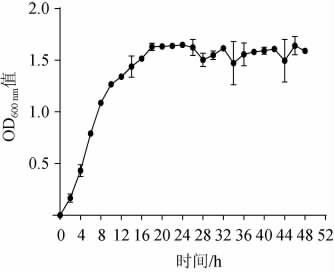
图2 菌株F11生长曲线
Fig.2 Growth curve of strain F11
2.5 分子生物学鉴定
菌株F11的系统发育树见图3。由图3可知,菌株F11与NCBI数据库中登录号为MT731408.1的菌株序列相似度最高,相似度为93%,因此,鉴定结果为库德里阿兹威毕赤酵母(Pichia kudriavzevii)。

图3 菌株F11的系统发育树
Fig.3 Phylogenetic tree of strain F11
2.6 菌株F11发酵特性研究
菌株F11属于兼性厌氧菌,溶氧对其代谢有着显著的影响,在三种培养方式下高级醇、葡萄糖及乙醇的含量变化结果见图4。
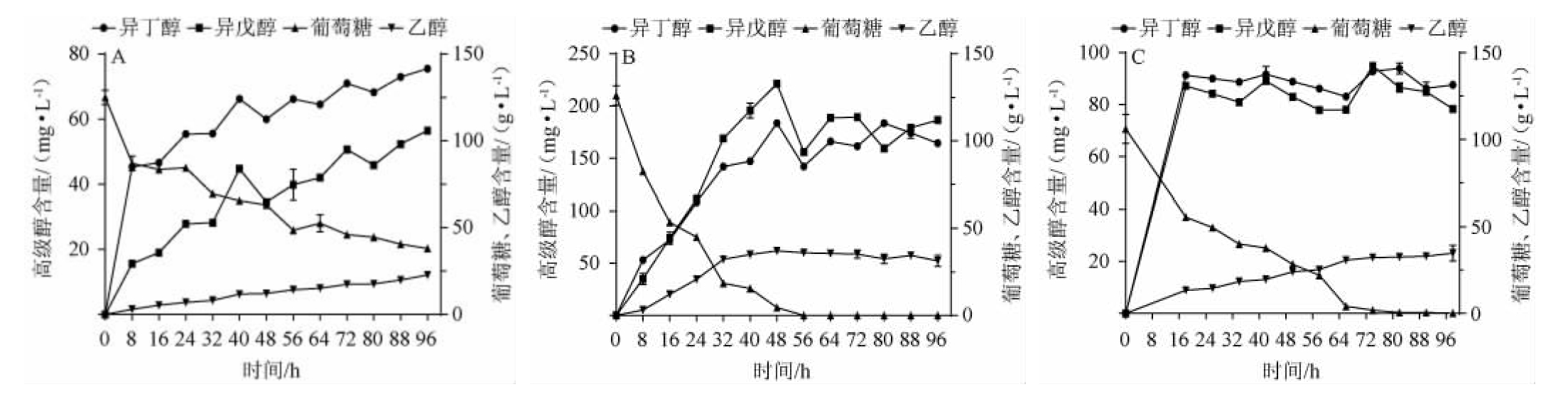
图4 菌株F11在三种培养方式下高级醇、葡萄糖及乙醇的含量变化趋势
Fig.4 Change trend of higher alcohol,glucose and ethanol contents of strain F11 under three culture methods
A:静置培养,B:振荡培养,C:培养至稳定期后转入静置培养。
由图4可知,三种模式下发酵96 h后乙醇的最终含量分别为22.8 g/L、31.4 g/L、34.75 g/L,可以看出静置培养条件下96 h乙醇产量最低,96 h异丁醇峰值含量分别为75.51 mg/L、183.55 mg/L、93.93 mg/L,异戊醇峰值含量分别为56.47 mg/L、221.25 mg/L、94.94 mg/L,在溶氧充足时两种高级醇的含量比溶氧匮乏时高了65%,此外在振荡培养期间乙醇的产生速率、葡萄糖的消耗速率要明显大于静置培养期间,而高级醇的生成趋势略有不同,在振荡培养的条件下异丁醇及异戊醇的含量在前48 h剧烈增长,在48~56 h出现轻微下降,推测其原因可能是由于在这一阶段生成了相应的乙酸酯而导致的,而在其他两种培养模式中这种改变并不明显,可能是因为在静置培养时酵母细胞大量沉积在底部发酵,这时由于缺乏足够的氧气使ATF基因的表达受到了抑制[25]。最终结果表明了高级醇的含量主要是伴随着酵母细胞的增殖而增加,在溶氧充足时细胞增殖快,所以高级醇生成快,进入发酵后期酵母细胞几乎不再增加,此时进入产次级代谢产物的阶段,高级醇的含量便趋于稳定。所以要想控制发酵体系中高级醇含量关键在于要控制酵母细胞的有序增殖。
3 结论
本研究从发酵酒醅中筛选出一株高耐受、低产高级醇的酵母F11,经分子生物学鉴定为库德里阿兹威毕赤酵母(Pichia kudriavzevii);该菌株在温度42 ℃、糖度25°Bx、乙醇含量12%,乳酸体积分数5%,乙酸体积分数5‰,己酸体积分数1‰的条件下能正常生长,在以高粱酶解液为发酵培养基时其挥发性代谢物中酯、醇、酸、醛类化合物占挥发物总量的84.16%,适合白酒酿造等应用环境。
[1]刘灿珍,秦伟帅,孙玉霞,等.酿酒酵母高级醇合成路径及关键基因[J].中国酿造,2018,37(8):9-13.
[2]LI P,LI T,ZHANG C Y,et al.Effect of ILV2 deletion and ILV3 or/and ILV5 overexpression in Saccharomyces uvarum on diacetyl and higher alcohols metabolism during wine fermentation[J].Eur Food Res Technol,2020,246:563-572.
[3]LUO Y,KONG L,XUE R,et al.Bitterness in alcoholic beverages: The profiles of perception,constituents,and contributors[J].Trends Food Sci Tech,2020,96:222-232.
[4]林熙.改进充氧工艺和控制方法对降低高级醇产生量的研究[J].中外酒业·啤酒科技,2020(15):33-37.
[5]郭辉祥,龙远兵,王晓平,等.多粮汽爆酿造小曲酒新工艺的应用研究[J].中国酿造,2018,37(7):203-207.
[6]ESTERAS-SAZ J,DE LA IGLESIA Ó,PEÑA C,et al.Theoretical and practical approach to the dealcoholization of water-ethanol mixtures andred wine by osmotic distillation[J].Sep Purif Technol,2021,270:118793.
[7]ZHANG Y,XU X,YANG H,et al.Separation of azeotropic mixture isopropyl alcohol plus ethyl acetate by extractive distillation: Vapor-liquid equilibrium measurements and interaction exploration[J].Fluid Phase Equilibr,2020,507:112428.
[8]刘红微,王耀,杨玉珍,等.活性炭在处理酒样过程中的危害分析[J].酿酒,2021,48(5):73-75.
[9]张建华,黄君君,陶绍木,等.树脂吸附法降低酒中高级醇的工艺研究[J].酿酒科技,2006(7):27-30.
[10]冯鹏鹏,周钰涵,高杏,等.低产高级醇工业上面发酵酵母的选育[J].食品与发酵工业,2022,48(5):23-28.
[11]ZHENG N,JIANG S,HE Y H,et al.Production of low-alcohol Huangjiu with improved acidity and reduced levels of higher alcohols by fermentation with scarless ALD6 overexpression yeast[J].Food Chem,2020,321:126691.
[12]刘学强,钱泓,周正,等.低产高级醇葡萄酒酵母菌株的筛选[J].食品与发酵工业,2016,42(3):73-78.
[13]吴丹丽,李高磊,王明月,等.低产尿素与高级醇黄酒酵母菌株的筛选、鉴定与发酵[J].食品科学,2019,40(6):100-105.
[14]LI W,WANG JH,ZHANG C Y,et al.Regulation of Saccharomyces cerevisiae genetic engineering on the production of acetate esters and higher alcohols during Chinese Baijiu fermentation[J].J Ind Microbiol Biot,2017,44(6):949-960.
[15]葛峻伶,郭莹,刘小二,等.一次敲除BAT2同时过表达Lg-ATF1对啤酒酵母产醇酯的影响[J].现代食品科技,2019,35(6):171-176.
[16]黄志久,张宿义,童文华,等.白酒酿造过程中高级醇的产生及控制技术研究进展[J].酿酒,2022,49(2):19-24.
[17]严锦,方尚玲,蒋威,等.降低小曲酒中杂醇油含量的研究进展[J].酿酒,2012,39(6):32-35.
[18]FAN G,TENG C,XU D,et al.Enhanced production of ethyl acetate using co-culture of Wickerhamomyces anomalus and Saccharomyces cerevisiae[J].J Biosci Bioeng,2019,128(5):564-70.
[19]袁琦,王家胜,毛豪,等.稻花香馫香型白酒风味特征分析[J].中国酿造,2022,41(2):53-59.
[20]王明瑞,侯彦喜,张亚丹.3,5-二硝基水杨酸法测定发酵液中多糖含量[J].现代食品,2020(4):216-222.
[21]晋湘宜,赵婷,王家胜,等.共培养时酿酒酵母对速生梭菌己酸代谢的影响及其机理[J].食品科学,2022,43(18):121-126.
[22]罗跃中,李忠英,李继睿,等.高效酒精酵母菌选育及其特性研究[J].中国酿造,2013,32(8):71-74.
[23]杨鲁君,蒋予箭,李余动,等.黄酒酵母优良抗逆菌株的筛选、鉴定及发酵特性研究[J].中国食品学报,2013,13(9):71-77.
[24]WEI Y,ZOU W,SHEN C H,et al.Basic flavor types and component characteristics of Chinese traditional liquors: A review[J].J Food Sci,2020,85(12):4096-4107.
[25]TONDINI F,LANG T,CHEN L,et al.Linking gene expression and oenological traits: Comparison between Torulaspora delbrueckii and Saccharomyces cerevisiae strains[J].Int J Food Microbiol,2019,294:42-49.