蛋白酶是一类能催化蛋白质肽键水解产生短肽或氨基酸的酶。蛋白酶的来源广泛,其中微生物蛋白酶因其生产成本低、稳定性好、特异性强等优点,具有工业生产的巨大潜力[1]。蛋白质的有限水解可以增加其使用范围,例如,通过应用特定的水解条件,可以生产出具有不同功能特性的水解产物,它们可以用于多种工业,如洗涤剂工业、食品工业和制药工业[2-4]。
曲酒发酵过程中的微生物主要来源于酒曲,而最终产品风味的形成离不开微生物产生大量酶的作用[5]。研究表明[6-7],细菌也是米酒曲中除酵母和霉菌外最主要的微生物,虽然细菌群落结构存在明显的差异,但在不同类型的曲酒中,芽孢杆菌是主导细菌,其可产生蛋白高效水解活力的蛋白酶,如甲醇芽孢杆菌[8]、解淀粉芽孢杆菌[9]等。
微生物产生的代谢物主要取决于菌种和培养基条件。培养基的组成对产物的形成、浓度和产量有很大的影响,因此起着关键作用[10-11]。统计优化可以快速筛选出大型试验设计中的重要变量,也可以确定每个成分的重要作用[12]。通过Plackett-Burman试验进行筛选,确定了对蛋白水解活力有显著影响的变量[13-15];根据最陡爬坡试验使关键因子的取值逐步逼近响应面的中心点;采用Box-Behnken试验设计[16]进一步优化这些变量添加量。
本研究从传统酒曲中分离鉴定高产胞外蛋白酶的菌株,探究其生长特性,通过酪蛋白平板法、福林酚法筛选高产蛋白酶菌株,并通过形态特征、生理生化试验、16S rDNA序列分析和种特异性基因分析鉴定菌株。采用单因素试验、Plackett-Burman试验、最陡爬坡试验及Box-Behnken试验优化其产酶条件,旨在筛选出酒曲中高产蛋白酶优异菌株,以期为食品加工及生物活性肽的制备提供蛋白酶来源,为工业化产酶奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
酒曲样品:产自山西运城的麦曲、麸曲、大曲和小曲。
1.1.2 化学试剂
酪蛋白酸钠(分析纯):美国Sigma-Aldrich公司;麦芽浸膏、马铃薯浸出粉、牛肉膏(均为生化试剂):北京奥博星生物技术有限责任公司;硫酸镁、磷酸二氢钠、乙酸钠(均为分析纯):麦克林生物科技有限公司。
1.1.3 培养基
初筛培养基:蛋白胨2.5 g/L、葡萄糖10 g/L、酵母浸粉1 g/L、酪蛋白酸钠10 g/L、琼脂20 g/L,蒸馏水1 000 mL。121 ℃灭菌15 min。
基础培养基采用LB液体培养基:酵母提取物5 g/L、胰蛋白胨10 g/L、氯化钠10 g/L,蒸馏水1 000 mL。121 ℃高压灭菌20 min。
LB固体培养基:LB液体培养基添加15 g/L琼脂粉。121 ℃高压灭菌20 min。
1.2 仪器与设备
MLS-3750高压蒸汽灭菌锅:日本Sanyo公司;HWS 12恒温水浴加热锅:上海一恒科学实验装备有限公司;HZQ-Q气浴恒温摇床:哈尔滨东联电子科技有限公司;CR21Ⅲ低温冷冻离心机:美国Bio-Rad公司;InfiniteM200PRONanoQuant酶标仪:瑞士Tecan公司;MG96+聚合酶链式反应(polymerase chainreaction,PCR)仪:杭州郎基科学仪器有限公司;JY04S-3C凝胶成像仪、JY300C电泳系统:北京君意东方电泳设备有限公司;3730XL测序仪:美国ABI公司。
1.3 方法
1.3.1 高产蛋白酶菌株的筛选
(1)产蛋白酶菌株的分离
称取1.0 g酒曲样品悬浮于100 mL无菌生理盐水中,并用生理盐水稀释适当倍数后取上清液涂布于酪蛋白平板,30 ℃倒置培养,选取酪蛋白平板上产生透明水解圈的单一菌落,以水解圈和菌落直径比值作为初筛标准。
(2)产蛋白酶菌株的复筛
将初筛菌株分别接种于LB液体培养基中,30 ℃、120 r/min振荡培养24 h后测定菌株发酵液蛋白水解活力。
1.3.2 菌株鉴定
(1)菌株形态学观察
将目标菌株接种于LB固体培养基上,30 ℃恒温培养1~2 d后观察菌落形态,并通过革兰氏染色后于高倍镜下进一步观察菌落形态。
(2)菌株生理生化特征分析
参照腾军伟等[17]的方法,采用API试剂盒进行生理生化特征分析。
(3)基于16S rDNA基因的菌种分子生物学鉴定
将产蛋白酶菌株分别接种于LB液体培养基中,30 ℃、120 r/min 振荡培养12 h后离心(3 000 r/min、4 ℃)30 min。利用细菌基因组DNA 提取试剂盒对其全基因组DNA 进行提取。并利用提取的DNA作为PCR模板,采用细菌通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-ACGGTTACCTTGTTACGACTT-3')进行PCR扩增[11]。
PCR扩增体系(50 μL):25 μL 2×Taq PCR MasterMix;2 μL全基因组DNA模板;2 μL 27F(10 μmol/L);2 μL 1492R(10 μmol/L);19 μL双蒸水(ddH2O)。
PCR扩增程序:95 ℃预变性3 min,95 ℃变性0.5 min,55 ℃退火0.5 min,72 ℃延伸1 min,35个循环,72 ℃末端延伸5 min,扩增结束后将产物放在-20 ℃冰箱中保存。
用质量分数为1.5%的琼脂糖凝胶电泳检测PCR 扩增是否成功,将有特异性条带的PCR产物送至北京新时代众合科技有限公司测序。测序结果提交到美国国家生物技术信息中心(national center of biotechnology information,NCBI)GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)分析,选取与筛选菌株序列大小相近的已知菌株的相应序列进行比对,利用MEGA6.0软件中邻接(neighbor joining,NJ)法构建系统发育进化树[18]。
1.3.3 菌株蛋白水解活力的测定
采用赵笑等[19]的福林酚法测定菌株产蛋白酶活力。蛋白酶酶活定义:在40 ℃条件下,1 min内水解酪蛋白产生相当于1 μg酪氨酸的酶量,为一个酶活单位(U/mL)。
1.3.4 菌株生长曲线的测定
取少量产蛋白菌株接种于LB液体培养基中,30 ℃、120 r/min振荡培养,持续监测菌体OD600nm值,直至菌株生长至衰亡期,试验重复3次。
1.3.5 高产蛋白酶菌株发酵培养基优化响应面试验
(1)单因素试验
分别探究添加量均为5 g/L的碳源(果糖、乳糖、麦芽浸膏、蔗糖、葡萄糖)、添加量均为10 g/L的氮源(牛肉膏、脱脂乳粉、大豆蛋白胨、柠檬酸铵、乳清粉)、添加量均为10 g/L的金属离子(氯化钾、硫酸锌、硫酸铵、硫酸铜、硫酸锰)、添加量均为1 g/L的磷酸盐(磷酸二氢钠、磷酸氢二钠、磷酸二氢钾、磷酸氢二钾)、添加量均为5 g/L的诱导剂(植酸、吐温80、吐温20、乙酸钠、甲醇)对菌株蛋白酶活力的影响。
(2)Plackett-Burman(PB)试验
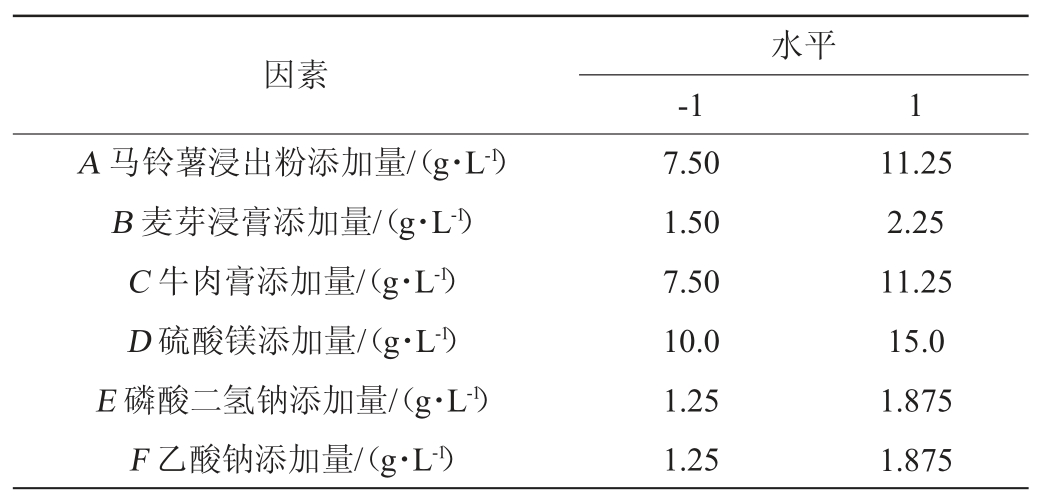
选取马铃薯浸出粉、麦芽浸膏、牛肉膏、硫酸镁、磷酸二氢钠、乙酸钠添加量为自变量,以粗酶液蛋白水解活力(Y)为响应值。选用N=15的试验设计,对6个因素同时进行考察,每个独立变量设置两个级别,分别为高水平(+1)和低水平(-1);设置3个中心点(5/13/15)。设计15个梯度,每个梯度3个平行的PB试验。将上述活化的枯草芽孢杆菌发酵液分别按照3%(V/V)的接种量接种于各分组培养基,30 ℃、120 r/min 条件下振荡培养24 h,测定粗酶液蛋白水解活力。PB试验设计因素与水平见表1。
表1 Plackett-Burman试验设计因素与水平
Table 1 Factors and levels of Plackett-Burman experiments design
(3)最陡爬坡试验
根据上述PB试验结果,采用最陡爬坡试验,选择显著影响蛋白酶酶活的因素,并确定显著影响因素的最适添加量。
(4)Box-Behenken(BB)试验
根据PB试验结果,以蛋白酶活力(Y)为响应值,选取马铃薯浸出粉(X1)、麦芽浸膏(X2)和牛肉膏(X3)添加量为自变量,设计3因素3水平响应面试验,Box-Behnken试验结果与分析见表2,每组试验3个平行。
表2 Box-Behnken试验设计因素与水平
Table 2 Factor and levels of Box-Behnken experiments design

1.3.6 数据处理
每个样品至少测定3次,试验数据采用Origin 2018作图,结果以“平均值±标准差”表示。
2 结果与分析
2.1 高产蛋白酶菌株的筛选
2.1.1 菌株的初筛
菌株的初筛结果见表3。由表3可知,从酒曲样品中分离筛选11株酪蛋白平板上水解圈/菌落直径比值(D/d)较大的菌株,编号为JQ-1、JQ-2、JQ-3、F1、F2、F3、F4、D1、D2、X1、X2,选择其中D/d较大的菌株JQ-2、F2、F3、F4、D1、X1进行复筛。
表3 高产蛋白酶菌株的初筛结果
Table 3 Preliminary screening results of high-yield proteaseproducing strains

2.1.2 菌株的复筛
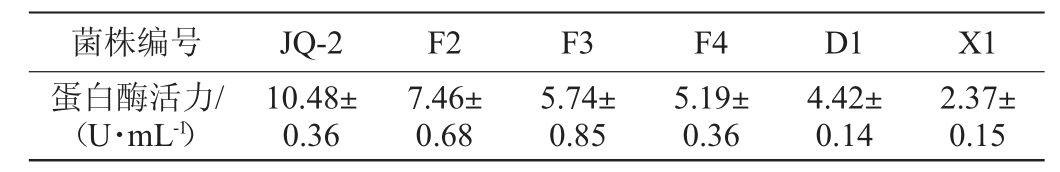
菌株的复筛结果见表4。由表4可知,菌株JQ-2粗酶液活力最高,为10.48 U/mL。因此,选择菌株JQ-2进行后续研究。
表4 高产蛋白酶菌株的复筛结果
Table 4 Rescreening results of high-yield protease-producing strains
2.2 高产蛋白酶菌株JQ-2的鉴定
2.2.1 菌株JQ-2的形态学观察
菌株JQ-2的菌落和细胞形态见图1。由图1a可知,菌落JQ-2在LB平板上划线培养24 h,菌落为乳白色,表面比较光滑,但边缘不规则,不透明,且粘性易挑起,菌落直径为1~6 mm;由图1b可知,倒置光学显微镜下,菌株JQ-2的细胞呈杆状,单细胞或多细胞首尾相连呈链状。
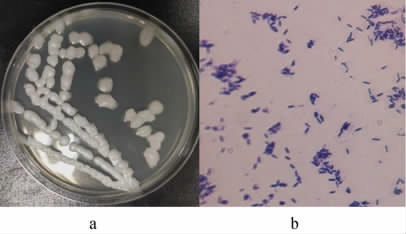
图1 菌株JQ-2的菌落(a)和细胞(b)形态
Fig.1 Colony (a) and cell (b) morphology of strain JQ-2
2.2.2 菌株JQ-2的生理生化试验
根据菌落和菌体形态、革兰氏染色及生理生化试验,按照《常见细菌系统鉴定手册进行初步分类》,菌株JQ-2的生理生化特征见表5。
表5 菌株JQ-2的生理生化试验结果
Table 5 Results of physiological and biochemical tests of strain JQ-2

续表
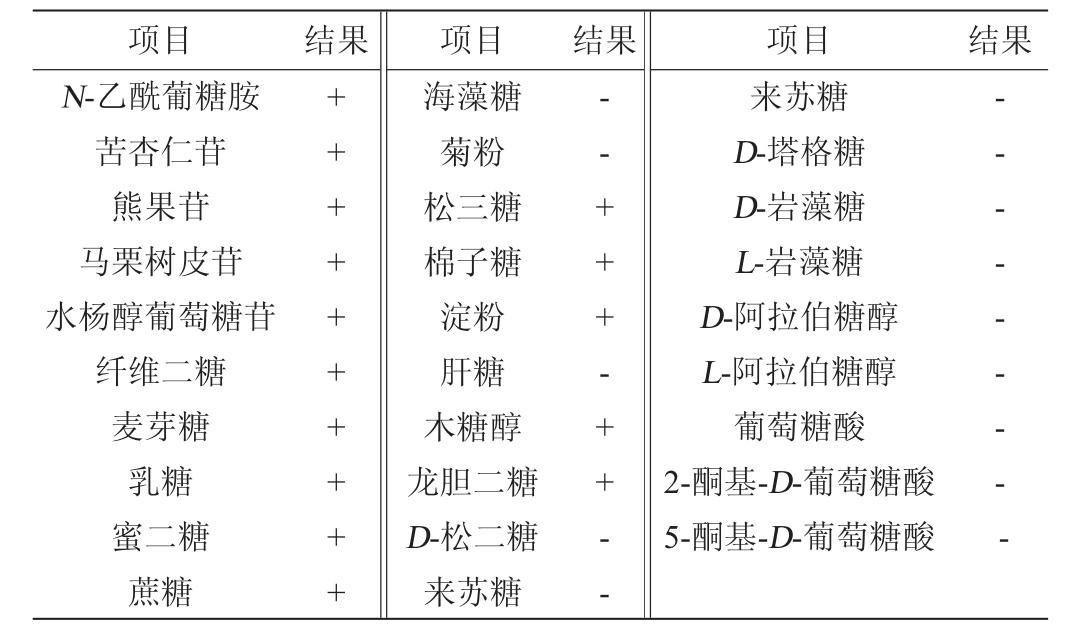
注:“+”表示结果呈阳性;“-”表示结果呈阴性。
将API 试剂条发酵结果提交到apiweb软件中进行比对鉴定,由表5可知,菌株JQ-2与枯草芽孢杆菌相似度高达97.3%,可初步断定其为枯草芽孢杆菌。
2.2.3 菌株JQ-2的分子生物学鉴定
以菌株JQ-2的基因组DNA为模板,通过16S rDNA基因序列的PCR扩增产物,经过琼脂糖凝胶电泳检测,结果见图2。由图2可知,在1 500 bp左右出现目的条带,符合预期结果,说明PCR成功扩增出了目标序列。
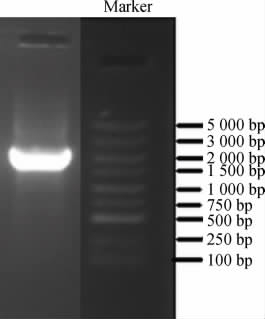
图2 菌株JQ-2的16S rRNA基因序列PCR扩增产物电泳结果
Fig.2 Electrophoresis results of PCR amplification product of 16S rRNA gene sequence of strain JQ-2
将基因测序结果提交到GenBank中进行BLAST比对分析,构建系统发育树,结果见图3。

图3 基于16S rDNA基因序列的菌株JQ-2菌株系统发育树
Fig.3 Phylogenetic tree of strain JQ-2 based on 16S rDNA gene sequence
由图3可知,菌株JQ-2与枯草芽孢杆菌(Bacillus subtilis)(KF758384.1)在同一分支上且它们的置信度高达99%。因此,菌株JQ-2被鉴定为枯草芽孢杆菌(Bacillus subtilis)。
2.3 菌株JQ-2生长曲线
由图4可知,菌株JQ-2在0~6 h生长速率较缓慢,菌体生物量不增加,为迟缓期;在8~14 h生长速率最快,菌体细胞以几何级数速率分裂,为对数生长期;在14~22 h菌体数量基本平衡,这一阶段为稳定期;在22 h之后,菌体量快速减少,菌体死亡速率高于新生速率,这一阶段为衰亡期,主要由于营养成分不足和后期代谢产物增加导致生长环境变化引起的,该结果与腾军伟等[17]研究的解淀粉芽孢杆菌生长特征一致。
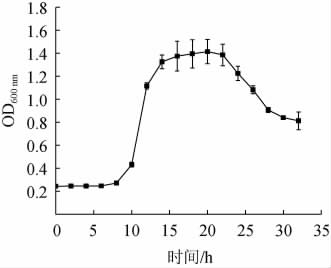
图4 枯草芽孢杆菌JQ-2的生长曲线
Fig.4 Growth curve of Bacillus subtilis JQ-2
2.4 枯草芽孢杆菌JQ-2发酵培养基优化单因素试验
2.4.1 碳源种类及最佳碳源添加量对蛋白酶活的影响
由图5a可知,与其他碳源相比,添加麦芽浸膏时蛋白酶活力最高,为(33.53±1.48)U/mL,与CHU W H[20]对芽孢杆菌胞外碱性蛋白酶的研究结果一致。因此,选择最佳碳源为麦芽浸膏。由图5b可知,麦芽浸膏添加量对蛋白水解活力的影响呈现低促高抑的现象,可能由于高浓度的麦芽浸膏会导致酶钝化或培养基的营养失衡,从而影响微生物产酶[21]。当麦芽浸膏添加量为2.0 g/L时,蛋白酶活力最佳,为(103.4±3.97)U/mL。因此,麦芽浸膏最佳添加量为2.0g/L。
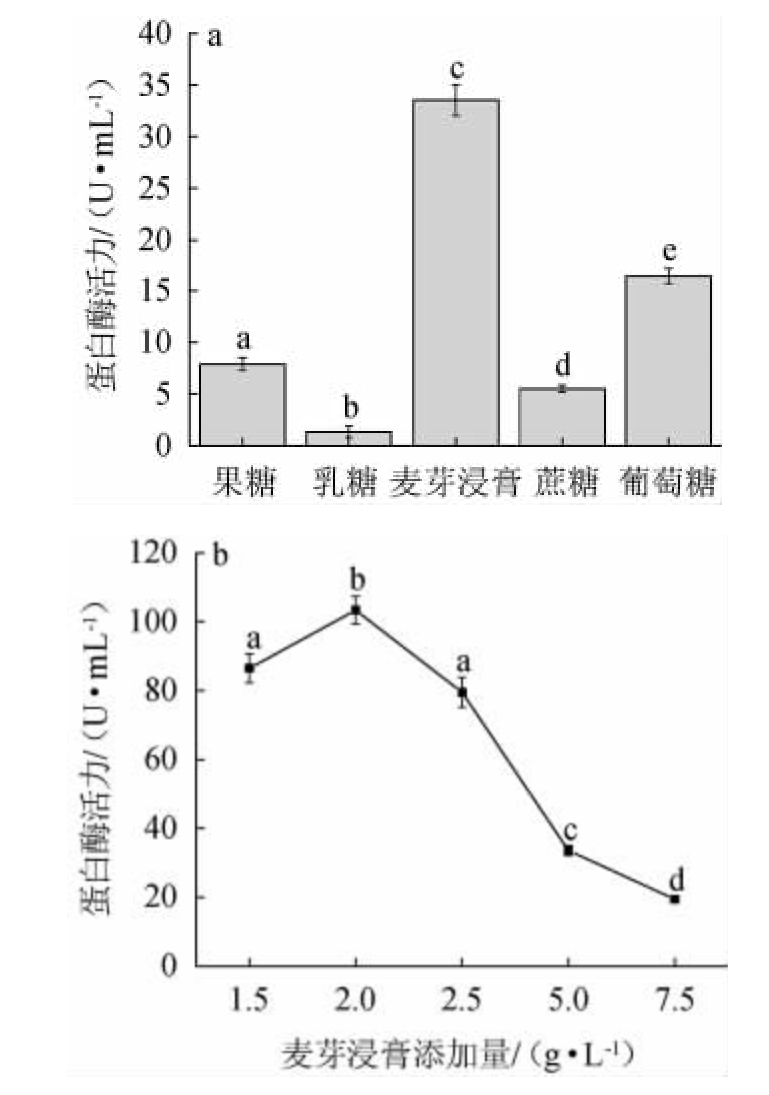
图5 碳源种类(a)和麦芽浸膏添加量(b)对菌株JQ-2产蛋白酶活力的影响
Fig.5 Effect of carbon source types (a) and malt extract addition (b)on protease activities of strain JQ-2
2.4.2 氮源种类及最佳氮源添加量对蛋白酶活的影响
氮源为菌体生长繁殖和代谢物质合成的原料。氮源种类及最佳氮源添加量对蛋白酶活的影响,结果见图6。
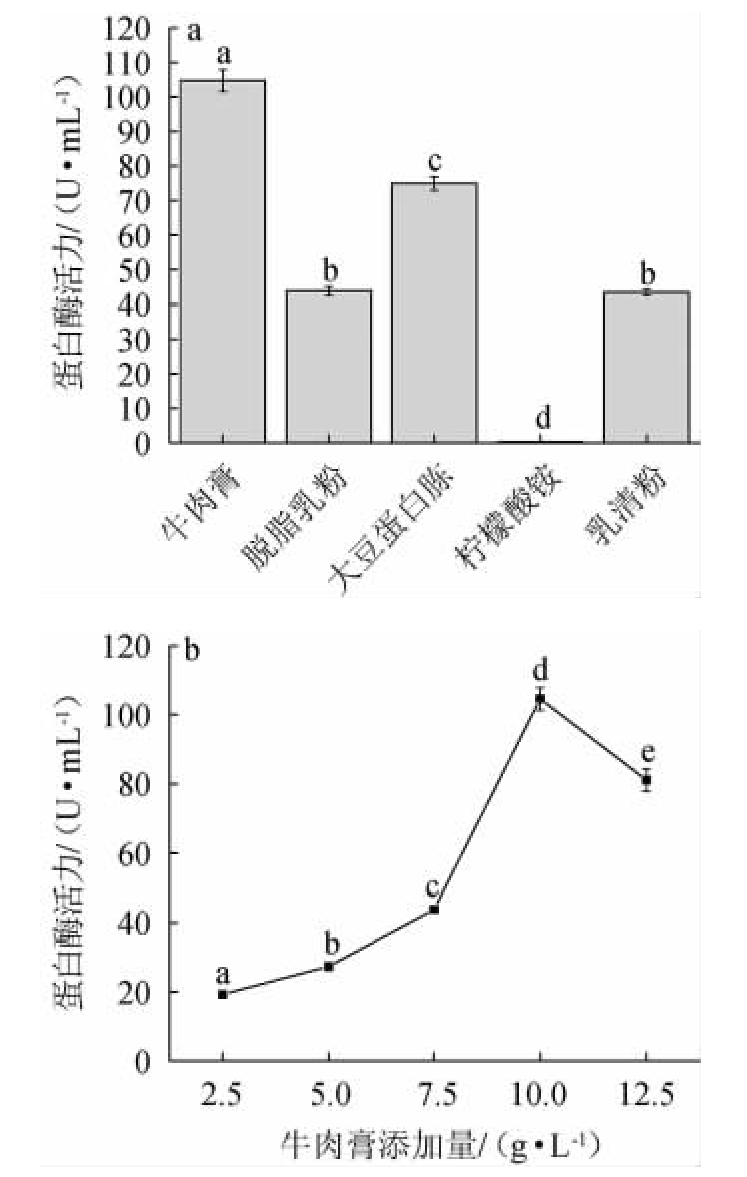
图6 氮源种类(a)和牛肉膏添加量(b)对菌株JQ-2产蛋白酶活力的影响
Fig.6 Effect of nitrogen source types (a) and beef extract addition (b)on protease activities of strain JQ-2
由图6a可知,当添加有机氮源时,对枯草芽孢杆菌JQ-2产酶具有促进作用;当添加柠檬酸铵等无机氮源,枯草芽孢杆菌JQ-2产酶受到抑制作用。与其他有机氮源相比,当添加牛肉膏时,蛋白酶活力最佳,为(104.68±3.26)U/mL。因此,选择最佳氮源为牛肉膏。由图6b可知,随着牛肉膏添加量增加至10 g/L时,蛋白酶活力达到(105.68±3.26)U/mL,进一步增加牛肉膏添加量,蛋白酶活力开始降低。因此,最佳牛肉膏添加量为10 g/L。
2.4.3 马铃薯浸出粉添加量对蛋白酶活的影响
由图7可知,马铃薯浸出粉的添加量对蛋白水解活力也呈现低促高抑的现象,当马铃薯浸出粉添加量为10 g/L时,蛋白水解活力最佳,为(65.42±1.42)U/mL。马铃薯浸出粉营养丰富,但是浓度过高时可能会导致菌体快速生长,密集的菌体会让发酵培养基溶氧水平降低,从而抑制代谢产物的活力[22]。当马铃薯浸出粉添加量>10 g/L之后,蛋白水解活力呈直线下降。因此,马铃薯浸出粉最佳添加量为10 g/L。
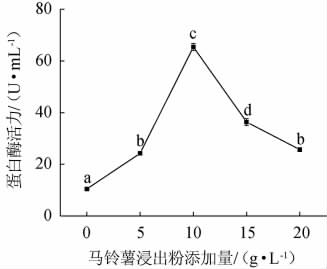
图7 马铃薯浸出粉添加量对菌株JQ-2产蛋白酶活力的影响
Fig.7 Effect of potato extract powder addition on protease activities of strain JQ-2
2.4.4 金属离子种类和硫酸镁添加量对蛋白酶活的影响
由图8a可知,对酶有激活作用的Zn2+、Mg2+、Cu2+、Mn2+以及调节渗透压的Na+,与其他金属盐相比,其中Mg2+对菌株JQ-2蛋白酶的合成具有明显激活作用,与LIU S等[23]对球形芽孢杆菌DS11蛋白酶的研究结果一致。MgSO4·7H2O作为无机盐可以提供与酶活力相关的Mg2+,促进细胞转录水平,从而促进菌体的生长代谢[24]。由图8b可知,当MgSO4·7H2O添加量为12.5 g/L时,蛋白酶活力最佳,为(17.78±1.18)U/mL。因此,最佳MgSO4·7H2O添加量为12.5 g/L。
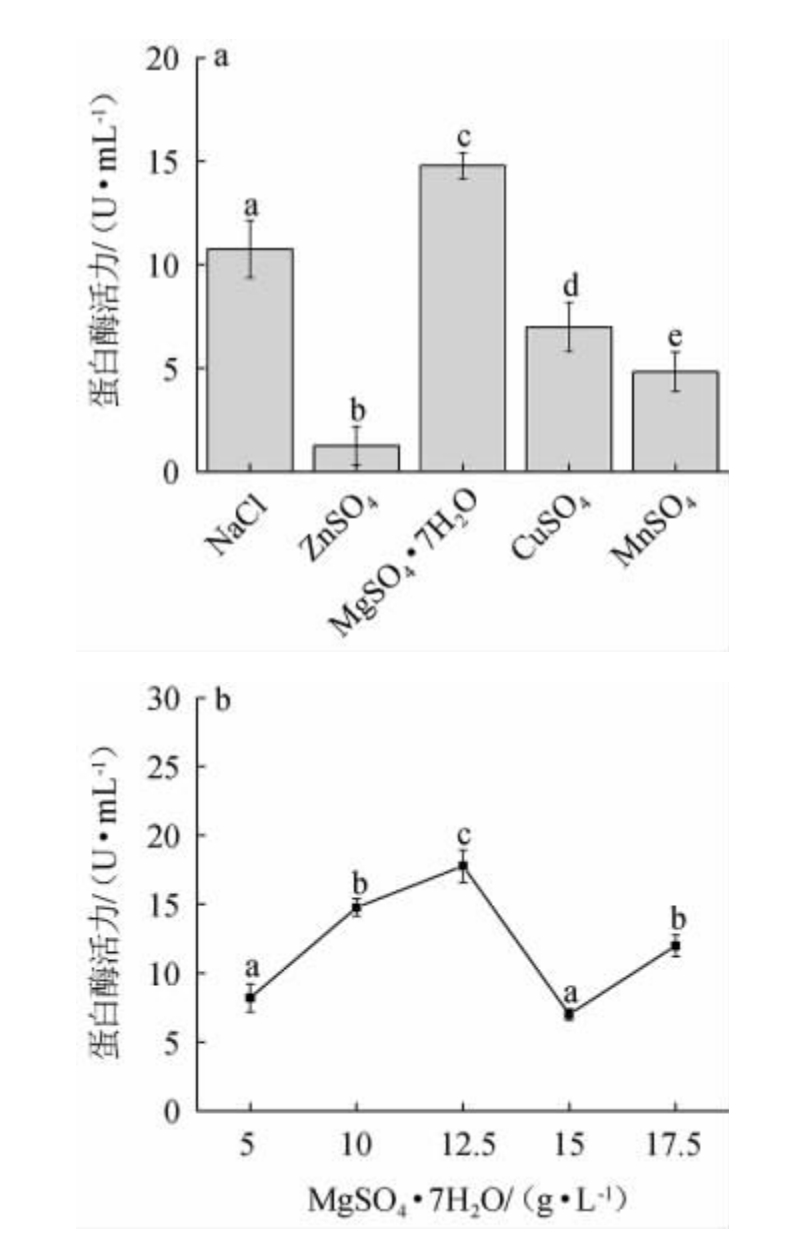
图8 金属离子种类(a)和硫酸镁添加量(b)对菌株JQ-2产蛋白酶活力的影响
Fig.8 Effect of metal ion types (a) and MgSO4·7H2O addition (b) on protease activities of strain JQ-2
2.4.5 磷酸盐种类和磷酸二氢钠添加量对蛋白酶活的影响
磷酸盐为微生物生长提供磷源和稳定的生长环境,不同种类的磷酸盐对菌株生长影响,结果见图9。由图9a可知,NaH2PO4对JQ-2蛋白酶的合成具有促进作用,而其他磷源无明显作用。因此,最佳磷酸盐为NaH2PO4。由图9b可知,当NaH2PO4添加量为1.5 g/L,蛋白水解活力最佳。因此,最佳NaH2PO4添加量为1.5 g/L。
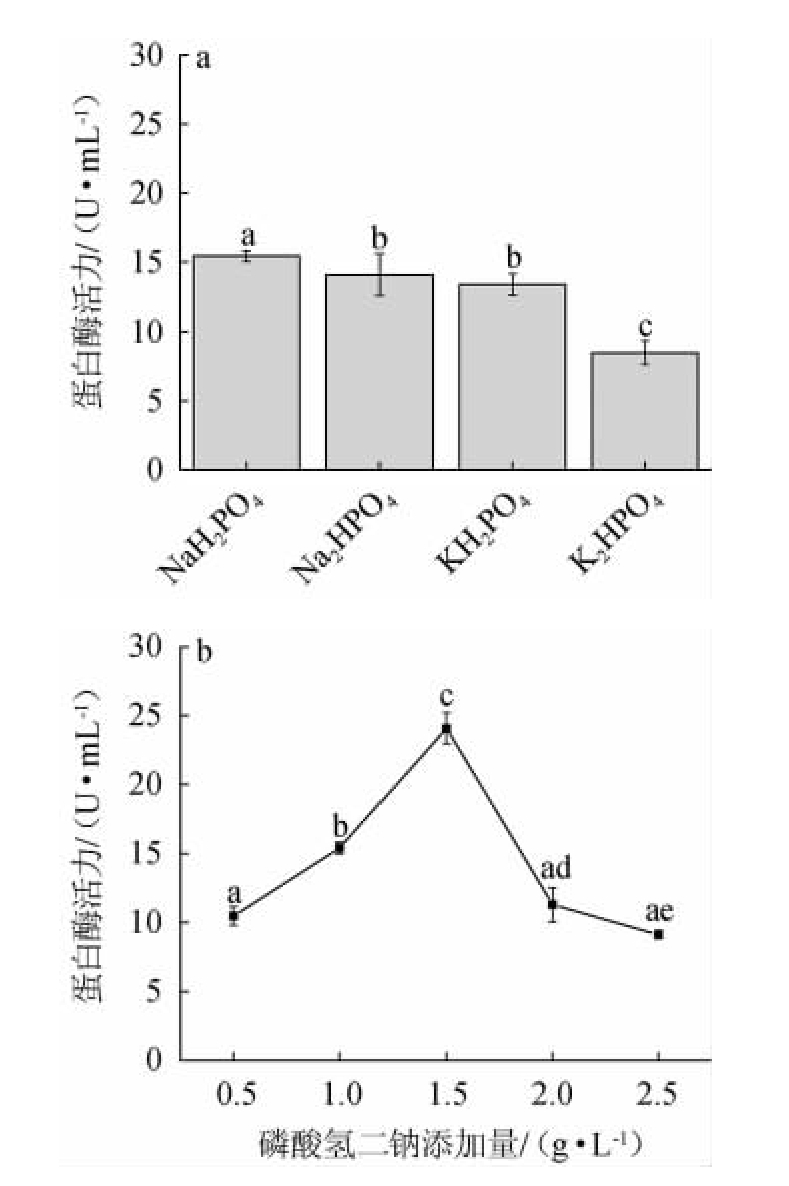
图9 磷酸盐种类(a)和磷酸二氢钠添加量(b)对菌株JQ-2产蛋白酶活力的影响
Fig.9 Effect of phosphates types (a) and sodium dihydrogen phosphate addition (b) on protease activities of strain JQ-2
2.4.6 诱导剂种类和乙酸钠添加量对蛋白酶活的影响
不同种类诱导剂对菌株蛋白酶活力影响结果见图10。由图10a可知,植酸、甲醇、吐温20对JQ-2菌株发酵产蛋白水解酶具有抑制作用,而乙酸钠对JQ-2菌株蛋白酶活力具有促进作用。因此,最佳诱导剂为乙酸钠。由图10b可知,当乙酸钠添加量为1.5 g/L时,蛋白酶活力最佳,为75.24±2.52。因此,乙酸钠最佳添加量为1.5 g/L。
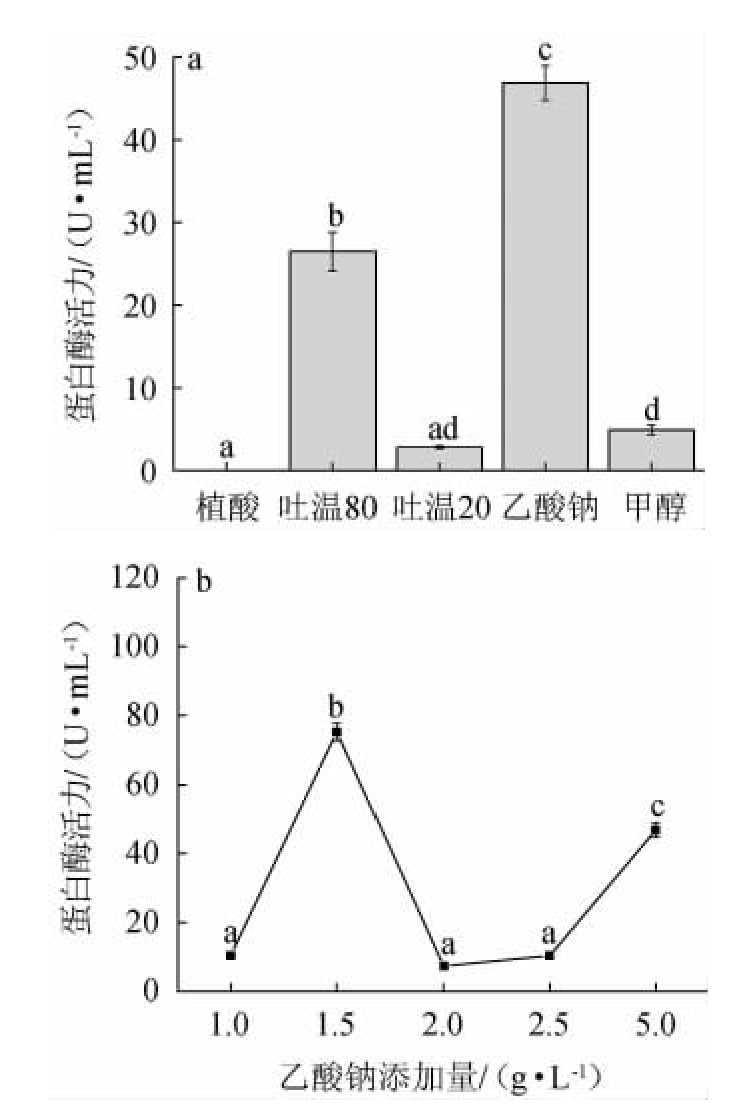
图10 诱导剂种类(a)和乙酸钠添加量(b)对菌株JQ-2产蛋白酶活力的影响
Fig.10 Effect of inducers types (a) and sodium acetate addition (b)on protease activities of strain JQ-2
2.5 枯草芽孢杆菌JQ-2培养基优化响应面试验
2.5.1 PB试验
以粗酶液蛋白酶活力(Y)为响应值,选取马铃薯浸出粉(A)、麦芽浸膏(B)、牛肉膏(C)、硫酸镁(D)、磷酸二氢钠(E)、乙酸钠(F)为考察因素,PB试验设计表与结果见表6,效应分析见表7。
表6 Plackett-Burman试验设计及结果
Table 6 Design and results of Plackett-Burman experiments
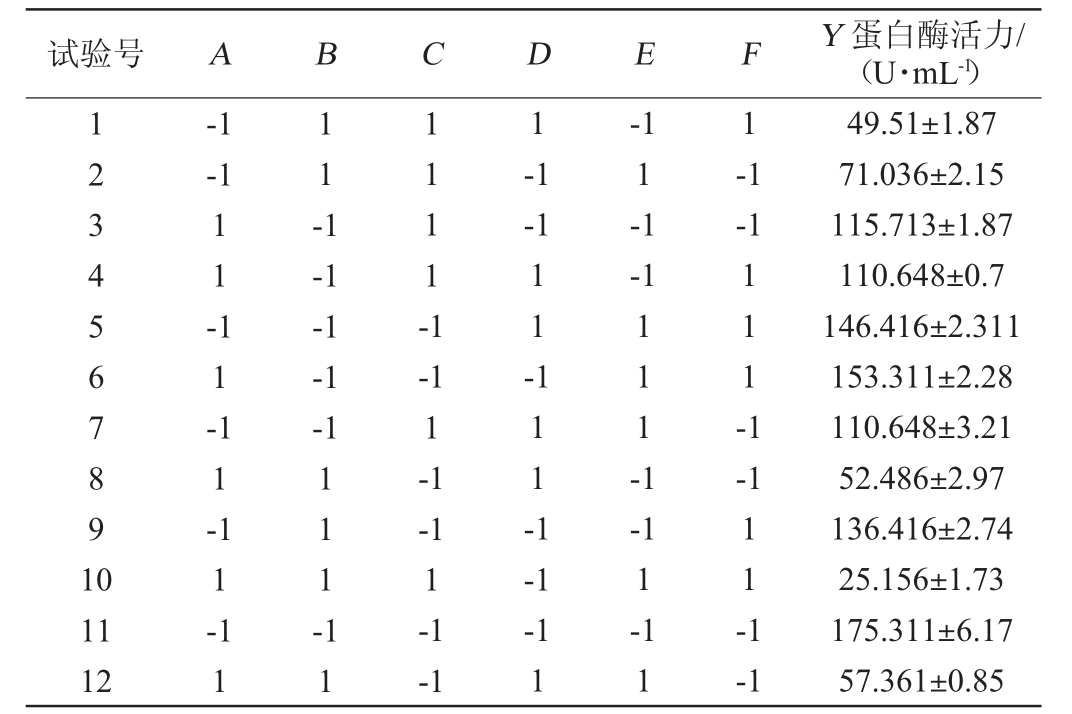
表7 Plackett-Burman试验方差分析结果
Table 7 Results of variance analysis of Plackett-Burman experiments
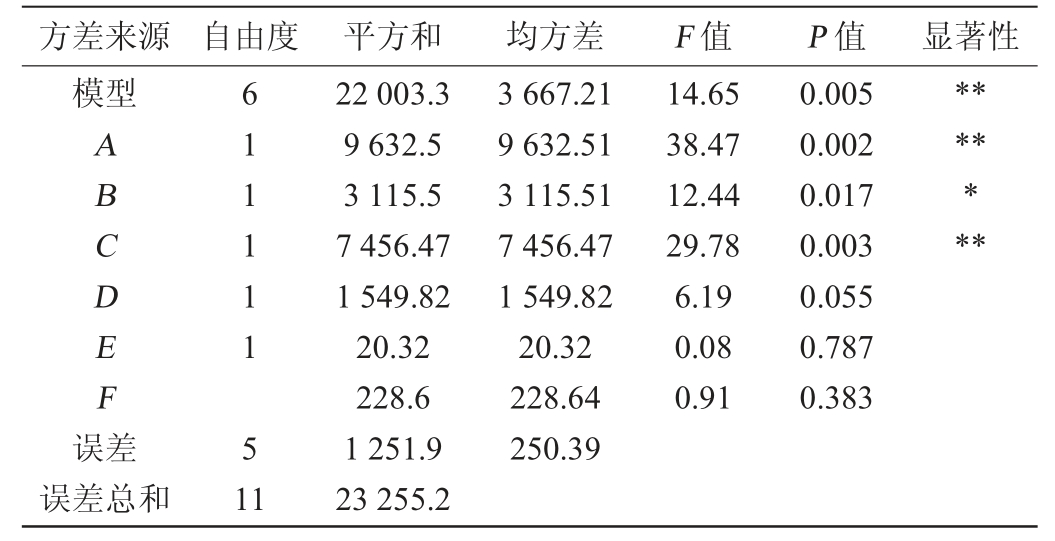
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。下同。
由表7可知,主效应的P值为0.036<0.05,说明Plackett-Burman试验设计中的因素在所选的水平范围内对菌株JQ-2发酵产蛋白水解酶具有显著影响,决定系数R2为0.879 5,说明该模型能够解释87.95%响应值的变化,试验误差小,设计可靠。变量的标准化效应在帕累托图上以单列表示,穿过列的垂直线表示变量具有95%置信水平的统计显著效应[25]。
2.5.2 最陡爬坡试验
根据PB试验筛选的三个影响显著的因素,通过梯度增加马铃薯浸出粉、麦芽浸膏和牛肉膏的添加量,采用最陡爬坡试验确定3个因素的最佳水平,最陡爬坡试验设计及结果见表8。
表8 最陡爬坡试验设计和结果
Table 8 Design and results of the steepest climbing experiments
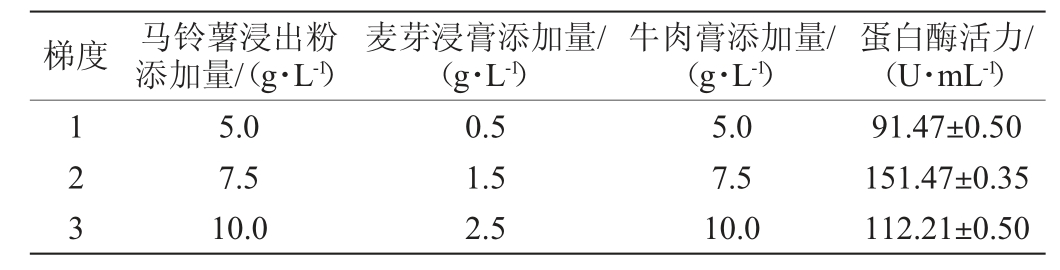
由表8可知,蛋白酶活力呈先上升后下降趋势,其中以第二组蛋白酶活力最佳,即马铃薯浸出粉添加量7.5 g/mL,麦芽浸膏添加量1.5 g/mL,牛肉膏添加量7.5 g/mL。在此条件下,蛋白酶活力为151.47 U/mL。因此,选择第二组中3因素及其对应水平作为响应面试验的因素和中心点。
2.5.3 Box-Behnken试验
以马铃薯浸出粉(X1)、麦芽浸膏(X2)和牛肉膏(X3)添加量为自变量,蛋白酶活力(Y)为响应值,Box-Behnken试验设计及结果见表9,方差分析见表10。根据Design-Expert 8.0.6软件对表9数据及结果进行多元回归分析,得到菌株JQ-2蛋白酶活力(Y)对马铃薯浸出粉(X1)、麦芽浸膏(X2)和牛肉膏(X3)添加量的二阶多项式回归模型方程如下:
表9 Box-Behnken试验设计及结果
Table 9 Design and results of Box-Behnken experiments
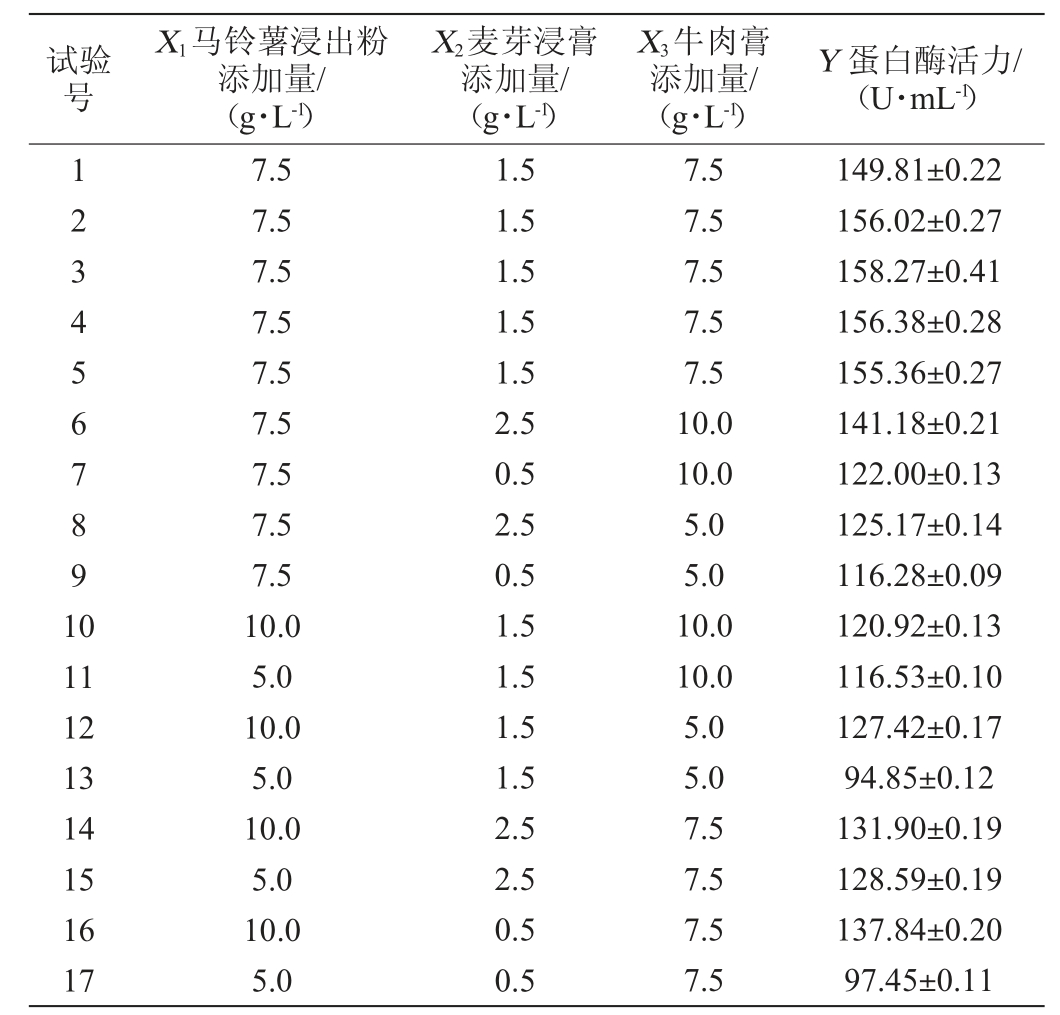
表10 回归模型方差分析
Table 10 Variance analysis of regression model
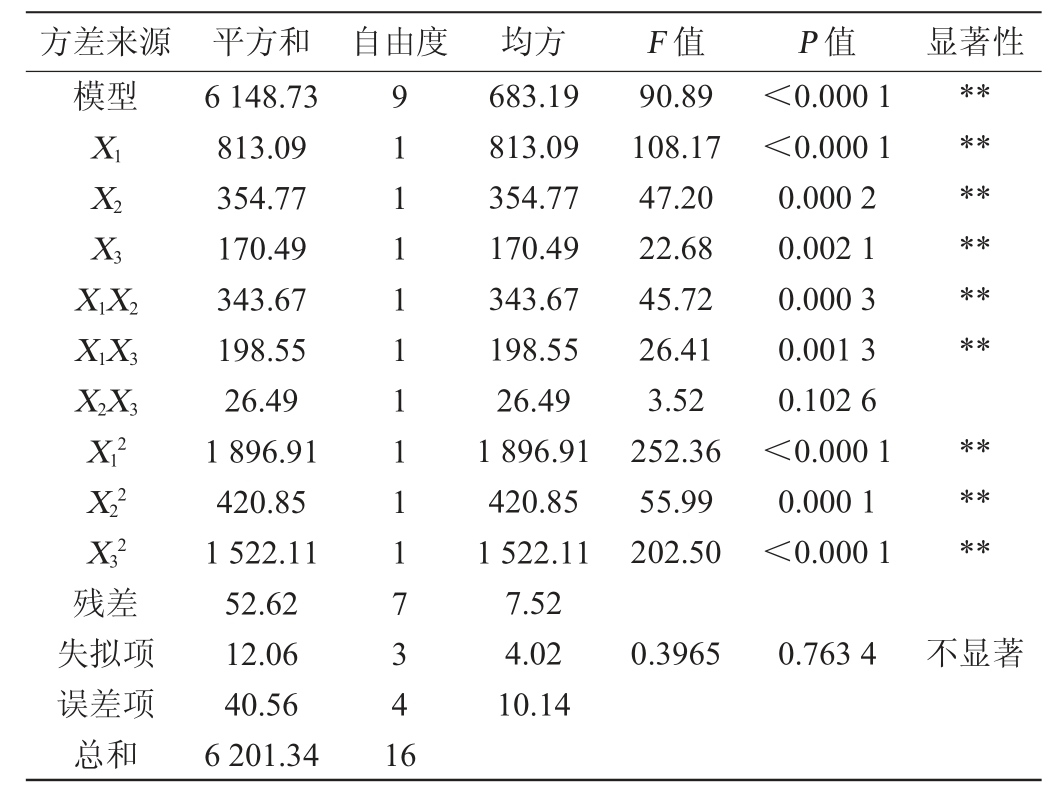
由表10可知,模型的P值<0.01,极显著,失拟项P值=0.763 4>0.05,不显著,说明该模型方程与实际拟合度较好。模型拟合的决定系数R2和调整决定系数R2adj分别为0.980 6和0.958 7,表明模型的拟合程度良好,可信度高,可用来分析和预测培养基成分对菌株JQ-2产蛋白酶活力的影响。由P值可知,一次项X1、X2、X3,二次项X12、X22、X32,交互项X1X2、X1X3对结果影响极显著(P<0.01)。由F值可知,各因素对结果的影响顺序为马铃薯浸出粉添加量>麦芽浸膏添加量>牛肉膏添加量。
采用Design-Expert 8.0.6软件对表9数据进行二次多元回归拟合分析,得到二次回归方程响应面及等高线见图11。由图11可知,马铃薯浸出粉和麦芽浸膏添加量、马铃薯浸出粉和牛肉膏添加量的交互作用表现极显著(P<0.01)。该结果与表7结论一致。
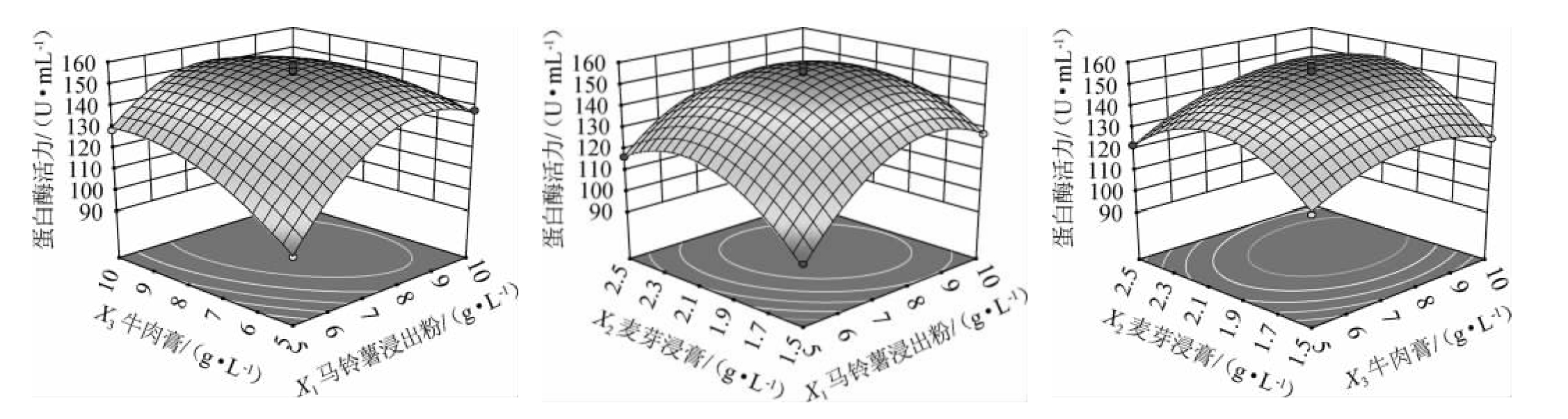
图11 各因素间交互作用对菌株JQ-2产蛋白酶活力影响的响应曲面及等高线
Fig.11 Response surface plots and contour lines of effects of interaction between each factor on the protease activities of strain JQ-2
通过Design-Expert 8.0.6软件预测得到最佳发酵培养基为:马铃薯浸出粉、麦芽浸膏、牛肉膏的最佳添加量分别为5.397 g/L,1.774 g/L,10.276 g/L。在此条件下,蛋白酶活力预测值为157.14 U/mL。为了方便实际操作及验证模型的有效性,将最佳培养基条件修正为:马铃薯浸出粉、麦芽浸膏、牛肉膏的添加量分别为5.4 g/L,1.8 g/L,10.0 g/L。在此优化条件下进行3次平行验证试验,蛋白酶活力实际值为(154.75±1.76)U/mL,与预测值总体吻合,说明模型可靠。
3 结论
本试验自酒曲中分离出一株高产蛋白水解酶的枯草芽孢杆菌,通过单因素试验、Plackett-Burman试验、最陡爬坡试验和Box-behnken试验得到其最优发酵培养基组成:马铃薯浸出粉5.4 g/L、麦芽浸膏1.8 g/L、牛肉膏10.0 g/L。在此优化条件下,蛋白酶活力为154.75 U/mL,是未优化培养基的14.77倍,为工业化产酶奠定了基础。
[1]NASCIMENT O T C E S,MOLINO J V D,DONADO P R S,et al.Antarctic fungus proteases generate bioactive peptides from caseinate[J].Food Res Int,2021,139:109944.
[2]NOUNOU M I,ZAGHLOUL T I,AHMED N A,et al.Skin permeability enhancement by Bacillus subtilis alkaline protease: Application to transdermal drug delivery[J].Int J Pharm,2017,529(1-2):423-432.
[3]王朋辉,王伟贤,杨涛.碱性蛋白酶洗涤性能的影响因素[J].日用化学工业,2021,51(11):1109-17.
[4]MOAYEDI A,MORA L,ARISTOY M C,et al.ACE-inhibitory and antioxidant activities of peptide fragments obtained from tomato processing by-products fermented using Bacillus subtilis:Effect of amino acid composition and peptides molecular mass distribution[J].Appl Biochem Biotech,2017,181:48-64.
[5]邓灿,高瑞杰,赵永威.高温大曲感官指标与理化指标、微生物群落和挥发性物质的关联研究[J].食品与发酵工业,2022,139:1-11.
[6]ZHAO X X,WANG Y R,CAI W C,et al.High-throughput sequencingbased analysis of microbial diversity in rice wine koji from different areas[J].Curr Microbiol,2020,77:882-889.
[7]ZHAO X X,XIANG F S,TANG F X,et al.Bacterial communities and prediction of microbial metabolic pathway in rice wine Koji from different regions in China[J].Front Microbiol,2022,12:3655.
[8]杨智杰,郑喆,蔡淼.甲醇芽孢杆菌蛋白酶的水解特性及酪蛋白水解产物活性分析[J].食品科学,2020,41(14):153-160.
[9]ZHAO X,WANG J,ZHENG Z,et al.Production of a milk-clotting enzyme by glutinous rice fermentation and partial characterization of the enzyme[J].J Food Biochem,2015,39(1):70-79.
[10]RAJESWARI P,JOSE PA,AMIYA R,et al.Characterization of saltern based Streptomyces sp.and statistical media optimization for its improved antibacterial activity[J].Front Microbiol,2015,5:753.
[11]JUNG S,LEE J H.Characterization of transcriptional response of Lactobacillus plantarum under acidic conditions provides insight into bacte-rial adaptation in fermentative environments[J].Sci Rep,2020,10(1):19203.
[12]ABDEL-FATTAH Y R,SAEED H M,GOHAR Y M,et al.Improved production of Pseudomonas aeruginosa uricase by optimization of process parameters through statistical experimental designs[J].Process Biochem,2005,40(5):1707-1714.
[13]ELSAYED E A,NA A.Medium optimization by response surface methodology for improved cholesterol oxidase production by a newly isolated Streptomyces rochei NAM-19 strain[J].BioMed Res Int,2020:1870807.
[14]JIANG J J,ZU Y Q,LI X Y,et al.Recent progress towards industrial rhamnolipids fermentation: Process optimization and foam control[J].Bioresource Technol,2020,298:122394.
[15]PLACKETT R L,BURMAN J P.The design of optimum multifactorial experiments[J].Biometrika,1946,33(4):305-325.
[16]YANG X,GUO P,LI M,et al.Optimization of culture conditions for amoxicillin degrading bacteria screened from pig manure[J].Int J Environ Res Public Health,2020,17(6):1973.
[17]腾军伟,赵笑,杨亚威.酒曲中产凝乳酶微生物菌株的分离筛选及鉴定[J].食品科学,2017,38(16):23-28.
[18]ALLMAN E S,RHODES J A,SULLIVANT S.Statistically consistent k-mer methods for phylogenetic tree reconstruction[J].J Comput Biol,2017,24(2):153-171.
[19]赵笑,蔡淼,杨智杰.解淀粉芽孢杆菌GSBa-1凝乳酶对切达干酪成熟过程中蛋白水解及生物活性的影响[J].食品科学,2020,41(22):103-111.
[20]CHU W H.Optimization of extracellular alkaline protease production from species of Bacillus[J].J Ind Microbiol Biot,2007,34(3):241-245.
[21]DING Z Y,LIU S P,GU Z H,et al.Production of milkclotting enzyme by Bacillus subtilis B1 from wheat bran[J].Afr J Biotechnol,2011,10(46):9370-9378.
[22]IZMIRLIOGLU G,DEMIRCI A.Strain selection and medium optimization for glucoamylase production from industrial potato waste by Aspergillus niger[J].J Sci Food Agr,2016,96(8):2788-2795.
[23]LIU S,FANG Y W,LV M S,et al.Optimization of the production of organic solvent-stable protease by Bacillus sphaericus DS11 with response surface methodology[J].Bioresource Technol,2010,101(20): 7924-7929.
[24]李盼盼,张庆芳,刘春莹.鼠李糖乳杆菌LP216高密度发酵培养基优化[J].中国酿造,2022,41(4):87-92.
[25]ZHAO H,ZHENG Z,ZHANG M,et al.Fermentation optimization of rennet-producing Bacillus amyloliquefaciens GSBa-1 for high-density culture and its kinetic model[J].Food Sci Technol,2022,42:e40122.