酱香、浓香和清香是中国白酒的三大基础香型[1],而作为我国白酒十二大香型之一的特香型白酒素有“浓头酱尾清中间”之说[2],因其“闻香优雅舒适、诸香协调、酒体柔绵醇和、回甜悠长”的特点受到广大消费者的喜爱[3],其中,特香型白酒以江西省樟树县生产的四特酒最为典型[4]。不同白酒大曲在原料和配比上存在一定差异,但大多以大麦、小麦和豌豆等为主,与之不同的是特香型白酒大曲原料主要为麦麸、面粉和酒糟,且原料和制曲工艺的差异也使得特香型白酒大曲与众不同[5]。
大曲中包含的各种微生物和多种酶系是白酒发酵过程中的内在驱动力[6],而大曲自然发酵过程中微生物的代谢产物和原料分解产物更是直接或间接的构成了白酒的风味物质,从而赋予白酒特殊的风味[7-8]。由此可见,白酒的发酵和品质形成离不开大曲的参与。大曲的发酵过程是决定大曲质量优劣的关键环节,而发酵温度更是直接决定了大曲的品质[9]。当发酵温度过高时不仅会导致酒曲中芽孢杆菌的数量降低,还会降低糖化力、酯化力和酸性蛋白酶活性[10];但明红梅等[11]通过提高制曲温度发现,超高温大曲的感官品质明显高于普通高温大曲。因此,探究不同温度大曲中微生物的构成和多样性,为进一步提升特香型白酒大曲的质量提供必要的数据支持是十分必要的。
本研究从江西省鹰潭市某酒业公司制曲车间采集了30份大曲样本,使用Illumina MiSeq高通量测序技术对其细菌菌群构成和多样性进行解析,并采用PICRUSt软件对中高温和高温大曲中细菌菌群的功能进行预测,以期为特香型白酒大曲的品质改善提供数据支持。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
特香型白酒中高温大曲(Z1~Z15)和高温大曲(G1~G15):采样于江西省鹰潭市某酒业公司制曲车间,中高温和高温大曲各15块,分别粉碎混匀后,每份五点取样300 g,并将其置于无菌袋中低温运回实验室备用。
1.1.2 试剂
rTaq酶、10×Buffer、脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP):宝生物工程(大连)有限公司;正向引物338F(5'-ACTCCTACGGGAGGCAGCA-3')和反向引物806R(5'-GGACTACHVGGGTWTCTAAT-3'):上海桑尼生物科技公司;高通量测序配套试剂、宏基因组DNA提取试剂盒:美国Illumina公司。其他试剂均为国产分析纯。
1.2 仪器与设备
MiSeq PE300高通量测序平台:美国Illumina公司;PowerEdge R930架式服务器:美国Dell公司;ND-2000C微量紫外分光光度计:美国Nano Drop公司;UVPCDS8000凝胶成像分析系统:美国Protein Simple公司;Veriti FAST梯度聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司。
1.3 方法
1.3.1 微生物宏基因组DNA提取及高通量测序
使用宏基因组DNA提取试剂盒对大曲中微生物的宏基因组DNA进行提取,并使用338F/806R引物对提取16SrRNA的V3-V4区基因进行PCR扩增,具体的PCR扩增条件和扩增体系参照王玉荣等[12]的方法。使用1.2%的琼脂糖凝胶电泳和微量紫外分光光度计对PCR扩增产物的浓度和纯度进行检验,并将检验合格的扩增产物送至上海美吉生物医药科技有限公司进行高通量测序,测序平台为Illumina MiSeq PE300。
1.3.2 生物信息学分析
将Illumina MiSeq平台的下机数据参照YANG C C等[13]的方法进行质控,并将质控后的高质量reads依据其碱基核苷酸标签(barcode)进行分配和质控,并将质控后的序列合并为一个fasta文件用于后续生物信息学分析。
本研究基于QIIME(v1.9.0)平台进行生物信息学分析,其主要步骤如下:首先使用PyNAST软件将高质量序列与16SrRNA标准数据库进行对齐和比对[14],并剔除非16SrRNA序列;使用UCLUST软件按照100%和97%相似度分两步对高质量的16S rRNA序列进行聚类[15],构建非冗余数据集和操作分类单元(operational taxonomic units,OTU);基于ChimeraSlayer软件对OTU中的嵌合体进行识别和剔除[16];分别基于SILVA、GREENGENE和核糖体数据库项目(ribosomal database project,RDP)数据库与每个OTU中的代表性序列进行同源性比对[17],并合并注释结果;基于Fast-Tree软件构建的系统发育树对大曲样本中细菌的α多样性和β多样性进行分析[18]。
基于GREENGENE数据库对高质量的序列进行聚类和注释,并使用PICRUSt软件对大曲中细菌菌群的功能基因进行预测[19],同时使用蛋白质直系同源簇(clusters of orthol ogous groups of proteins,COG)数据库对功能基因进行注释,以完成大曲中细菌的功能分析。
1.3.3 多元统计学分析
使用Wilcoxon test对中高温和高温大曲中细菌菌群的α多样性指数、菌群构成和功能类群进行差异分析;使用置换多因素方差分析对中高温和高温大曲中细菌菌群的整体结构进行分析;使用Spearman相关性分析对优势菌属间的相关关系进行分析。本研究所有分析和可视化均使用R软件完成。
2 结果与分析
2.1 大曲样品中细菌菌群多样性分析
采用4种α多样性指数对两种大曲样品中细菌群落的丰富度和多样性进行分析,结果见图1。
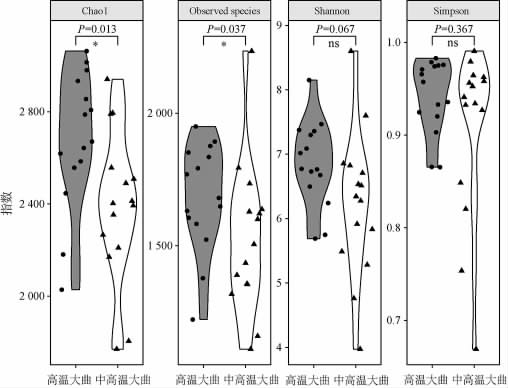
图1 中高温和高温大曲中细菌菌群的α多样性分析结果
Fig.1 Results of alpha diversity analysis of bacterial flora in medium-high-temperature and high-temperature Daqu
“*”表示差异显著(P<0.05),“ns”表示差异不显著(P>0.05)。
由图1可知,高温大曲中细菌菌群的Chao1指数和发现物种数(Observedspecies)均显著高于中高温大曲(P<0.05),但香农(Shannon)指数和辛普森(Simpson)指数则与中高温大曲无显著性差异(P>0.05)。Chao1指数和发现物种数常被用来评估环境中微生物的丰富度,而香农指数和辛普森指数常被用于评估环境中微生物的多样性。由此可见,高温大曲中细菌菌群的丰富度显著高于中高温大曲(P<0.05),但两者细菌菌群的α多样性指数无显著差异(P>0.05)。与α多样性相比,β多样性可以从定性和定量两个角度评估不同微生物群落间的整体相似性,基于加权和非加权的UniFrac距离对高温及中高温大曲中细菌群落结构进行主坐标分析(principal co-ordinates analysis,PCoA),结果见图2。
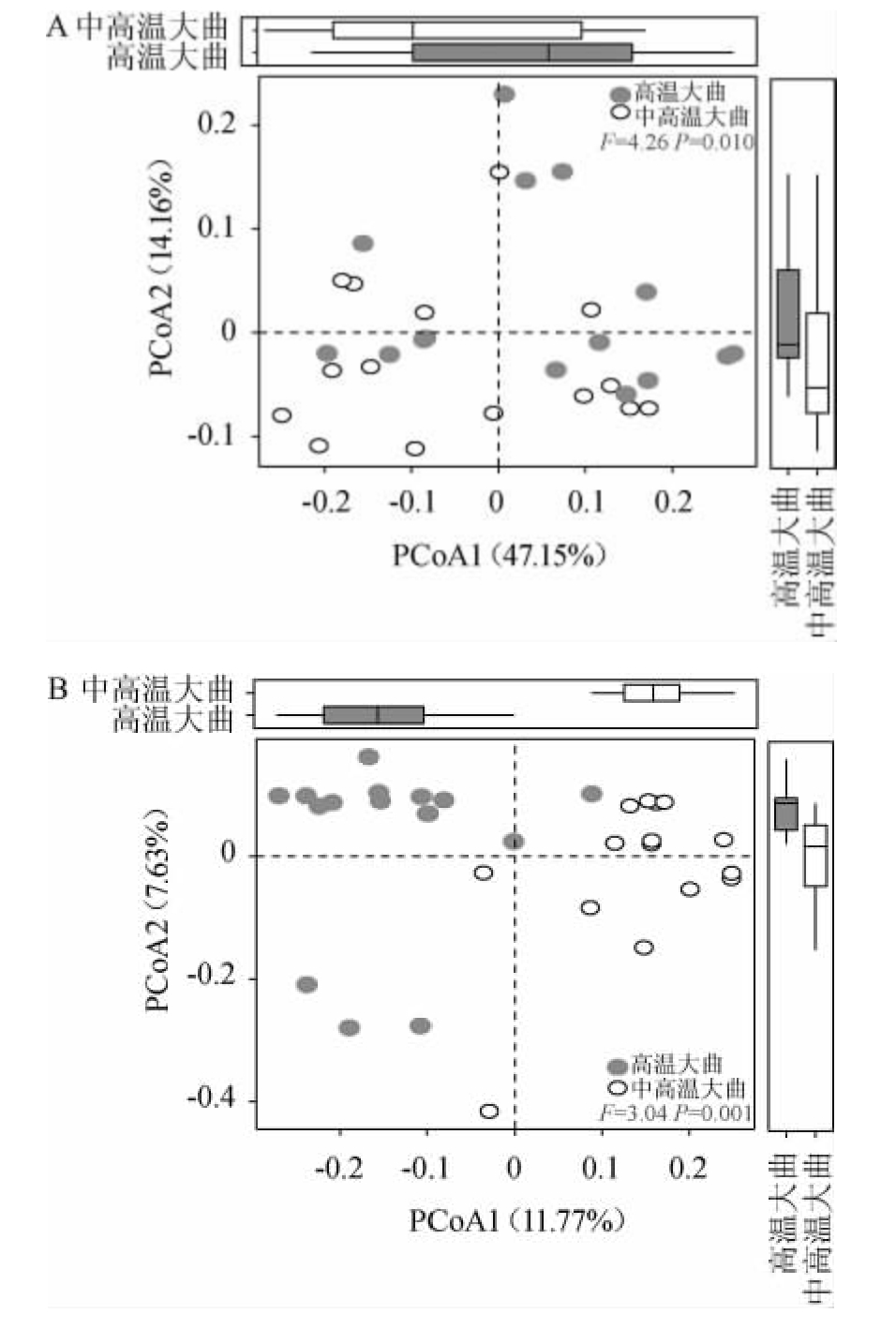
图2 基于加权(A)和非加权(B)的UniFrac距离大曲样品中细菌菌群结构的主坐标分析结果
Fig.2 Principal coordinate analysis results of bacterial flora structure of Daqu samples based on weighted (A) and unweighted (B)UniFrac distance
由图2A可知,中高温大曲样品主要集中在第三象限,两组大曲样本在空间分布上呈现出明显的分离趋势,且置换多因素方差分析发现,两者在空间分布上差异显著(F=4.26,P=0.010);由图2B可知,中高温大曲样品绝大部分分布于X轴的正方向,而高温大曲样品则绝大部分分布于X轴的负方向,两者在空间上几乎完全分离,且置换多因素方差分析也进一步证明两者具有显著差异(F=3.04,P=0.001)。非加权UniFrac在计算时仅考虑物种的存在,而加权UniFrac在计算时同时考虑了物种的存在和其在群落中的相对丰度。由此可见,中高温大曲和高温大曲样品中均存在大量独特的低丰度物种,且部分高丰度物种的丰度亦存在明显差异。
综上,两种大曲样品中细菌菌群的多样性无显著性差异(P>0.05),而中高温大曲样品中细菌菌群的丰富度显著高于高温大曲(P<0.05),究其原因可能与发酵温度紧密相关[20]。相关研究证实随着发酵温度的升高,部分微生物会停止生长代谢,甚至死亡[21]。同时,发酵温度的升高会导致大曲中水分的快速蒸发,从而降低大曲中的水分含量,而进一步限制大曲中细菌的生长繁殖。由此可见,不同的发酵温度会导致大曲中细菌的群落结构出现较大的差异。
2.2 大曲样品中细菌菌群结构分析
通过多样性分析发现,中高温和高温大曲样品中细菌的群落结构存在较大差异,为解析造成细菌群落差异的具体因素,进一步对大曲样品中细菌菌群的构成和相对丰度进行比较分析,大曲样品中细菌群落结构在门水平上的组成见图3。
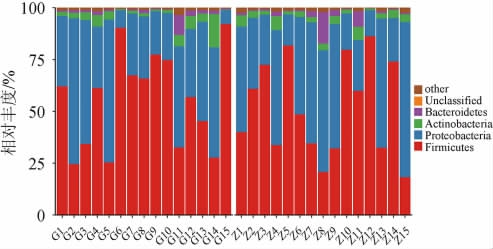
图3 基于门水平中高温和高温大曲样品中细菌菌群结构分析结果
Fig.3 Results of bacterial flora structure analysis of mediumhigh-temperature and high-temperature Daqu samples based on phylum level
other表示优势菌门(平均相对丰度>1%)外的其他菌门。
从大曲样品中共注释到39个细菌门,其中从高温大曲样品中注释到37种,而从中高温大曲样品中注释到32种。由图3可知,大曲样品中有4个优势细菌门(平均相对丰度>1%),分别为硬壁菌门(Firmicutes)(53.80%)、变形菌门(Proteobacteria)(39.35%)、放线菌门(Actinobacteria)(3.55%)和拟杆菌门(Bacteroidetes)(2.04%),且高温大曲和中高温大曲样品在门水平上的构成较为相似。在此基础上,进一步在属水平上对大曲样品中的细菌菌群结构进行分析,结果见图4。
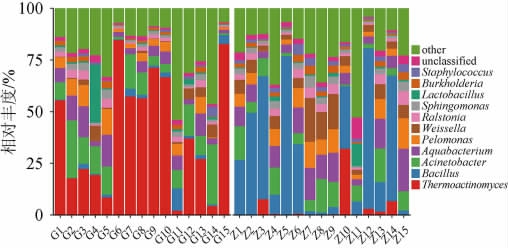
图4 基于属水平中高温和高温大曲样品中细菌菌群结构分析结果
Fig.4 Results of bacterial flora structure analysis of mediumhigh-temperature and high-temperature Daqu samples based on genus level
other表示优势菌属(平均相对丰度>1%)外的其他菌属。
从大曲样品中共注释到822个细菌属,其中高温大曲样品中注释到669个,而中高温大曲样品中共注释到657个。由图4可知,大曲样品中有11个优势细菌属(平均相对丰度>1%),分别为高温放线菌属(Thermoactinomyces)(22.25%)、芽孢杆菌属(Bacillus)(16.21%)、不动杆菌属(Acinetobacter)(10.00%)、水杆状菌属(Aquabacterium)(8.07%)、泥单胞菌属(Pelomonas)(5.51%)、魏斯氏菌属(Weissella)(4.62%)、劳尔氏菌属(Ralstonia)(2.55%)、鞘脂单胞菌属(Sphingomonas)(2.29%)、乳杆菌属(Lactobacillus)(1.95%)、伯克氏菌属(Burkholderia)(1.71%)和葡萄球菌属(Staphylococcus)(1.37%)。值得注意的是,与门水平构成不同,高温和中高温大曲样品中的优势细菌属存在明显区别。例如高温大曲样品中以Thermoactinomyces为主,平均相对丰度高达40.92%,而中高温大曲样品则以Bacillus为主,平均相对丰度为30.21%。
为了更加准确的对两类大曲样品中的差异物种进行分析,本研究利用线性判别分析效应量(linear discriminant analysis effect size,LEfSe)分析对两组样本标志菌群进行解析,结果见图5。
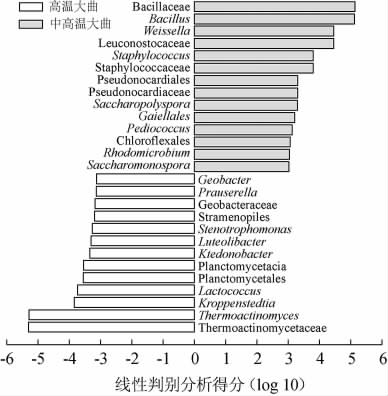
图5 中高温和高温大曲样品中细菌群落结构的LEfSe分析结果
Fig.5 LEfSe analysis results of bacteria community structure in medium-high-temperature and high-temperature Daqu samples
由图5可知,通过LEfSe分析共甄别到27个存在显著差异的细菌类群(P<0.05),其中有13个在中高温大曲样品中显著富集(P<0.05),有14个在高温大曲样品中显著富集(P<0.05)。进一步分析发现,存在差异的27个类群中有4个隶属于优势细菌属,分别为Bacillus、Weissella、Staphylococcus和Thermoactinomyces,其中Bacillus、Weissella和Staphylococcus在中高温大曲样品中显著富集(P<0.05),而Thermoactinomyces在高温大曲样品中显著富集(P<0.05)。
菌群差异分析进一步揭示了不同发酵温度对大曲中细菌菌群结构的影响,高温大曲样品中以高温放线菌属为主,而中高温大曲样品中则主要以Bacillus为主。何猛超等[22]针对茅台地区不同高温大曲细菌群落结构进行解析发现,高温大曲中的优势菌属主要为芽孢杆菌属、乳杆菌属和高温放线菌属等,其优势菌属种类与本研究类似,但相对丰度存在较大差异,这可能与大曲的种类和制作环境有着密切的联系。相关研究显示,芽孢杆菌是大曲中广泛存在并且丰度较高的细菌类群之一,其不仅具有强大的水解酶系统,还具有水解淀粉和蛋白质的能力,在白酒的发酵过程中发挥着重要的作用[4]。有研究证实高温放线菌属是一种耐高温菌属,其对于纤维素和淀粉具有较强的代谢能力,也直接或间接的影响着白酒的发酵进程[23]。大曲作为白酒重要的糖化剂和发酵剂,是白酒酿造过程中的内在驱动力,大曲中细菌群落的差异可能直接影响着白酒的发酵进程而最终影响白酒的品质。值得注意的是,高温大曲中乳酸菌的相对丰度较低,而相关研究已经证实乳酸菌对于白酒的香味形成具有重要的作用[24]。因此,乳酸菌相对丰度的下降在一定程度上也可能影响白酒的香味形成。
2.3 功能预测及相关性分析
本研究进一步使用PICRUSt软件对大曲样品中细菌群落的基因功能进行预测,并基于COG数据库对细菌的基因功能进行注释,结果见图6。
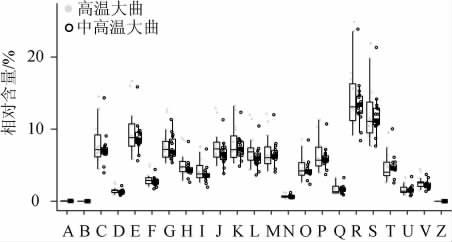
图6 中高温和高温大曲样品中细菌菌群功能类别的比较
Fig.6 Comparison of functional categories in medium-hightemperature and high-temperature Daqu samples
A:核糖核酸(ribonucleic acid,RNA)的加工与修饰;B:染色质结构与动力学;C:能量生产和转换;D:细胞周期控制、细胞分裂、染色体分割;E:氨基酸转运与代谢;F:核苷转运与代谢;G:碳水化合物运输和代谢;H:辅酶转运与代谢;I:脂质转运与代谢;J:翻译、核糖体结构与生物发生;K:转录;L:复制、重组和修复;M:细胞壁/膜/包膜生物发生;N:细胞运动;O:翻译后修饰,蛋白质周转,伴侣;P:无机离子运输与代谢;Q:次生代谢产物的合成、转运和分解代谢;R:一般功能预测;S:未知功能;T:信号转导机制;U:细胞内运输,分泌和囊泡运输;V:防御机制;Z:细胞骨架。
由图6可知,从高温大曲样品中共注释到4 644个COGs,这些COGs主要隶属于23个一级功能层。一般功能预测和未知功能具有最高的表达量,而RNA的加工与修饰表达量相对较低。经Wilcoxon检验发现,23个一级功能在两组中均不存在显著性差异(P>0.05)。同时,本研究进一步对高温和中高温大曲样品中优势细菌属间的相关性进行分析,结果见图7。
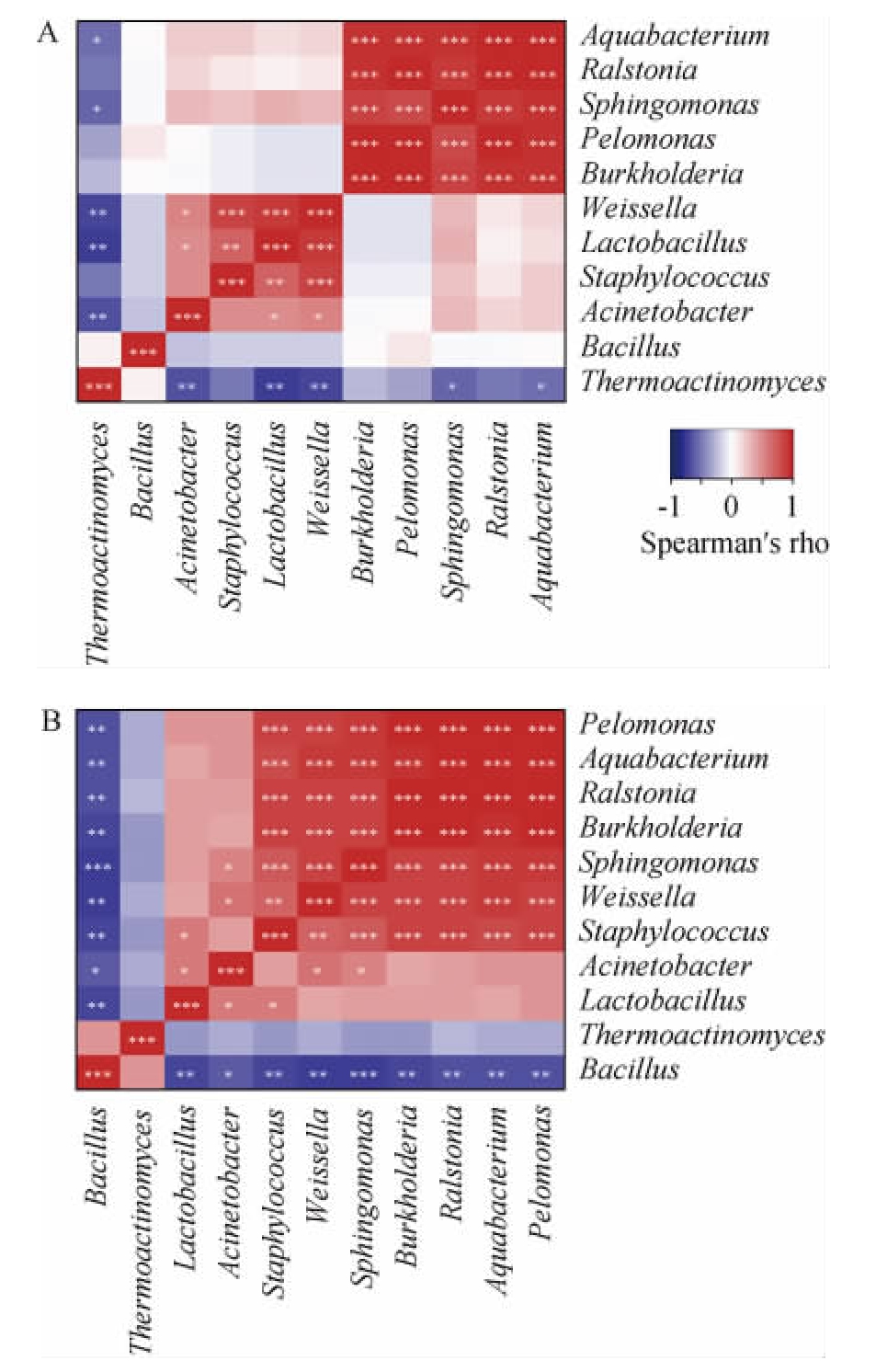
图7 高温(A)和中高温(B)大曲样品中优势细菌属间的相关性分析结果
Fig.7 Correlation analysis results of dominant bacteria genera between high-temperature (A) and medium-high-temperature (B)Daqu samples
“*”代表相关性显著(P<0.05);“**”代表相关性非常显著(P<0.01);“***”代表相关性极显著(P<0.001)
由图7可知,高温大曲样品中的优势细菌属间存在20条显著相关关系(P<0.05),而中高温大曲样品中的优势细菌属间则存在34条显著相关关系(P<0.05)。由此可见,中高温大曲样品中优势细菌属之间的互作强度明显高于高温大曲,高温可能影响生态中微生物网络的稳定性。
相关研究已经证实,与生态中微生物群落结构稳定性相比,其功能结构具有更高的稳定性[25]。尽管生态中可能存在极少部分的微生物具有某些特殊的功能,但绝大多数功能在生态中是存在冗余的[25]。因此,部分物种的丰度发生变化并不会直接导致生态系统的整体功能发生较大的变化。而通过物种构成分析发现,温度的变化主要影响高温放线菌属和芽孢杆菌属的丰度,而两者均具有代谢碳水化合物的能力,这也可能是一级功能层没有显著变化的原因之一。同时,本研究发现中高温大曲样品中优势菌属的相互作用更强,这表明中高温大曲中细菌群落具有更高的稳定性,可能有利于白酒品质的稳定。
3 结论
本研究采用高通量测序技术对鹰潭特香型白酒中高温和高温大曲中细菌菌群的多样性和构成进行解析,结果发现,中高温和高温大曲细菌菌群多样性差异不显著(P>0.05),但前者细菌菌群丰富度显著高于后者(P<0.05)。特香型大曲中的细菌菌群主要隶属于Firmicutes和Proteobacteria,以Thermoactinomyces、Bacillus和Acinetobacter为主,且高温和中高温大曲中的主要差异菌属分别为Thermoactinomyces和Bacillus等。功能预测和相关性分析表明,中高温和高温大曲样品中细菌菌群功能无显著性差异(P>0.05),而高温大曲样品中优势菌属之间的互作强度明显低于中高温大曲。综上,大曲发酵温度的变化会导致大曲中的细菌群落结构和丰富度出现显著变化,且温度的变化会明显影响大曲中细菌群落的稳定性。
[1]ZHANG X W,HAN B Z. Baijiu,Chinese liquor: history,classification and manufacture[J].J Ethnic Foods,2016,3(1):19-25.
[2]章肇敏,吴生文.特香型白酒酿造工艺分析[J].中国酿造,2012,31(5):164-167.
[3]张治刚,张彪,赵书民,等.中国白酒香型演变及发展趋势[J].中国酿造,2018,37(2):15-18.
[4]刘青阳,黄晓宁,陆玮,等.中高温大曲中芽孢杆菌多样性及代谢特征研究[J].中国酿造,2022,41(7):26-31.
[5]林钰宽,吴生文,游勇,等.不同培曲工艺对特香型大曲微生物群落结构的影响[J].食品与发酵工业,2022,48(6):188-194.
[6]DENG L,MAO X,LIU D,et al.Comparative analysis of physicochemical properties and microbial composition in high-temperature Daqu with different colors[J].Front Microbiol,2020,11(5):588117.
[7]HE G Q,HUANG J,ZHOU R Q,et al.Effect of fortified Daqu on the microbial community and flavor in Chinese strong-flavor liquor brewing process[J].Front Microbiol,2019,10:56.
[8]JIN Y,LI D,AI M,et al.Correlation between volatile profiles and microbial communities: a metabonomic approach to study Jiang-flavor liquor Daqu[J].Food Res Int,2019,121(7):422-432.
[9]CAI W C,WANG Y R,NI H,et al.Diversity of microbiota,microbial functions,and flavor in different types of low-temperature Daqu[J].Food Res Int,2021,150:110734.
[10]陈可丹,吴晓江,陈延儒,等.顶温对特香型大曲理化指标及菌群演替的影响[J].食品与发酵工业,2020,46(5):52-58.
[11]明红梅,刘宇驰,卓毓崇,等.制曲温度对酱香型大曲质量的影响[J].中国酿造,2010,29(7):157-160.
[12]王玉荣,杨成聪,葛东颖,等.扩增区域对鲊广椒细菌MiSeq测序的影响[J].食品科学,2019,40(10):134-140.
[13]YANG C C,ZHAO F Y,HOU Q C,et al.PacBio sequencing reveals bacterial community diversity in cheeses collected from different regions[J].J Dairy Sci,2020,103(2):1238-1249.
[14]CAPORASO J G,BITTINGER K,BUSHMAN F D,et al.PyNAST: a flexible tool for aligning sequences to a template alignment[J].Bioinformatics,2010,26(2):266-267.
[15]EDGAR R C.Search and clustering orders of magnitude faster than BLAST[J].Bioinformatics,2010,26(19):2460-2461.
[16]KING W L,JENKINS C,GO J,et al.Characterisation of the Pacific oyster microbiome during a summer mortality event[J].Microb Ecol,2019,77(2):502-512.
[17]MAIDAK B L,COLE J R,LILBURN T G,et al.The RDP (ribosomal database project)continues[J].Nucleic Acids Res,2000,28(1):173-174.
[18]PRICE M N,DEHAL P S,ARKIN A P.FastTree:computing large minimum evolution trees with profiles instead of a distance matrix[J].Mol Biol Evol,2009,26(7):1641-1650.
[19]WILKINSON T J,HUWS S A,EDWARDS J E,et al.CowPI: a rumen microbiome focussed version of the PICRUSt functional inference software[J].Front Microbiol,2018,9(5):1095.
[20]HOU Q C,WANG Y R,CAI W C,et al.Metagenomic and physicochemical analyses reveal microbial community and functional differences between three types of low-temperature Daqu[J].Food Res Int,2022,156:111167.
[21]ZHU M,ZHENG J,XIE J,et al.Effects of environmental factors on the microbial community changes during medium-high temperature Daqu manufacturing[J].Food Res Int,2022,153:110955.
[22]何猛超,任义平,熊林,等.茅台地区不同高温大曲微生物群落结构解析[J].中国酿造,2022,41(6):51-57.
[23]PANOSYAN H.Thermoactinomycetes isolated from geothermal springs in Armenia capable of producing extracellular hydrolases[J].Environ Sustain,2019,2:219-226.
[24]ZHAO Q S,YANG J G,ZHANG K Z,et al.Lactic acid bacteria in the brewing of traditional Daqu liquor[J].J I Brewing,2020,126(1):14-23.
[25]OLSSON L M,BOULUND F,NILSSON S,et al.Dynamics of the normal gut microbiota:A longitudinal one-year population study in Sweden[J].Cell Host Microbe,2022,30(5):726-739.