虾青素(astaxanthin)化学名为3,3'-二羟基-4,4'-二酮基-β,β'-胡萝卜素,是一种深红色的酮式类胡萝卜素[1-2],天然虾青素主要来源于藻类、虾蟹类、酵母等生物体[3]。许多研究表明,虾青素具有抗氧化、抗炎、抗癌、保护免疫系统等多种功能特性,在动物饲料、食品工业、保健品、化妆品等多个行业得到了广泛的应用[4-11]。
目前,虾青素的生产方法主要有化学合成法、提取法、微生物合成法[12]。化学合成法合成的虾青素抗氧化活性低,合成过程污染高[13];从虾壳、蟹壳等甲壳废弃物中提取的虾青素含量低,提取过程复杂,易造成污染[14];微生物合成虾青素主要包括雨生红球藻(Haematococcus pluvialis)合成法和红发夫酵母(Phaffia rhodozyma)合成法,雨生红球藻生长周期长,培养条件苛刻,需要光照,主要以酯化形式存在,游离虾青素较少,虾青素存在于厚壁孢子中,提取困难[15-16];红发夫酵母生产虾青素生长周期短,易于培养,生产的虾青素为游离态,被美国食品药品监督管理局(food anddrugadministration,FDA)确认为一般认为安全(generally recognized as safe,GRAS)级[17]。红发夫酵母能够利用农业食品废弃物作为廉价的营养源,菌体可直接作为饲料添加剂,是一种比化学法更绿色、更安全的选择[18-21],在可持续生产领域具有很大的潜能。
目前,野生型红发夫酵母合成虾青素的产量较低,还不能满足工业化生产需求,主要通过诱变选育及发酵条件优化提高虾青素的产量,刘晓桐等[22]通过亚硝基胍诱变,选育出一株稳定遗传的突变株,并对突变株发酵条件进行优化,其虾青素含量达到279.89 μg/g,与出发菌株相比,虾青素含量提高98.9%;何璞等[23]通过原生质体融合和紫外诱变选育虾青素高产菌株,虾青素产量为4.79 mg/L,较出发菌株提高85.6%。
紫外光(ultra violet,UV)能阻碍碱基间的正常配对,引起基因突变,是微生物育种中常见且有效的诱变方法之一[24]。硫酸二乙酯(diethyl sulfate,DES)是一种具有烷化作用的化学诱变剂,能与脱氧核糖核酸(deoxyribonucleic acid,DNA)发生烷化作用,使DNA复制时碱基发生错配而引起突变[25]。物理化学复合诱变具有协同效应,优于单一诱变[26]。因此,本研究以红发夫酵母(Phaffia rhodozyma)PR2为出发菌株,采用UV-DES对其进行复合诱变,经过二苯胺平板初筛与摇瓶复筛及遗传稳定性试验筛选一株稳定遗传的高产虾青素突变株,并通过单因素试验优化其发酵条件,进一步提高虾青素产量,为红发夫酵母工业化生产虾青素提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
红发夫酵母(Phaffia rhodozyma)PR2:本实验室保藏。
1.1.2 试剂
葡萄糖、蛋白胨、酵母浸粉、磷酸二氢钾、硫酸镁、硫酸铵、氯化钙、琼脂粉、硫酸二乙酯(DES)、无水乙醇(均为分析纯或生化试剂):国药集团化学试剂有限公司;甲醇(色谱纯):赛默飞世尔科技(中国)有限公司;二苯胺(分析纯):上海麦克林生化科技有限公司;虾青素标准品(纯度≥98%):上海源叶生物科技有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基[27]:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸粉10 g/L,pH自然,115 ℃高压蒸汽灭菌20 min。固体培养基中添加琼脂20 g/L。
初筛培养基[28]:在YPD固体培养基中添加不同浓度(20 μmol/L、40 μmol/L、50 μmol/L、60 μmol/L、80 μmol/L)的二苯胺(色素合成抑制剂)。
发酵培养基[29]:葡萄糖20 g/L,酵母浸粉3 g/L,磷酸二氢钾2 g/L,硫酸镁0.5 g/L,硫酸铵5 g/L,氯化钙0.2 g/L,115 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
PTX-FA210S电子天平:华志(福建)电子科技有限公司;PB-10酸度计:赛多利斯科学仪器(北京)有限公司;Heraeus Fresco 21低温高速离心机:赛默飞世尔科技(中国)有限公司;MX-S可调式混匀仪:大龙兴创试验仪器(北京)股份公司;K2025高效液相色谱(high performance liquid chromatography,HPLC)仪:山东悟空仪器有限公司。
1.3 方法
1.3.1 生长曲线的绘制
取0.5 mL甘油管保藏的红发夫酵母PR2菌液接种于YPD液体培养基,22 ℃、180 r/min振荡培养48 h,取1 mL活化好的菌液接种于50 mL YPD液体培养基中,每2 h取样一次,利用紫外可见光分光光度计在波长600 nm处测定菌液的吸光度值(OD600nm值),以培养时间为横坐标,OD600nm值为纵坐标,绘制生长曲线。
1.3.2 二苯胺添加浓度的确定
二苯胺是酵母类胡萝卜素合成抑制剂,加入一定浓度的二苯胺,能够使菌落颜色变淡变白,根据此原理,二苯胺可用于高产虾青素菌株的初筛[30]。将对数生长期的菌液稀释至10-4,取0.1 mL稀释液涂布于含有不同浓度二苯胺的初筛培养基平板上,置于22 ℃恒温培养箱中倒置培养4 d,观察菌落生长状况及颜色,将不影响菌株生长且使菌落成白色的最低浓度,确定为最佳二苯胺添加浓度。
1.3.3 红发夫酵母PR2的诱变处理
(1)UV诱变
无菌超净台中25W UV灯预热30 min,将对数生长期的菌液稀释至10-4,取0.1 mL涂布于YPD固体培养基平板上,打开皿盖,将其置于UV灯下45 cm处,分别照射20 s、40 s、60 s、80 s、100 s、120 s、140 s、180 s,22 ℃倒置培养4 d,记录平板菌落数,根据空白对照(未经UV诱变处理)平板上的菌落数,计算不同照射时间UV诱变致死率,以UV照射时间为横坐标,致死率为纵坐标,绘制UV诱变致死曲线。UV诱变致死率计算公式如下:
(2)DES诱变
以UV诱变筛选得到的突变株为DES诱变出发菌株,取2 mL菌液4 ℃条件下8 000 r/min离心5 min,用无菌生理盐水洗涤3次,离心收集菌体。将菌体分别重悬于2 mL0.5%、1%、1.5%、2%、2.5%的DES溶液中,在22℃条件下处理30 min,加入2 mL过滤除菌的10%硫代硫酸钠溶液,中和DES,终止反应。将诱变后的菌液梯度稀释至10-4,取0.1 mL稀释液涂布于YPD固体培养基平板上,22 ℃倒置培养4 d。根据空白对照(未经DES诱变处理)平板上的菌落数,计算不同含量DES的诱变致死率,以DES含量为横坐标,致死率为纵坐标,绘制DES诱变致死曲线。DES诱变致死率计算公式同UV诱变致死率计算公式。
1.3.4 高产虾青素菌株的筛选
初筛:以上述确定的最佳条件进行诱变处理,将诱变处理的菌液梯度稀释至10-4,取0.1mL稀释液涂布于含有最佳浓度二苯胺的YPD固体培养基平板,待菌落长出后,挑取生长快、颜色红、菌落大的单菌落作为初筛菌株,并对其进行编号。
复筛:将初筛的突变株接种于YPD液体培养基,22 ℃条件下培养24 h,按照6%(V/V)的接种量接种于发酵培养基,22 ℃、160 r/min条件下发酵培养96 h,测定生物量及虾青素产量,筛选虾青素高产菌株。
1.3.5 遗传稳定性试验
将筛选得到的突变株连续传代8次,将每一代突变株按6%(V/V)的接种量接种于发酵培养基,分别测定其生物量及虾青素产量,选取遗传性质稳定且高产虾青素的菌种,保藏备用。
1.3.6 突变株产虾青素发酵条件优化
初始发酵条件为发酵温度22 ℃、初始pH自然、接种量6%、摇瓶转速160 r/min、摇瓶装液量75 mL/300 mL,发酵时间96 h。采用单因素轮换法依次考察发酵温度(18 ℃、20 ℃、22 ℃、24 ℃、26 ℃)、初始pH值(4.0、4.5、5.0、5.5、6.0)、接种量(4%、6%、8%、10%、12%)、转速(160 r/min、180 r/min、200 r/min、220 r/min、240 r/min)、装液量(50 mL/300 mL、75 mL/300 mL、100 mL/300 mL、125 mL/300 mL、150 mL/300 mL)、发酵时间(72 h、84 h、96 h、108 h、120 h、132 h、144 h)对突变株生物量和虾青素产量的影响。
1.3.7 测定方法
生物量的测定:取2 mL菌液于离心管中,8 000 r/min离心5 min,离心得到的菌体用无菌水清洗3次,将菌体沉淀于烘箱内干燥至恒质量,称量菌体干质量,计算生物量,每次做3个平行。生物量计算公式如下:
虾青素产量的测定:取2mL发酵液于离心管中,8 000r/min离心5 min,离心得到的菌体用无菌水洗涤3次,收集菌体,用1 mL无水乙醇重悬制成菌悬液,加入100 mg直径为0.5 mm的玻璃珠,放置于可调式混匀仪,1 000 r/min振荡破壁30min,8 000 r/min离心5 min,上清即为虾青素提取液,按照此步骤反复破壁提取至菌体为白色,合并提取液。用0.22 μm微滤膜过膜,采用高效液相色谱法测定酵母提取液中虾青素的产量[31]。
1.3.8 数据处理
采用Excel 2019对数据进行整理,用Origin 2018对数据进行作图。每组试验重复3次,数据结果以“平均值±标准差”表示。
2 结果与分析
2.1 生长曲线的绘制
出发菌株红发夫酵母(Phaffia rhodozyma)PR2的生长曲线见图1。由图1可知,培养12 h后开始进入对数生长期,培养30 h达到稳定期。有研究发现,对数生长期菌液浓度合适,对理化因素敏感,有利于进行诱变处理[32],故选取培养24 h的菌体进行诱变处理。
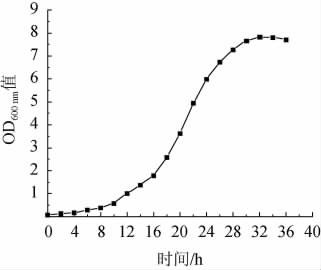
图1 红发夫酵母PR2的生长曲线
Fig.1 Growth curve of Phaffia rhodozyma PR2
2.2 二苯胺添加浓度的确定
将出发菌株红发夫酵母PR2稀释涂布于含有不同浓度二苯胺的YPD固体培养基平板上,其颜色变化见图2。由图2可知,随着二苯胺浓度的增加,菌落红色逐渐变淡,在含有50 μmol/L二苯胺的平板上,菌落呈白色且菌落大小无明显影响,因此,确定二苯胺的最佳添加浓度为50 μmol/L。

图2 不同二苯胺浓度对红发夫酵母PR2菌落颜色的影响
Fig.2 Effects of different diphenylamine concentrations on Phaffia rhodozyma PR2 colony color
2.3 诱变条件的确定
2.3.1 UV诱变致死曲线
将经过不同时间UV诱变处理的菌株PR2菌液稀释涂布于YPD固体培养基平板,22 ℃倒置培养4 d,UV诱变致死曲线见图3。由图3可知,致死率与UV照射时间呈正相关,当UV照射时间为100 s时,致死率为77.18%,通常认为致死率在70%~80%可获得较高的正突变率[33],故选择100 s作为最佳UV诱变时间。
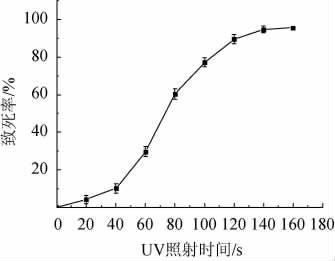
图3 菌株PR2 UV诱变致死曲线
Fig.3 Lethal curve of strain PR2 by UV mutation
2.3.2 DES诱变致死曲线
将经过不同含量的DES诱变处理的菌液稀释涂布于YPD固体培养基平板,22 ℃倒置培养4 d,DES诱变菌株PR2致死曲线见图4。由图4可知,DES诱变致死率随DES含量的增加而增加,DES含量为1%时致死率为75.57%,选择其作为最佳DES诱变含量。
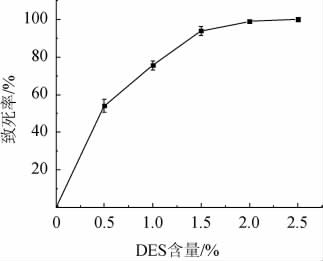
图4 菌株PR2硫酸二乙酯诱变致死曲线
Fig.4 Lethal curve of strain PR2 by diethyl sulfate mutation
2.4 高产虾青素突变菌株的筛选结果
2.4.1 UV诱变筛选结果
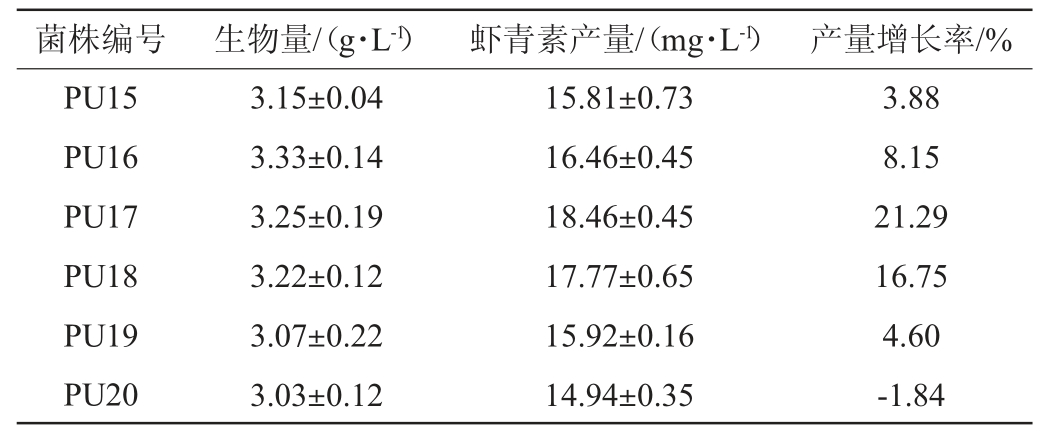
将UV照射100 s的红发夫酵母PR2菌液稀释涂布于含有50 μmol/L二苯胺的YPD固体培养基平板上,培养4 d,选取20株颜色红、分离好、形态较大的单菌落接种于YPD液体培养基培养至对数生长期,按照10%(V/V)的接种量接种于发酵培养基,测定生物量和虾青素产量,结果见表1。由表1可知,突变株PU9生物量和虾青素产量最高,分别为3.45 g/L、19.21 mg/L,与出发菌株相比,虾青素产量增加26.22%。因此,将突变株PU9作为进行DES诱变的出发菌株。
表1 UV诱变后突变株的生物量与虾青素产量
Table 1 Biomass and astaxanthin production of mutant strains after UV mutation
续表
2.4.2 DES诱变筛选结果
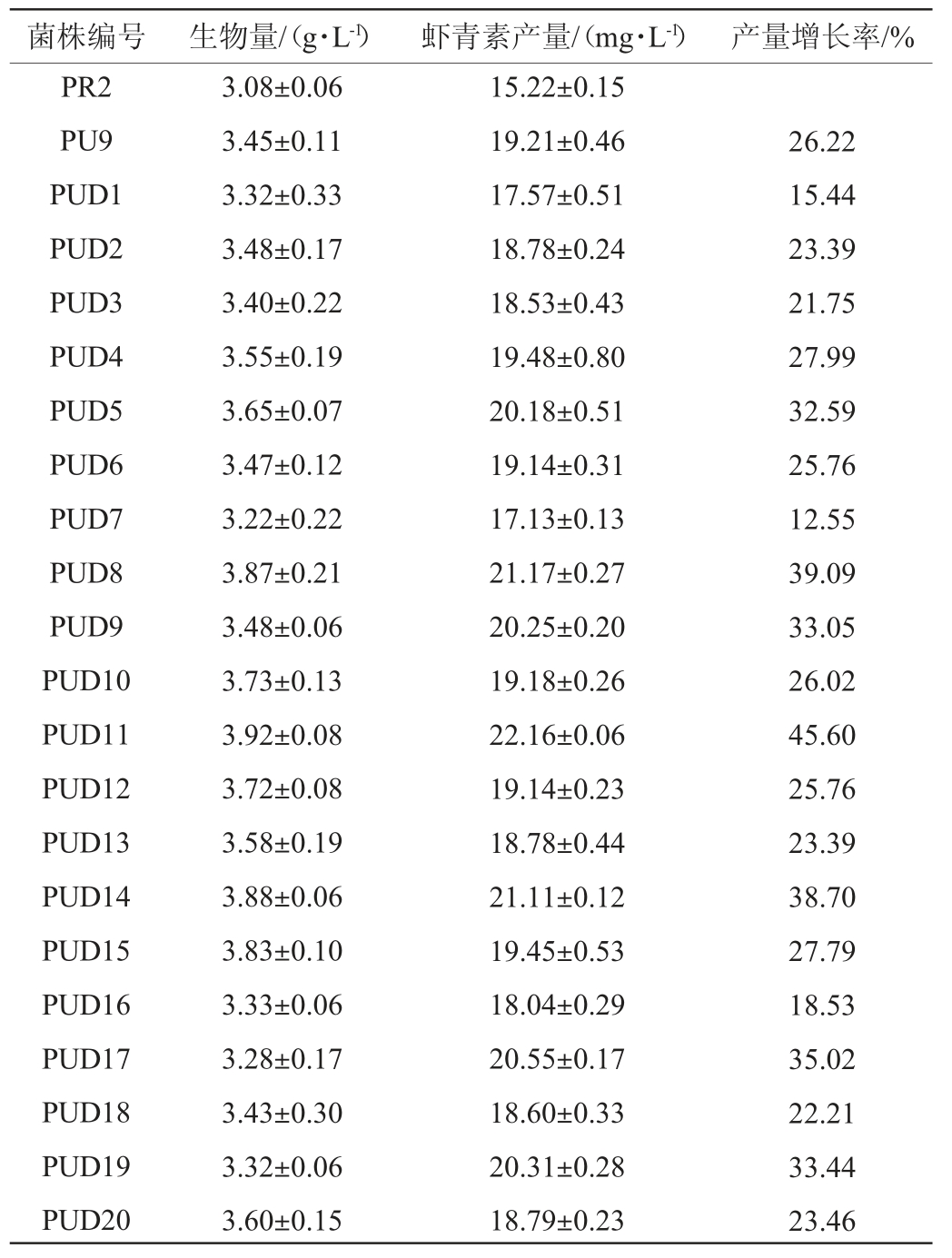
采用1%的DES处理突变株PU9菌悬液30 min,稀释涂布于含有50 μmol/L二苯胺的平板,培养4 d,经过观察,挑选20株颜色红、分离好、形态较大的单菌落进行摇瓶发酵培养,测定其生物量及虾青素产量,结果见表2。由表2可知,突变株PUD8、PUD11、PUD14的虾青素产量增幅较大,与出发菌株红发夫酵母PR2相比,虾青素产量分别增加39.09%、45.60%、38.70%,因此,对这3株诱变株进行遗传稳定性试验。
表2 UV-硫酸二乙酯复合诱变后突变株的生物量与虾青素产量
Table 2 Biomass and astaxanthin production of mutant strains induced by UV and diethyl sulfate compound mutation
2.5 突变株的遗传稳定性试验结果
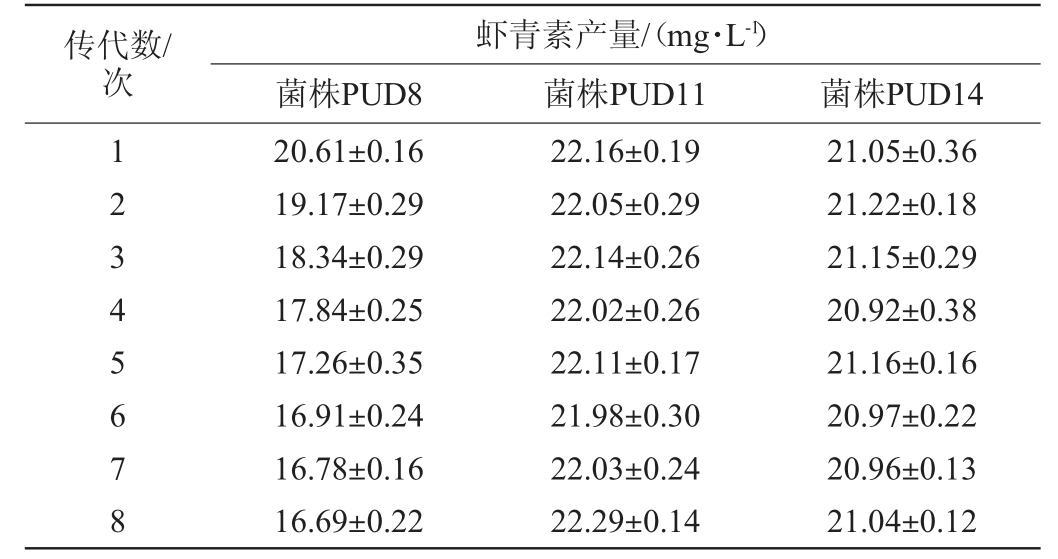
将获得的突变株PUD8、PUD11、PUD14连续传代8次,测定每一代菌株的虾青素产量,结果见表3。由表3可知,随着传代次数的增加,突变株PUD8的虾青素产量有所下降,突变株PUD11和PUD14的遗传稳定性好,且突变株PUD11的虾青素产量最高,为22.16 mg/L,比出发菌株PR2提高了45.60%。因此,选择突变株PUD11为高产虾青素且稳定遗传的优良菌株。
表3 突变株的遗传稳定性试验结果
Table 3 Genetic stability test results of mutant strains
2.6 突变株PUD11产虾青素发酵条件优化单因素试验结果
不同发酵条件对突变株PUD11生物量和虾青素产量的影响见图5。
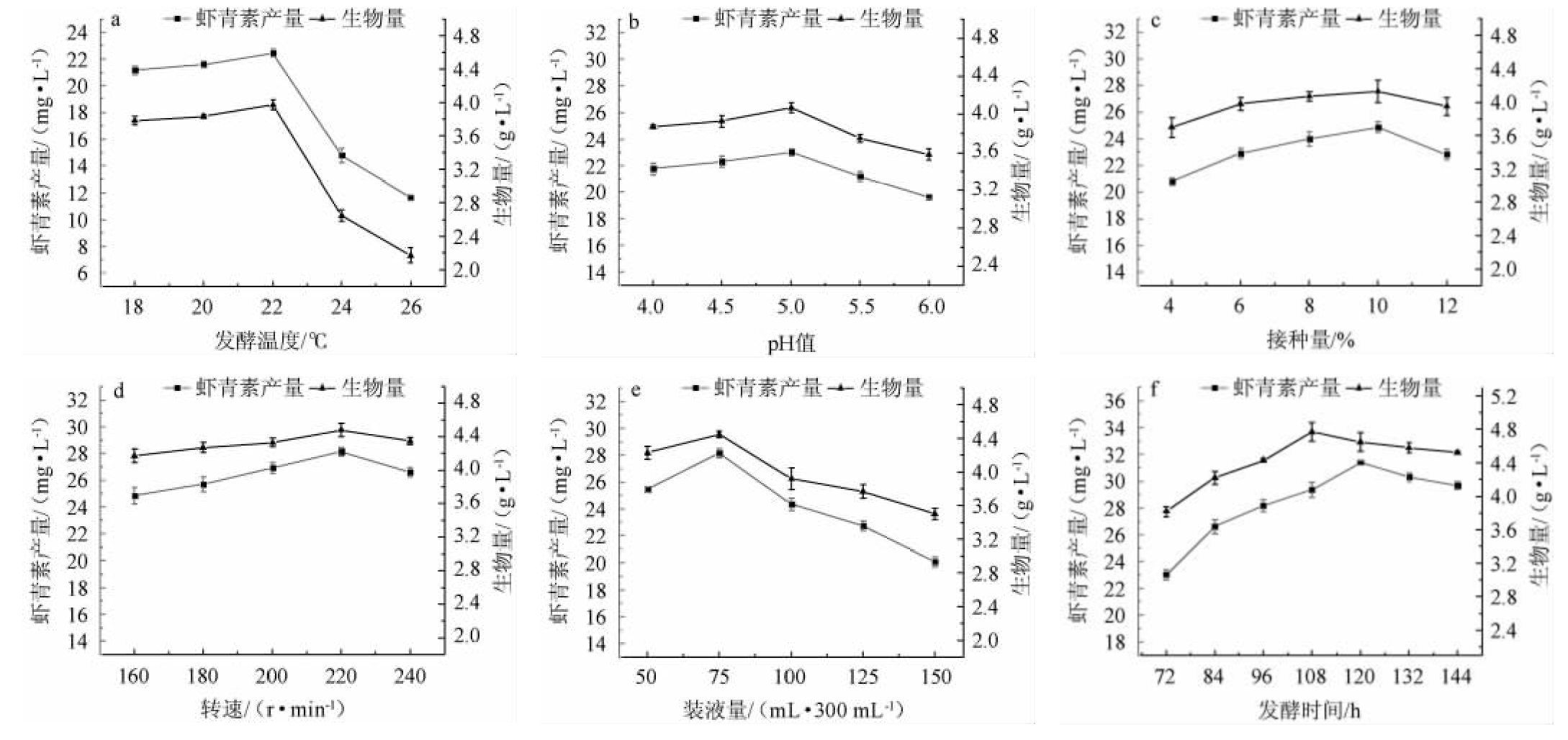
图5 突变株PUD11发酵条件优化结果
Fig.5 Results of fermentation conditions optimization of mutant strain PUD11
由图5a可知,当培养温度在18~22 ℃时,突变株PUD11的生物量和虾青素产量变化较小;当培养温度为22~26 ℃时,生物量和虾青素产量呈递减的趋势,可能原因是红发夫酵母PR2最初是从美国阿拉斯加高山和日本北海道山区分离得到的,生长温度一般都是在15~25 ℃之间[34];当培养温度为22 ℃时,生物量和虾青素产量均达到最高,分别为3.93 g/L和22.44 mg/L。
由图5b可知,当初始pH值从4.0~5.0时,突变株PUD11的生物量和虾青素产量变化不大;当初始pH>5.0之后,生物量和虾青素产量降低;当初始pH为5.0时,生物量和虾青素产量均达到最大,分别为3.97 g/L和23.03 mg/L。
由图5c可知,当接种量为4%~10%时,随着接种量的增加,突变株PUD11的生物量和虾青素产量增加;当接种量为10%时,生物量和虾青素产量均达到最大,分别为4.13 g/L和24.87 mg/L;但随着接种量的继续增大,生物量和虾青素产量均减少,可能是因为接种量过大时,会导致前期生长过快,营养成分不足而提前死亡,影响产物合成[35]。
红发夫酵母是好氧菌[36],溶氧量对其生长和产物合成具有重要影响,摇瓶水平影响溶氧量的主要是转速和装液量,由图5d和图5e可知,随着转速和装液量的增加,突变株PUD11的生物量及虾青素产量均呈先升高后下降的趋势,当转速为220 r/min时,生物量及虾青素产量均达到最高,分别为4.48 g/L、28.12 mg/L;当装液量为75 mL/300 mL时,生物量和虾青素产量均达到最高,分别为4.45 g/L和28.15 mg/L。
由图5f可知,随着发酵时间的延长,突变株PUD11的生物量和虾青素产量均呈先升高后下降的趋势,当发酵时间为108 h时,生物量达到最大,为4.77 g/L,当发酵时间为120 h时,虾青素产量达到最大,为31.39 mg/L,说明虾青素的合成在时间上滞后于酵母的生长,为了积累更多的虾青素,选择120 h作为最佳发酵时间。
综上,确定突变株PUD11的最优发酵条件为发酵温度22 ℃、培养基初始pH值5.0、接种量10%、摇瓶转速220 r/min,装液量75 mL/300 mL,发酵时间120 h,在此条件下,虾青素产量达到最高,为31.39mg/L,比优化前提高了41.65%。目前,摇瓶水平红发夫酵母产虾青素的产量主要在1~30 mg/L之间[37],由此可知,虾青素产量31.39 mg/L属于较高产量,为后续红发夫酵母高密度发酵高产虾青素做铺垫。
3 结论
本研究以红发夫酵母PR2为出发菌株,采用UV-DES复合诱变,确定UV照射时间为100 s,DES含量为1%为最佳复合诱变条件,对诱变后的菌株进行二苯胺平板初筛、摇瓶复筛、遗传稳定性试验,最终筛选获得一株高产虾青素且可稳定遗传的突变菌株PUD11,其虾青素产量为22.16 mg/L。通过单因素试验确定突变菌株PUD11产虾青素的最佳发酵条件为发酵温度22 ℃、初始pH值5.0、接种量10%、摇瓶转速220 r/min,装液量75 mL/300 mL,发酵时间120 h。在此优化条件下,虾青素产量达到31.39 mg/L,较出发菌株提高106.24%,为红发夫酵母工业化生产虾青素奠定基础。后续研究可通过比较出发菌株与突变菌株基因表达差异,从分子水平对突变株提高产量的机制进行探究,为进一步提高虾青素产量提供理论依据。
[1]HAN D,LI Y,HU Q.Astaxanthin in microalgae:pathways,functions and biotechnological implications[J].Algae,2013,28(2):131-147.
[2]宋超,王际辉,叶淑红,等.红法夫酵母分批发酵产虾青素条件的优化[J].中国酿造,2009,28(12):59-61.
[3]SCHMIDT I,SCHEWE H,GASSEL S,et al.Biotechnological production of astaxanthin with Phaffia rhodozyma/Xanthophyllomyces dendrorhous[J].Appl Microbiol Biotechnol,2011,89(3):555-571.
[4]姚金明,陈秀梅,刘明哲,等.饲料中添加虾青素对大鳞副泥鳅生长和体色的影响[J].饲料工业,2019,40(8):46-51.
[5]姜巨峰,韩现芹,周勇,等.饲料中添加天然虾青素对棘颊雀鲷生长性能及体色的影响[J].饲料研究,2021,44(20):38-42.
[6]陈秀梅,高东旭,李祖洋,等.虾青素对黄颡鱼生长、体色及抗氧化的影响[J].饲料工业,2022,43(4):21-24.
[7]AO X,KIM I H.Effects of astaxanthin produced by Phaffia rhodozyma on growth performance,antioxidant activities,and meat quality in Pekin ducks[J].Poult Sci,2019,98(10):4954-4960.
[8]STACHOWIAK B,SZULC P.Astaxanthin for the food industry[J].Molecules,2021,26(9):2666.
[9]KANWUGU O,GLUKHAREVA T,DANILOVA I,et al.Natural antioxidants in diabetes treatment and management:prospects of astaxanthin[J].Crit Rev Food Sci Nutr,2022,62(18):5005-5028.
[10]付佳.天然虾青素的生物保健功能及安全性概述[J].国外医学:卫生学分册,2007,34(6):382-386.
[11]GONG M,BASSI A.Carotenoids from microalgae: A review of recent developments[J].Biotechnol Adv,2016,34(8):1396-1412.
[12]张辰,徐慧,朱坤福,等.微生物法生产虾青素的研究进展[J].中国酿造,2021,40(10):29-35.
[13]崔海辉.虾青素的生物学功能及在动物生产中的应用[J].饲料研究,2019,42(9):112-115.
[14]ZHANG C,CHEN X,TOO H P.Microbial astaxanthin biosynthesis:recent achievements,challenges,and commercialization outlook[J].Appl Microbiol Biotechnol,2020,104(13):5725-5737.
[15]BAUER A,MINCEVA M.Direct extraction of astaxanthin from the microalgae Haematococcus pluvialis using liquid-liquid chromatography[J].RSC Adv,2019,9(40):22779-22789.
[16]KATSUDA T,SHIRAISHI H,ISHIZU N,et al.Effect of light intensity and frequency of flashing light from blue light emitting diodes on astaxanthin production by Haematococcus pluvialis[J].J Biosci Bioeng,2008,105(3):216-220.
[17]NUTAKOR C,KANWUGU O N,KOVALEVA E G,et al.Enhancing astaxanthin yield in Phaffia rhodozyma: current trends and potential of phytohormones[J].Appl Microbiol Biotechnol,2022,106(9-10):3531-3538.
[18]彭小兰.虾青素的生理功能及其生产与应用研究[J].当代畜牧,2005(11):50-52.
[19]AMADO I R,VAZQUEZ J A.Mussel processing wastewater:a low-cost substrate for the production of astaxanthin by Xanthophyllomyces dendrorhous[J].Microbial Cell Fact,2015,14:177.
[20]蔡俊,游智能.发酵法生产虾青素的研究进展[J].食品科学,2015,36(23):358-366.
[21]KANWUGU O,SHATUNOVA S,GLUKHAREVA T,et al.Effect of different sugar sources on P.rhodozyma Y1654 growth and astaxanthin production[J].Agron Res,2020,18(S3):1700-1716.
[22]刘晓桐,孙欣宇,刘玥,等.诱变筛选高产虾青素法夫酵母及发酵条件优化[J].大连工业大学学报,2021,40(6):396-400.
[23]何璞,任泽焕,何润清,等.红法夫酵母原生质体制备条件优化及紫外诱变高产虾青素菌株筛选[J].上海农业学报,2014,30(2):38-42.
[24]李旭媛,王刚,费卓群,等.紫外-亚硝基胍复合诱变筛选高产淀粉酶菌株[J].中国生物制品学杂志,2012,25(11):1543-1546.
[25]刘宝.角蛋白降解菌的紫外线和硫酸二乙酯复合诱变[D].南京:南京农业大学,2012.
[26]胡悦,李汉文,喻晨,等.LiCl-ARTP复合诱变选育高产碱性蛋白酶菌株及其发酵条件优化[J].中国酿造,2021,40(2):59-65.
[27]白玉峰,张文霞,田亚楠,等.宁夏贺兰山东麓降L-苹果酸葡萄酒酵母的筛选[J].中国酿造,2021,40(1):49-54.
[28]胡向东,潘晓燕,章祺,等.复合诱变选育高产虾青素红法夫酵母菌株[J].食品与发酵工业,2014,40(10):58-62.
[29]沈宁燕.法夫酵母产虾青素发酵工艺的研究及代谢调控发酵[D].厦门:集美大学,2015.
[30]张蕊,周博,李贤宇.红发夫酵母高产虾青素菌株的选育[J].天津科技,2011,38(4):18-20.
[31]潘雪珊,凌雪萍,叶驰名,等.红发夫酵母生产虾青素的氮源补加策略[J].厦门大学学报,2013,52(4):545-552.
[32]耿海波,郑辉,张丽媛,等.常压室温等离子体诱变选育耐酸酿酒酵母菌株[J].中国酿造,2022,41(2):144-148.
[33]徐彩荣,闫真真,朱传合.超声波-LiCl对红法夫酵母复合的诱变效应[J].食品与发酵工业,2013,39(3):125-128.
[34]杨瑞.法夫酵母发酵生产虾青素及其包含物的研究[D].海口:海南大学,2011.
[35]余萍,张春宇,矫艳平,等.一株鼠李糖乳杆菌培养条件的优化[J].中国乳品工业,2021,49(9):28-32.
[36]裘娟萍,沈寅初.红发夫酵母的生物学特性[J].工业微生物,2001,31(3):6-8.
[37]ZHU X,MENG C,SUN F,et al.Sustainable production of astaxanthin in microorganisms:the past,present,and future[J].Crit Rev Food Sci Nutr,2022 DOI:10.1080/10408398.2022.2080176.