康普茶是一种以茶为原料,由酵母和细菌共同发酵而成的饮料[1],具有酸甜、清爽的独特味道,原产于中国东北[2],距今有几千年的历史[3]。康普茶之所以越来越受欢迎,是因为其含有大量功能性物质,对人体健康有很大益处,能促进脂肪代谢,有效降低胆固醇和甘油三酯水平,对肝脏具有保护特性[4]。康普茶富含大量有机酸,主要是乙酸、葡萄糖酸、葡萄糖醛酸、L-乳酸,还有维生素、氨基酸以及抗菌活性物质等,其中葡萄糖醛酸被认为是康普茶饮料中最重要的活性物质之一[5],因其对人体具有解毒、保肝等多重功效,受到人们广泛关注。因此,人们试图通过功能微生物共培养、发酵条件优化等途径提高康普茶中葡萄糖醛酸的含量。De FILIPPIS F等[6]研究认为,嗜高渗酵母是康普茶自然发酵过程中参与风味和活性物质形成的主要微生物;JAYABALAN R等[7]研究总结了自然发酵的康普茶中还有许多酵母种属,如糖酵母属、酒香酵母属、毕赤酵母属和接合酵母属等,突出了酵母种属在康普茶发酵中的重要地位。研究表明,酵母菌属和醋酸菌属、少量的乳酸菌属构成康普茶优势菌属,而葡萄糖醛酸的合成首先得通过酵母菌属的转化酶将双糖水解单糖后,进而转化为葡萄糖醛酸[8]。因此,酵母菌属是参与康普茶中葡萄糖醛酸合成的重要微生物[9-10]。NGUYEN N K等[11]从传统康普茶中筛选出一株布鲁塞尔德克酵母(Dekkera bruxellensis)KN89和中间葡糖酸醋杆菌(Gluconacetobacter intermedius)KN89,两株菌进行组合比例优化后,葡萄糖醛酸含量可高达175.80 mg/L。本课题组冯子娟[12]以提高康普茶中葡萄糖醛酸为目标,于自然发酵的康普茶中筛选出一株高产葡萄糖醛酸的功能菌株季也蒙毕赤酵母MCJ-1,其与木糖驹形氏杆菌C-2混菌(混合比例7∶3)发酵制备康普茶,葡萄糖醛酸含量可达2 120 mg/L。
目前菌粉的制备主要采用真空冷冻干燥和喷雾干燥。真空冷冻干燥被认为是最为温和的脱水技术[13],具有菌粉存活率高、稳定性好、便于运输和不易污染的优点。为了得到存活率高的菌粉,通常选择真空冷冻干燥法进行制备优化。但保护剂是决定菌粉质量的关键因素。因此,在菌粉制备过程中,对保护剂种类、浓度及比例进行研究,是制备高质量菌粉的关键。
因此,为了进一步满足功能菌株工业化生产康普茶的要求,本研究以从康普茶混菌发酵体系中筛选获得的季也蒙毕赤酵母(Pichia guilliermondii)MCJ-1为研究对象,采用单因素试验及响应面试验优化菌株MCJ-1的培养条件,并对其冻干菌粉的制备条件进行研究。旨在为生产葡萄糖醛酸含量较高的优质康普茶提供质量稳定、贮存稳定性好、活性较高的季也蒙毕赤酵母MCJ-1冻干菌粉。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
季也蒙毕赤酵母(Pichia guilliermondii)MCJ-1:保藏于广东省微生物菌种保藏中心(保藏编号为GDMCC No:62236;专利申请号:202210399060.X)。
1.1.2 试剂
葡萄糖、果糖(均为分析纯):天津市科密欧化学试剂有限公司;酵母浸出粉、蛋白胨(均为生化试剂):上海博微生物科技有限公司;琼脂(生化试剂):北京索莱宝科技有限公司;麦芽糖(分析纯):天津市致远化学试剂有限公司;蔗糖、硫酸铵、氯化铵(均为分析纯):成都金山化学试剂有限公司;脱脂乳粉:上海源叶生物科技有限公司;麦芽糊精、海藻糖(均为分析纯):河南万邦实业有限公司;蔗糖(分析纯):贵阳市绿谷超市;甘油(分析纯):马来西亚泰柯棕化有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基:葡萄糖20 g/L,酵母浸出粉10 g/L,蛋白胨20 g/L。115 ℃灭菌15 min。
YPD固体培养基:YPD液体培养基加入琼脂20 g/L。115 ℃灭菌15 min。
1.2 仪器与设备
Vaco5D-Ⅱ-D真空冷冻干燥机:德国Zirbus公司;YXQ-75SⅡ型立式压力蒸汽灭菌锅:上海博讯实业有限公司医疗设备厂;ZQPL-200恒温摇床:天津市莱玻特瑞仪器设备有限公司;MJ-160B-Ⅱ恒温培养箱:上海跃进医疗器械厂;ECLIPSE-E200显微镜:日本Nikon公司;SIGMA 1-4台式高速离心机:德国Sigma公司;PHS-3C pH计:上海虹谊仪器仪表有限公司。
1.3 方法
1.3.1 菌株MCJ-1冻干菌粉的制备
从-80 ℃保藏的甘油管中挑取季也蒙毕赤酵母MCJ-1于YPD固体培养基,30 ℃静置培养2~3 d,连续活化2次。挑取单菌落接种于YPD液体培养基,于30 ℃、160 r/min条件下振荡培养18 h,通过血球板计数法计数,培养至菌浓度为1×108 CFU/mL,得到菌株MCJ-1种子液。将菌株MCJ-1种子液以3%(V/V)接种量接种于YPD液体培养基中,30 ℃、160 r/min条件下振荡培养18 h,得到菌株MCJ-1发酵液,在4 ℃、6 000 r/min离心10 min后除去上清液,无菌生理盐水洗涤3次,收集菌泥。菌泥与保护剂1∶1混合后在-20 ℃下预冻12 h[14],待其彻底冻结后迅速将样品转移至真空冷冻干燥机,冷冻干燥(-60 ℃)24 h后,即得冻干菌粉。
1.3.2 菌株MCJ-1生物量测定及菌株MCJ-1存活率的计算
将培养后的菌液振荡摇匀,取2 mL于4 000 r/min离心10 min,除去上清液,用无菌水洗涤2次后60 ℃烘至质量恒定[15],得到菌体干质量,以菌体干质量反映菌株MCJ-1生物量。菌株MCJ-1存活率的计算公式如下:
1.3.3 菌株MCJ-1培养条件优化
(1)单因素试验
碳源的选择:以不含葡萄糖的YPD液体培养基为基础培养基,分别添加蔗糖、葡萄糖、麦芽糖、果糖四种碳源,添加量分别为10 g/L、15 g/L、20 g/L、25 g/L、30 g/L。在接种量为3%(V/V),30 ℃、160 r/min条件下振荡培养18 h,取2 mL菌液于4 000 r/min离心10 min,除去上清液,用无菌水洗涤2次后60 ℃烘至质量恒定[15],得到菌体干质量。考察不同碳源对季也蒙毕赤酵母MCJ-1生物量的影响。
氮源的选择:在蛋白胨、酵母浸粉(蛋白胨10.00 g/L、酵母浸粉5.00 g/L)作为有机氮源的基础上,分别添加无机氮源硫酸铵、氯化铵,添加量分别为1 g/L、3 g/L、5 g/L、7 g/L、9 g/L。在接种量为3%(V/V),30 ℃、160 r/min条件下振荡培养18 h,取2 mL菌液于4 000 r/min离心10 min,除去上清液,用无菌水洗涤2次后60 ℃烘至质量恒定,得到菌体干质量。考察不同氮源对季也蒙毕赤酵母MCJ-1生物量的影响。
培养条件的选择:设置转速分别为140 r/min、160 r/min、180 r/min、200 r/min、220 r/min,培养温度分别为20 ℃、25 ℃、30 ℃、35 ℃,初始pH值分别为4、5、6、7、8。在接种量为3%(V/V),30 ℃、160 r/min条件下振荡培养18 h,取2 mL菌液于4 000 r/min离心10 min,除去上清液,用无菌水洗涤2次后60 ℃烘至质量恒定,得到菌体干质量。考察不同转速、培养温度及初始pH值对季也蒙毕赤酵母MCJ-1生物量的影响。
(2)响应面试验
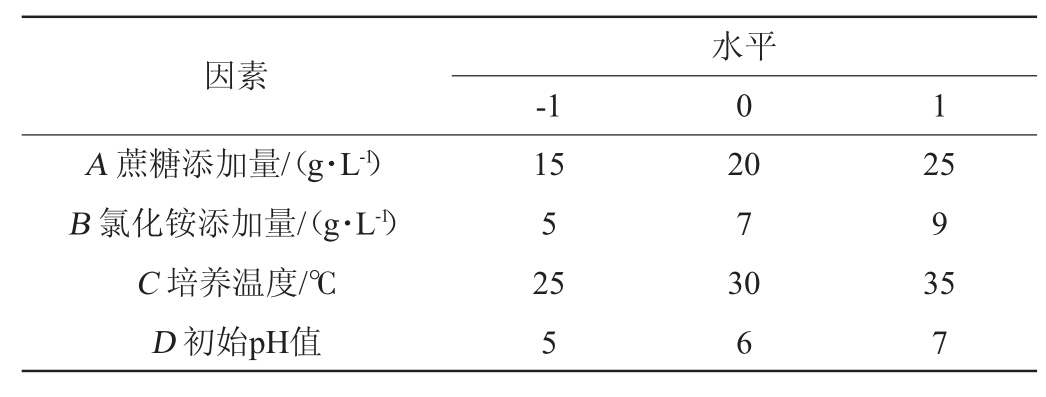
根据单因素试验结果,固定转速200 r/min,以蔗糖添加量(A)、氯化铵添加量(B)、培养温度(C)和初始pH值(D)作为自变量,以菌体干质量(Y)为响应值,设计4因素3水平Box-Behnken试验。Box-Behnken试验因素及水平见表1。
表1 培养条件优化Box-Behnken试验设计因素及水平
Table 1 Factors and levels of Box-Behnken experiments design for culture conditions optimization
1.3.4 冻干保护剂的筛选
对冻干保护剂脱脂乳粉[14]、海藻糖[16]、蔗糖[17]、甘油[18]、麦芽糊精[19-20]进行筛选。设置脱脂乳粉添加量分别为6.0%、7.5%、9.0%、10.5%、12.0%;海藻糖、蔗糖添加量分别为5.0%、7.5%、10.0%、12.5%、15.0%;麦芽糊精添加量分别为9%、12%、15%、18%、21%;甘油添加量分别为1%、2%、3%、4%、5%。上述冻干保护剂于115 ℃灭菌10 min,以不添加保护剂为对照,以菌株MCJ-1存活率为评价指标,筛选最佳冻干保护剂。
1.3.5 菌泥与保护剂比例的选择[21]
设置菌泥与保护剂的比例分别为3∶1、2∶1、1∶1、1∶2、1∶3,以菌株MCJ-1存活率为评价指标,筛选最佳菌泥与保护剂比例。
1.3.6 数据处理
试验均设置三组平行,结果以“平均值±标准差”表示,采用Origin 9.5绘图,SPSS 25.0统计分析和Design-Expert 8.0.6软件进行响应面试验数据分析。
2 结果与分析
2.1 季也蒙毕赤酵母MCJ-1培养条件优化
2.1.1 碳源对菌株MCJ-1生物量的影响
葡萄糖、蔗糖是促进酵母细胞生长的主要营养物质[22]。果糖作为单糖,可以被酵母菌直接利用。在宋洋洋等[23]对酵母优化培养的研究中,麦芽糖的效果仅次于蔗糖和果糖。因此,选择果糖、麦芽糖、葡萄糖、蔗糖作为菌株培养基碳源进行优化,结果见图1。由图1可知,碳源种类不同,菌株MCJ-1的菌体干质量存在差异。以麦芽糖作为碳源,其添加量为10%时,菌体干质量为最大值,(3.13±0.15)mg/mL。以蔗糖作为碳源,其添加量为20 g/L时菌体干质量达到最大,为(5.43±0.15)mg/mL,添加量的变化对菌体干质量影响显著(P<0.05),葡萄糖和果糖作为碳源时,其添加量对菌体干质量的影响呈现先增高后下降的趋势,在葡萄糖和果糖添加量25 g/L时,菌体干质量达到最大值,分别为(5.30±0.2)mg/mL、(5.20±0.35)mg/mL。因此,季也蒙毕赤酵母MCJ-1的最佳碳源为蔗糖,添加量为20 g/L。这与黄章娆等[24]的研究结果相似,可能是酵母基因组中有蔗糖水解酶基因,具有利用蔗糖作为碳源的能力。
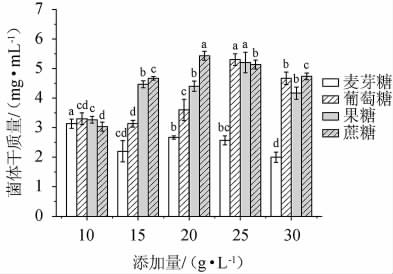
图1 碳源及其添加量对季也蒙毕赤酵母MCJ-1生物量的影响
Fig.1 Effect of carbon sources and addition on biomass of Pichia guiliermondii MCJ-1
不同小写字母表示差异显著(P<0.05)。下同。
2.1.2 氮源对菌株MCJ-1生物量的影响
从YPD培养基氮源种类分析,蛋白胨、酵母浸出粉作为有机氮源,除了提供氮源,还含有丰富的氨基酸和维生素等物质,对微生物的生长形成了有利的条件[25]。硫酸铵、氯化铵作为无机氮源,成分单一,质量相对稳定,能被部分微生物直接利用。同时,王珊等[26]的研究表明,菌株利用复合氮源的生物量比单一氮源高。因此,在蛋白胨、酵母浸粉作为有机氮源的基础上,分别添加无机氮源硫酸铵、氯化铵,考察其对菌体干质量的影响,结果见图2。
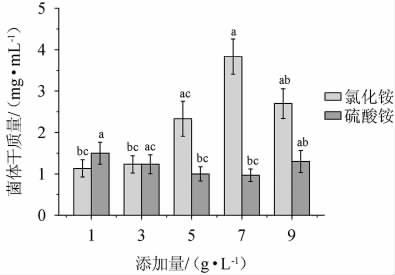
图2 氮源及其添加量对季也蒙毕赤酵母MCJ-1生物量的影响
Fig.2 Effect of nitrogen sources and addition on biomass of Pichia guiliermondii MCJ-1
由图2可知,菌体干质量随氯化铵添加量在1~7 g/L范围内增加随之增高;氯化铵添加量为7 g/L时,菌体干质量达到最大,为(3.83±0.42)mg/mL;氯化铵添加量>7 g/L之后,菌体干质量随之下降。菌体干质量随硫酸铵添加量在1~7 g/L范围内增加随之下降,硫酸铵添加量>7 g/L之后,菌体干质量有所升高,但硫酸铵添加量为7 g/L和9 g/L时,对季也蒙毕赤酵母MCJ-1的菌体干质量影响不显著(P>0.05)。因此,季也蒙毕赤酵母MCJ-1的最佳无机氮源为氯化铵,添加量为7 g/L。
2.1.3 初始pH值、转速及培养温度对菌株MCJ-1生物量的影响
初始pH值、转速、培养温度对菌株MCJ-1生物量的影响,结果见图3。
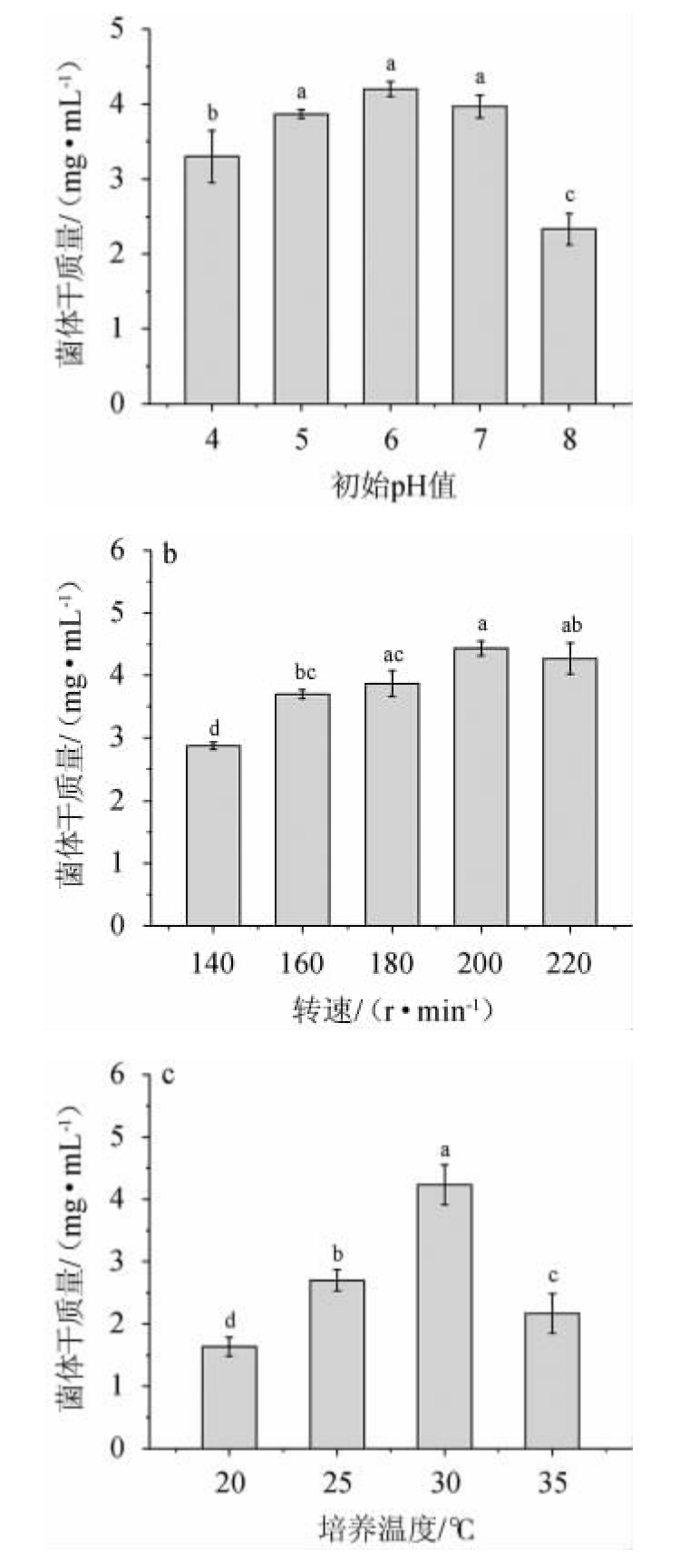
图3 初始pH值(a)、转速(b)及培养温度(c)对季也蒙毕赤酵母MCJ-1生物量的影响
Fig.3 Effects of initial pH (a),rotational speed (b) and culture temperature (c) on biomass of Pichia guiliermondii MCJ-1
由图3a可知,随着初始pH在4~6范围内升高,菌体干质量随之增高;在初始pH值为6时,菌体干质量达到最大,为(4.20±0.1)mg/mL;在初始pH值>6之后,菌体干质量有所下降。因此,最佳初始pH值为6。由图3b可知,随着转速在140~200 r/min范围内升高,菌体干质量随之增高;当转速为200r/min时,菌体干质量达到最大,为(4.43±0.12)mg/mL;当转速>200 r/min之后,菌体干质量有所下降。因此,最佳转速为200 r/min。由图3c可知,培养温度在20~30 ℃范围内升高,菌体干质量随着温度的升高显著增大(P<0.05);当培养温度在30℃时,菌体干质量达到最大,为(4.23±0.32)mg/mL;当培养温度高于30 ℃之后,菌体干质量有所下降。因此,季也蒙毕赤酵母MCJ-1的最适培养温度为30 ℃。
2.1.4 Box-Behnken响应面试验
在单因素试验结果基础上,选择影响较大的蔗糖添加量(A)、氯化铵添加量(B)、培养温度(C)、初始pH值(D)进行4因素3水平的Design-Expert 8.0.6响应面试验设计,以菌体干质量(Y)作为响应值,筛选出季也蒙毕赤酵母MCJ-1培养工艺的最佳条件。Box-Behnken试验设计及结果见表2,方差分析见表3。
表2 培养条件优化Box-Behnken试验设计及结果
Table 2 Design and results of Box-Behnken experiments for culture conditions optimization
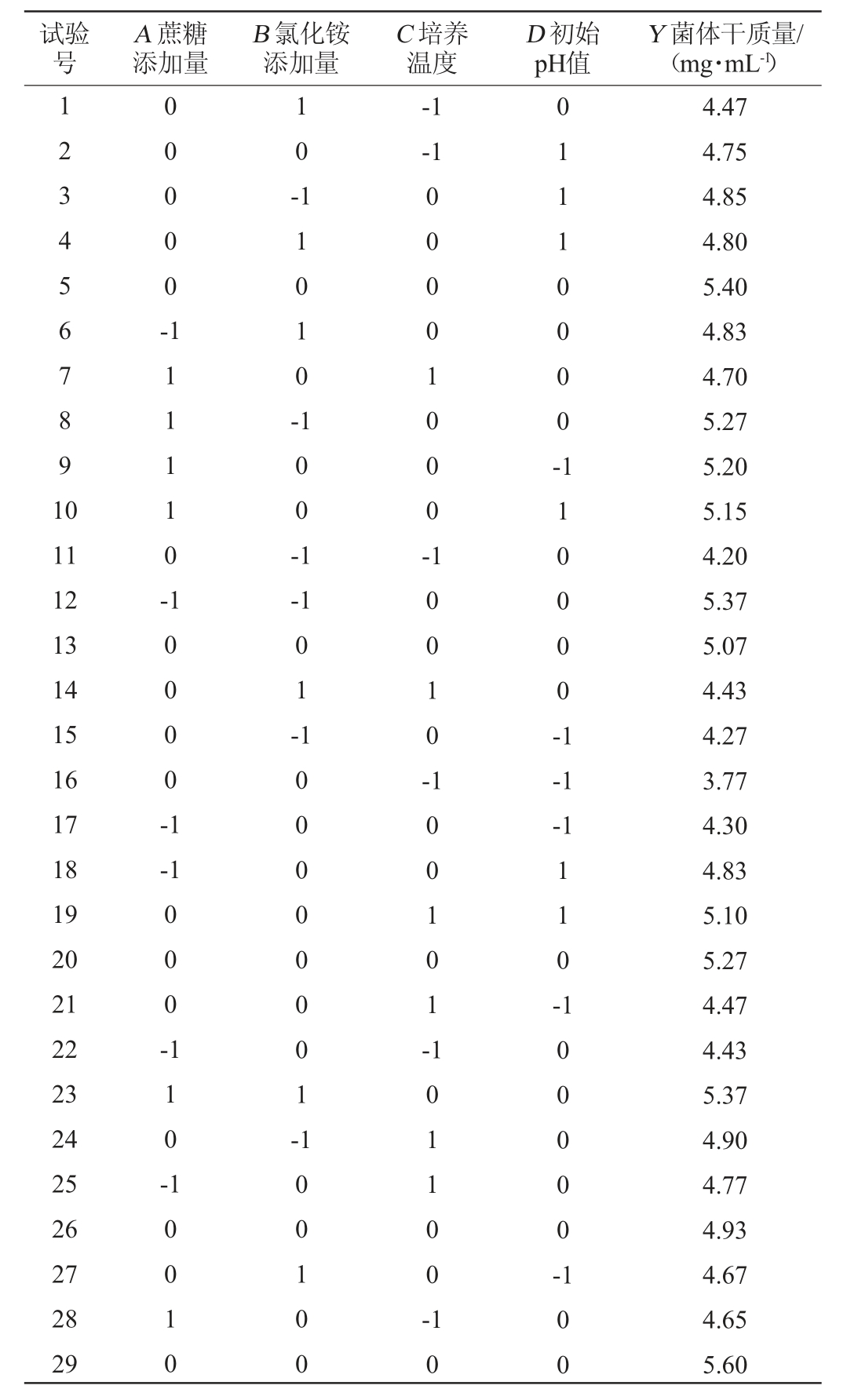
表3 回归模型方差分析
Table 3 Variance analysis of regression model
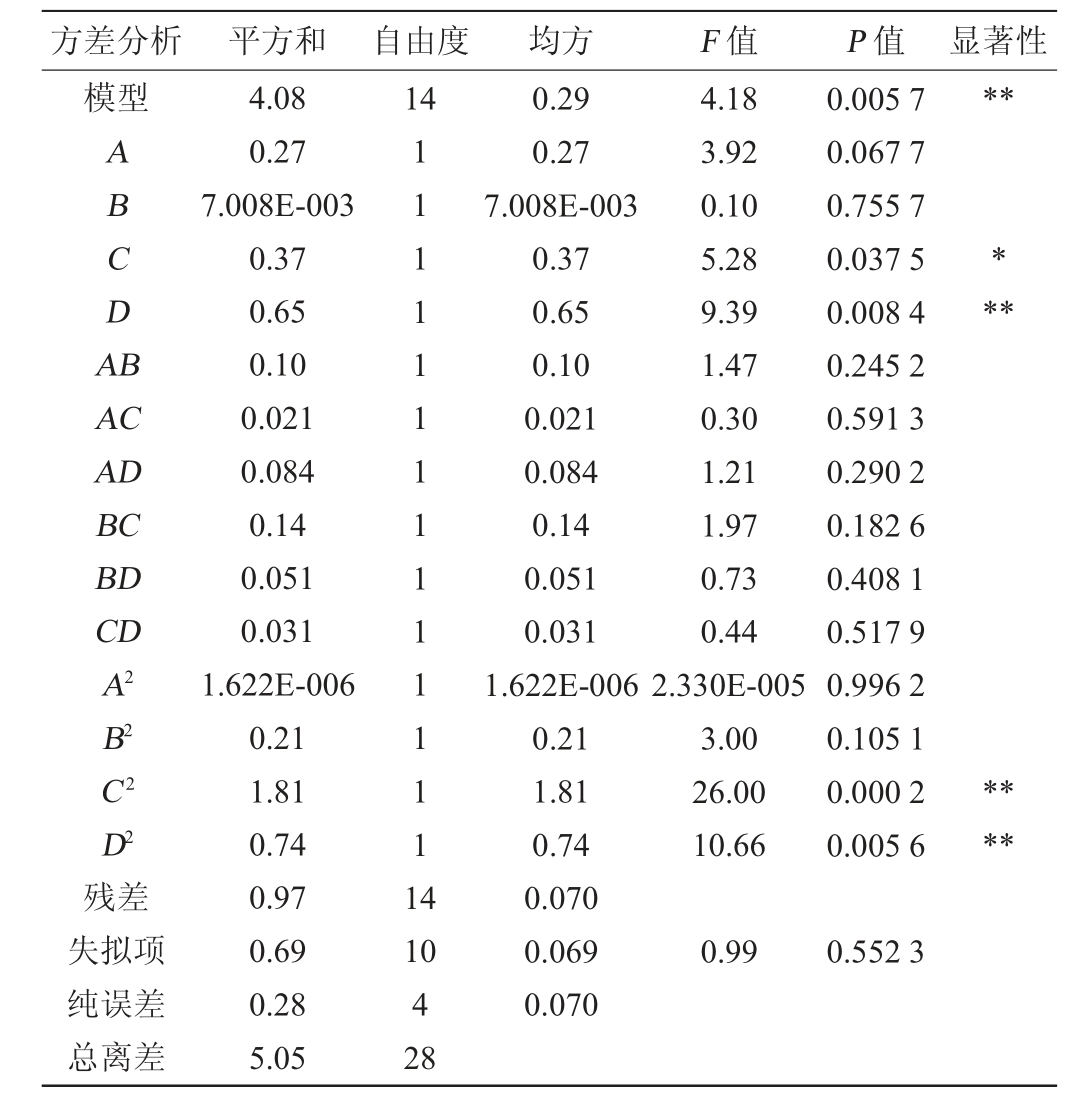
注:“**”表示对结果影响极显著(P<0.01),“*”表示对结果影响显著(P<0.05)。
由表3可知,模型P值为0.005 7<0.01,则该模型极显著,失拟项P值为0.552 3>0.05,即失拟项不显著。该模型的决定系数R2=0.807 1,调整决定系数R2Adj=0.614 1,说明该模型合理可行。由P值可知,一次项D,二次项C2、D2对结果影响极显著(P<0.01),一次项C对结果影响显著(P<0.05)。由F值可知,各因素对菌体干质量影响大小顺序为初始pH值(D)>培养温度(C)>蔗糖添加量(A)>氯化铵添加量(B)。通过Design-Expert 8.0.6软件分析,得到多元二次响应面回归模型方程为:

等高线的形状越接近圆形或者马鞍形,两因素之间的交互作用就不显著,形状越接近椭圆形,交互作用就越显著[27]。四个因素的响应面曲线都呈现抛物线形态,且开口向下,表明有峰值存在。响应面坡度越陡,各因素间的交互作用就越显著。各因素交互作用对结果影响的响应面及等高线见图4。由图4可知,各因素交互作用对结果影响均不显著(P>0.05),氯化铵添加量和培养温度的等高线呈椭圆形,即两因素之间的交互作用对结果影响较大,其余各因素交互作用对结果影响较小。该结果与表3结果一致。
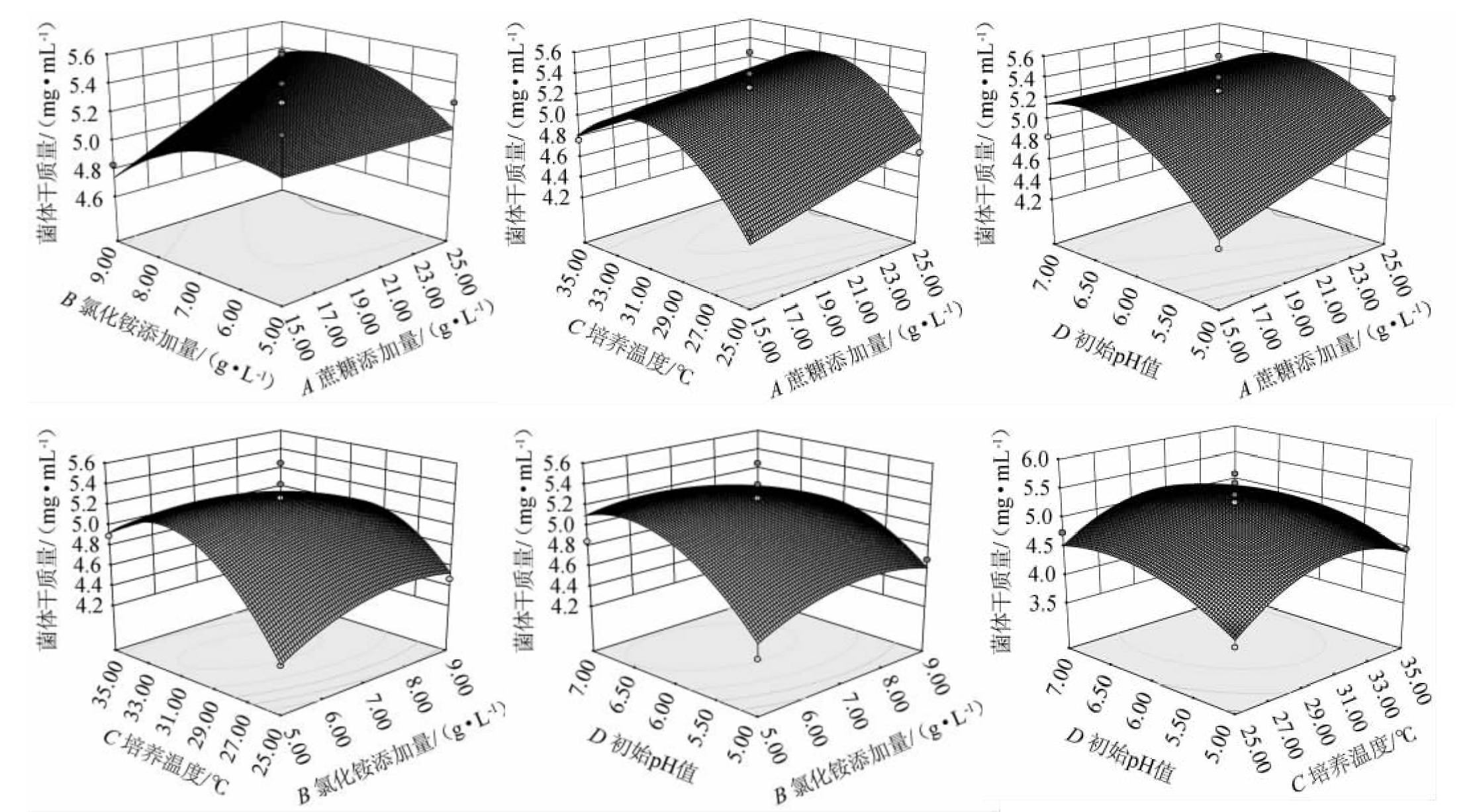
图4 各因素间交互作用对也蒙毕赤酵母MCJ-1生物量影响的响应面及等高线
Fig.4 Response surface plots and contour lines of effects of interaction between various factors on biomass of Pichia guiliermondii MCJ-1
2.1.5 验证试验
由软件Design-Expert 8.0.6分析,得到最佳培养条件为:蔗糖添加量25 g/L、氯化铵添加量7.68 g/L、培养温度为30.16 ℃、初始pH值为6.07。此优化条件下菌体干质量理论值为5.43 mg/mL。为了方便实际操作,将最佳培养条件修正为:蔗糖添加量25 g/L、氯化铵添加量7.7 g/L、培养温度30 ℃、初始pH值6。在此条件下进行3次平行验证试验,得到菌体干质量平均实际值为(5.06±0.22)mg/mL,与预测值(5.43 mg/mL)接近,比优化前提高了64.82%,因此该模型预测该菌株的菌体干质量准确可靠。
2.2 季也蒙毕赤酵母MCJ-1冻干菌粉制备
2.2.1 保护剂的选择
以无菌水作为空白对照,考察冻干保护剂脱脂乳粉、海藻糖、蔗糖、甘油、麦芽糊精对季也蒙毕赤酵母MCJ-1的存活率的影响,结果见图5。由图5a可知,不加冻干保护剂的对照组冷冻干燥后季也蒙毕赤酵母MCJ-1的存活率仅33.78%。由图5a可知,以脱脂乳粉作为保护剂能有效提高该菌株冷冻干燥后的存活率,当脱脂乳粉添加量为10.50%时,菌株的存活率最高,为76.68%。由图5b可知,蔗糖、海藻糖两种糖类保护剂的最佳添加量分别为7.5%、10.0%,季也蒙毕赤酵母MCJ-1的存活率分别达80.20%、78.01%。由图5c可知,以麦芽糊精作为保护剂,添加量为12%时,季也蒙毕赤酵母MCJ-1的存活率最高,为74.38%。由图5d可知,甘油添加量为4%时,季也蒙毕赤酵母MCJ-1的存活率最高,为83.91%。结果表明,冻干保护剂甘油对季也蒙毕赤酵母MCJ-1有较好的保护作用。保护剂可分为渗透类、半渗透类和不渗透类保护剂。试验所用到的保护剂中,甘油保护效果优于脱脂乳粉、海藻糖、麦芽糊精、蔗糖。可能由于甘油作为渗透类保护剂,不仅能改善细胞膜的流动性,而且能防止细胞过度脱水[13],在一定程度上提高了存活率。因此,4%甘油为菌株MCJ-1的最佳保护剂。
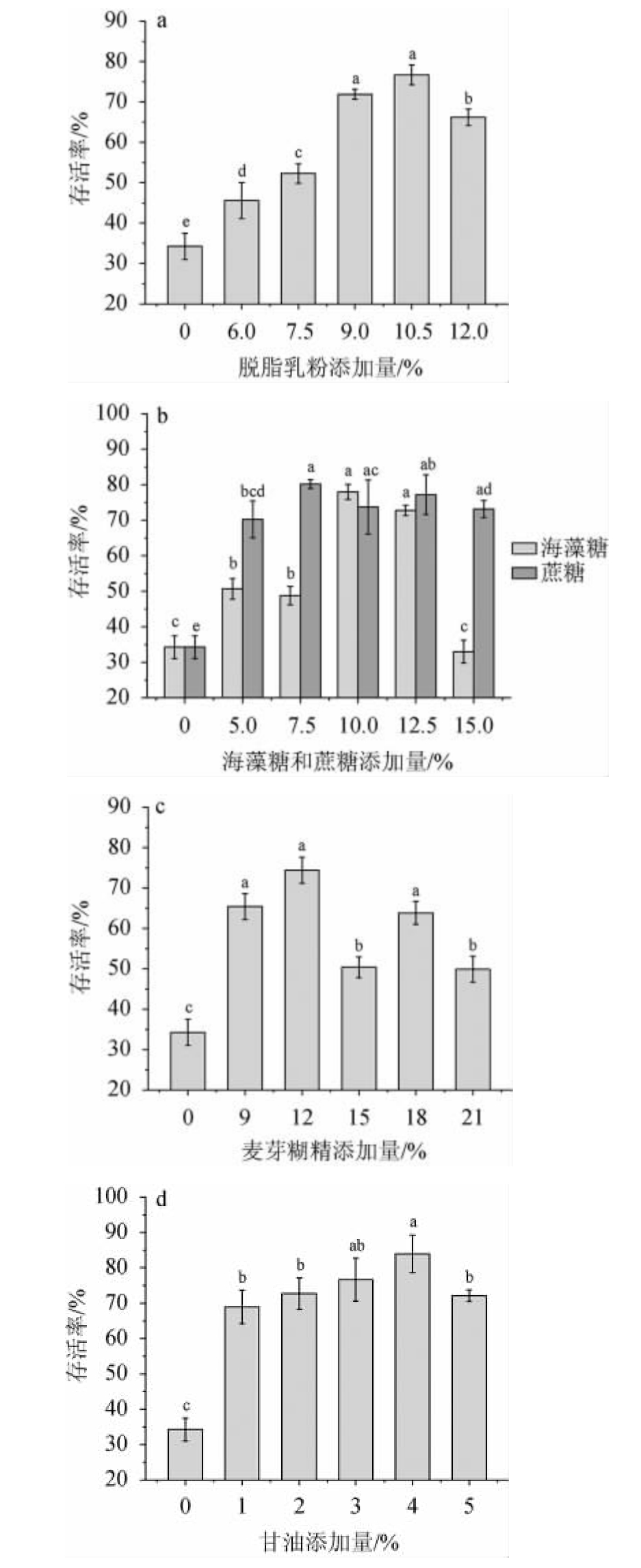
图5 不同保护剂对菌株MCJ-1存活率的影响
Fig.5 Effects of different protective agents on survival rate of strain MCJ-1
2.2.2 菌泥与保护剂比例的确定
菌泥与保护剂的比例是影响菌体冷冻干燥后存活率的重要因素之一。保护剂过少,会造成菌泥与保护剂混合不均匀,保护剂适当增加,使得菌泥与保护剂充分融合,能够提高菌株存活率[28]。由图6可知,菌泥与保护剂的比例在一定范围内随着保护剂的增加存活率显著上升(P<0.05),在1∶1时达到最高,随之降低。因此,菌泥与甘油的最佳比例为1∶1,在此条件下存活率高达(80.83±5.36)%。
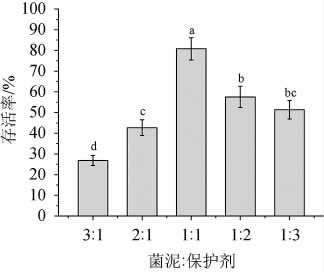
图6 菌泥与保护剂比例对菌株MCJ-1存活率的影响
Fig.6 Effect of ratio of yeast sludge and protective agents on survival rates of strain MCJ-1
3 结论
康普茶作为传统发酵饮品,含有葡萄糖醛酸等多种活性成分,对健康有着积极影响。为了利用功能菌株MCJ-1工业化生产康普茶,对其进行菌粉制备。本研究通过单因素试验及响应面试验,得到菌株MCJ-1的最佳培养条件为蔗糖25.00 g/L、蛋白胨10.00 g/L、酵母浸粉5.00 g/L、氯化铵7.7 g/L、培养温度为30 ℃、初始pH值6、转速200 r/min。在此优化条件下,菌体干质量为(5.06±0.22)mg/mL,比优化前提高了64.82%。
季也蒙毕赤酵母MCJ-1具备高产葡萄糖醛酸的能力,对其进行菌粉制备工艺研究,从最大程度上保留了该菌株的活性,制备出了质量稳定、便于长期贮存、活性较高的功能菌粉。这一研究结果简化了生产流程,强化了康普茶的功能,同时为工业化生产功能强化的康普茶奠定了基础。
[1]ARIKAN M,MITCHELL A L,FINN R D,et al.Microbial composition of Kombucha determined using amplicon sequencing and shotgun metagenomics[J].J Food Sci,2020,85(2):455-464.
[2]时胜阳,王帅,梁会朋,等.康普茶直投式发酵剂的制备及其发酵性能的研究[J].食品安全质量检测学报,2022,13(20):6577-6584.
[3]SAVARY O,MOUNIER J,THIERRY A,et al.Tailor-made microbial consortium for Kombucha fermentation:microbiota-induced biochemical changes and biofilm formation[J].Food Res Int,2021,147:110549.
[4]CARDOSO R R,MOREIRA L P D,DE CAMPOS COSTA M A,et al.Kombuchas from green and black teas reduce oxidative stress,liver steatosis and inflammation,and improve glucose metabolism in Wistar rats fed a high-fat high-fructose diet[J].Food Funct,2021,12(21):10813-10827.
[5]KUMAR V,JOSHI V K.Kombucha:technology,microbiology,production,composition and therapeutic value[J].Int J Food Ferment Technol,2016,6(1):13-24.
[6]De FILIPPIS F,TROISE A D,VITAGLIONE P,et al.Different temperatures select distinctive acetic acid bacteria species and promotes organic acids production during Kombucha tea fermentation[J].Food Microbiol,2018,73:11-16.
[7]JAYABALAN R,MALBAŠA R V,LONCˇAR E S,et al.A review on kombucha tea-microbiology,composition,fermentation,beneficial effects,toxicity,and tea fungus[J].Compr Rev Food Sci Food Saf,2014,13(4):538-550.
[8]MARTINEZ-LEAL J,PONCE-GARCÍA N,ESCALANTE-ABURTO A,et al.Recent evidence of the beneficial effects associated with glucuronic acid contained in kombucha beverages[J].Curr Nutr Rep,2020,9:163-170.
[9]TU C H,HU W X,TANG S J,et al.Isolation and identification of Starmerella davenportii strain Do18 and its application in black tea beverage fermentation[J].Food Sci Hum Well,2020,9(4):355-362.
[10]VILLARREAL-SOTO S A,BOUAJILA J,PACE M,et al.Metabolome-microbiome signatures in the fermented beverage,Kombucha[J].Int J Food Microbiol,2020,333:108778.
[11]NGUYEN N K,NGUYEN P B,NGUYEN H T,et al.Screening the optimal ratio of symbiosis between isolated yeast and acetic acid bacteria strain from traditional kombucha for high-level production of glucuronic acid[J].LWT-Food Sci Technol,2015,64(2):1149-1155.
[12]冯子娟.康普茶制备及其葡萄糖醛酸强化研究[D].贵阳:贵州大学,2022.
[13]寇佳祥,乔建军,朱宏吉,等.提高乳杆菌属冷冻干燥存活率研究进展[J].食品与发酵工业,2022,48(13):296-303.
[14]高恩燕.乳源马克思克鲁维酵母菌的筛选、增殖培养及其冻干菌粉制备的优化研究[D].镇江:江苏大学,2019.
[15]王亮,胡曼,王江月,等.马克斯克鲁维酵母高密度发酵条件的优化研究[J].食品工业科技,2017,38(17):111-118,124.
[16]于焕.益生菌发酵工艺、冻干保护剂优化与活性研究[D].沈阳:辽宁大学,2017.
[17]乔宏萍,燕平梅,武晓英,等.红茶菌优势微生物冻干菌粉的制备[J].食品科技,2016,41(3):18-20.
[18]李周勇,王凡,栾少萌,等.嗜热链球菌MN002冻干菌粉的制备工艺[J].中国乳品工业,2019,47(12):19-24.
[19]孙长涛.直投式高活性果蔬醋酸发酵剂制备[D].南昌:江西农业大学,2013.
[20]赵禹彤.罗伊氏乳杆菌冻干保护剂的筛选及在发酵乳中的应用[D].长春:吉林大学,2020.
[21]雷张腾.保拉迪酵母菌粉的制备及稳定性研究[D].西安:陕西科技大学,2017.
[22]ZHANG W X,ZHUO X H,HU L L,et al.Effects of crude β-glucosidases from Issatchenkia terricola,Pichia kudriavzevii,Metschnikowia pulcherrima on the flavor complexity and characteristics of wines[J].Microorganisms,2020,8(6):953.
[23]宋洋洋,李旺,聂利波,等.饲用产朊假丝酵母优化培养研究[J].饲料研究,2017(12):18-23.
[24]黄章娆,王昱,崔沛杰,等.响应面法优化富锌酵母培养条件[J].中国酿造,2020,39(11):97-102.
[25]宫达非,廖静云,曾慧帆,等.假单胞菌增殖培养基中碳源氮源的优化[J].安徽农业科学,2020,48(7):83-84,88.
[26]王珊,杨润青,宋培钦,等.碳氮源优化提高兼养三角褐指藻生物量和岩藻黄素产量[J].食品与生物技术学报,2021,40(10):82-90.
[27]肖甜甜,胡娜,冯子娟,等.黑曲霉B1401固态发酵茶叶加工废料产单宁酶的研究[J].食品研究与开发,2021,42(6):104-111.
[28]谭莎莎,马方励,崔树茂,等.罗伊氏乳杆菌冻干保护剂的优选及高密度冻干工艺优化[J].食品与发酵工业,2020,46(4):1-6.