清香型白酒是中国三大香型白酒之一,生产中用到清茬曲、红心曲和后火曲3种大曲[1]。这3种大曲的生产原料均为大麦和豌豆,工艺流程也基本相似,原料粉碎拌水成型后在曲房要经历七个时期,即卧曲期、上霉期、晾霉期、潮火期、大火期、后火期、养曲期,约26 d,然后出房称为出房曲,再经3~6个月贮存后用于酿酒生产[2-3]。3种大曲的区别在于发酵过程中温度不同,导致微生物及理化指标也略有不同。韩英[4]总结汾酒试点研究工作发现,3种单一品种大曲酿酒生产写实中,后火曲的产量和质量均最好,且在实际生产中后火曲的使用比例最高,说明后火曲是清香大曲中最重要的曲种。
曲乃酒之骨,说明大曲在白酒酿造过程中具有重要的作用[5-6],受到企业和学术界的高度重视。酿酒企业较关注大曲的生产过程管理[7-9]、大曲的酿酒性能[10]、对基酒产量和质量的影响等[11];学术界更关注的是大曲微生物,针对大曲微生物的研究多集中在两个方面,一方面是大曲微生物群落结构,早期利用传统的分离纯化法研究大曲中可培养微生物的种类,近年来则多用高通量测序法解析培养和未培养微生物[12-15],样品包括不同产地不同厂家到不同季节的各种大曲样品[14-16]。另一方面是大曲功能微生物的研究,张学林等[10]研究发现,产β-苯乙醇的库德里阿兹威(氏)毕赤酵母(Pichia kudriavzevii)能有效提高白酒中β-苯乙醇和苯乙酸乙酯等物质的含量,使基酒粮香、窖香、糟香和酯香协调,口感醇甜舒顺,改善基酒品质;LI W W等[17]研究发现,高产己酸乙酯的葡萄牙棒孢酵母(Clavispora lusitaniae)经过条件优化后能产生62.0 mg/L的己酸乙酯,接种葡萄牙棒孢酵母的强化大曲在酿酒试验中能显著增加酒液的己酸乙酯含量[17],将其应用于实际生产将有助于改善基酒质量。目前,对于清香大曲制作过程中主要理化、生化指标及微生物的变化及驱动分析等尚不完全清楚。
本研究聚焦清香大曲中单品种后火曲的制曲过程,采集不同阶段的曲坯为样品,分析各个曲坯样品的主要理化和生化指标,同时采用高通量测序技术分析曲坯中微生物群落结构,以了解大曲制作过程中主要微生物类群的动态变化,进一步分析理化、生化指标与微生物变化的相关性,以便深入理解大曲制作机制,为后期通过功能菌强化大曲改善大曲品质提供理论依据,同时也能为大曲标准化生产提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
大曲原料及曲坯样品取自山西省某清香大曲厂,由经验丰富的制曲师傅在后火曲制作过程中的卧曲期、上霉期、晾霉期、潮火期、大火期、后火期、出房期分别取样,每个时期取三个平行样品。
1.1.2 试剂
氢氧化钠(分析纯):洛阳市化学试剂厂;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、福林试剂、磷酸、三氯乙酸(均为分析纯):天津市光复精细化工研究所;可溶性淀粉(生化试剂)、碘化钾(分析纯):天津市科密欧化学试剂有限公司;醋酸钠、冰醋酸、无水葡萄糖、碳酸钠、碘(均为分析纯):天津市光复科技发展有限公司;无水乙醇(分析纯):天津市北辰方正试剂厂;酪氨酸(分析纯):上海源叶生物科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
HW-860W磨粉机:广州旭朗机械设备有限公司;PHS-3C型pH计:上海雷磁仪器厂;DHG-9031A电热鼓风干燥箱:上海一恒科学仪器有限公司;DZKW-0-4电热恒温水浴锅:上海科恒实业发展有限公司;722S数显可见分光光度计:上海菁华科技仪器有限公司;Sorvall ST 16R台式离心机:赛默飞世尔科技(中国)有限公司;BSA224S电子分析天平:赛多利斯科学仪器(北京)有限公司;2720型聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:美国ABI公司。
1.3 方法
1.3.1 大曲样品主要理化和生化指标的检测
水分、酸度、pH、糖化力、液化力及氨基酸态氮(amino nitrogen,AN)含量的测定:参考文献[18];酸性蛋白酶和中性蛋白酶活力的测定:采用福林酚法[19-20]。
1.3.2 大曲样品微生物菌群的高通量测序
采用Mo Bio/QIAGEN公司的DNeasy PowerSoil Kit提取大曲样品微生物群落的基因组脱氧核糖核酸(deoxyribonucleic acid,DNA),以其为模板,采用引物338F(5'-ACTCCTACGGGAGGCAGCA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')PCR扩增细菌的16S rRNA V4区基因序列,采用引物ITS5F(5'-GGAAGTAAAAGTCGTAACAAGG-3')和ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')PCR扩增真菌内部转录间隔区(internal transcribed spacers,ITS)基因序列。引物通过添加纠错条形码进行修改,该条形码对每个样品都是唯一的,并用作多路复用标记。PCR扩增体系:反应缓冲液(5×)5 μL,脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphate,dNTP)混合液(2.5 mmol/L)2 μL,正向引物和反向引物(10 μmol/L)各1 μL,DNA模板1 μL,超纯水14.75 μL,Q5 DNA聚合酶0.25 μL;PCR扩增程序:98 ℃预变性2 min;98 ℃变性15 s,55 ℃退火30 s,72 ℃延伸30 s,共25个循环;72 ℃再延伸5 min。采用Illumina MiSeq平台对PCR扩增产物进行高通量测序。
采用滑动窗口法对双端的FASTQ序列进行质量过滤,采用Qiime(version 1.9.0)进行序列过滤。丢弃无法组装的读数,并运用mothur(version 1.31.2)软件中的uchime方法识别和去除嵌合体序列。数据过滤标准:①去除5'端引物错配碱基数>1的序列;②去除含有N(模糊碱基)的序列;③去除含有连续相同碱基数>8的序列;④去除碱基长度≤150 bp的序列;⑤去除嵌合体序列。然后对获得的序列按97%的序列相似度进行归并和操作分类单元(operational taxonomic unit,OTU)划分,物种注释使用的数据库为Unite;在Qiime中调用基本局部比对搜索工具(basic local alignment search tool,BLAST)在数据库中对序列进行比对,获得每个OTU代表序列的分类学信息。
1.3.3 数据处理及统计分析
所有样品重复做3次平行,结果表示为“平均值±标准差”。根据OTU列表中各样品物种丰度情况,应用软件mothur中的summary.single命令,进行Alpha多样性分析,计算4种常用的生物多样性指数,包括超1(Chao1)指数、ACE指数、香农(Shannon)指数和辛普森(Simpson)指数,评价不同样品微生物群落的丰富度和多样性。采用Origin2021绘制两矩阵相关性热图,主要用来反映微生物与环境因子之间的相关性。
2 结果与分析
2.1 后火曲制曲过程中主要理化指标的变化趋势
理化指标是大曲质量评价的重要依据,大曲的主要理化指标有水分、酸度和pH值[21]。后火曲制作过程中理化指标的变化趋势见图1。
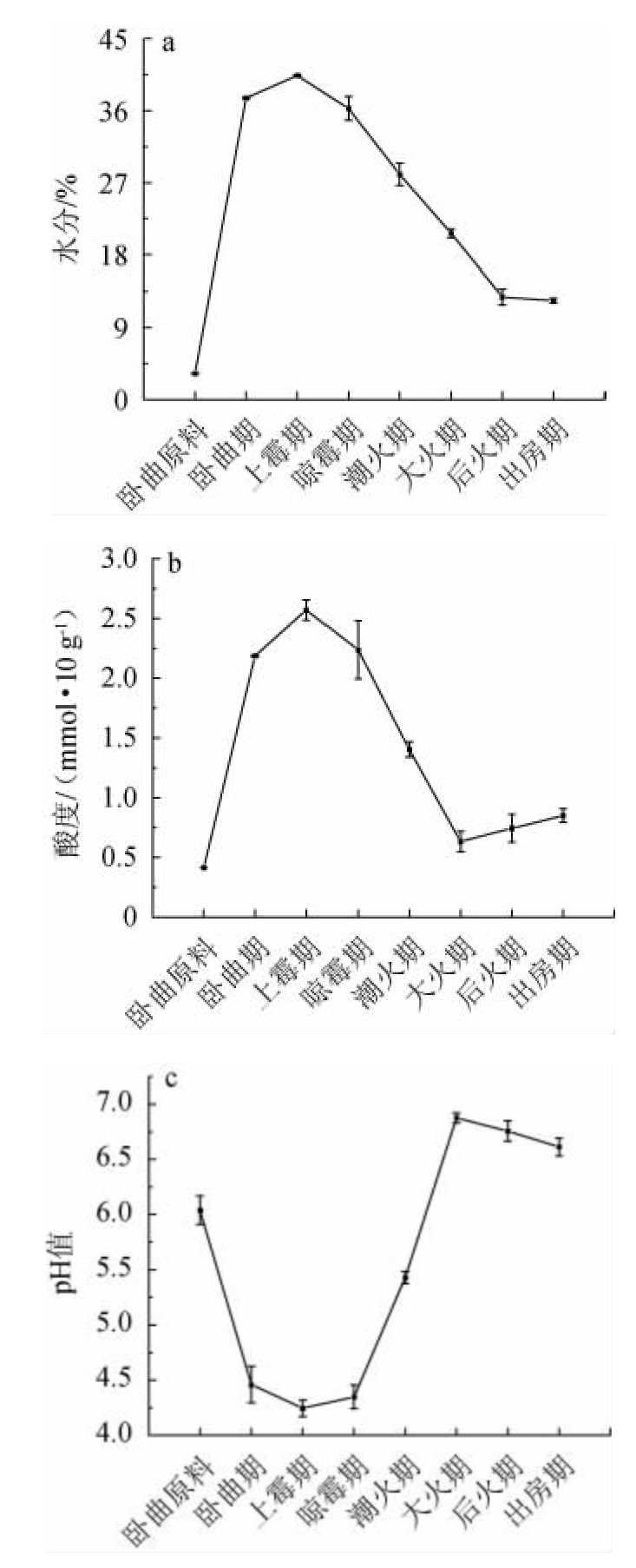
图1 后火曲制曲过程中水分(a)、酸度(b)和pH值(c)的变化
Fig.1 Changes of moisture (a),acidity (b) and pH value (c) during the Houhuoqu preparation
水分是微生物生长代谢和植物种子中酶分子激活的重要条件[22]。清香大曲原料大麦和豌豆能够安全保存的水分一般<12.5%[16],由图1a可知,原料水分含量只有3.24%,说明其保存条件适宜,保存效果较好;卧曲是大曲原料粉碎拌水压制成型后在曲房的第一道工序,这时曲坏水分含量为37.6%,软硬适宜,成型较好,符合制曲要求;卧曲之后是上霉期,大曲中的微生物遇水开始生长,由于微生物生长代谢产生热量使曲坯品温升高,游离水增加到40.4%;当曲坯品温达到38~40 ℃时进入晾霉期,曲坯品温继续升高加速水分蒸发,曲坯水分开始下降;之后曲坯水分持续下降,直到出房时曲坯水分仅略微下降,为12.3%。
大曲酸度是微生物生长代谢的综合指标[21]。由图1b可知,制曲原料酸度较低,为0.41 mmol/10 g;到卧曲期酸度已大幅提升至2.19 mmol/10 g,究其原因可能是制曲原料加水后,来自于原料、环境和工具的各种微生物开始大量生长,尤其是产酸微生物快速生长代谢产酸;到上霉期,曲坯酸度持续增加到最高(2.57 mmol/10 g),此时水分含量也最大。由图1c可知,曲坯的pH变化正好与酸度相反,pH从原料的6.0降至上霉期的4.25;之后的发酵过程中,曲坯酸度整体处于下降趋势;到大火期,酸度不再下降,pH也升至6.88后趋于稳定。这也说明大曲制作过程中涉及到多种微生物的消长演替,在大曲发酵前期主要是各类产酸菌,发酵后期的微生物产酸较弱甚至不再产酸,因而曲坯酸度下降和pH上升程度也可以作为大曲发酵成熟的一个指标。
2.2 后火曲制曲过程中主要生化指标的变化趋势
大曲是酿酒的糖化发酵剂,在把酿酒原料中的淀粉降解为还原糖的过程中起到重要作用[23-24]。后火曲制曲过程中糖化力和液化力的变化见图2。
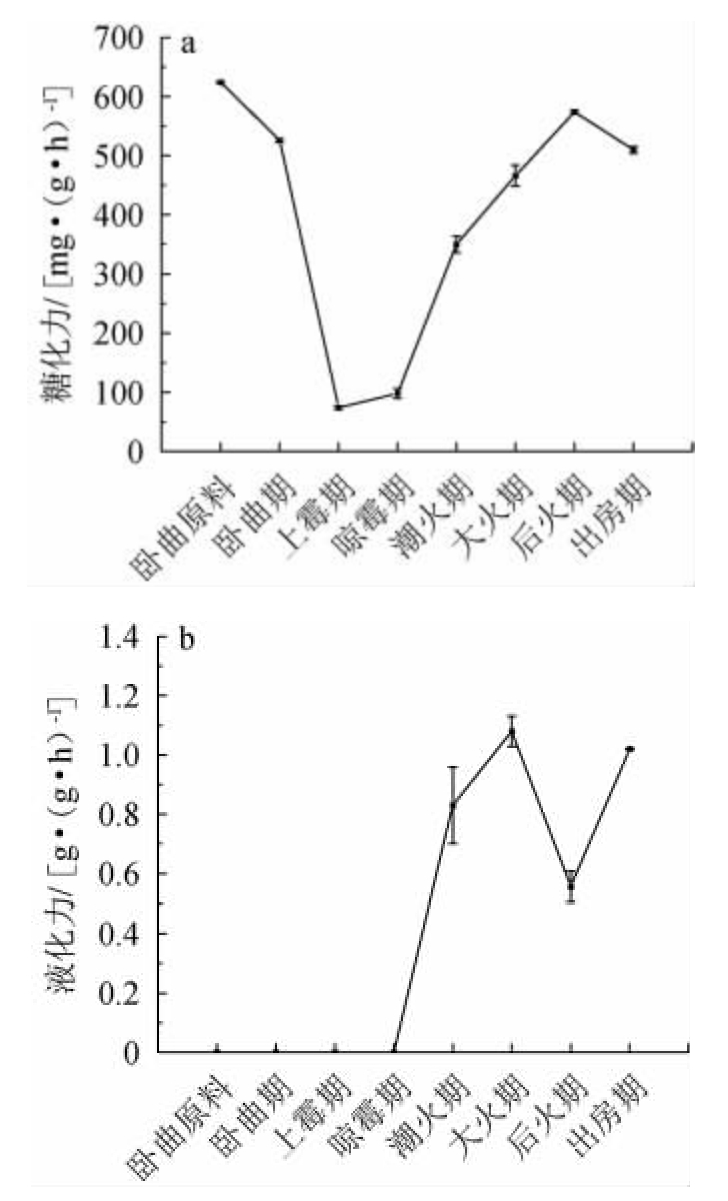
图2 后火曲制曲过程中糖化力(a)及液化力(b)的变化
Fig.2 Changes of saccharification power (a) and liquefaction power(b) during the Houhuoqu preparation
由图2a可知,清香大曲原料糖化力高达624 mg/(g·h),制成曲坯后开始下降,到上霉期降至74 mg/(g·h),之后开始回升,尤其是在晾霉期后有大幅提升,大火期后糖化力增加变缓,到出房时糖化力高达510 mg/(g·h)。糖化力的检测方法旨在分析大曲中的葡萄糖淀粉酶,但其检测原理是用斐林试剂对还原糖含量的测定,植物种子中β-淀粉酶产生的还原性麦芽糖同样可以检出。β-淀粉酶不仅是种子萌发中活性最强的水解酶,而且成熟的大麦种子中含有游离态和束缚态的β-淀粉酶,在种子萌发时不需要从头诱导合成,只需要从束缚态逐渐释放即可[25]。制曲原料在糖化力测定时,先在35 ℃浸泡1 h提取粗酶液,然后在35 ℃酶解反应1 h,可以促使β-淀粉酶转化为游离态因而检测到较高酶活[18]。因此,制曲原料的糖化力应该是植物种子中淀粉酶的体现。另外植物种子中的β-淀粉酶不耐热,而制曲过程中从卧曲期到上霉期、晾霉期,5~6 d酸性环境下28~40 ℃的处理很容易使β-淀粉酶失活。
液化力从制曲原料到晾霉期完全没有检测到,之后的变化趋势与糖化力相似,先是大幅提升,潮火期液化力增至0.83 g/(g·h),大火期后增幅变缓,出房时液化力达到1.02 g/(g·h)。植物种子中也有α-淀粉酶,α-淀粉酶的激活,需要完整且有活性的胚在适宜条件下激活赤霉素,赤霉素诱导α-淀粉酶从头合成[26]。制曲原料粉碎后使种子失去完整性,α-淀粉酶的诱导合成受阻因而未能检测到。因此,制曲早期的糖化力有可能是制曲原料来源的β-淀粉酶,后期糖化力和液化力再次升高,可能是大曲中微生物生长代谢积累所致。
清香大曲的原料只有大麦和豌豆,没有专门添加速效氮源,而大曲制作中大量微生物的生长需要氮源,只能利用蛋白酶将原料中的蛋白质降解后利用。考虑到制曲过程中曲坯pH是不断变化的,从原料的中性,至快速产酸,再回到中性,曲坯中微生物类群也不断发生消涨演替,其中有的能产酸性蛋白酶,有的能产生中性蛋白酶。因此,对后火曲制曲过程中酸性蛋白酶和中性蛋白酶进行检测,结果见图3。
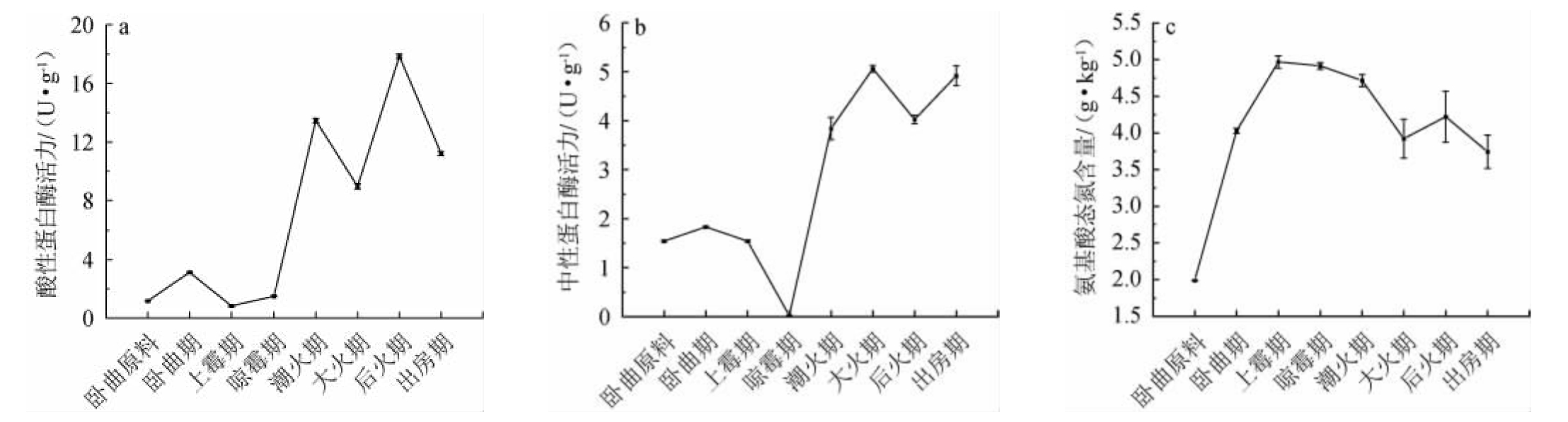
图3 后火曲制曲过程中酸性蛋白酶活力(a)、中性蛋白酶活力(b)及氨基酸态氮含量(c)的变化
Fig.3 Changes of acid protease activities (a),neutral protease activities (b) and amino acid nitrogen contents (c) during the Houhuoqu preparation
由图3a和图3b可知,后火曲制曲过程中,中性和酸性蛋白酶酶活力的变化趋势类似,在制曲初期即晾霉期前酶活较低,之后大幅增加。卧曲期、上霉期和晾霉期曲块酸度较大,应该有大量产酸微生物,如乳酸菌可在pH 3.0条件下生长,但其产生的蛋白酶多为中性蛋白酶[27-29],而且是在弱酸或中性条件下合成[27,30-31],可能是中性蛋白酶后期增加的一个原因,后期可能还有微生物如芽孢杆菌等产生中性蛋白酶;酸性蛋白酶升高可能是后期产酸性蛋白酶微生物的生长,如清香大曲中分离到产酸性蛋白酶的米曲霉(Aspergillus oryzae)MQ-1和米根霉(Rhizopus oryzae)MG-1[20];米曲霉和米根霉能产生糖化酶,导致大曲糖化力增加,与图2a较吻合;原料中也检测到低活性的中性蛋白酶,中性蛋白酶的最适pH为中性而不耐酸,在卧曲期、上霉期和晾霉经过高酸环境后活性几乎降到零,之后大幅提升推测可能是新出现的微生物合成中性蛋白酶。
氨基酸态氮是酿酒微生物生长的氮源,也是白酒中许多香气成分的前体物质,大曲中的氨基酸态氮可以由制曲原料中蛋白质在蛋白酶作用下降解产生,也可以由大曲中微生物死亡后细胞裂解释放[32]。由图3c可知,原料中的氨基酸态氮含量较少,到卧曲期明显增加,卧曲期大曲酸度也明显增加,分析原因可能是产酸微生物大量的生长同时产生少量蛋白酶,使氨基酸态氮含量增加;到上霉期时,氨基酸态氮含量最高,分析原因可能是上霉期大曲酸度最大,导致许多不耐酸微生物死亡裂解,从而使得氨基酸态氮含量增加,到大火期大曲酸度下降,微生物生长导致氨基酸态氮含量下降。
2.3 后火曲制曲过程中微生物菌群的变化
2.3.1 后火曲制曲过程中微生物菌群多样性分析
本研究对后火曲制曲过程中细菌菌群的16S rDNA V4区基因序列和真菌菌群的ITS区基因序列进行高通量测序,过滤嵌合体序列后得到1 832 013条有效细菌序列和526 979条有效真菌序列,对有效数据进行α-多样性分析,结果见表1。
表1 后火曲制曲过程中微生物群落的α-多样性指数
Table 1 Alpha diversity indexes of microbial communities during the Houhuoqu preparation
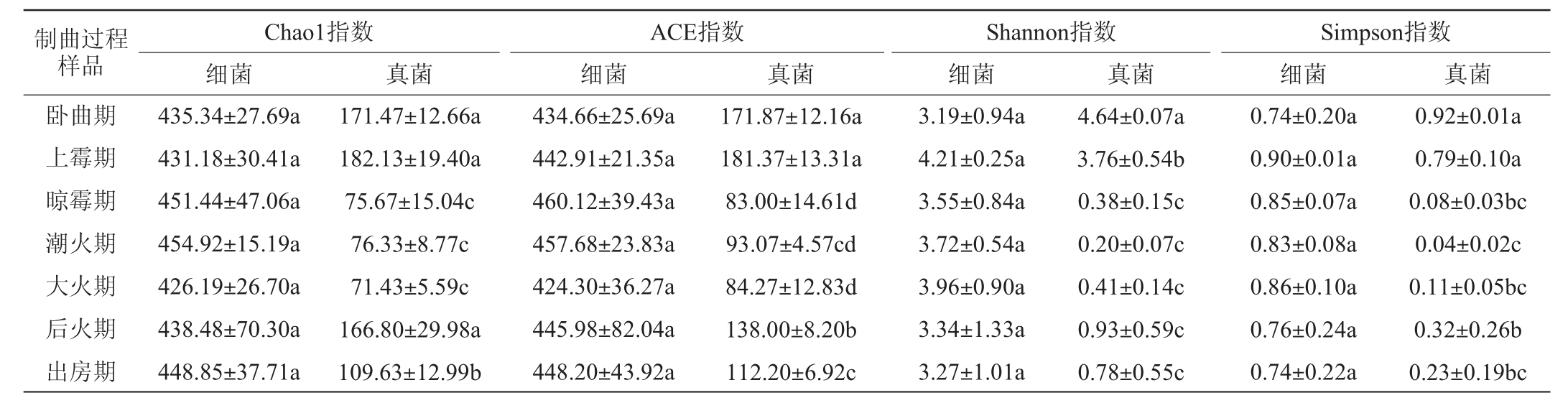
注:同一列标有不同小写字母者表示差异显著(P<0.05);同一列标有相同小写字母者表示差异不显著(P>0.05)。
由表1可知,后火曲制曲过程中,细菌菌群的物种丰富度Chao1指数和ACE指数均高于真菌菌群,且细菌菌群的丰富度指数(Chao1和ACE指数)和多样性指数(Shannon指数和Simpson指数)在不同时期均没有显著变化(P>0.05),而真菌菌群的丰富度指数(Chao1指数和ACE指数)和多样性指数(Shannon指数和Simpson指数)均在晾霉期、潮火期和大火期显著低于卧曲期和上霉期(P<0.05),后火期和出房期的丰富度指数显著回升(P<0.05),多样性指数也略有回升,但不显著(P>0.05)。
从后火曲制曲过程中的不同样品中共检出605个细菌OTUs数,235个真菌OTUs数,其中,卧曲期、上霉期、晾霉期、潮火期、大火期、后火期、出房期样品中的细菌OTUs数分别为524个、495个、522个、512个、495个、527个、508个,真菌OTUs数分别为191个、202个、92个、65个、76个、100个、128个。在生物云平台上绘制韦恩图,结果见图4。由图4a可知,不同样品共有的细菌OTUs数为320个,占总OTUs数的52.89%,出房期独有的细菌OTUs数高达11个,说明制曲后期干燥的曲坯中还有可能出现新的细菌。由图4b可知,不同样品共有的真菌OTUs数为25个,占总OTUs数的10.64%,卧曲期独有的真菌OTUs数高达10个,到上霉期和晾霉期骤降到1个,之后全部为0,说明在大曲制作过程中,原料来源的真菌种类较多,但受曲坯微生物和环境影响后期显著减少,因此制曲本身是酿酒微生物筛选的过程。
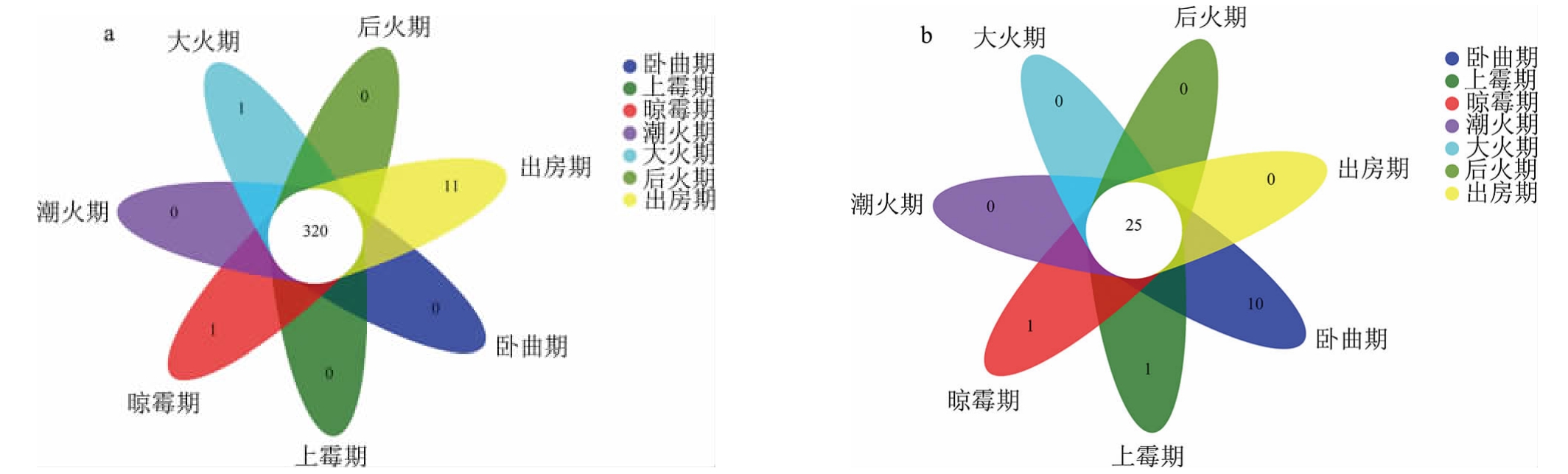
图4 后火曲制曲过程中细菌(a)和真菌(b)菌群的OTU Venn图
Fig.4 OTU Venn diagram of bacterial (a) and fungal (b) flora during the Houhuoqu preparation
2.3.2 后火曲制曲过程中微生物群落结构分析
根据OTU划分和序列比对鉴定结果,细菌菌群共注释到12个门、99个属,真菌菌群共注释到5个门、12个属。后火曲制曲过程中,微生物门菌群结构见图5,优势微生物属菌群结构见图6。
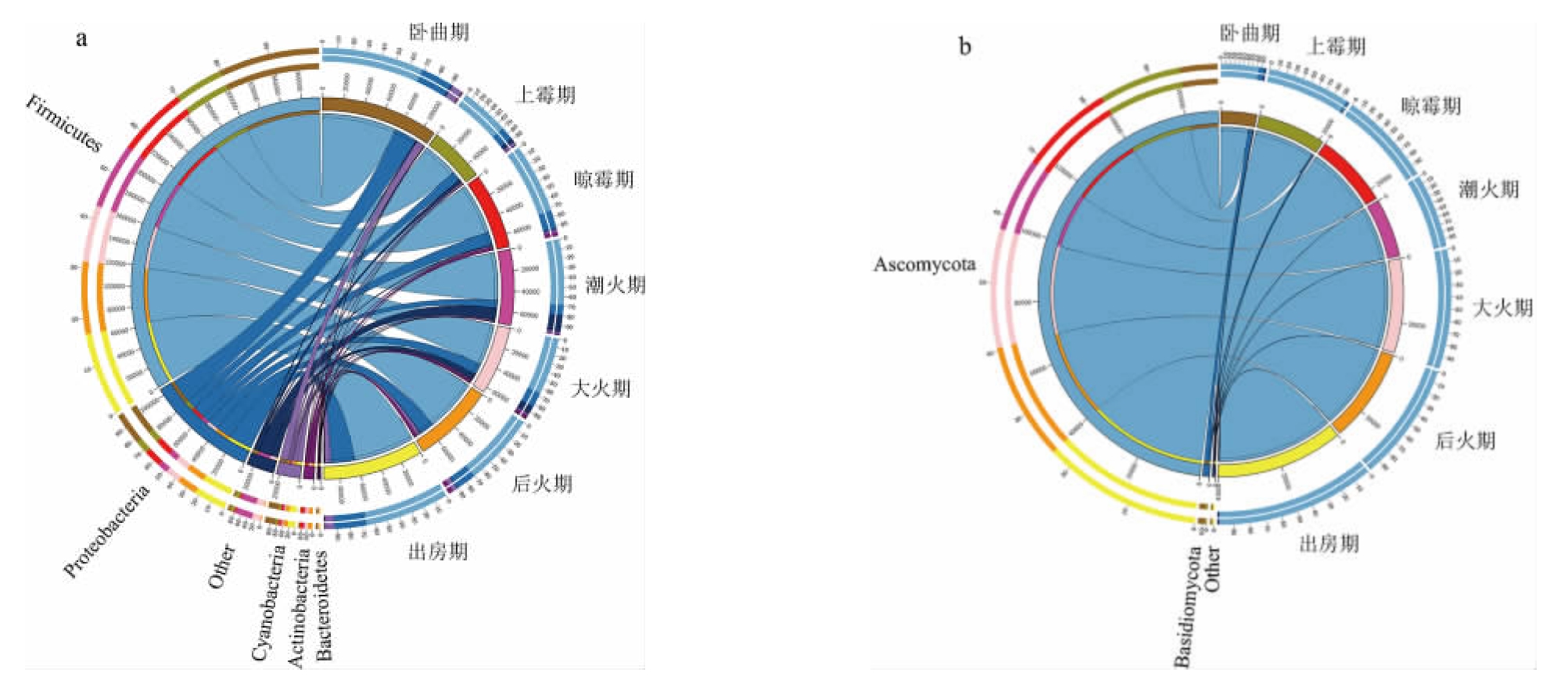
图5 基于门水平后火曲制曲过程中细菌(a)及真菌(b)群落组成
Fig.5 Community composition of bacteria (a) and fungi (b) during the Houhuoqu preparation based on phylum level
Other:相对丰度<1%的其他菌门。左半圆表示微生物门的组成,右半圆表示制曲过程中的各个时期;图中左右两边相同颜色相对应,表示各个菌门在不同时期的分布占比。
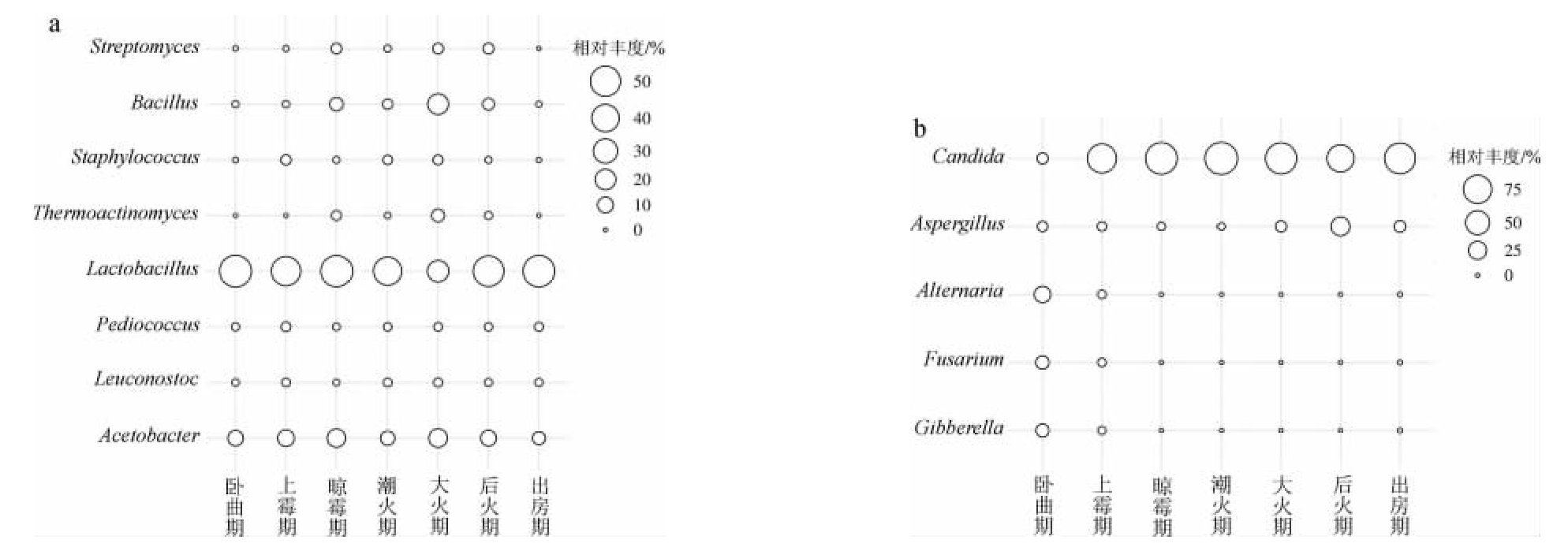
图6 基于属水平后火曲制曲过程中细菌(a)及真菌(b)群落组成
Fig.6 Community composition of bacteria (a) and fungi (b) during the Houhuoqu preparation based on genus level
由图5a可知,在门水平上,从后火曲制曲过程中共检测到5个优势细菌门(平均相对丰度>1%),分别为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、蓝藻门(Cyanobacteria)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes),其中Firmicutes最丰富,在整个制曲期都占据主导地位,相对丰度为66.07%~73.22%,变形菌门(Proteobacteria)次之,相对丰度为10.54%~25.76%。由图5b可知,在门水平上,从后火曲制曲过程中共检测到2个优势真菌门(平均相对丰度>1%),分别为子囊菌门(Ascomycota)、担子菌门(Basidiomycota),其中,子囊菌门(Ascomycota)在整个制曲期占据绝对的优势,相对丰度为83.84%~99.93%。
由图6a可知,在属水平上,从后火曲制曲过程中共检测到8个优势细菌属(平均相对丰度>1%),分别为乳酸杆菌属(Lactobacillus)、醋酸杆菌属(Acetobacter)、芽孢杆菌属(Bacillus)、高温放线菌属(Thermoactinomyces)、链霉菌属(Streptomyces)、明串珠菌属(Leuconostoc)、葡萄球菌属(Staphylococcus)、片球菌属(Pediococcus),其中乳酸杆菌属(Lactobacillus)、醋酸杆菌属(Acetobacter)、芽孢杆菌属(Bacillus)的相对丰度较高。乳酸杆菌属(Lactobacillus)是后火曲制曲过程中的绝对优势菌,其在不同时期样品中的相对丰度高达22.10%~56.60%,且在大火期最低,相对丰度为22.10%。其次为醋酸杆菌属(Acetobacter),其在不同时期样品中的相对丰度为5.80%~15.40%。芽孢杆菌属(Bacillus)在上霉期出现,大火期相对丰度最高为20.40%。高温放线菌(Thermoactinomyces)在晾霉期到后火期均有检出,在大火期相对丰度最高为5.70%。葡萄球菌(Staphylococcus)也在大部分时期样品中都有检出,在上霉期、潮火期和大火期相对丰度较高,分别为2.80%、2.20%和2.50%。由图6b可知,在属水平上,从后火曲制曲过程中共检测到5个优势真菌属(平均相对丰度>1%)。卧曲期的真菌属种类较多,其中链格孢属(Alternaria)、镰孢属(Fusarium)和赤霉菌属(Gibberella)的相对丰度较高,分别为19.10%、10.80%和10.30%,这些菌属多为植物病原菌,推测为制曲原料来源的真菌。培养到上霉期时真菌属种类大幅下降,到晾霉期及以后,优势菌真菌属只有假丝酵母(Candida)和曲霉属(Aspergillus),其原因可能是后火曲中酸度增加抑制了植物病原性真菌生长。假丝酵母属(Candida)是一类重要的非酿酒酵母[33],能发酵生成乙醇,且在酿造中可产生乙酸乙酯等香味物质,在发酵前中期为绝对优势菌,后期相对丰度有所下降,可能与水分或营养物质含量低有关,也可能与菌丝自溶有关[34]。曲霉属(Aspergillus)在整个制曲过程中相对丰度呈现先降后升的趋势,在晾霉期和潮火期相对丰度较低,分别为2.20%和1.30%,后火期相对丰度最高,然后是出房期,分别为27.40%和7.30%。曲霉属的很多菌株能产生多种大量的淀粉酶、蛋白酶等酶制剂,是糖化力的主要功能菌。后火曲制曲过程中真菌群落地变化较好地说明了大曲发酵本身就是对酿酒微生物的筛选过程。
2.4 后火曲制曲过程中优势微生物属与主要理化和生化指标的相关性分析
进一步对后火曲制曲过程中的优势菌属与主要理化、生化指标之间的相关性进行分析,结果见图7。
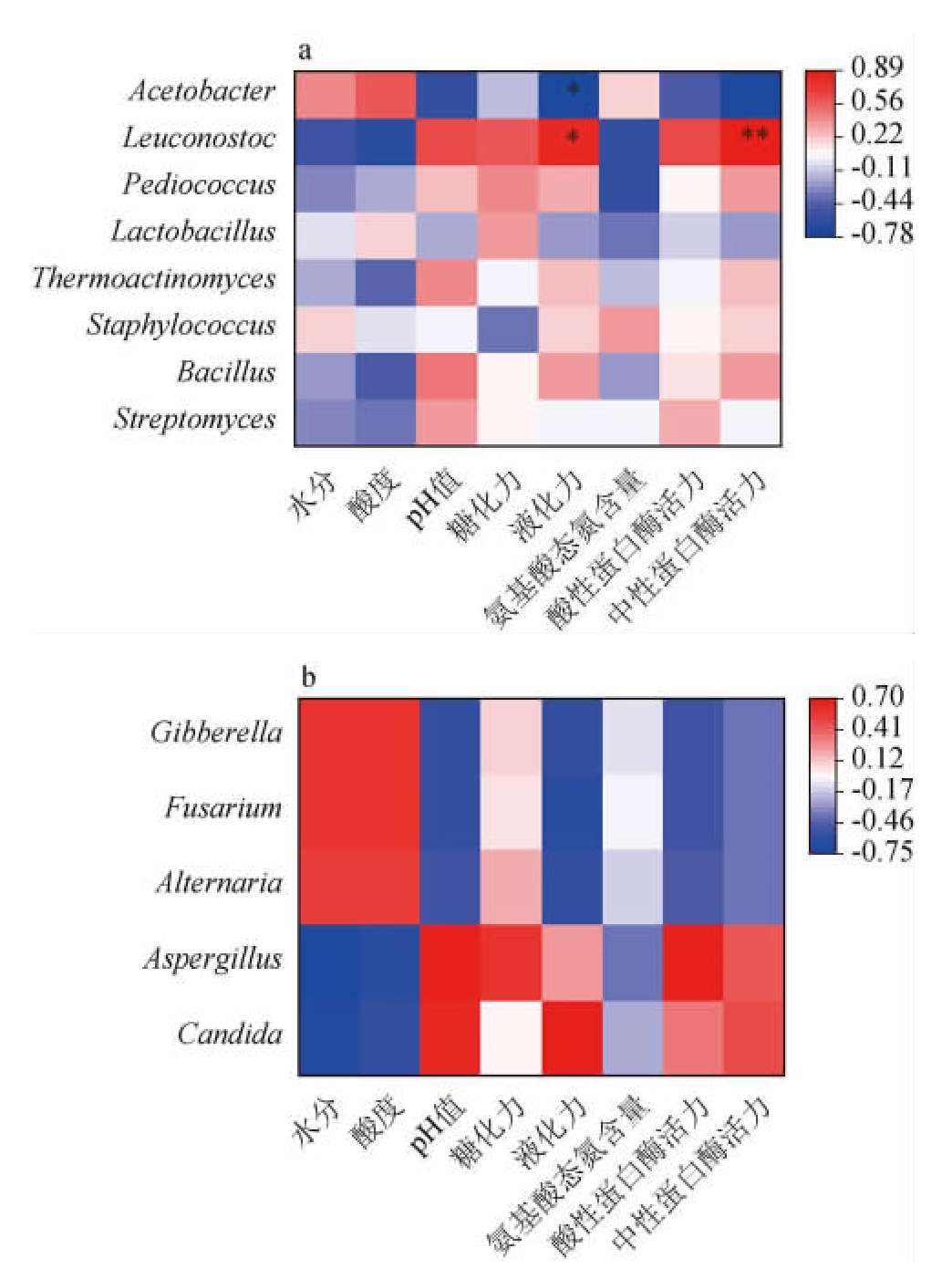
图7 后火曲中优势细菌属(a)及真菌属(b)与主要理化和生化指标之间的相关性分析结果
Fig.7 Results of correlation analysis between dominant bacterial genus (a) and fungal genus (b) and main physicochemical and biochemical indexes in Houhuoqu
“**”表示极显著相关(P<0.01),“*”表示显著相关(P<0.05)。图中红色代表呈正相关,颜色越深,正相关性越强;相反,蓝色代表呈负相关,颜色越深,负相关性越强。
由图7a可知,后火曲制曲过程中,细菌菌群中与酸度相关性最高的是醋酸杆菌属(Acetobacter),其次是乳酸杆菌属(Lactobacillus),与pH正好相反,负相关性最高的是醋酸杆菌属,其次是乳酸杆菌属。芽孢杆菌属(Bacillus)、高温放线菌属(Thermoactinomyces)、链霉菌属(Streptomyces)和片球菌属(Pediococcus)与大曲的酸度呈负相关,与大曲pH呈正相关。明串珠菌属与pH、糖化力、液化力、酸性蛋白酶和中性蛋白酶相关性较高,但是由于其相对丰度不是很高,实际贡献可能较小。芽孢杆菌属与酸度呈负相关,与液化力和中性蛋白酶活力呈正相关,这是因为芽孢杆菌在代谢过程中能产生大量的α-淀粉酶和蛋白酶,尤其是中性蛋白酶[35-39]。
真菌菌群中曲霉属(Aspergillus)(1.30%~27.40%)和假丝酵母属(Candida)(6.10%~98.40%)的相对丰度较高。由图7b可知,曲霉属与大曲糖化力呈正相关,说明曲霉是后火曲糖化力的重要来源,是后火曲产糖化力的功能菌。有研究报道,曲霉属中的米曲霉(Aspergillus oryzae)和黑曲霉(Aspergillus niger)都是常见的产糖化酶功能菌[40-41]。假丝酵母与液化力、酸性蛋白酶、中性蛋白酶呈正相关。假丝酵母经常产生多种水解酶,如VIDOTTO V等[42]分离的26株杜氏假丝酵母(Candida dubliniensis)和27株白色念珠菌(Candida albicans)都能产生蛋白酶,65%的Candida dubliniensis和88%Candida albicans都能产生液化酶。
3 结论
在清香大曲后火曲制作过程中,曲坯在上霉期时,水分和酸度均最大,之后逐渐下降。pH变化趋势与酸度相反,上霉期最低,之后逐渐上升;糖化力呈典型的U字型,在上霉期最低,之后出现大幅度回升;液化力在前期检测不到,潮火期以后出现略有波动;中性和酸性蛋白酶酶活力的变化趋势相似,在晾霉期前酶活较低,之后大幅增加;氨基酸态氮在原料中的含量较少,到卧曲期明显增加,上霉、晾霉和潮火期含量较高,之后逐渐下降;细菌菌群丰富度高于真菌菌群,细菌菌群多样性和丰富度无显著性变化(P>0.05),优势细菌属(平均相对丰度>1%)有8个,其中乳酸杆菌属、醋酸杆菌属和芽孢杆菌属相对丰度最高,分别为22.10%~56.60%、5.80%~15.40%、0.30%~20.40%;真菌菌群多样性和丰富度在晾霉期都显著降低(P<0.05),直到后火期后丰富度显著回升,多样性则是略有回升。优势真菌属有5个,其中假丝酵母属和曲霉属相对丰度较高,分别为6.10%~98.40%、1.30%~27.40%。相关性分析结果表明,醋酸杆菌属及乳酸杆菌属与酸度呈正相关,芽孢杆菌与中性蛋白酶和液化力呈正相关,曲霉与糖化力呈正相关,假丝酵母与液化力、酸性蛋白酶活力、中性蛋白酶活力呈正相关。
[1]赵景龙.浅谈清香型酒三种大曲的差异性[J].酿酒,2000,27(5):43-44.
[2]王广峰.清香型大曲工艺特点及其质量改进[J].酿酒,2011,38(2):60-61.
[3]刘昌录,魏耀成,任润斌.浅析汾酒三种大曲的生产特点[J].酿酒,2012,39(5):31-32.
[4]韩英.1964年汾酒试点科研成就[J].酿酒科技,2018(2):97-105.
[5]SHI J H,XIAO Y P,LI X R,et al.Analyses of microbial consortia in the starter of Fen liquor[J].Lett Appl Microbiol,2009,48(4):478-485.
[6]曹苗文,相里加雄,杨凯环,等.清香型大曲白酒酿造中发酵微生物的分析研究[J].酿酒科技,2022(1):36-41,46.
[7]崔如生.温度、酸度对大曲酒产、质量的影响[J].酿酒,2007,34(6):30-31.
[8]李科发,胡贤民,付毅华,等.关于夏季压窖期间不同投粮量对基酒产、质量的影响研究[J].酿酒,2016,43(3):41-43.
[9]林培,肖美兰,吴生文,等.不同的曲粮比对夏季特香型基酒产、质量的影响[J].酿酒科技,2018(1):57-61,68.
[10]张学林,季斌,许玲,等.清香型大曲中产β-苯乙醇酵母的分离、鉴定及在白酒酿造中的应用[J].中国酿造,2022,41(1):123-127.
[11]徐秋硕,陈亚祥,石凤,等.不同大曲对清香基酒产质量影响的研究[J].酿酒,2021,48(1):116-119.
[12]王勇,周森,魏金旺.基于高通量测序技术分析牛栏山大曲微生物多样性[J].中国酿造,2019,38(2):58-61.
[13]张双燕,廖永红,纪南,等.基于高通量测序技术分析北京清香型大曲微生物多样性[J].中国酿造,2016,35(11):49-53.
[14]周森,胡佳音,崔洋,等.应用高通量测序技术解析清香型大曲微生物多样性[J].中国食品学报,2019,19(6):244-250.
[15]李斌,胡俊杰,张兰兰,等.基于高通量测序浓香型和芝麻香型白酒酒曲真菌群落结构的分析[J].中国酿造,2019,38(10):96-100.
[16]马茹菲,马玉帛,佟世生,等.不同清香型大曲理化生化指标和挥发性成分分析[J].酿酒科技,2019(3):70-75.
[17]LI W W,FAN G S,FU Z L,et al.Effects of fortification of Daqu with various yeasts on microbial community structure and flavor metabolism[J].Food Res Int,2020,129:108837.
[18]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998:615-626.
[19]李季鹏.淀粉酶、蛋白酶在芝麻香型白酒中的应用[D].济南:济南大学,2013.
[20]冯利芳.大曲蛋白酶的效果分析及其功能菌的分离鉴定和应用研究[D].太原:山西师范大学,2018.
[21]DENG L,MAO X,LIU D,et al.Comparative analysis of physicochemical properties and microbial composition in high-temperature Daqu with different colors[J].Front Microbiol,2020,11:588117.
[22]李兵,张超,王玉霞,等.白酒大曲功能微生物与酶系研究进展[J].中国酿造,2019,38(6):7-12.
[23]张秀红,马冰,李素琴,等.清香型大曲淀粉水解酶测定方法研究[J].酿酒科技,2012(10):115-118.
[24]韩兴林,王建耀,王广峰,等.清香型大曲糖化力的简单分析[J].酿酒科技,2009(9):68-70.
[25]韩玉娥,王建林.大麦β-淀粉酶活性与品种及环境效应研究进展[J].安徽农学通报,2017,23(16):24-27.
[26]姜晓东,张京,郭刚刚.中国大麦地方品种的α-淀粉酶酶活性研究[J].植物遗传资源学报,2013,14(2):322-328.
[27]方芳,冀林立,张彦斌,等.产耐热蛋白酶乳酸菌的筛选、产酶条件及其酶学性质的研究[J].食品科学,2008,29(10):375-379.
[28]童敏.乳杆菌胞壁蛋白酶分离纯化及特性研究[D].宁波:宁波大学,2011.
[29]袁清珠,林笃志,北村良久,等.乳酸菌Enterococcuse faecalis TN-9低温蛋白酶的提纯及性质[J].微生物学杂志,2009,29(5):20-25.
[30]宋园亮,黄文宇,张忠华,等.高产蛋白酶菌株Bacillus cereus KM-4的产酶实时动态研究[J].生物技术通报,2011(6):198-204.
[31]程旺开.产蛋白酶乳酸菌的筛选及发酵豆奶产酶条件优化[J].芜湖职业技术学院学报,2018,20(1):1-5.
[32]沈才洪,应鸿,许德富,等.大曲质量标准的研究(第三报):大曲生香力的特征指标探讨[J].酿酒科技,2005(8):20-22.
[33]卜光明,周化斌,周茂洪,等.酿造酒中非酿酒酵母的研究进展[J].食品工业科技,2019,40(14):346-352.
[34]DE VUYST L,HARTH H,VAN KERREBROECK S,et al.Yeast diversity of sourdoughs and associated metabolic properties and functionalities[J].Int J Food Microbiol,2016,239:26-34.
[35]吴海锋,张瑾,陆祖军,等.酱香型白酒大曲细菌与蛋白酶研究进展[J].广西师范大学学报(自然科学版),2022,40(5):398-405.
[36]冯利芳,李素琴,刘鹏烩,等.清香大曲中性蛋白酶产生菌的分离鉴定及应用研究[J].食品科技,2018,43(11):1-6.
[37]李娜,附俊杰,刘军,等.一株产中性蛋白酶菌株的筛选及其发酵产酶条件优[J].食品工业科技,2023,44(1):189-199.
[38]周婉婷,侯宏伟,贺瑞琦,等.豆豉中产蛋白酶菌株的酶学性质及风味酶基因挖掘[J].食品与发酵工业,2022,48(24):181-193.
[39]张晋,宇海萍,马磊磊,等.高温淀粉酶高产菌株的ARTP诱变选育及发酵条件优化[J].食品科技,2021,46(8):22-26.
[40]杨丹丹,钱志伟,陈茂彬,等.高糖化力菌种的筛选及诱变育种[J].中国酿造,2010,29(1):36-38.
[41]赵中开,龙可,马莹莹,等.米曲霉菌在酿酒工业中的研究进展[J].现代食品科技,2013,29(4):932-935,862.
[42]VIDOTTO V,PONTÓN J,AOKI S,et al.Differences in extracellular enzymatic activity between Candida dubliniensis and Candida albicans isolates[J].Rev Iberoam Micol,2004,21:70-74.