酱香型白酒生产过程中,由于独特的高温工艺,微生物组成主要为细菌以及耐高温真菌,其中酵母是不可或缺的微生物[1]。酿酒酵母(Saccharomyces cerevisiae)富含多种酶类以及营养物质,可将原料中的葡萄糖转化为乙醇及二氧化碳[2-3]。因此,酿酒酵母被认为是酒体中乙醇的主要来源[4-5]。白酒的主体成分是乙醇和水,占总量的98%~99%[6]。酵母发酵性能的优劣直接决定白酒的产量,对产酒率具有重要的影响[7]。
在白酒发酵过程中,酿酒酵母会受到不同环境因子的胁迫作用,如高温、高酒精度、高糖度的高渗透压、pH值变化等[8-9]。筛选与选育出优良的酿酒酵母不仅能提高乙醇产量和风味丰富度,还能降低生产成本与增加市场竞争力[10-11]。因此,选育和培养出发酵性能优良且耐受性强的酵母是提高酱香型白酒产量的关键。李园子等[12]通过多步骤筛选获得一株耐酸性且增加香气化合物的酿酒酵母;王晓丹等[13]采用耐高糖实验筛选出12株产多元醇酵母;金红等[14]经高醇、高糖和高硫耐受试验后筛选出2株酵母并运用于葡萄酒的酿造;陈忠军等[15]通过紫外诱变筛选出一株具有耐乙醇特性的酿酒酵母。
目前,对于酱香型白酒酿酒微生物的研究多为微生物的相互作用及微生物多样性研究[16-18],因此,通过筛选出高耐受性酿酒酵母,不仅能促进乙醇生产,还能从源头提高白酒的产量与品质。酱香型白酒历史悠久,酿酒酵母在长期生产过程中被不断驯化,在遗传、产酒精和酒精耐受性方面相对高效稳定[19-20]。本研究采用自然选育,从高温堆积的酱香型白酒酒醅中分离纯化酵母菌株,通过发酵能力测定及耐受性分析从中筛选高产酒精的优良酵母菌株,并通过形态观察及分子生物学技术对其进行菌种鉴定,旨在获得高产酒精且生理耐性较强的酵母菌,以提高白酒产量。
1 材料与方法
1.1 材料与试剂
1.1.1 样品及菌株
高温堆积酱香型白酒酒醅样品:贵州某酒企;安琪酿酒酵母:安琪酵母股份有限公司。
1.1.2 试剂
植物脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司;乙醇(纯度99.7%):天津市科密欧化学试剂有限公司;2,3,5-三苯基氯化四氮唑(2,3,5-triphenyltetrazolium chloride,TTC);上海麦克林生化科技有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
孟加拉红琼脂培养基、酵母浸出粉胨葡萄糖(yeast peptone dextrose,YPD)液(固)体培养基、麦芽汁发酵培养基:青岛海博生物技术有限公司。
初筛培养基[21]:上层培养基:TTC 0.05 g,葡萄糖0.5 g,琼脂1.5 g,蒸馏水100 mL,115 ℃灭菌20 min。下层培养基:YPD固体培养基。
1.2 仪器与设备
FE28台式酸度计:梅特勒-托利多公司;奥林巴斯cx43显微镜:奥林巴斯(中国)有限公司;GC-2030型气相色谱(gaschromatography,GC)仪:岛津(上海)实验器材有限公司;ZQTY-70V台式全温振荡培养箱:上海知楚仪器有限公司;DL-339101糖度计:得力集团有限公司;2720 thermal cycler聚合酶链式反应(polymerase chain reaction,PCR)仪:美国应用生物系统公司。
1.3 方法
1.3.1 酵母菌分离纯化
准确称取5.00g酒醅置于50mL无菌水中,30℃、150r/min条件下振荡30 min得到菌悬液。取菌悬液1 mL置于9 mL无菌水试管中,得到10-1的稀释菌悬液,以此类推,依次制成10-2、10-3、10-4、10-5、10-6的稀释菌悬液。吸取0.1 mL 10-4~10-6稀释菌悬液均匀涂布于孟加拉红培养基,每个梯度三个平行,于30 ℃培养箱中倒置培养24 h。
根据稀释涂布平板上菌落的不同形态特征,将长势良好且具有典型酵母菌菌落形态的单菌落进行显微镜镜检,将符合酵母细胞形态的菌落多次划线纯化后,接种到YPD试管斜面4 ℃保存备用。
1.3.2 酵母发酵能力筛选
(1)酵母菌一级筛选(TTC法):将分离得到的菌株接种于下层培养基,30 ℃培养24 h,出现菌落后,添加覆盖一层上层培养基,30 ℃避光培养2~3 h。根据显色的颜色深浅判断酵母菌的产酒精能力。
(2)酵母菌二级筛选(麦芽汁发酵实验):以安琪酿酒酵母作为对照,将不同酵母菌株接种于YPD液体培养基,150 r/min、30 ℃扩培得到种子液,以106 CFU/mL的接种量接种于麦芽汁发酵培养基,在30 ℃、150 r/min条件下摇床培养3 d,测定发酵液CO2质量损失[22],比较发酵能力。发酵液经脱脂棉过滤后进行理化指标测定并进行感官评价。
1.3.3 酵母菌耐受性分析
温度耐受性测定:将待测菌株接种于YPD固体培养基后,分别在20 ℃、25 ℃、30 ℃、35 ℃、40 ℃、45 ℃、50 ℃条件下培养1~2 d后观察记录菌落生长情况。
酒精耐受性测定:向酒精度分别为5%vol、10%vol、15%vol、20%vol、25%vol的麦芽汁发酵培养基中放入倒置杜氏小管,将待测菌株按同一菌体浓度(106 CFU/mL)接入,置于150 r/min、30 ℃的恒温摇床中培养24 h后,通过血球计数板镜检计数[23],并观察酵母产气情况。
酸耐受性测定:向pH值分别为2、3、4、5、6的麦芽汁发酵培养基中放入倒置杜氏小管,将待测菌株按同一菌体浓度(106 CFU/mL)接入,置于150 r/min、30 ℃的恒温摇床中培养24 h后,通过血球计数板镜检计数,并观察酵母产气情况。
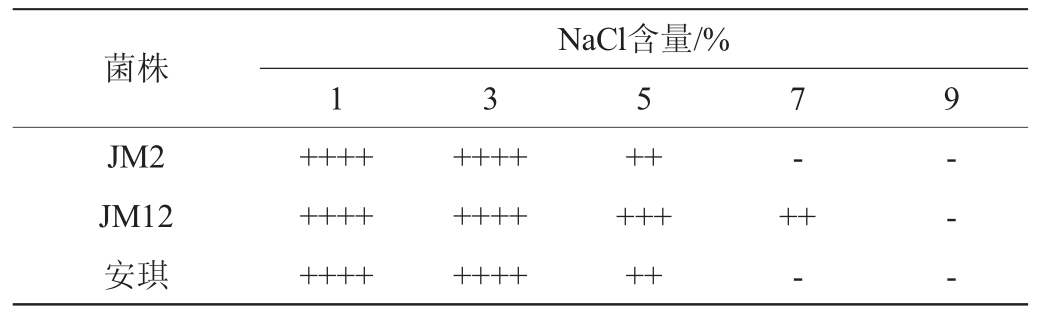
盐耐受性测定:向NaCl含量分别为1%、3%、5%、7%、9%的麦芽汁发酵培养基中放入倒置杜氏小管,将待测菌株按同一菌体浓度(106 CFU/mL)接入,置于150 r/min、30 ℃的恒温摇床中培养24 h后,通过血球计数板镜检计数,并观察酵母产气情况。
糖耐受性测定:向葡萄糖含量分别为10%、20%、30%、40%、50%的YPD液体培养基中放入倒置杜氏小管,将待测菌株按同一菌体浓度(106 CFU/mL)接入,置于150 r/min、30 ℃的恒温摇床中培养24 h后,通过血球计数板镜检计数,并观察酵母产气情况。
1.3.4 酵母菌株的鉴定
(1)形态观察
将筛选得到的菌株划线接种于YPD固体培养基上,在30 ℃条件下培养24 h后观察单菌落形状、隆起情况、边缘状态、颜色、质地等菌落形态特征。用接种环挑取少量菌体于显微镜下观察其细胞形态。
(2)分子生物学鉴定
DNA提取:使用植物DNA提取试剂盒并按说明提取样品DNA,提取后于-20 ℃保藏。根据参考文献[24-25],采用内部转录间隔区(internal transcribed spacer,ITS)引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')对目的菌株进行PCR扩增。PCR扩增体系:1×PCR MIX 45 μL,正向引物ITS1和反向引物ITS4各2 μL,DNA模板1 μL。PCR扩增程序:98 ℃预变性2 min;98 ℃变性10 s,55 ℃退火10 s,72 ℃延伸30 s,35个循环;72 ℃终延伸5 min,4 ℃保存。采用1%琼脂糖凝胶电泳检测质量,将检测合格的目的片段送至通用生物(安徽)股份有限公司进行测序。
将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性搜索,选取同源性较高的模式菌株的ITS rRNA基因序列,采用MEGA X软件中的邻接(neighbor-joining)法构建系统发育树。
1.3.5 测定方法
可溶性固形物含量的测定:采用手持糖度计测定;酸度和残糖量的测定:参考《酿酒分析与检测》[26];感官评定方法:参考GB/T 33405—2016《白酒感官品评术语》[27];酒精度的测定:参考GB 5009.225—2016《食品安全国家标准酒中乙醇浓度的测定》[28]中气相色谱法,并对其色谱条件进行调整,GC条件为DB-WAX毛细管柱(30 m×0.25 mm×1 μm),汽化室温度250 ℃;载气高纯氮气(N2),载气流速1 mL/min;分流进样,分流比20∶1。升温程序为起始温度50℃,保持2 min,以5 ℃/min升温至90 ℃,再以25 ℃/min升温至190 ℃,保持3 min,运行时间52 min。
1.3.6 数据处理及分析
数据统计采用SPSS 20.0软件,绘图采用EXCEL 2019软件,系统发育树由MEGA X软件绘制。
2 结果与分析
2.1 酵母菌的分离
结合稀释涂布和平板划线的方法从高温堆积酱香型白酒酒醅中共分离纯化出12株菌落形态存在差异的酵母菌株,分别编号为JM1、JM2、JM3、JM4、JM5、JM6、JM7、JM8、JM9、JM10、JM11、JM12,其菌落及细胞形态见图1及表1。由图1及表1可知,除菌株JM3、JM6、JM8的菌落颜色为红色,其余菌株均为乳白色。菌落边缘除菌株JM1、JM4、JM5、JM10为锯齿状外,基本光滑无扩散,质地均易挑起。12株菌的细胞形态基本为圆形或椭圆形,且都为单种细胞形态类型,符合酵母的形态学特性。
表1 筛选酵母菌株的菌落及细胞形态特征
Table 1 Colony and cell morphological characteristics of screened yeast strains
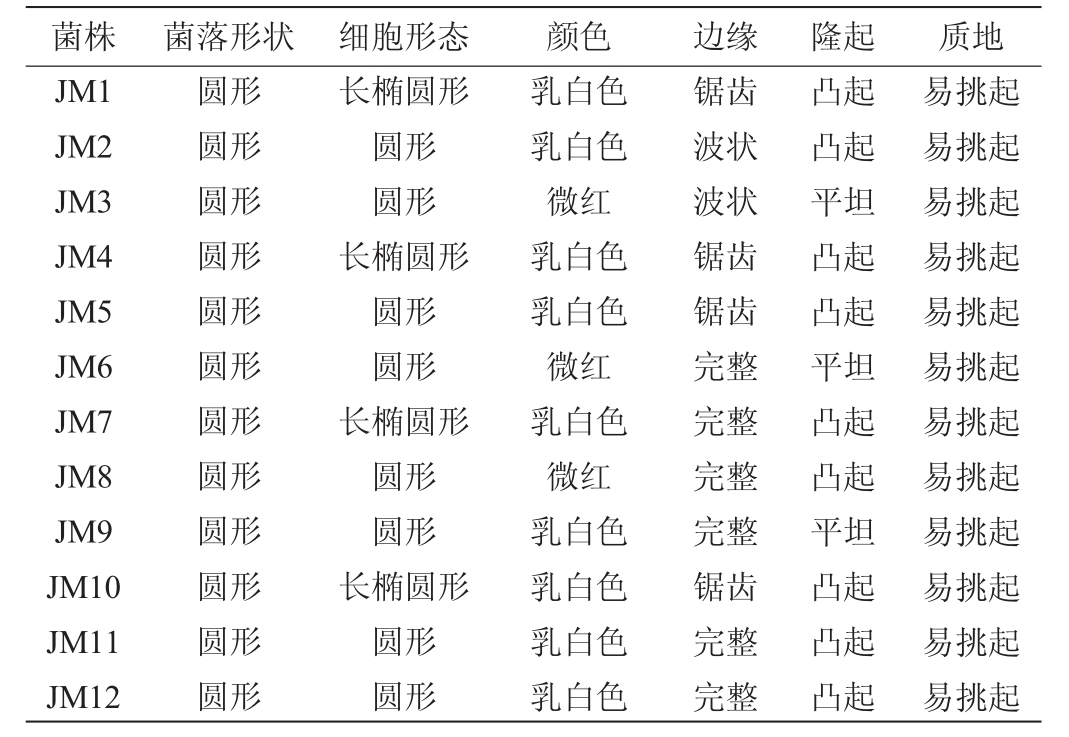

图1 筛选酵母菌株的菌落(a)和细胞(b)形态(100×)
Fig.1 Colony (a) and cell (b) morphology of screened yeast strains(100×)
2.2 酵母菌发酵能力的筛选
2.2.1 一级筛选
TTC平板显色法筛选结果见图2。由图2可知,菌株JM11和JM12呈深红色、菌株JM2和JM9呈粉红色,其余酵母菌不显色。因此,将菌株JM2、JM9、JM11、JM12进行进一步复筛,并与安琪酿酒酵母进行对比。

图2 筛选酵母菌菌株的一级筛选结果
Fig.2 Primary screening results of screened yeast strains
a为酵母菌株在下层培养基上的生长情况;b为添加上层培养基后酵母菌株的生长情况。
2.2.2 二级筛选
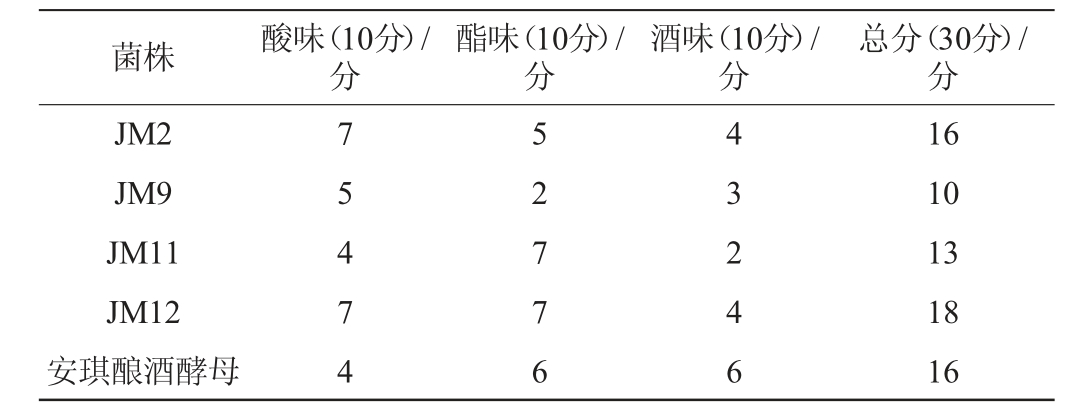
将安琪酿酒酵母与初筛获得的菌株接种于麦芽汁发酵培养基进行复筛,其发酵液理化指标及感官评价分别见表2和表3。由表2可知,菌株JM9、JM12和安琪酿酒酵母的CO2质量损失较大,可溶性固形物和残糖量较低,代谢耗糖能力强。菌株JM9、JM11的总酸含量较高,产酸类物质能力较强。菌株JM2、JM12的产酒能力较强,酒精度分别达到5.53%vol和6.52%vol,菌株JM12的酒精度高于安琪酿酒酵母。由表3可知,菌株JM2、JM12的发酵风味较优异,感官评分分别为16分、18分,而菌株JM9、JM11的发酵风味较差,感官评分分别为10分、13分。结合发酵能力与感官评价,选用菌株JM2、JM12为高产酒精菌株进行耐受性实验。
表2 筛选酵母菌菌株发酵力的测定结果
Table 2 Determination results of fermentation capacity of screened yeast strains
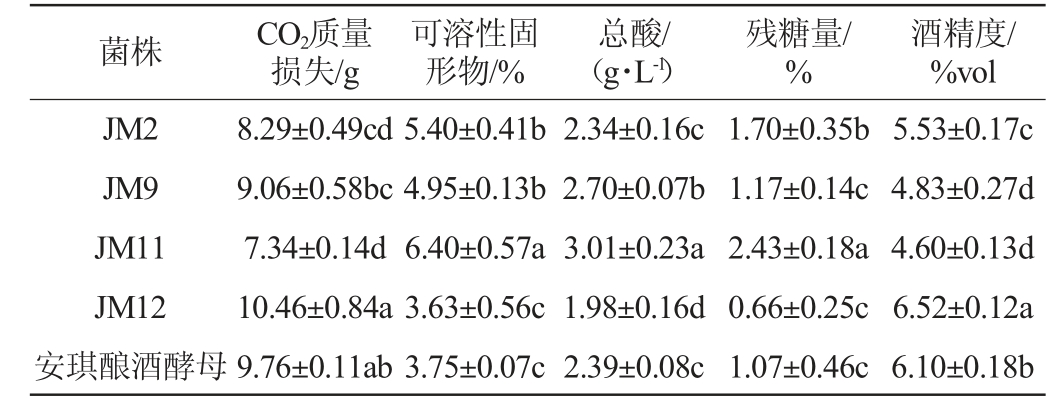
注:同一列不同字母表示差异显著(P<0.05)。
表3 筛选酵母菌菌株发酵麦芽汁培养基的感官评价结果
Table 3 Sensory evaluation results of wort medium fermented by screened yeast strains
2.3 酵母菌株的耐受性分析
2.3.1 温度耐受性测定
酱香型白酒的生产特点之一是“四高”,即高温制曲、高温堆积、高温发酵和高温馏酒[29]。高温工艺可以促进美拉德反应的进行,提高代谢速率,使食品的颜色风味产生变化,但同时抑制部分微生物的生长代谢[30]。以安琪酿酒酵母为对照,菌株JM2、JM12在不同培养温度下的生长情况见表4。
表4 筛选酵母菌株的温度耐受性
Table 4 Temperature tolerance of screened yeast strains
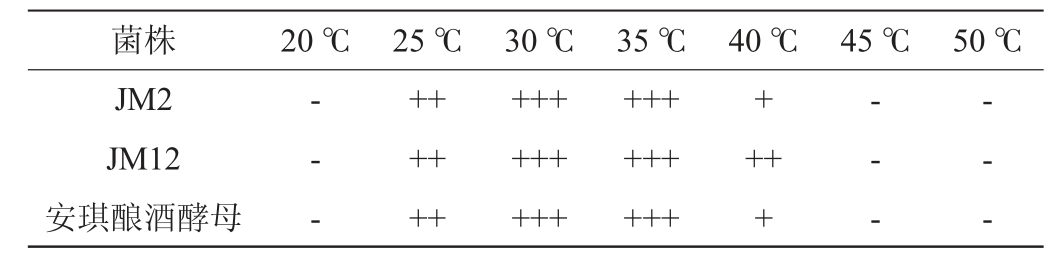
注:“+++”表示生长旺盛,“++”表示生长较好,“+”表示可以生长,“-”表示不生长。
由表4可知,菌株JM2、JM12和安琪酵母均能在25~35℃旺盛生长,在40 ℃生长受到一定抑制,在20 ℃以下与45 ℃以上的环境中则不能生长,说明3株菌的温度耐受性相差不大,最高耐受温度均为40 ℃。
2.3.2 酒精耐受性测定
以安琪酿酒酵母为对照,菌株JM2和JM12在不同酒精度的麦芽汁发酵培养基中的菌落数量及产气情况分别见图3和表5。
表5 筛选酵母菌株在不同酒精度下的产气情况
Table 5 Gas production of screened yeast strains under different alcohol content conditions
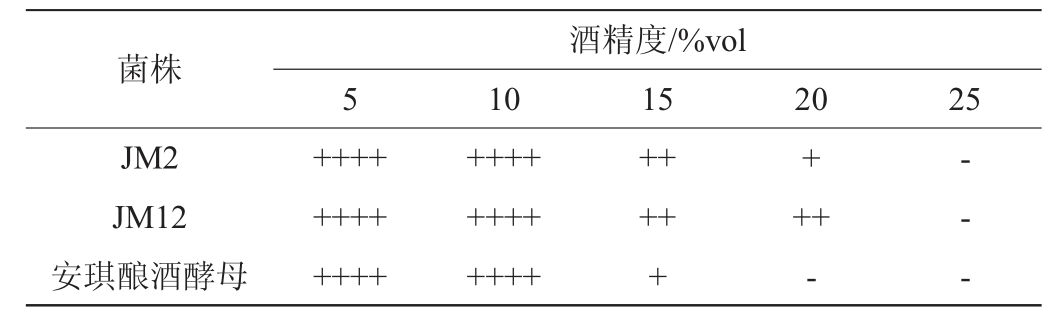
注:“+”表示杜氏管内气体体积达到1/4,“++”表示杜氏管内气体体积达到1/2,“+++”表示杜氏管内气体体积达到3/4,“++++”表示杜氏管内气体满管,“-”表示不产气。下同。
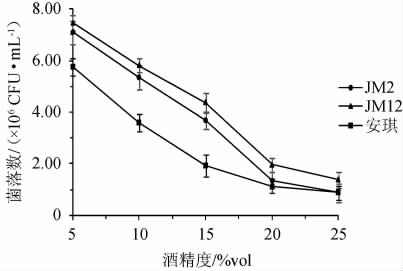
图3 筛选酵母菌株在不同酒精度条件下的菌落数
Fig.3 Number of colonies of screened yeast strains under different alcohol content conditions
由图3可知,3株酵母菌株在酒精度为5%vol~25%vol的麦芽汁发酵培养基中,随着酒精度的增加,活菌数不断减少,说明高的酒精度会抑制酵母菌的生长繁殖。当酒精度为20%vol时,菌株JM12有少量生长,菌株JM2和安琪酿酒酵母基本不生长。
由表5可知,酵母菌菌株JM2和JM12在酒精度20%vol的条件下仍可发酵产气,而安琪酿酒酵母在高于15%vol酒精度的条件下已不能产气。综上,菌株JM12具有良好的酒精耐受性,在25%vol酒精度下仍可生长,在20%vol酒精度下发酵产气。
2.3.3 酸耐受性测定
以安琪酿酒酵母为对照,菌株JM2和JM12在不同酸性条件下的菌落数量及产气情况分别见图4和表6。
表6 筛选酵母菌株在不同酸性条件下的产气情况
Table 6 Gas production of screened yeast strains under different acidic conditions
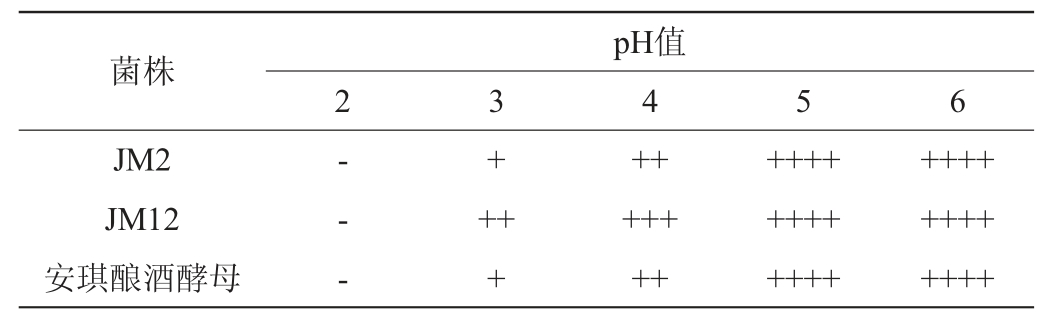
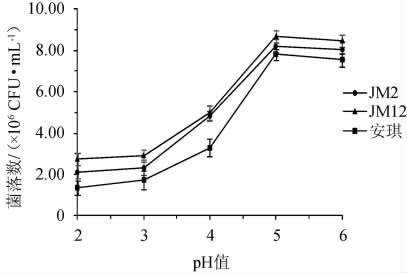
图4 筛选酵母菌株在不同酸性条件下的菌落数
Fig.4 Number of colonies of screened yeast strains under different acidic conditions
由图4可知,当pH为5时,3株菌株的菌落数均最高,且菌株JM12的菌落数最多,为8.21×106 CFU/mL。随着pH降低,活菌数降低,说明3株菌的适宜生长pH为5。
由表6可知,3株菌在pH值为2时已不产气,而在pH值为3~4时都能产气,其中菌株JM12的发酵产气能力较其余两株菌株强。当pH值为5~6时,3株菌的产气能力稳定,此现象与图5的结果一致。相比之下,菌株JM12的耐酸能力更强,在pH值为3时仍可生长并发酵产气。
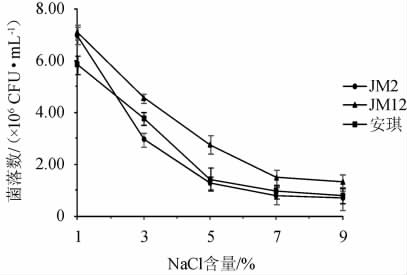
图5 筛选酵母菌株在不同盐含量条件下的菌落数
Fig.5 Number of colonies of screened yeast strains under different salt content conditions
2.3.4 盐耐受性测定
以安琪酿酒酵母为对照,菌株JM2和JM12在不同盐含量的麦芽汁发酵培养基中的菌落数量及产气情况分别见图5和表7。
表7 筛选酵母菌株在不同盐含量条件下的产气情况
Table 7 Gas production of screened yeast strains under different salt content conditions
由图5可知,随着NaCl含量的升高,3株酵母菌的生长均受到抑制,酵母菌数明显下降。在相同盐含量条件下,菌株JM12的活菌数高于另外两株菌,即耐盐能力比菌株JM2与安琪酿酒酵母更优。
由表7可知,NaCl含量为1%~3%时,3株菌的发酵产气能力稳定,随着NaCl含量的增加,产气能力受到抑制。NaCl含量达到7%时,菌株JM2与安琪酵母已不产气。而NaCl含量达到9%时,菌株JM12的发酵产气能力才被完全抑制。综上,菌株JM12的耐盐能力较另外两株更高,在NaCl含量为7%时仍可生长并发酵产气。
2.3.5 糖耐受性测定
以安琪酿酒酵母为对照,菌株JM2和JM12在不同糖含量的麦芽汁发酵培养基中的菌落数量及产气情况分别见图6和表8。
表8 酵母菌株在不同糖含量条件下的产气情况
Table 8 Gas production of yeast strains under different sugar content conditions
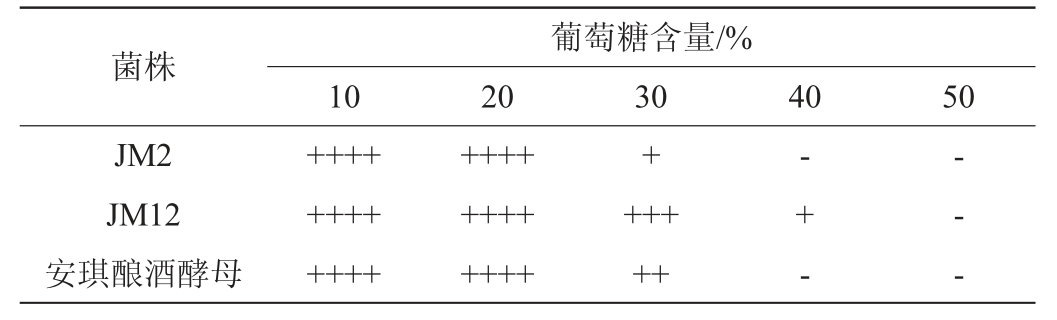
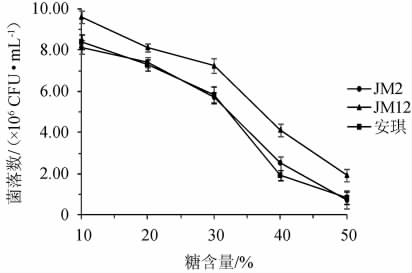
图6 筛选酵母菌株在不同糖含量条件下的菌落数
Fig.6 Number of colonies of screened yeast strains under different sugar content conditions
由图6可知,3株菌随着葡萄糖含量的升高生长受到抑制,菌落数逐渐降低。当葡萄糖含量达到30%以上,菌落数显著降低。其中菌株JM12在葡萄糖含量为50%时可以生长,菌落数为1.92×106 CFU/mL,而菌株JM2和安琪酿酒酵母菌落数均低于初始接种量1×106 CFU/mL。
由表8可知,当葡萄糖含量为10%和20%时,菌株的产气能力未受到抑制。当葡萄糖含量>20%后,菌株的产气能力被抑制,当葡萄糖含量为30%时,菌株JM2和安琪酿酒酵母的产气能力降低;当葡萄糖含量为40%时,菌株JM12产气被抑制,而菌株JM2和安琪酵母已不产气。在相同葡萄糖含量条件下,菌株JM12的耐糖能力优于其余两株,在葡萄糖含量达到40%时仍可生长并发酵产气。
综上,酿酒酵母JM12耐受性较好,在培养温度40 ℃、酒精度20%vol、pH 3.0、NaCl含量7%以及葡萄糖含量40%的条件下仍能较好生长发酵,为优良高产酒精酵母菌株。
2.4 酵母菌株JM12的分子生物学鉴定
基于ITSrRNA基因序列菌株JM12的系统发育树见图7。

图7 基于ITS rRNA基因序列菌株JM12的系统发育树
Fig.7 Phylogenetic tree of strain JM12 based on ITS rRNA gene sequences
由图7可知,菌株JM12与酿酒酵母(Saccharomyces cerevisiae)聚于一支,亲缘关系最近,相似度达到99%,结合形态学特征将菌株JM12鉴定为酿酒酵母(Saccharomyces cerevisiae)。
3 结论
本研究采用自然选育从高温堆积酱香型白酒酒醅中分离得到12株形态具有差异的酵母菌株。通过多次筛选得到两株发酵性能较优的菌株JM2和JM12,通过产酒能力测定及耐受性分析发现,菌株JM12的发酵能力及耐受性最好,其在麦芽汁发酵培养基中30 ℃发酵72 h后,酒精度达6.52%vol,高于对照安琪酿酒酵母(6.10%vol),可在培养温度40 ℃、酒精度20%vol、pH 3.0、NaCl含量7%以及葡萄糖含量40%的条件下较好生长发酵,可应用于白酒酿造,经鉴定,该菌株为酿酒酵母(Saccharomyces cerevisiae)。
[1]陈梦圆,刘学彬,汪平,等.产酯香功能菌对酱香型酒醅的影响[J].食品科学,2018,39(10):199-205.
[2]丁斌,邢爽,刘露,等.酿酒酵母在动物生产中的应用研究进展[J].饲料研究,2019,42(7):114-116.
[3]DE ALMEIDA SILVA VILELA J,DE FIGUEIREDO VILELA L,RAMOS C L,et al.Physiological and genetic characterization of indigenous Saccharomyces cerevisiae for potential use in productions of fermented maizebased-beverages[J].Braz J Microbiol,2020,51(3):1297-1307.
[4]戎梓溢,白茹,闫学娇,等.酱香型白酒酿造微生态中酵母菌的研究进展[J].食品研究与开发,2022,43(13):180-188.
[5]SHAGHAGHI-MOGHADDAM R,JAFARIZADEH-MALMIRI H,MEHDIKHANI P,et al.Screening of the five different wild,traditional and industrial Saccharomyces cerevisiae strains to overproduce bioethanol in the batch submerged fermentation[J].Z Naturforsch C,2018,73(9-10):361-366.
[6]ZHENG X W,HAN B Z. Baijiu,Chinese liquor: History,classification and manufacture[J].J Ethnic Foods,2016,3(1):19-25.
[7]山其木格,梁慧珍,张长霞,等.糟醅堆积过程中微生物种群的变化规律[J].食品与生物技术学报,2016,35(3):330-335.
[8]STANLEY D,BANDARA A,FRASER S,et al.The ethanol stress response and ethanol tolerance of Saccharomyces cerevisiae[J].J Appl Microbiol,2010,109(1):13-24.
[9]LI R,XIONG G,YUAN S,et al.Investigating the underlying mechanism of Saccharomyces cerevisiae in response to ethanol stress employing RNA-seq analysis[J].World J Microbiol Biotechn,2017,33(11):1-13.
[10]TIAN T,WU D,NG C T,et al.A multiple-step strategy for screening Saccharomyces cerevisiae strains with improved acid tolerance and aroma profiles[J].Appl Microbiol Biot,2020,104(7):3097-3107.
[11]秦立芹,殷欢,成柳洁,等.一株高产己酸乙酯酵母菌株的筛选、鉴定及发酵条件优化[J].食品与发酵工业,2022,48(1):55-61.
[12]李园子,田伏锦,王凤寰,等.白酒酿造中适产高级醇酿酒酵母菌株选育研究进展[J].食品与发酵工业,2022,48(15):316-324.
[13]王晓丹,韩超,印丽,等.白酒酿造过程中耐高糖酵母的筛选及发酵产多元醇分析[J].中国酿造,2020,39(8):54-58.
[14]金红,张小燕,路宏科,等.耐高渗酵母选育及其在葡萄酒中的应用研究[J].中国酿造,2021,40(6):192-195.
[15]陈忠军,杨小冲,赵洁,等.具高乙醇耐受力酵母菌的选育及其在猕猴桃果酒中的应用[J].食品工业科技,2018,39(2):141-151.
[16]侯强川,王玉荣,王文平,等.茅台和尧治河高温大曲细菌群落结构差异及功能预测[J].食品与发酵工业,2022,48(1):36-44.
[17]沈毅,陈波,王西,等.酱香型郎酒高温大曲、酒醅和窖泥中细菌群落结构分析[J].中国酿造,2020,39(2):89-93.
[18]刘正,秦培军,卢延想,等.酱香型白酒酿造过程中微生物多样性及代谢过程研究进展[J].中国酿造,2022,41(6):6-11.
[19]吴士业.酒用耐(嗜)酸性酵母菌的自然选育[J].中国酿造,2008,27(24):82-83.
[20]毛志群,张伟,檀建新,等.燃料乙醇用高产酒精酵母的筛选及鉴定[J].酿酒,2003,30(3):35-37.
[21]巩园园,毛志海,王奕芳,等.黄酒曲酵母的筛选和耐受性研究[J].酿酒科技,2020(3):93-99.
[22]池海波,陈小娥,方旭波,等.“快速活性干酵母发酵力的测定”实验改进[J].生物学通报,2021,5(5):54-57.
[23]李雪松,陈翔宇,李蒙蒙,等.基于图像计数酿酒酵母的统计分析[J].食品与发酵工业,2022,1(1):1-11.
[24]周阳子,边名鸿,刘文艺,等.高温大曲中一株产淀粉酶酵母的分离鉴定及其特性研究[J].食品与发酵工业,2020,46(2):79-84.
[25]武俊瑞,王晓蕊,唐筱扬,等.辽宁传统发酵豆酱中乳酸菌及酵母菌分离鉴定[J].食品科学,2015,36(9):78-83.
[26]王福荣.酿酒分析与检测[M].北京:化学工业出版社,2005:25-27.
[27]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 33405—2016 白酒感官品评术语[S].北京:中国标准出版社,2016.
[28]中华人民共和国国家卫生和计划生育委员会.GB 5009.225—2016酒中乙醇浓度的测定[S].北京:中国标准出版社,2016.
[29]崔利.酱香型白酒“四高两长”酿酒理论的作用、价值、地位之我见[J].酿酒,2022,49(5):3-6.
[30]刘向勇,张小华,鲍晓明.酿酒酵母工业菌株胁迫条件耐受性分析[J].中国酿造,2006,25(1):8-11.