豆酱通常是以豆科作物的种子,如黄豆(Glycine max(L.)Merr.)或蚕豆(Vicia faba L.)等为主要原料,经制曲、发酵等工序制作而成的豆类发酵调味品[1]。蚕豆豆瓣酱(以下简称豆瓣酱)常以去皮的蚕豆瓣为主要原料,根据是否添加辣椒(Capsicum frutescens L.),分为不加辣椒的甜蚕豆瓣酱和添加辣椒的辣蚕豆瓣酱。其中,以蚕豆瓣为原料生产的辣蚕豆瓣酱,也就是通常所说的豆瓣酱,由于集鲜、辣、咸、甜、酸于一体,而成为川菜等菜系的重要调味料之一[1-2]。
目前我国商品化的豆瓣酱通常是将去皮的干蚕豆瓣清洗、浸泡、沥干和蒸熟后,接种米曲霉(Aspergillus oryzae)制曲,然后将豆瓣曲与一定比例的盐水混合进行蚕豆瓣前发酵,同时将破碎的辣椒与一定比例盐水混合进行辣椒前发酵,最后将完成前发酵的蚕豆瓣和辣椒按一定比例(通常1∶1)混合,继续发酵(后发酵),即得到产品[3]。为节省能源和降低生产成本,有些豆瓣酱生产厂家,在蚕豆瓣经清洗、浸泡和沥干后,不蒸熟而直接进行制曲,即所谓生料制曲[3-4]。因生料制曲可节约生产成本,其产品风味与传统熟料制曲的几乎无差别[3],因此生料制曲越来越得到豆瓣酱生产企业的青睐。
风味是豆瓣酱重要的品质指标之一,其中挥发性风味成分(volatile flavor components,VFCs)是构成豆瓣酱风味的重要成分,主要与原料、微生物(菌群)和工艺条件有关[4]。其中,微生物对VFCs的形成起着至关重要的作用[3-4]。目前,关于豆瓣酱发酵过程中微生物(菌群)及其风味成分的相关研究较多[5-7],但关于豆瓣酱发酵过程中微生物与VFCs之间的相关性研究较少。
另外,食盐对豆瓣酱风味的形成发挥着至关重要的作用。豆瓣酱中的食盐不仅能赋予豆瓣酱咸味,还能与氨基酸共同作用,形成鲜味物质,丰富豆瓣酱的口感与风味。食盐浓度过高在抑制有害微生物的同时,对有益微生物也有抑制作用,导致豆瓣酱香气成分单一,功能性物质累积减少,豆瓣酱的发酵周期延长[8-10]。食盐浓度过低在导致豆瓣酱鲜味和咸味失调的同时,对有害微生物的抑制作用降低,微生物群落改变,可能导致不良风味成分和有害物质的产生[6,11]。此外,大量研究表明,摄入过量食盐可能与肥胖、骨质疏松、肾结石以及心脑血管病等疾病存在关联[12-13]。目前,豆瓣酱的生产存在食盐浓度过高的问题,因此探讨适当降低盐度的同时保证产品品质风味显得非常必要。
本研究以高通量测序和顶空固相微萃取结合气质联用(headspace solid phase microextraction and gas chromatography mass spectrometry,HS-SPME-GC-MS)方法,首先对3组不同食盐含量豆瓣酱前发酵与后发酵过程中的微生物菌群和VFCs进行了分析,然后基于Pearson相关性,分析豆瓣酱后发酵中优势微生物与VFCs的相关性。研究结果对豆瓣酱风味改良与品质提升具有一定参考价值。
1 材料与方法
1.1 材料与试剂
蚕豆、辣椒:湖北省某豆瓣酱生产企业;食盐、面粉:市售;曲精、米曲霉(Aspergillus orzea)沪酿3.042的孢子粉:济宁玉园生物科技有限公司;2-辛醇(色谱纯):上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
50/30 μm DVB/CAR/PDMS萃取纤维头:美国Supelco公司;岛津GCMS-QP2010气相色谱-质谱仪:日本岛津公司;Nano Drop2000微量紫外分光光度计:美国Thermo Scientific公司;ABI GeneAmp 9700 型聚合酶链式反应(polymerase chain reaction,PCR)仪:ABI 公司;AxyPrep脱氧核糖核酸(deoxyribonucleic acid,DNA)Gel Extraction Kit 试剂盒:美国Axygen Biosciences公司;QuantusTM 荧光检测仪:美国Promega公司;Miseq PE300/NovaSeq PE250平台测序:上海美吉生物医药科技有限公司。
9700 型聚合酶链式反应(polymerase chain reaction,PCR)仪:ABI 公司;AxyPrep脱氧核糖核酸(deoxyribonucleic acid,DNA)Gel Extraction Kit 试剂盒:美国Axygen Biosciences公司;QuantusTM 荧光检测仪:美国Promega公司;Miseq PE300/NovaSeq PE250平台测序:上海美吉生物医药科技有限公司。
1.3 方法
1.3.1 蚕豆豆瓣酱的制作工艺流程与操作要点
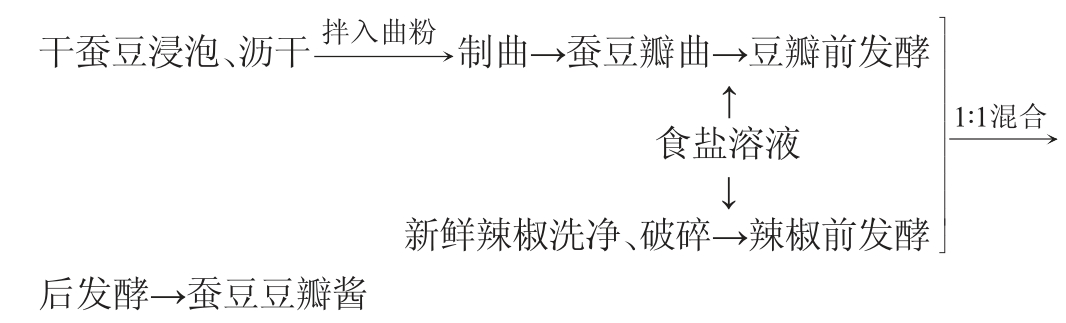
操作要点:
分拣:剔除杂质与霉变的蚕豆瓣。
浸泡与沥干:干蚕豆瓣加自来水浸泡45 min后,沥干。
制曲:蚕豆、面粉和曲精的质量比为1 000∶12∶0.4,先将面粉(60 g)与曲精(2 g)混合后再拌入沥干的蚕豆瓣(干蚕豆瓣5 kg)中,充分混合均匀,装入曲盘(80 cm×80 cm×8 cm)中,制曲温度30 ℃。制曲过程中,首先将曲料堆成约15 cm的厚度,保温12 h,然后将曲料摊薄成约2 cm的厚度,继续保温36 h,每12 h翻曲一次。
前发酵:将蚕豆瓣曲转移至发酵坛中,按料水比1∶1(g∶g)加入食盐水溶液,混合均匀后,室温条件下(约20 ℃)发酵15 d,每天搅拌1次;将洗净破碎后的新鲜辣椒放入发酵坛中,按料水比1∶1(g∶g),加入食盐水溶液,混合均匀后,室温条件下发酵15 d,每天搅拌1次。
后发酵:将前发酵15 d的豆瓣与辣椒按1∶1(g∶g)混合均匀后,继续室温条件下发酵20 d,得到蚕豆豆瓣酱成品。
1.3.2 蚕豆豆瓣酱发酵过程中食盐含量实验设计
参照湖北某豆瓣酱生产企业的工艺参数设计前发酵过程中食盐含量为22%、18%和15%的的豆瓣样品,分别编号为CD1、CD2和CD3;食盐含量为20%、15%和10%的辣椒样品,分别编号为LJ1、LJ2和LJ3;后发酵过程中食盐含量为21%、17%和13%的豆瓣酱样品,分别编号为HH1、HH2和HH3。
1.3.3 挥发性风味成分的测定
豆瓣酱挥发性风味成分(VFCs)的测定,参考于松峰[14]报道的方法,并略作修改。称取5.00 g 的CD、LJ或HH样品,置于30 mL固相微萃取采样瓶中,加入5.0 mL蒸馏水、0.5 g NaCl、1 μL 1.6 mg/mL 2-辛醇(内标)和磁力搅拌子,混匀,拧紧瓶盖后,将采样瓶置于60 ℃水浴中,磁力搅拌器速度400 r/min,热平衡15 min后,将活化的萃取头通过瓶盖隔垫插入采样瓶内,推出纤维头,使之距样品液面约5 mm,顶空吸附40 min。快速移出萃取头,并将萃取头立即插入气相色谱仪进样口热(250 ℃)解吸5 min进样。
GC条件:采用Agilent HP-5毛细管柱(30 m×250 μm×0.25 μm);载气为高纯(99.999%)氦气(He),流速1 mL/min,不分流进样,进样口温度250 ℃;升温程序:起始温度40 ℃保留5 min,以6 ℃/min升至85 ℃,保留1.5 min;再以2.5 ℃/min升至148 ℃,保留1 min;最后以20 ℃/min升至280 ℃,保持1 min。
MS条件:电子电离(electron ionization,EI)源,电子能量70 eV,离子源温度230 ℃,四极杆温度150 ℃,质量扫描范围25~450 amu,辅助温度280 ℃,调谐文件stune.u,扫描模式Scan。
定性与定量分析:根据质谱和保留指数,通过美国国家标准与技术研究所(national institute of standards and technology,NIST)谱库和人工解谱的方法,对检出VFCs成分进行定性(匹配度>80%),以2-辛醇为内标物进行相对定量分析。VFCs相对含量以其峰面积与内标物峰面积比值计算。做3个平行。
1.3.4 PCR扩增和MiSeq测序
PCR扩增和MiSeq测序由上海美吉生物医药科技有限公司完成,主要过程如下:
以EZNA soil DNA kit抽提试剂盒提取样品总脱氧核糖核酸(DNA),以Nano Drop2000测定DNA含量和纯度。以提取的DNA为模板,使用携带Barcode序列的上游引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和下游引物806R(5'-GGACTACHVGGGTWTCTAAT-3')对16S rRNA基因V3-V4可变区进行PCR 扩增,真菌使用引物ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3'和5'-GCTGCGTTCTTCATCGATGC-3)在ITS1区进行PCR扩增。
soil DNA kit抽提试剂盒提取样品总脱氧核糖核酸(DNA),以Nano Drop2000测定DNA含量和纯度。以提取的DNA为模板,使用携带Barcode序列的上游引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和下游引物806R(5'-GGACTACHVGGGTWTCTAAT-3')对16S rRNA基因V3-V4可变区进行PCR 扩增,真菌使用引物ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3'和5'-GCTGCGTTCTTCATCGATGC-3)在ITS1区进行PCR扩增。
PCR扩增体系为:5×TransStart FastPfu 缓冲液4 μL,2.5 mmol/L 脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphates,dNTPs)2 μL,上游引物(5 μmol/L)0.8 μL,下游引物(5 μmol/L)0.8 μL,TransStart FastPfu DNA聚合酶0.4 μL,模板DNA 10 ng,补足至20 μL。PCR扩增程序为:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),然后72 ℃稳定延伸10 min,最后4 ℃进行保存。每个样本3个重复。将同一样本的PCR产物混合后,以2%琼脂糖凝胶电泳回收PCR产物,以AxyPrep DNA Gel ExtractionKit试剂盒纯化回收产物,2%琼脂糖凝胶电泳检测,以QuantusTM荧光检测仪对DNA进行定量分析。
建库与MiSeq测序:以NEXTFLEX Rapid DNA-Seq Kit 试剂盒对纯化后的PCR产物进行建库,主要包括:①接头链接;②以磁珠筛选去除接头自连片段;③通过PCR扩增进行文库模板富集;④磁珠回收PCR产物得到最终文库。然后以Miseq PE300/NovaSeq PE250平台进行测序。
Rapid DNA-Seq Kit 试剂盒对纯化后的PCR产物进行建库,主要包括:①接头链接;②以磁珠筛选去除接头自连片段;③通过PCR扩增进行文库模板富集;④磁珠回收PCR产物得到最终文库。然后以Miseq PE300/NovaSeq PE250平台进行测序。
1.3.5 高通量测序数据分析
使用FASTP软件对双端原始测序序列进行质控,使用FLASH软件进行拼接。具体过程为:①过滤Reads尾部质量值20以下的碱基,设置50 bp的窗口,如果窗口内的平均质量值低于20,从窗口开始截去后端碱基,过滤质控后50 bp以下的Reads,去除含N碱基的Reads;②根据PE Reads之间的Overlap关系,将成对Reads拼接(Merge)成一条序列,最小Overlap长度为10 bp;③拼接序列的Overlap区允许的最大错配比率为0.2,筛选不符合序列;④根据序列首尾两端的Barcode和引物区分样品,并调整序列方向,Barcode允许的错配数为0,最大引物错配数为2。使用UPARSE软件,根据97%的相似度对质控拼接后的序列进行操作分类单元(operational taxonomic unit,OTU)聚类并剔除嵌合体,将序列按照彼此的相似性分为许多小组,一个小组就是一个OTU,以此反映不同样品中菌落组成的相似性和重叠情况。去除所有样品中注释到叶绿体和线粒体的序列。为了尽量减少测序深度对后续Alpha多样性和Beta多样性数据分析的影响,将所有样本序列数抽平至20 000后,每个样本的平均序列覆盖度(Good's coverage)需达到99%以上。采用核糖体数据库项目(ribosomal database project,RDP)Classifier比对Silva 16S rRNA基因数据库(v138)进行OTU物种分类学注释,置信度阈值为70%,并在不同物种分类水平下统计每个样本的群落组成。
1.3.6 微生物与挥发性风味成分的相关性分析
以Pearson相关性分析法,对豆瓣酱后发酵过程中的优势微生物(群落)与VFCs进行相关性分析[15]。以TBtools 2019软件对相关性数据作热图[16]。
2 结果与分析
2.1 豆瓣酱发酵过程中挥发性风味物质的分析
豆瓣酱发酵(包括前发酵与后发酵)过程中,在微生物及其酶(系)等的作用下,产生大量VFCs,赋予豆瓣酱特定的风味[17]。采用HS-SPME-GC-MS技术,对不同食盐含量下,前发酵15 d的蚕豆瓣(CD1、CD2、CD3)和辣椒(LJ1、LJ2、LJ3),以及后发酵20 d的豆瓣酱(HH1、HH2、HH3)样品中的VFCs进行了分析与鉴定,结果见表1。由表1可知,共检测出225种化合物,包括醇类、酸类、酯类、醛类、酮类、呋喃类、吡嗪类和其他,共8类VFCs。各种类与各种VFCs的相对含量及种类数中醇类VFCs的含量最高,前发酵至15 d,CD1、CD2和CD3醇类VFCs的相对含量分别为37.16%、7.02%、12.56%;LJ1、LJ2、LJ3醇类VFCs的相对含量分别为34.91%、28.49%、32.59%;后发酵第20天,HH1、HH2、HH3醇类VFCs的相对含量分别为16.72%、27.24%、41.34%。豆瓣酱的醇类VFCs主要是由酵母菌等微生物产生的[18-19],是酱类产品中重要的呈香物质,可赋予酱类产品果香和油脂香[20]。其中,2-苯乙醇存在于豆瓣酱的前后发酵过程中,可赋予豆瓣酱浓郁酱香风味[6];芳樟醇和4-萜烯醇具有花香味[19]。含量最低的是呋喃类VFCs,前发酵至15 d时,它们在CD1、CD2和CD3中的相对含量分别为0.25%、0.96%、0.76%,在LJ1、LJ2、LJ3中的相对含量分别为0、0.12%、0.59%,而后发酵第20天,它们在HH1、HH2、HH3中的相对含量分别为0.21%、0.23%、0.86%,主要为2,3-二氢-1-苯并呋喃。呋喃类化合物主要是通过蛋白质或氨基酸的降解反应、糖与蛋白质或氨基酸美拉德反应形成的[21]。
表1 蚕豆豆瓣酱发酵过程中挥发性风味化合物的相对含量及数量
Table 1 Relative content and numbers of volatile flavor compounds during fermentation of broad bean paste
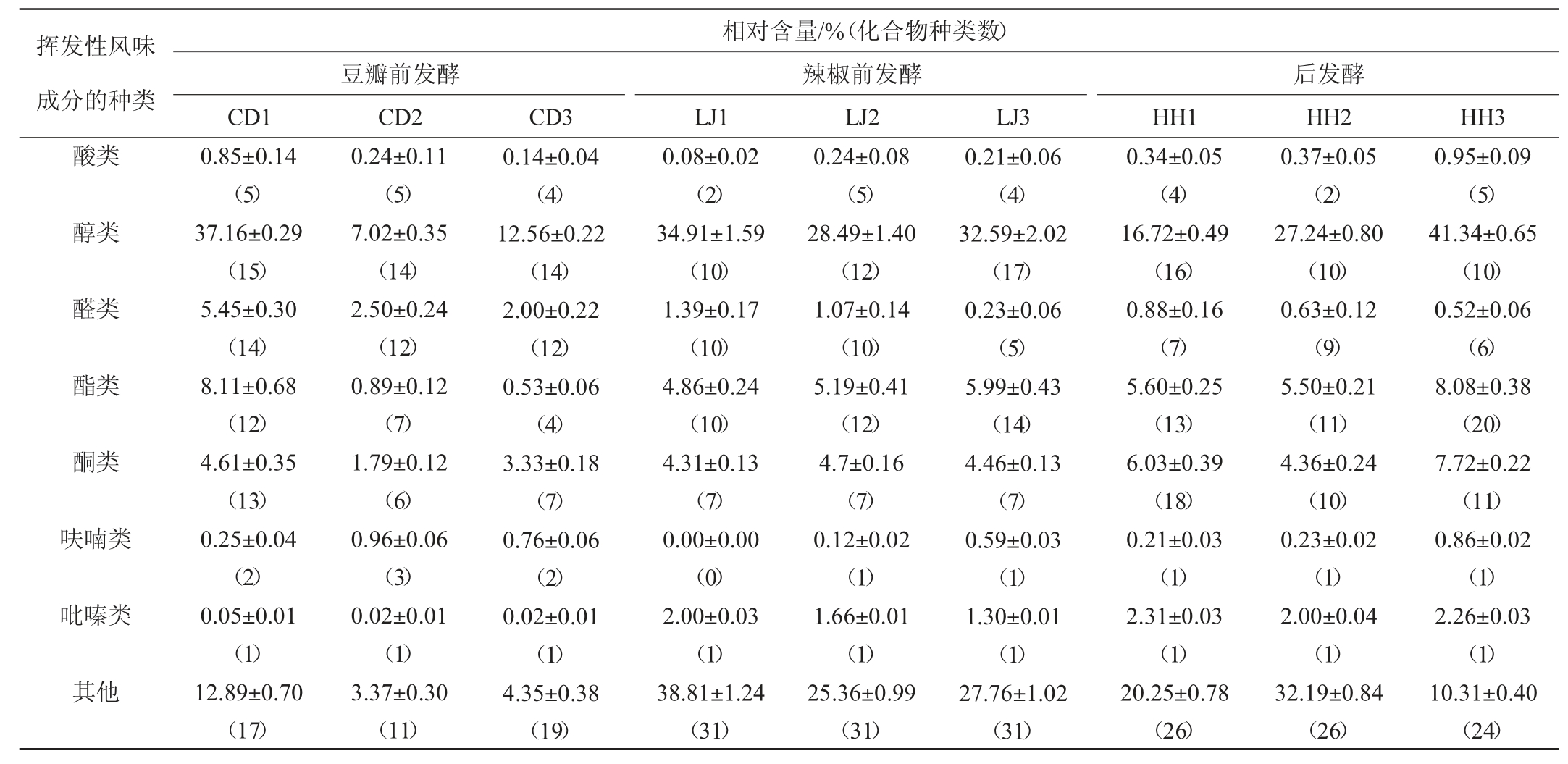
由表1还可以看出,食盐含量对不同VFCs含量存在一定影响。后发酵结束时,食盐含量越低,醇类与酯类VFCs的含量越高,与HH1和HH2相比,HH3中醇类和酯类VFCs含量更高,特别是醇类VFCs的相对含量高达41.34%;酯类VFCs的数量高达20种。这可能是较低含量食盐对微生物的抑制作用较低,微生物生长代谢更加旺盛,从而产生更多的醇类VFCs[22-23],并进一步生成酯类VFCs[24]。
2.2 豆瓣酱发酵过程微生物测序结果的质量分析
分别提取前发酵15 d的CD1、CD2、CD3、LJ1、LJ2、LJ3以及后发酵20 d的HH1、HH2、HH3样品的总DNA,重复数为2。以细菌通用引物338F/806R对细菌16S rRNA的V3-V4区域进行PCR扩增和测序,结果见表2。
表2 样品的微生物测序数据
Table 2 Microbial sequencing data of samples

由表2可知,质控过滤后,共得到1 100 802条优化序列;以真菌通用引物ITS1F/ITS2R对真菌ITS1扩增测序并质控过滤,共得到1 624 852条优化序列。以随机抽取的测序号为横坐标,对应的物种数量为纵坐标,绘制样品的细菌、真菌群落稀释曲线和Shannon指数曲线见图1。
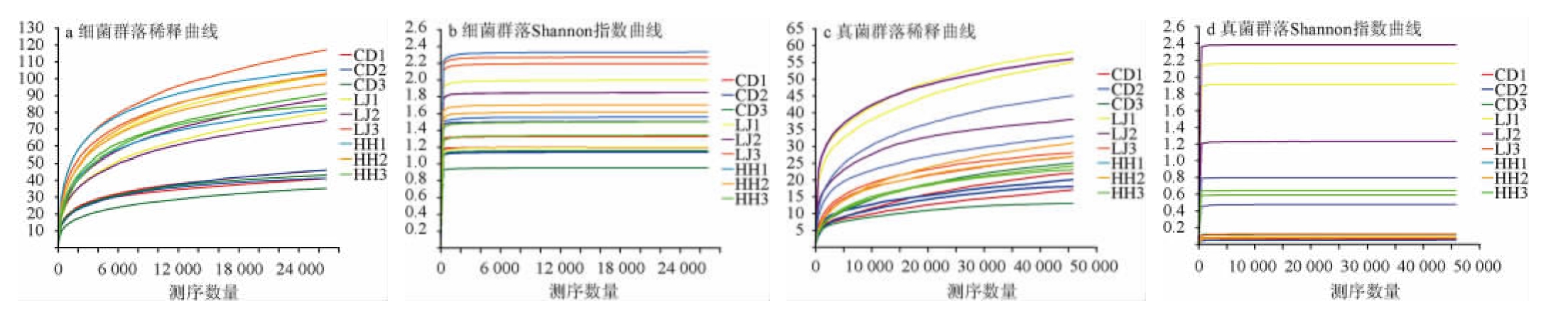
图1 微生物群落稀释曲线和Shannon指数曲线
Fig.1 Microbial community rarefaction curves and Shannon index curves
由图1a可知,当测序数量>2 000 Reads时,细菌稀释曲线逐渐平坦。由图1b可知,Shannon指数曲线达到饱和,而本研究测序数量高达26 000 Reads,所以测序数据可用于对样品中细菌多样性分析。由图1c可知,当测序数量>5 000 Reads时,真菌稀释曲线逐渐平坦。由图1d可知,Shannon指数曲线达到饱和,而本研究的测序数量高达45 000 Reads,因此,相关测序数据也用于样品中真菌的多样性分析。
2.3 豆瓣酱发酵过程微生物群落的OTU分析
2.3.1 细菌群落的OTU分析
对9个豆瓣酱样品共有与独有的OTU数进行叠加,得到的细菌OTU分布的花瓣图见图2。
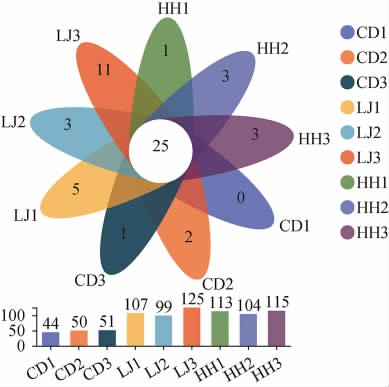
图2 蚕豆豆瓣酱发酵过程中细菌群落的操作分类单元分析
Fig.2 Operational taxonomic unit analysis of bacterial community during fermentation of broad bean paste
由图2可知,在不同食盐含量下,豆瓣酱在不同发酵时期(豆瓣和辣椒的前发酵第15天和后发酵第20天)共有的OTU数为25个,而豆瓣和辣椒前发酵至第15天时,CD1、CD2、CD3特有的OTU数分别为0、2、1,LJ1、LJ2、LJ3特有的OTU数分别为5、3、11;后发酵至第20天时,HH1、HH2、HH3特有的OTU数分别1、3、3。这表明在豆瓣酱的不同发酵时期,共有的细菌群落数远大于它们特有的细菌群落数。随着食盐含量的降低,豆瓣前发酵样品的OTU数呈上升趋势;辣椒前发酵样品中OTU数和后发酵的样品的OTU数随着食盐含量的降低,呈现先减少后增加的趋势。
由图2还可以看出,不同食盐含量下,豆瓣前发酵15 d时,一共有145个OTU。其中,CD1包含44个OTU,CD2包含50个OTU,CD3包含51个OTU。这表明,随着食盐含量降低,豆瓣前发酵样品中OTU数逐渐增多,细菌物种数增多。食盐含量的降低会导致食盐对细胞渗透压的降低,有利于一些不耐高含量食盐的细菌生长,这可能是细菌物种数增多的原因。在不同食盐含量下,辣椒前发酵15 d时,一共有331个OTU。其中,LJ1包含107个OTU,LJ2包含99个OTU,LJ3包含125个OTU。随着食盐含量降低,OTU数呈现先减少后增大的趋势,说明细菌的物种数先减少后增多。后面图4中的结果表明,LJ2中欧文氏菌属(Erwinia)比LJ1和LJ3中高,而该属中部分菌种能产生抗生素[25-26],对其他细菌具有抑制作用,这可能是导致LJ2中OTU数最小的原因。后发酵20 d时,一共有332个OTU。其中,HH1包含113个OTU,HH2包含104个OTU,HH3包含115个OTU,随着食盐含量的变化,OTU数变化不大。此外,各辣椒前发酵样品的OTU数大于各对应蚕豆前发酵样品中OTU而小于各对应混合后发酵样品的OTU数。这是由于原料不同,细菌群落数会有一定差异;各蚕豆前发酵样品的食盐含量略高于各辣椒前发酵样品,对细菌群落数也有影响;此外,低温发酵下细菌的繁殖变慢,由于进入发酵后期时间延长,细菌群落数有一定增加,导致混合后发酵样品中OTU数高于辣椒前发酵样品中的OTU数。
2.3.2 真菌群落的OTU分析
对CD1、CD2、CD3、LJ1、LJ2、LJ3和HH1、HH2、HH3共有与独有的OTU数进行叠加,得到真菌OTU分布的花瓣图见图3。
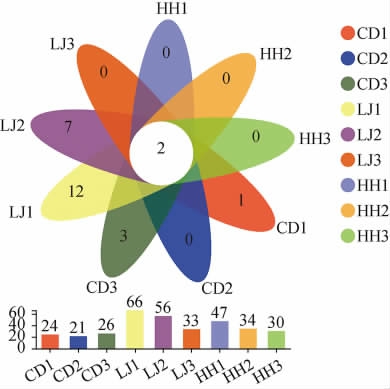
图3 蚕豆豆瓣酱发酵过程中真菌群落的操作分类单元分析
Fig.3 Operational taxonomic unit analysis of fungal community during fermentation of broad bean paste
由图3可知,在不同食盐含量下,豆瓣酱在不同发酵时期(豆瓣和辣椒的前发酵第15天和后发酵第20天)共有的OTU数仅为2个,而豆瓣和辣椒前发酵至第15天时,CD1、CD2、CD3特有的OTU分别为1、0和3,LJ1、LJ2、LJ3特有的OTU分别为12、7、0;后发酵至第20天时,HH1、HH2、HH3特有的OTU均为0。结果表明,豆瓣与辣椒前发酵样品中,特有真菌群落数总体上多于它们共有的真菌群落数;后发酵样品中,特有的真菌群落数少于它们共有的真菌群落数。
由图3还可以看出,不同食盐含量下,豆瓣前发酵至15 d时,一共有71个OTU。其中,CD1包含24个OTU,CD2包含21个OTU,CD3包含26个OTU,随着食盐含量的降低,OTU数目先减小后增加。辣椒前发酵至15 d时,一共有155个OTU。其中,LJ1包含66个OTU,LJ2包含56个OTU,LJ3包含33个OTU,随着食盐含量降低,OTU数目逐渐减小。由图3可知,随着食盐含量的降低,德巴利酵母属(Debaryomyces)逐渐占据主要地位,该属的酵母可能因抢占营养物质,从而导致OTU数目随食盐含量的降低呈下降趋势。后发酵至20 d时,一共有111个OTU。其中,HH1包含47个OTU,HH2包含34个OTU,HH3包含30个OTU,随着食盐含量降低,OTU数目逐渐减小。此外,各辣椒前发酵样品的OTU数大于各对应蚕豆前发酵样品中OTU数和各对应混合后发酵样品的OTU数。这一方面是由于原料差异和食盐含量的不同所导致,另一方面是辣椒和豆瓣混合后,由于豆瓣中含有植酸、单宁和蛋白酶抑制剂等抗营养因子[27],且混合后发酵样品中欧文氏菌属为主要菌属,该属部分菌种产生的抗生素对真菌有抑制作用[25-26],导致混合后发酵样品的OTU数小于辣椒前发酵样品中的OTU数。
2.4 豆瓣酱发酵过程微生物群落结构组成
不同食盐含量样品,豆瓣(CD1、CD2和CD3)和辣椒(LJ1、LJ2和LJ3)前发酵至第15天、后发酵(HH1、HH2和HH3)20 d时,细菌、真菌属水平群落组成(相对丰度>1%)见图4。
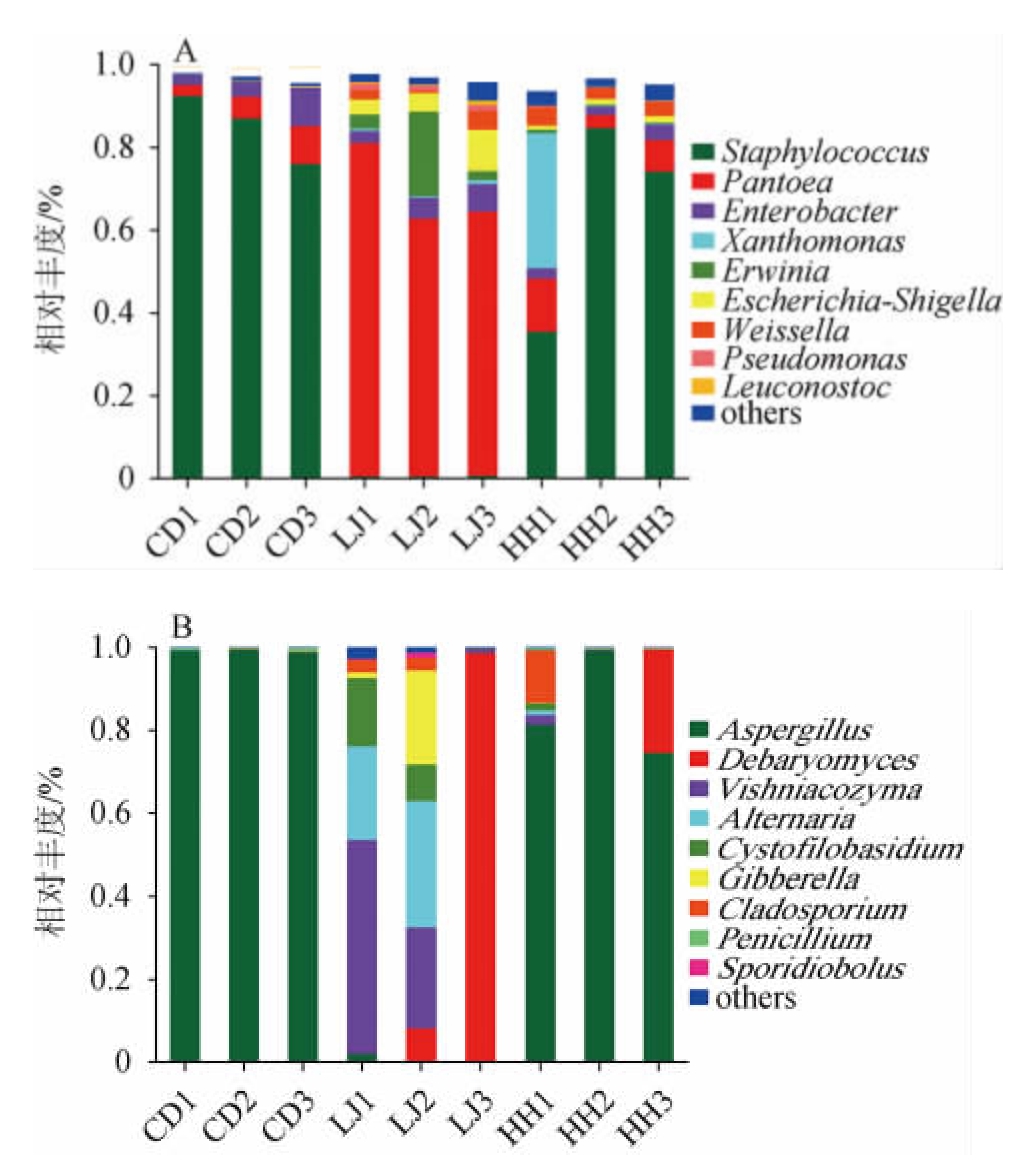
图4 蚕豆豆瓣酱发酵过程中细菌(A)和真菌(B)群落结构热图
Fig.4 Heatmaps of community structure of bacteria (A) and fungi (B)during fermentation of broad bean paste
由图4A可知,豆瓣前发酵至15 d时,葡萄球菌属(Staphylococcus)、泛菌属(Pantoea)、肠杆菌属(Enterobacter)随食盐含量变化相对丰度变化较大。葡萄球菌属的相对丰度是最高的,是优势菌属。随食盐含量的降低,葡萄球菌属的相对丰度由86.89%下降至75.91%再上升至92.35%;泛菌属的相对丰度由5.4%上升至9.19%再下降至2.67%;肠杆菌属的相对丰度由3.41%上升至9.29%再下降至2.29%。黄单胞菌属(Xanthomonas)、欧文氏菌属、埃希氏-志贺氏菌属(Escherichia-Shigella)、魏斯氏菌属(Weissella)、假单胞菌属(Pseudomonas)和明串珠菌属(Leuconostoc)在豆瓣前发酵中的相对丰度变化较小。
由图4A还可以看出,在不同食盐含量下,辣椒前发酵至15 d时,泛菌属、肠杆菌属、欧文氏菌属、埃希氏-志贺氏菌属、魏斯氏菌属,随食盐含量变化相对丰度变化较大。泛菌属相对丰度最高,是优势菌属。随食盐含量的降低,泛菌属的相对丰度由80.53%下降至62.34%再上升至63.83%;肠杆菌属相对丰度由2.94%上升至5.02%再上升至6.61%;欧文氏菌属由3.35%上升至20.35%再下降至2.15%;埃希氏-志贺氏菌属由3.61%上升至4.47%再上升至10.13%。葡萄球菌属、黄单胞菌属、肠杆菌科、欧文菌科、假单胞菌属和明串珠菌属的相对丰度变化较小。其中,肠杆菌属和埃希氏-志贺氏菌属随食盐含量的降低相对丰度逐渐上升,说明食盐含量降低对肠杆菌属、埃希氏-志贺氏菌属的抑制作用降低,使其生长繁殖更快。肠杆菌属可以赋予产品成熟、柔软的口感特性[28],而埃希氏-志贺氏菌属则是食源性致病菌,可引起人类肠道感染性腹泻疾病的发生[29],因此,在降低食盐含量的同时,应注意控制埃希氏-志贺氏菌属细菌的生长繁殖,以避免可能导致食品安全问题。
后发酵至20 d时,葡萄球菌属、泛菌属、黄单胞菌属和魏斯氏菌属随食盐含量变化相对丰度变化较大。葡萄球菌相对丰度最高,是优势菌属。随食盐含量的降低,葡萄球菌相对丰度由35.36%上升至74.10%再上升至84.57%;泛菌属由12.91%下降至7.6%再下降至3.17%;黄单胞菌属由32.61%下降至0.31%再下降至0.18%;魏斯氏菌属和乳杆菌相对丰度也逐渐下降,分别由4.25%下降至3.30%再下降至2.54%、4.06%下降至2.84%再下降至1.62%(图4A)。肠杆菌属、欧文氏菌属、埃希氏-志贺氏菌属、假单胞菌属和明串珠菌属的相对丰度在后发酵过程中的变化较小。
从上述结果可以看出,不同食盐含量下,豆瓣和辣椒前发酵至15 d和混合后发酵至20 d的主要细菌都分别是葡萄球菌属、泛菌属,这与许多研究结果相似[28,30]。其中,在混合后发酵样品中,葡萄球菌属的相对丰度大于其他细菌群落,表明在细菌群落中葡萄球菌属的贡献最大,而葡萄球菌属主要来自蚕豆前发酵期;泛菌属在蚕豆和辣椒前发酵期都有产生。葡萄球菌可产蛋白酶、脂肪酶等,有助于提高豆瓣酱品质,同时,葡萄球菌还可以抑制生物胺的产生,提高产品的食品安全性[31]。葡萄球菌还可与假单胞菌属等有害微生物形成竞争,抑制有害微生物生长[32]。泛菌属属于一种常见的植物内生菌[33],至于泛菌属在豆瓣酱发酵过程中的具体作用尚未见详细报道。
由图4B可知,豆瓣前发酵至15 d时,曲霉属(Aspergillus)为优势菌属,相对丰度分别为99.30%、99.43%、98.81%,青霉属(Penicillium)等真菌在蚕豆发酵期相对丰度较小。由图4B还可以看出,辣椒前发酵至15 d时,德巴利酵母属(Debaryomyces)、卡恩斯维希尼克氏酵母属(Vishniacozyma)、链格孢霉属(Altemaria)、双孢囊孢霉属(Cystofilobasidium)、赤霉菌属(Gibberella)、枝孢霉属(Cladosporium)相对丰度变化较大。随食盐含量的降低,德巴利酵母属的相对丰度由0上升至7.99%再上升至98.61%;卡恩斯维希尼克氏酵母属由51.51%下降至24.45%再下降至0.75%;链格孢霉属由22.60%上升至30.31%再下降至0;双孢囊孢霉属由16.58%下降至8.94%再下降至0;赤霉菌属由1.32%上升至22.65%再下降至0%;枝孢霉属由16.58%下降至8.94%再下降至0。德巴利酵母属、卡恩斯维希尼克氏酵母属、链格孢霉属、双孢囊孢霉属、赤霉菌属是辣椒发酵期优势菌属。
后发酵至20 d时,曲霉菌属、德巴利酵母属、枝孢霉属为优势菌属。HH1的豆瓣酱以曲霉菌属、枝孢霉属为优势菌属,相对丰度分别为81.20%、12.76%;HH2的豆瓣酱以曲霉菌属为优势菌属,相对丰度为99.20%。HH3的豆瓣酱以曲霉菌属和德巴利酵母属为优势菌属,相对丰度分别为74.41%、25.05%。
从上述结果可以看出,不同食盐含量下,豆瓣和辣椒前发酵至15 d和混合后发酵至20 d的主要真菌包括曲霉属、德巴利酵母属、卡恩斯维希尼克氏酵母属、链格孢霉属、双孢囊孢霉属、赤霉菌属、枝孢霉属、青霉属和锁掷孢酵母属(Sporidiobolus)。其中,在混合后发酵样品中,曲霉属的丰度明显大于其他真菌的丰度,表明在真菌群落中曲霉属的贡献度最大,而曲霉属主要来自豆瓣前发酵期,而德巴利酵母属、枝孢霉属主要来自辣椒前发酵期。曲霉属是豆瓣酱中普遍存在的属,它通过分解蛋白质和脂质在改善风味方面发挥重要作用[6]。德巴利酵母属是发酵食品中常见的酵母,对发酵食品的发酵风味有重要贡献,德巴利酵母属的物种常被用作发酵剂增强发酵食品的风味及安全性[14]。不同食盐含量豆瓣酱在辣椒前发酵样品中真菌群落在属水平上相对丰度差异较大。总体而言,发酵环境、豆瓣、辣椒等原料品种、加工过程中天然存在的真菌以及食盐含量都会影响豆瓣酱中的真菌多样性[5]。因此,制造过程中的环境条件以及食盐含量在很大程度上决定了豆瓣酱中存在的最终真菌群落。
2.5 豆瓣酱后发酵过程中优势微生物与挥发性风味成分相关性分析
豆瓣酱的挥发性风味成分主要受原料、微生物和工艺条件的影响[9]。其中,微生物(菌群)对挥发性风味成分的产生起着至关重要的作用,而且不同微生物对VFCs的贡献度是有差别的[4]。为探索不同微生物(群落)对豆瓣酱后发酵过程中VFCs的贡献度,基于Pearson相关性,分析了豆瓣酱后发酵期优势微生物(相对丰度排名前9的微生物)与VFCs之间的相关性。优势微生物与风味成分相关性的热图见图5。
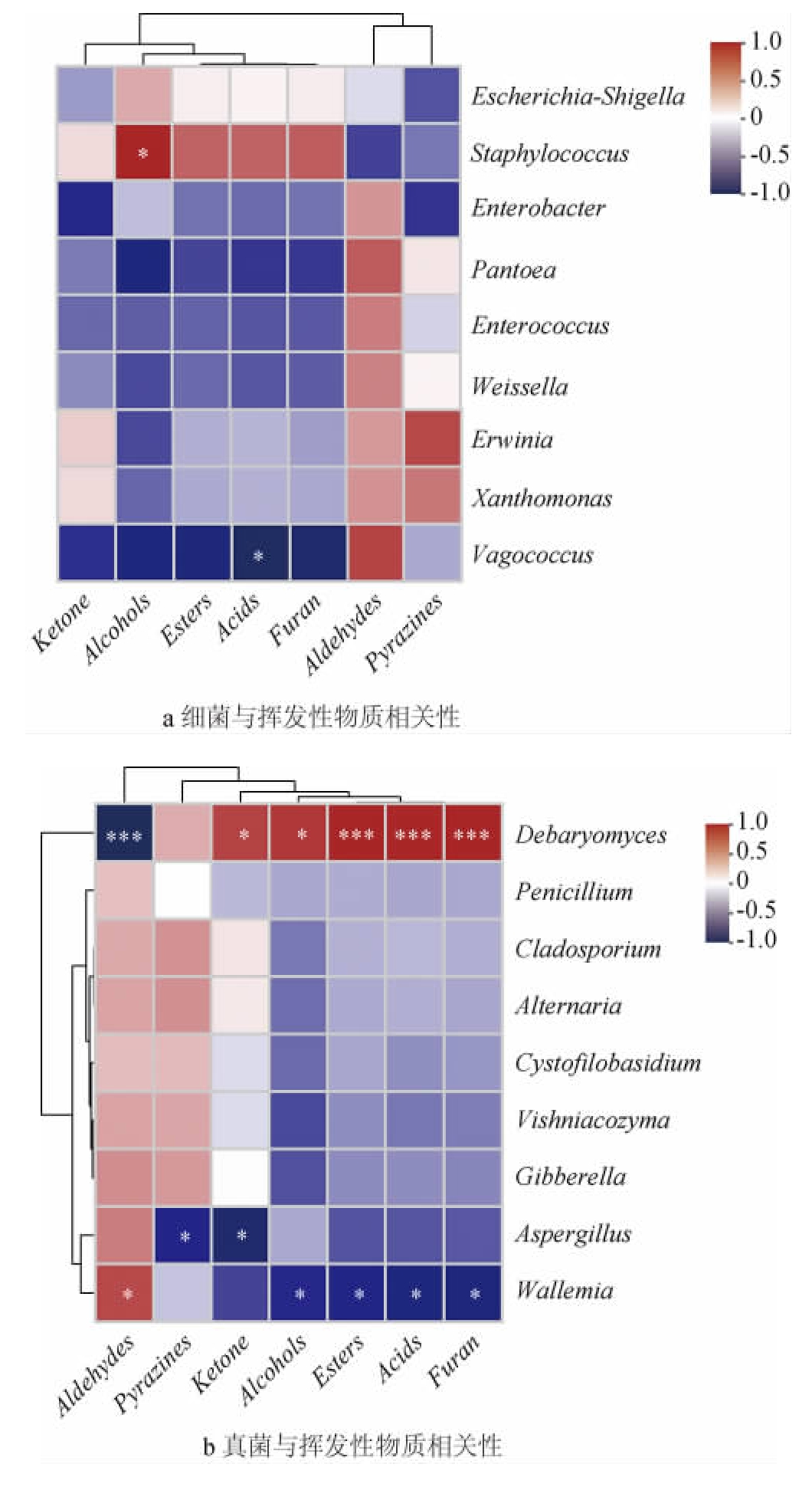
图5 蚕豆豆瓣酱发酵过程中微生物与挥发性风味物质相关性热图
Fig.5 Heatmaps of correlation between microbes and volatile flavor substances during fermentation of broad bean paste
右侧图例是不同相关系数R值的颜色区间,红色表示正相关,蓝色表示负相关,颜色越深表示线性相关程度越高;“*”表示具有相关性(P<0.05);“**”表示显著性相关(P<0.01);“***”表示极显著性相关(P<0.001)。
由图5可知,葡萄球菌属与醇类VFCs呈现正相关(P<0.05),漫游球菌属(Vagococcus)与酸类VFCs呈现负相关(P<0.05);德巴利酵母属与酸类、酯类和呋喃类VFCs呈现极显著正相关(P<0.001),与醇类和酮类VFCs呈现正相关(P<0.05),与醛类VFCs呈现极显著负相关(P<0.001)。曲霉属与酮类和吡嗪类VFCs呈现负相关(P<0.05)。节担菌属(Wallemia)与醛类VFCs呈现正相关(P<0.05),与醇类、酸类、酯类和呋喃类VFCs呈现负相关(P<0.05)。通过前文的研究发现德巴利酵母属是辣椒发酵期及混合发酵期的优势菌属,且它能够通过代谢乳糖、蛋白质和乳酸而产生香味,同时也会产生一些有助于人体消化的小分子物质[34],本研究中德巴利酵母属与多种风味物质呈现显著正相关,与风味形成关系密切。
3 结论
豆瓣酱不同发酵过程的VFCs主要分为醇类、酸类、酯类、醛类、酮类、呋喃类和吡嗪类,其中醇类VFCs的种类和含量最高,呋喃类VFCs的种类和含量最低。豆瓣酱发酵过程中的优势细菌主要为葡萄球菌属、泛菌属、肠杆菌属、黄单胞菌属、欧文氏菌属、埃希氏-志贺氏菌属、魏斯氏菌属、假单胞菌属、明串珠菌属;优势真菌主要为曲霉属、德巴利酵母属、卡恩斯维希尼克氏酵母属、链格孢霉属、双孢囊孢霉属、赤霉菌属、枝孢霉属、青霉属和锁掷孢酵母属。在混合后发酵样品中,葡萄球菌属的相对丰度在细菌群落中最高,分别为35.36%,74.10%和85.57%,曲霉属的相对丰度在真菌群落中最高,分别为81.20%,99.20%和74.41%,这两个属都主要来自蚕豆前发酵期;德巴利酵母属、卡恩斯维希尼克氏酵母属和枝孢霉属主要来自辣椒前发酵期。葡萄球菌属与后发酵过程中醇类VFCs呈现正相关(P<0.05),漫游球菌属与酸类VFCs呈现负相关(P<0.05);德巴利酵母属与酸类、酯类和呋喃类VFCs呈现极显著正相关(P<0.001),与醇类和酮类VFCs呈现正相关(P<0.05),与醛类VFCs呈现极显著负相关(P<0.001)。曲霉属与酮类和吡嗪类VFCs呈现负相关(P<0.05)。节担菌属(Wallemia)与醛类VFCs呈现正相关(P<0.05),与醇类、酸类、酯类和呋喃类VFCs呈现负相关(P<0.05)。这些研究结果表明,通过调控豆瓣酱发酵过程,特别是后发酵过程中的德巴利酵母属、葡萄球菌属的丰度,将有助于改善豆瓣酱的风味。此外,食盐含量的不同,会造成豆瓣酱发酵过程中微生物的组成及占比不同,导致各VFCs形成具有差异。
[1]张欢,王端好,陆光端,等.酸性蛋白酶对发酵黄豆酱品质的影响[J].中国酿造,2021,40(8):150-156.
[2]李燕.基于挤压蒸煮技术的蚕豆酱酿造及其品质分析[D].无锡:江南大学,2019.
[3]谷晓东,李素萍,刘怡琳,等.红谷黄酒发酵过程中微生物多样性与理化指标、挥发性风味的相关性分析[J].食品工业科技,2022,43(23):133-143.
[4]庞惟俏.黑龙江大豆酱中微生物群落与挥发性成分关系的研究[D].大庆:黑龙江八一农垦大学,2018.
[5]杨帆,邓维琴,李恒,等.不同来源及不同发酵阶段豆瓣酱微生物多样性的比较分析[J].食品与发酵科技,2021,57(6):27-34,119.
[6]贾云.蚕豆酱发酵过程微生物群落结构及其功能分析[D].无锡:江南大学,2021.
[7]ZHAO S,NIU C T,YANG X H,et al.Roles of sunlight exposure on chemosensory characteristic of broad bean paste by untargeted profiling of volatile flavors and multivariate statistical analysis[J].Food Chem,2022,381:132115.
[8]XIE C X,ZENG H Y,QIN L K.Physicochemical,taste,and functional changes during the enhanced fermentation of low-salt Sufu paste,a Chinese fermented soybean food[J].Int J Food Prop,2018,21(1):2714-2729.
[9]LEE S H,JUNG J Y,JEON C O.Effects of temperature on microbial succession and metabolite change during sacu-jeot fermentation[J].Food Microbiol,2014,38:16-25.
[10]刘志伟.豆瓣酱生产工艺优化研究[D].长沙:湖南农业大学,2012.
[11]CHUN B H,KIM K H,JEONG S E,et al.The effect of salt concentrations on the fermentation of doenjang,a traditional Korean fermented soybean paste[J].Food Microbiol,2020,86:103329.
[12]AMINDE L N,COBIAC L J,VEERMAN J L.Potential impact of a modest reduction in salt intake on blood pressure,cardiovascular disease burden and premature mortality:a modelling study[J].Open Heart,2019,6(1):e000943.
[13]陈希,马吉祥,郭晓雷,等.国内外有关减盐防控高血压的策略与行动[J].预防医学论坛,2011,17(9):817-821.
[14]于松峰.传统豆瓣辣椒酱发酵过程细菌群落演替及其与风味物质变化的对应分析[D].天津:天津科技大学,2017.
[15]REISER M,CAGNONE S,ZHU J.An extended GFfit statistic defined on orthogonal components of Pearson's chi-square[J].Psychometrika,2023,88:208-240.
[16]CHEN C J,CHEN H,ZHANG Y,et al.TBtools: an integrative toolkit developed for interactive analyses of big biological data[J].Mol Plant,2020,13(8):1194-1202.
[17]TIAN S L,LI L,SHAH S N M,et al.The relationship between red fruit colour formation and key genes of capsanthin biosynthesis pathway in Capsicum annuum[J].Biol Plant,2015,59:507-513.
[18]曾雪晴.豆瓣酱发酵过程中生物胺及理化指标的变化研究[D].重庆:西南大学,2020.
[19]SUN S Y,JIANG W G,ZHAO Y P.Profile of volatile compounds in 12 Chinese soy sauces produced by a high-salt-diluted state fermentation[J].J I Brewing,2010,116(3):316-328.
[20]金华勇,曾灿伟,康旭,等.顶空固相微萃取-气-质联用技术分析传统甜面酱中挥发性风味成分[J].中国酿造,2009,28(5):152-154.
[21]CHUNG H Y,FUNG P K,KIM J S.Aroma impact components in commercial plain sufu[J].J Agri Food Chem,2005,53(5):1684-1691.
[22]孙玉亮,王颉.HS-SPME/GC-MS分析发酵前后扇贝豆酱中的香气成分[J].中国酿造,2010,29(11):156-159.
[23]武俊瑞,顾采东,田甜,等.豆酱自然发酵过程中蛋白质和氨基酸的变化规律[J].食品科学,2017,38(8):139-144.
[24]ZHAO J X,DAI X J,LIU X M,et al.Comparison of aroma compounds in naturally fermented and inoculated Chinese soybean pastes by GC-MS and GC-Olfactometry analysis[J].Food Control,2011,22(6):1008-1013.
[25]ISHIMARU C A,KLOS E J,BRUBAKER R R.Multiple antibiotic production by Erwinia herbicola[J].Phytopathology,1988,78(6):746-750.
[26]SÁNCHEZ-HERNÁNDEZ E,BUZÓN-DURÁN L,LORENZO-VIDAL B,et al.Physicochemical characterization and antimicrobial activity against Erwinia amylovora, Erwinia vitivora,and Diplodia seriata of a light purple Hibiscus syriacus L.cultivar[J].Plants,2021,10(9):1876.
[27]唐杰,薛文通,张惠.蚕豆中抗营养因子的生理功能[J].食品工业科技,2013,34(5):388-391,395.
[28]袁琳娜.蚕豆瓣发酵过程中有害物质的形成与动态变化研究[D].重庆:西南大学,2020.
[29]张传斌,袁飞,黄海兰,等.食品中志贺氏菌检测方法的研究进展[J].食品工业,2017,38(6):262-266.
[30]董丹.郫县豆瓣发酵过程细菌多样性及动态演化研究[D].成都:西华大学,2016.
[31]姚粟,王鹏辉,白飞荣,等.中国传统发酵食品用微生物菌种名单研究(第二版)[J].食品与发酵工业,2022,48(1):272-307.
[32]VAN RECKEM E,CLAEYS E,CHARMPI C,et al.High-throughput amplicon sequencing to assess the impact of processing factors on the development of microbial communities during spontaneous meat fermentation[J].Int J Food Microbiol,2021,354:109322.
[33]KINI K,AGNIMONHAN R,DOSSA R,et al.Genomics-informed multiplex PCR scheme for rapid identification of rice-associated bacteria of the genus Pantoea[J].Plant disease,2021,105(9):2389-2394.
[34]JUNG W Y,JUNG J Y,LEE H J,et al.Functional characterization of bacterial communities responsible for fermentation of doenjang:a traditional Korean fermented soybean paste[J].Front Microbiol,2016,7:827.