高温大曲是白酒酿造原动力,可以提供丰富的功能微生物、酶类和风味物质,直接影响白酒品质[1]。在制曲过程中,曲胚发酵品温高达65~70 ℃,其高温高湿的环境造就了微生物菌群结构的演替和有效富集[2]。高温大曲微生物主要包括细菌、霉菌、放线菌及酵母菌[3]。酱香白酒酿造过程中的微生物大多来源于生产用曲,因此,探究高温大曲微生物菌群多样性有助于解析制曲以及白酒发酵机理,提高大曲和白酒产品质量。
目前,对于高温大曲微生物的研究主要集中在传统分离培养和高通量测序两大方面。如王晓丹等[4]利用传统分离培养法从贵州茅台酒生产用高温大曲中筛选出扣囊复膜酵母(Saccharomycopsis fibuligera)、东方伊萨酵母(Issatchenkia orientalis)等;朱治宇等[5]基于高通量测序技术从茅台镇7个主酿区酿造大曲中检测到曲霉属(Aspergillus)、热子囊菌属(Thermoascus)等。然而不同地区会使得大曲在发酵过程中微生物群落产生差异,从而形成不同的白酒品质。当前研究大多集中于以茅台镇为代表的南方地区,对北方生产的高温大曲探究较少,因此,对北方生产的酱香大曲微生物菌群结构进行研究,有助于全方位多角度了解高温大曲,对促进制曲产业发展有重要作用。目前被报道过的北方高温大曲包括山东云门大曲[6]、北大仓大曲[7],但天津自古就是北酒之源,具有悠久的酿酒历史,天津南濒渤海,北依蓟运河,四季分明的气候环境会造就独特的微生物环境,然而目前并没有关于天津高温大曲的研究。
为初步揭示天津高温大曲微生物群落结构,对比不同地区高温大曲微生物间的菌群差异,本研究采用高通量测序技术对天津高温大曲微生物群落结构组成和多样性进行解析,并以贵州高温大曲作为对照,旨在初步揭示天津高温大曲微生物多样性及结构特征,为天津高温大曲品质研究提供新参数,同时也为后续高温大曲的相关研究奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料高温大曲(ZC):天津芦台春酿造有限公司;高温大曲(WG):贵州怀仁市售。
1.1.2 试剂
脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司;琼脂糖(分析纯):西班Biowest公司;KOD FX Neo:北京百灵克生物科技有限责任公司;引物:深圳市英俊生物技术有限公司;DNA纯化磁珠:南京诺唯赞生物科技有限公司;DNA纯化试剂盒、Monarch DNA胶回收试剂盒:北京鸿跃创新科技有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
Veriti96well9902聚合酶链式反应(polymerase reaction,PCR)仪:美国Applied biosystems公司;DynaMag96Side skirted磁力架:赛默飞世尔科技(中国)有限公司;OSE-MC8瞬时离心机:天根生化科技(北京)有限公司;Illumina HiSeq 2500测序仪:美国Illumina公司;FA1004N电子分析天平:上海精密科学仪器有限公司。
1.3 方法
1.3.1 DNA提取和PCR扩增
使用TGuide S96磁珠法土壤基因组DNA提取试剂盒从高温大曲样本中提取总基因组DNA,以其为模板进行PCR扩增。PCR扩增体系:基因组DNA、上游引物(10 μmol/L)0.3 μL,下游引物(10 μmol/L)0.3 μL,KOD FX Neo buffer 5 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)(2 mmol/L)2 μL,KOD FX Neo 0.2 μL,再用双蒸水补充至10 μL。其中,细菌使用引物338F(5'-ACTCCTACGGGAGGCAGCA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')结合适配器和条形码序列对16S rRNA基因的V3-V4高变区进行PCR扩增;真菌使用引物ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2(5'-GCTGCGTTCTTCATCGATGC-3')对ITS1区进行PCR扩增。PCR扩增程序:95 ℃预变性5 min;95 ℃变性30 s,50 ℃退火30 s,72 ℃延伸40 s,共25个循环;72 ℃再延伸7 min。PCR扩增产物经1.8%琼脂糖凝胶电泳检测后,使用OMEGA DNA纯化试剂盒对DNA进行纯化,再利用Monarch DNA胶回收试剂盒对DNA回收。
1.3.2 高通量测序
DNA质量检测合格后,由北京百迈客生物科技有限公司在Illumina novaseq 6000平台上进行高通量测序。首先,使用Trimmomatic(version 0.33)对原始数据进行质量过滤,然后使用Cutadapt(version 1.9.1)进行引物序列的识别与去除,其后使用USEARCH(version 10)对双端reads进行拼接并去除嵌合体,最终得到高质量的序列用于后续分析。使用USEARCH(version 10.0)在相似性97%的水平上对序列进行聚类获得操作分类单元(operational taxonomic unit,OTU),并基于Silva(细菌)和UNITE(真菌)分类学数据库对OTU进行分类学注释[8]。
1.3.3 数据处理
采用Microsoft Office Excel 2016进行数据计算和分析,使用QIIME 2软件,对样品Alpha多样性指数进行评估,基于R语言(3.6.1)分析微生物门、属组成情况,利用百迈克云平台(www.biocloud.net)和R语言绘制稀释曲线和堆积柱状图等,采用QIIME 2软件挑选出属分类学水平上相对丰度最高的特征序列作为代表序列,进行多重序列比对并构建系统进化树,进一步使用MEGAN软件将物种丰度信息回归至分类学系统关系树中构建分类学树状图。
2 结果与分析
2.1 Alpha多样性分析
基于高通量测序技术分析天津高温大曲和贵州高温大曲中真菌和细菌菌群的OTU及Alpha多样性指数,结果分别见图1和表1。由图1及表1可知,从两个高温大曲样品中共检测到201个细菌OTU和61个真菌OTU,根据韦恩图可知,两个大曲样品中细菌OTUs总数和唯一数均更高,ZC样品中特有的细菌OTUs数比WG样品多53个,而ZC样品中特有的真菌OTUs比WG样品少8个,说明天津高温大曲的真菌种类与贵州高温大曲相差不大,但细菌种类比贵州高温大曲更为丰富。
表1 高温大曲样品中微生物菌群的Alpha多样性分析结果
Table 1 Alpha diversity analysis results of microflora in high-temperature Daqu samples
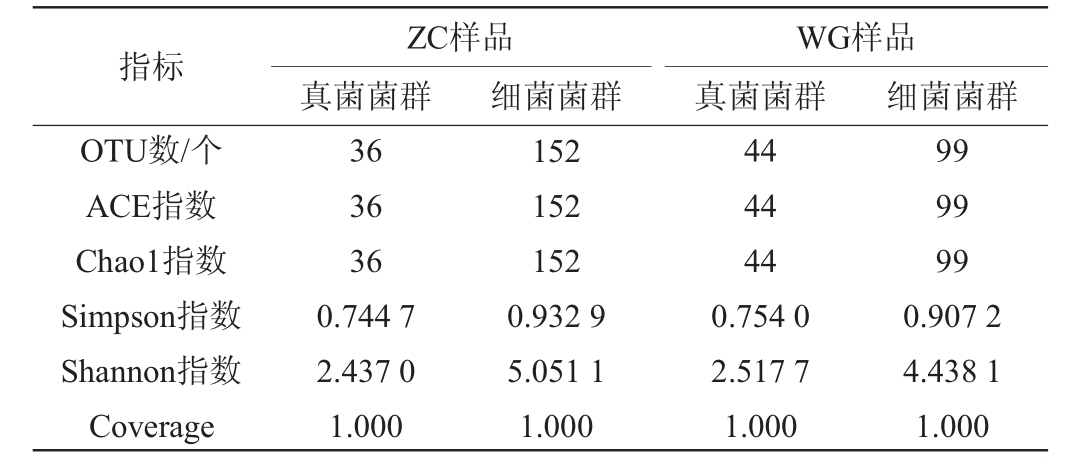
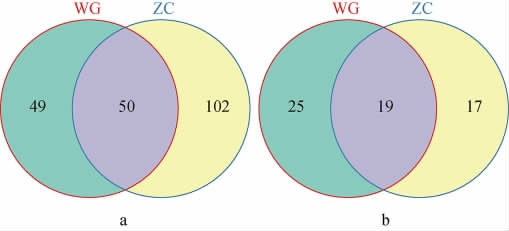
图1 高温大曲样品中细菌(a)和真菌(b)OTUs的韦恩图
Fig.1 Venn diagram of bacteria (a) and fungi (b) OTUs in high-temperature Daqu samples
Alpha多样性反映的是单个样品物种的丰度及多样性,通常用Chao1指数、ACE指数、Shannon指数和Simpson指数作为衡量指标,其中,Shannon指数和Simpson指数用于衡量物种多样性,其值越高,物种多样性越丰富;Chao1指数和ACE指数用于衡量物种丰度,其数值越高,物种丰度越高;Coverage值则用来反映测序得到的微生物群落的覆盖率[9]。由表1可知,ZC样品细菌菌群的Shannon指数和Simpson指数更大,说明ZC样品的细菌群落多样性更高;而WG样品的真菌菌群Shannon指数和Simpson指数更大,说明WG样品的真菌群落多样性较高。ZC样品细菌菌群的Chao1指数和ACE指数更大,表明ZC样品的细菌群落物种的丰富度更大;而WG样品真菌菌群的Chao1指数和ACE指数更大,则表明WG样品的真菌群落物种的丰富度较大。结果表明,WG样品真菌群落物种丰富度较大且群落多样性较高,而ZC样品细菌群落物种丰富度大且群落多样性更高。两个高温大曲样品的Coverage值均为1,说明该实验测序结果能够很好地反映样品中真菌和细菌菌群的情况。
2.2 稀释曲线及香农指数分析
有研究表明,稀释曲线能够反映测序深度情况[10]。两种高温大曲样品细菌菌群和真菌菌群的稀释曲线见图2。由图2可知,两种大曲样品的细菌和真菌菌群稀释曲线均随测序深度的增加呈现先直线上升后缓慢上升直至趋于平坦,说明测序样品数据量已经能够反映样品中绝大多数的微生物菌群信息,再增加测序深度也无法获得更多的OTU,菌群的多样性也不会发生改变,所测数据能够满足后续实验分析。
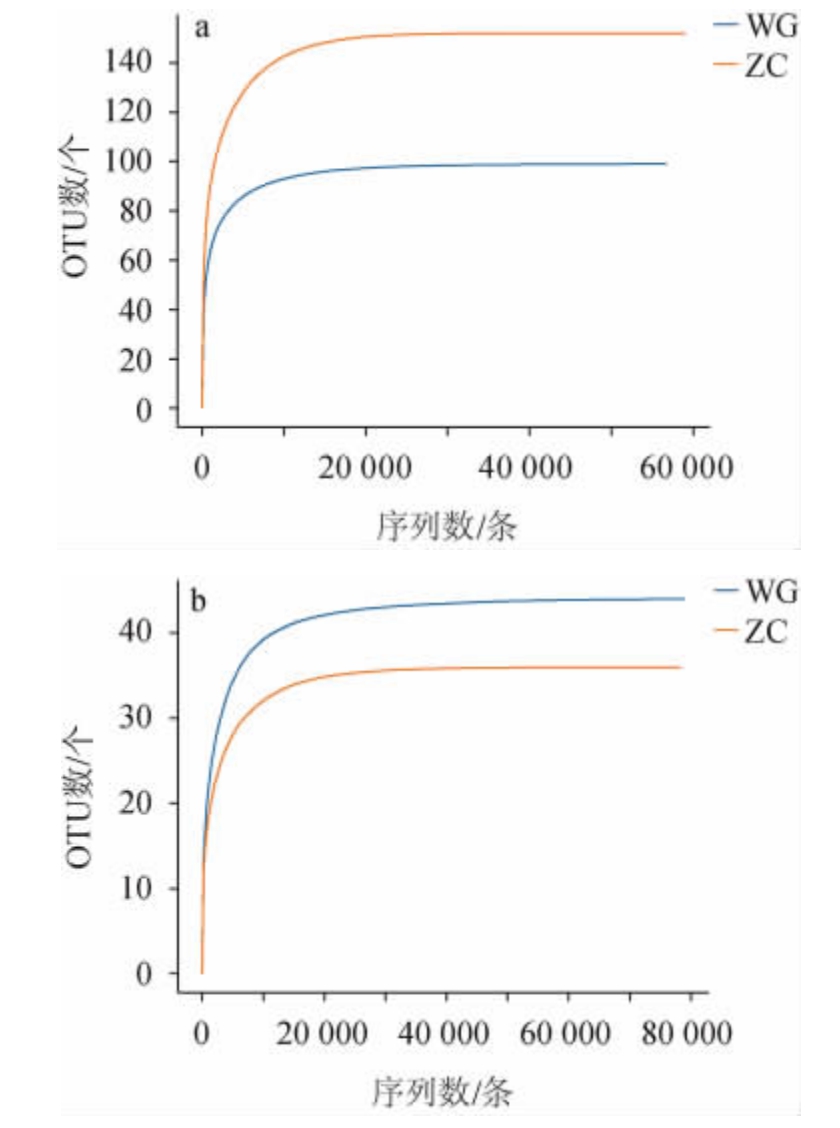
图2 高温大曲样品中细菌(a)和真菌菌群(b)的稀释曲线
Fig.2 Dilution curves of bacteria (a) and fungi (b) community in high-temperature Daqu samples
对两种高温大曲样品中细菌和真菌菌群的Shannon指数进行分析,绘制Shannon指数曲线,见图3。Shannon指数曲线用于反映各样本在不同测序数量时的微生物多样性,Shannon指数越大则物种种类越多,物种越丰富,表明样品中已涵盖绝大多数的微生物物种信息,当曲线趋向平坦时,说明测序数据量足够大,特征种类不会随测序量增加而增长[11]。由图3可知,随着测序数量的增加,细菌和真菌菌群的Shannon指数曲线均趋向平坦,说明测序数据量渐进合理。随着测定序列数目的增加,WG和ZC样品细菌菌群的Shannon指数值均明显高于2.5,说明两个样本细菌菌群的物种多样性和丰富度都较高;而WG和ZC样品真菌菌群的Shannon指数曲线相差不大,这是由于两样品的Shannon指数也相差较小,所以真菌群落物种的多样性也相差不大。
图3 高温大曲样品中细菌(a)和真菌菌群(b)的香农指数曲线
Fig.3 Shannon indexes curves of bacteria (a) and fungi (b)community in high-temperature Daqu samples
2.3 高温大曲样品微生物群落结构分析
两种高温大曲样品所检测到的201个细菌OTU隶属于7个门、9个纲、24个目、51个科、79个属和92个种;而检测到的61个真菌OTU隶属于5个门、9个纲、11个目、18个科、26个属和41个种。
基于门水平对两种高温大曲样品中的细菌和真菌群落结构进行分析,结果见图4。

图4 基于门水平高温大曲样品中细菌(a)和真菌(b)群落结构
Fig.4 Bacterial (a) and fungal (b) community structure in hightemperature Daqu samples based on phylum level
由图4a可知,ZC样品中共检测到7个细菌门,包括厚壁菌门(Firmicutes)、放线菌门(Actinobacteriota)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidota)、梭菌门(Fusobacteriota)、酸杆菌门(Acidobacteriota)和未分类的细菌(Unclassified Bacteria),其中,厚壁菌门相对丰度最高,达到83.91%。WG样品中共检测到5个细菌门,包括厚壁菌门(Firmicutes)、放线菌门(Actinobacteriota)、变形菌门(Proteobacteria)、梭菌门(Fusobacteriota)和未分类的细菌(unclassified_Bacteria),同样也是厚壁菌门相对丰度最高,达96.09%。两个大曲样品中均以厚壁菌门为绝对优势门(相对丰度>80%)。有研究表明,茅台镇不同主酿区域酱香型白酒酿造大曲中的优势细菌门为厚壁菌门和放线菌门[12],与本研究结果一致。但ZC样品的放线菌门和变形菌门相对丰度要高于WG样品。由图4b可知,ZC样品中共检测到4个真菌门,包括子囊菌门(Ascomycota)、毛霉菌门(Mucoromycota)、担子菌门(Basidiomycota)和壶菌门(Chytrid iomycota),其中子囊菌门相对丰度最高,达98.96%。而WG样品共检测到5个真菌门,包括子囊菌门(Ascomycota)、毛霉菌门(Mucoromycota)、担子菌门(Basidiomycota)、壶菌门(Chytridiomycota)和未分类的真菌(unclassified_Fungi),其也是子囊菌门相对丰度最高,达99.62%。两个大曲样品中均以子囊菌门为绝对优势门(相对丰度>80%)。
基于属水平对两种高温大曲样品中的细菌和真菌群落结构进行分析,结果见图5。
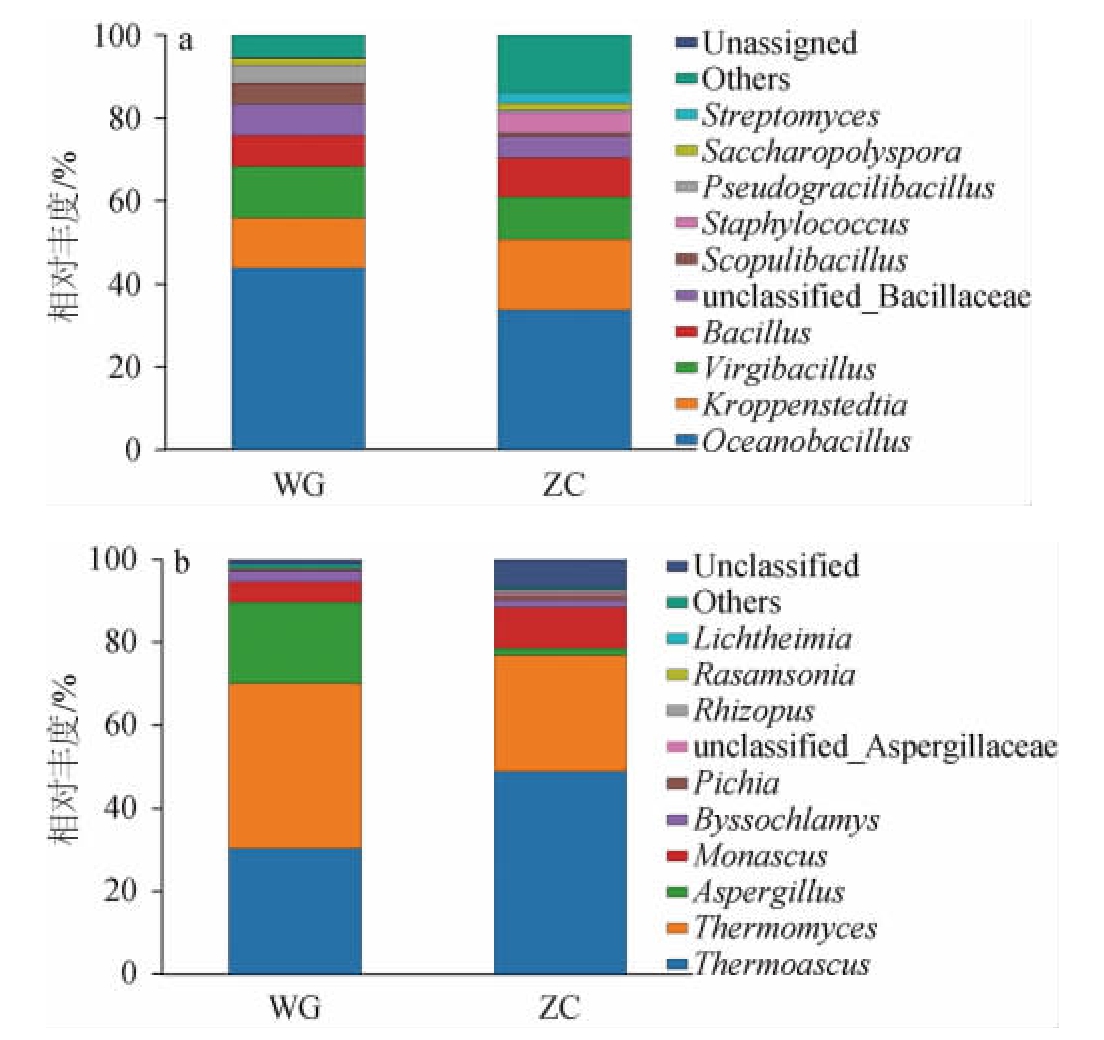
图5 基于属水平高温大曲样品中细菌(a)和真菌(b)群落结构
Fig.5 Bacterial (a) and fungal (b) community structure in hightemperature Daqu samples based on genus level
由图5a可知,ZC样品中共检测到64个细菌属,其中优势细菌属(相对丰度>1%)包括海洋芽孢杆菌属(Oceanobacillus)、克罗彭斯特菌属(Kroppenstedtia)、枝芽孢杆菌属(Virgibacillus)、芽孢杆菌属(Bacillus)、未分类的芽孢杆菌科(unclassified_Bacillaceae)、葡萄球菌属(Staphylococcus)、链霉菌属(Streptomyces)和糖多孢菌属(Saccharopolyspora),相对丰度最高的是海洋芽孢杆菌属(33.79%)。WG样品中仅检测到45个细菌属,其中优势细菌属(相对丰度>1%)包括海洋芽孢杆菌属(Oceanobacillus)、枝芽孢杆菌属(Virgibacillus)、克罗彭斯特菌属(Kroppenstedtia)、未分类的芽孢杆菌科(unclassified_Bacillaceae)、芽孢杆菌属(Bacillus)、火山渣芽孢杆菌属(Scopulibacillus)、Pseudogracilibacillus和糖多孢菌属(Saccharopolyspora),相对丰度最高的同样是海洋芽孢杆菌属(43.90%)。两个大曲样品在属水平上的优势细菌属种类大体相似但略有不同,且相对丰度有一定差异。海洋芽孢杆菌属在贵州茅台镇某酱香型白酒企业自制生产的酱香高温大曲中检测到过,但其相对丰度较低,介于0.10%~1.00%之间[13],但在本研究的天津和贵州高温大曲中海洋芽孢杆菌属相对丰度均很高。克罗彭斯特菌属和枝芽孢杆菌属在ZC和WG两个大曲样品中相对丰度也较高,分别为16.86%和10.18%以及11.86%和12.46%,这与ZOU Q C等[14]探究传统与机械化制备高温大曲发酵过程中细菌菌群多样性的结果一致。据报道,克罗彭斯特菌属在白酒发酵过程中能够有利于乳酸和乙酸乙酯等物质的增加[15],在一定程度上会影响白酒的风味。枝芽孢菌属在白云边白酒发酵剂[16]、玉米黄酒[17]以及郫县豆瓣[18]等发酵产品中均曾被发现过,且DU F M等[19]研究发现,枝芽孢菌属与3-甲基-1-丁醇和月桂酸乙酯等化合物呈正相关关系。芽孢杆菌属作为细菌中重要的一类,属于需氧菌,适宜在偏酸性、潮湿的环境中生存[20],在大曲发酵过程中起到至关重要的作用,也是大曲中的功能性微生物,它能够分泌强活性的蛋白酶、脂肪酶和淀粉酶,同时还能产生酚类、吡嗪和挥发酸等风味化合物[21],能够对酱香型白酒的风味和品质的形成产生重要贡献。糖多孢菌属在ZC和WG两个大曲样品中相对丰度均为1.60%。据唐佳代等[22]研究发现,糖多孢菌属在贵州省仁怀市某酒厂的出仓曲中检测到,在黑曲中的相对丰度为5.39%,在黄曲中的相对丰度为1.11%,与本研究结果大致相同。葡萄球菌属和链霉菌属在ZC大曲样品中相对丰度分别为4.83%、2.60%,而在WG大曲样品中相对丰度较低。火山渣芽孢杆菌属则在WG大曲样品中相对丰度为4.87%,在ZC大曲样品中相对丰度较低。此外,ZC大曲样品中其他属的相对丰度也高于WG大曲样品。
由图5b可知,ZC样品中共检测到19个真菌属,其中优势真菌属(相对丰度>1%)包括热子囊菌属(Thermoascus)、嗜热真菌属(Thermomyces)、红曲霉属(Monascus)、Unidentified、丝衣霉属(Byssochlamys)、曲霉属(Aspergillus)、毕赤酵母属(Pichia)和根霉属(Rhizopus),其中,相对丰度最高的是热子囊菌属(48.75%)。WG样品中共检测到22个真菌属,其中优势真菌属(相对丰度>1%)包括嗜热真菌属(Thermomyces)、热子囊菌属(Thermoascus)、曲霉属(Aspergillus)、红曲霉属(Monascus)、丝衣霉属(Byssochlamys)和Unidentified,其中相对丰度最高的是嗜热真菌属(39.70%)。热子囊菌属和嗜热真菌属是两种最常见的高温大曲中的真菌,容易在高温条件下繁殖,并且能够产生多种耐热的水解酶和高热稳定性的木聚糖酶、脂肪酶等[23-24],从而帮助白酒堆积糖化发酵,对酱香风味的形成具有重要作用[25-26]。热子囊菌属和嗜热真菌属是ZC和WG两个大曲样品中的优势菌属,该结果与孙利林等[27]对贵州省仁怀市茅台镇酱香型白酒大曲的主要真菌群落结构的研究结果一致。曲霉属在ZC和WG两个大曲样品中的相对丰度也较高,分别为16.45%和19.61%,曲霉属能够产生水解酶,使淀粉糖化、蛋白质水解以及生成类黄酮,进而促进芳香类物质的形成[28]。红曲霉属作为ZC和WG两个大曲样品的优势菌属之一,其相对丰度分别为9.94%和4.95%,红曲霉属可以产生大量酯酶,对苯乙醇以及肉豆蔻酸乙酯的形成具有促进作用[29]。丝衣霉属在ZC和WG两个大曲样品中的相对丰度分别为1.73%和2.67%,它能够耐热、耐酸,还可以产果胶酶,并且据JIN Y等[30]报道,丝衣霉属与酱香型白酒主体香气成分己酸乙酯和辛酸乙酯等有密切关系。
综上所述,ZC和WG两个大曲样品在主要的优势细菌属和真菌属上具有很高的一致性,但ZC大曲样品中有葡萄球菌属和链霉菌属两个独有的优势细菌属以及毕赤酵母属和根霉属两个独有的优势真菌属,而WG大曲样品中只有火山渣芽孢杆菌属一个独有的优势细菌属,表明南方和北方区域间的微生物存在一定的共性;但同时两个大曲样品间也存在各自的特性。
2.4 高温大曲微生物系统发育分析
采用QIIME 2软件挑选出属分类学水平上相对丰度最高的特征序列作为代表序列,进行多重序列比对并构建系统进化树,结果见图6。
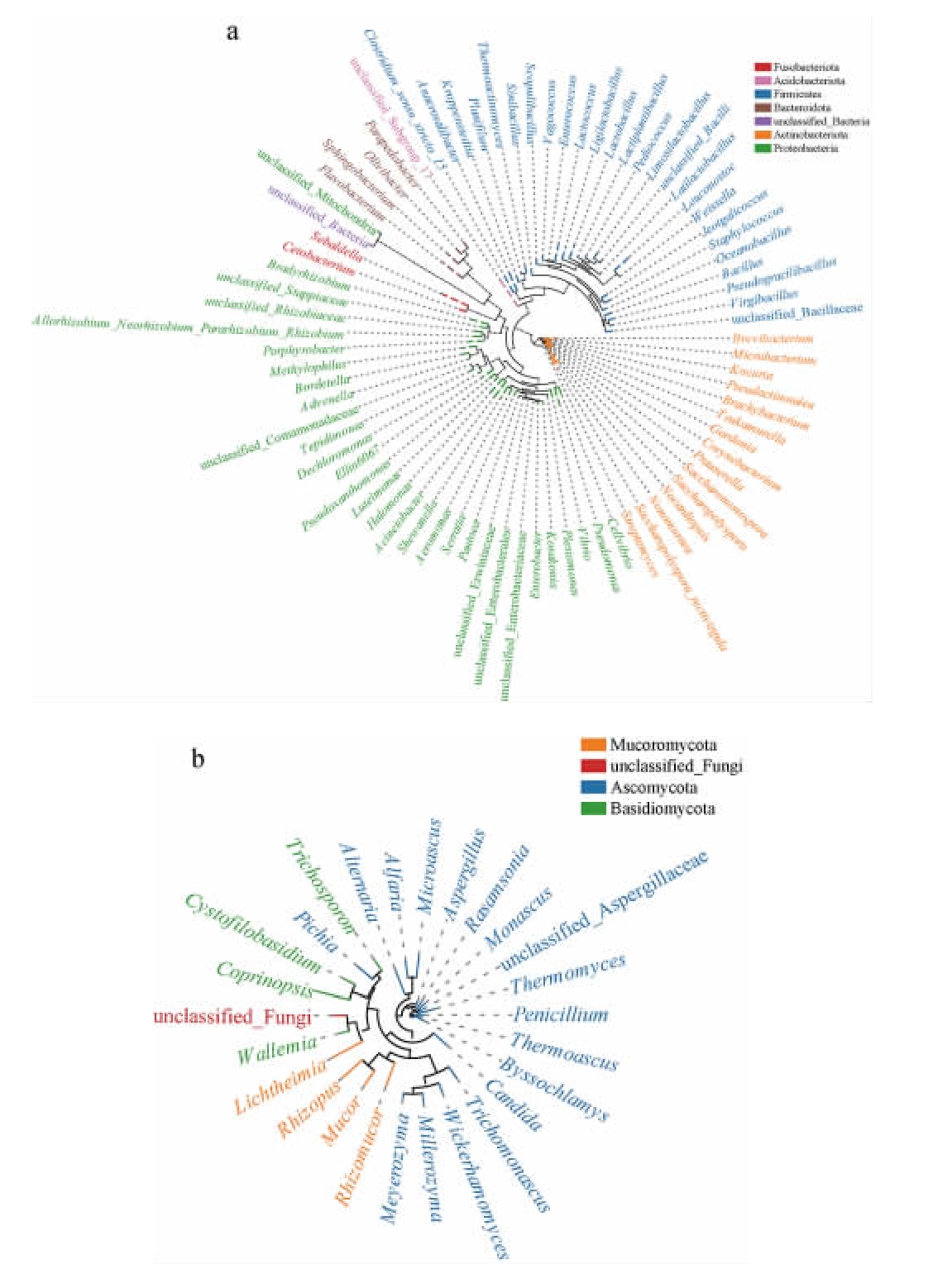
图6 高温大曲样品中细菌(a)和真菌(b)的系统进化树
Fig.6 Phylogenetic tree of bacteria (a) and fungi (b) in high-temperature Daqu samples
图6中相同颜色属名代表属于相同的门,进化树中每条树枝代表一个物种,树枝长度为两个物种间的进化距离,即物种的差异程度。由图6a可知,高温大曲细菌菌群主要聚类于变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)和厚壁菌门(Firmicutes)。由图6b可知,高温大曲真菌菌群主要聚类于子囊菌门(Ascomycota)、毛霉菌门(Mucoromycota)和担子菌门(Basidiomycota)。
进一步使用MEGAN软件将测序得到的物种丰度信息回归至数据库的分类学系统关系树中,从整个分类系统的角度全面了解样品中微生物的进化关系和丰度差异。分类学树状图用于比对不同样品在某分支上的序列丰度差异,饼状图面积越大,说明在分支处序列相对丰度越大,不同颜色代表不同样品,某颜色扇形面积越大,说明在该分支上,其对应样品的序列数比其他样品多。两个高温大曲样品的细菌和真菌分类学树状图见图7。
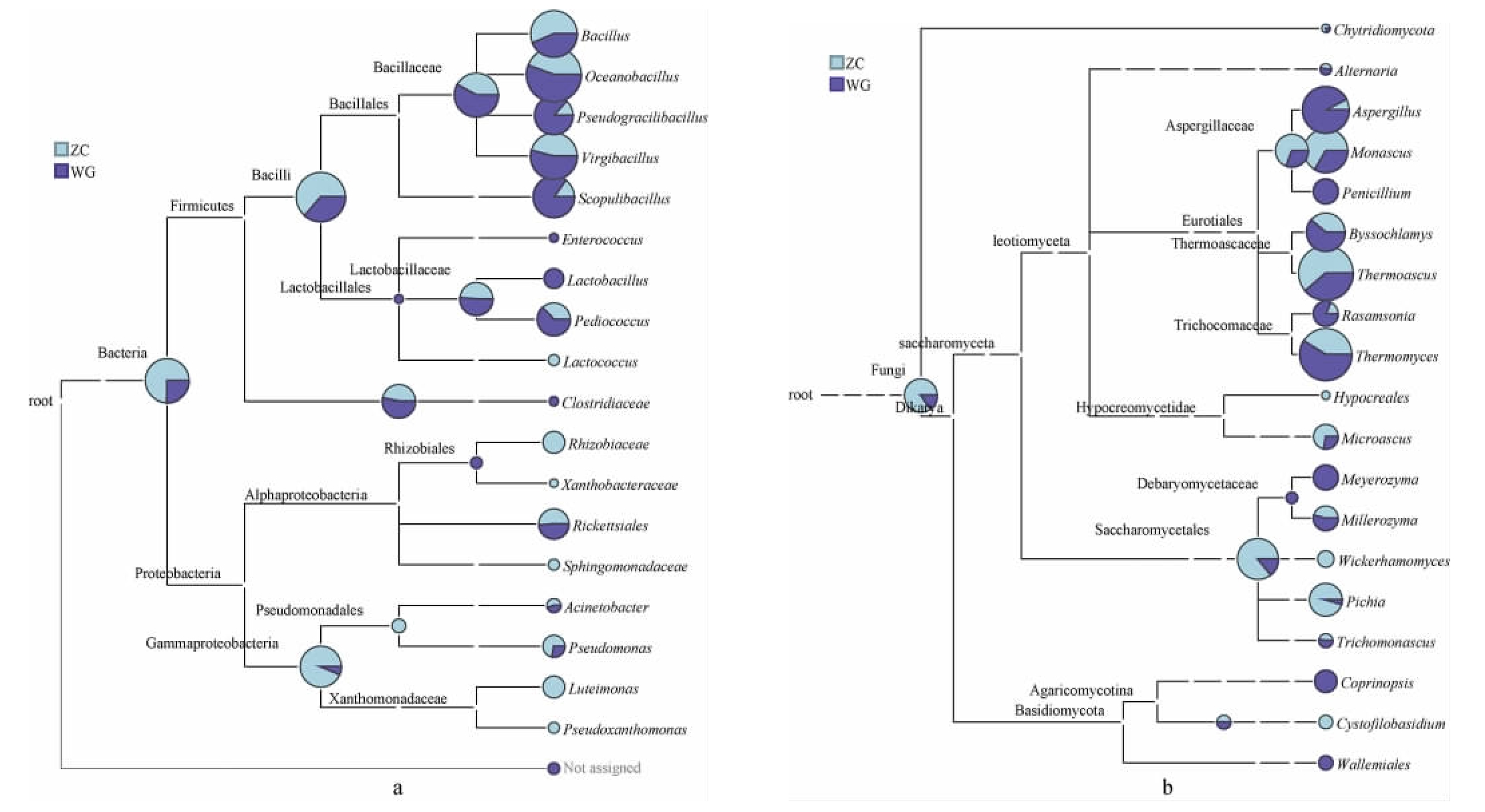
图7 基于属水平高温大曲样品中细菌(a)和真菌(b)的分类学树状图
Fig.7 Taxonomic dendrogram of bacteria (a) and fungi (b) in high-temperature Daqu samples based on genus level
由图7a可知,在杆菌中,ZC样品序列相对丰度较大,其中ZC样品在芽孢杆菌科中序列相对丰度小于WG样品,在乳杆菌科中序列相对丰度与WG大致相同。具体来说,ZC样品中的海洋杆菌属(Oceanobacillus)、枝芽孢杆菌属(Virgibacillus)、Pseudogracilibacillus、火山渣芽孢杆菌属(Scopulibacillus)、乳酸菌属、肠球菌属和片球菌属的序列相对丰度均小于WG样品,但ZC样品在芽孢杆菌属和乳球菌属的序列相对丰度却大于WG样品。除杆菌外,ZC样品中变形菌的序列相对丰度远大于WG样品,在根瘤菌属、Xanthobacteraceae、Sphingomonadaceae、不动杆菌属、假单胞菌属、Luteimonas、Pseudoxanthomonas中的序列相对丰度均远大于WG样品。这说明ZC样品在细菌种类上更丰富,这也使得ZC样品在细菌总丰度上明显大于WG样品。由图7b可知,在丝状菌中,ZC样品中曲霉属、青霉属、丝衣霉属、Rasamsonia、嗜热真菌属的序列相对丰度均小于WG样品,但ZC样品中红曲霉属、热子囊菌属、Hypocreales、Microascus的序列相对丰度却大于WG样品。在酵母菌中,ZC样品中毕赤酵母属以及威克汉逊酵母属的序列相对丰度远大于WG样品。
3 结论
本研究以天津高温大曲为研究对象,以贵州高温大曲作为对照,采用高通量测序技术对其微生物群落结构和多样性进行分析。结果表明,与贵州高温大曲相比,天津高温大曲的细菌群落物种丰富度较大且多样性更高,而真菌群落相反。在细菌属中,两个样品的共有优势细菌属(相对丰度>1%)为海洋芽孢杆菌属、克罗彭斯特菌属、枝芽孢杆菌属、芽孢杆菌属、糖多孢菌属、unclassified_Bacillaceae,除此之外,天津高温大曲还以葡萄球菌属和链霉菌属为特有优势细菌属,贵州高温大曲以火山渣芽孢杆菌属和Pseudogracilibacillus为特有优势细菌属。在真菌属中,两个样品的共有优势真菌属(相对丰度>1%)为热子囊菌属、嗜热真菌属、红曲霉属、曲霉属、丝衣霉属和Unidentified,除此之外,天津高温大曲还以毕赤酵母属和根霉属为特有优势属。目前对天津高温大曲微生物多样性的研究尚少,后续可以进一步利用代谢组学、转录组学和蛋白质组学方法研究天津高温大曲的功能菌株及发酵机制。本研究能够在一定程度上初步丰富人们对天津高温大曲微生物菌群的认识,为进一步探究天津高温大曲优势微生物功能性及特色菌株的应用提供一定的理论支撑。
[1]GOU M,WANG H,YUAN H,et al.Characterization of the microbial community in three types of fermentation starters used for Chinese liquor production[J].J I Brewing,2015,121(4):620-627.
[2]郭敏.基于高通量测序对酱香大曲制曲微生态多样性的研究[D].贵阳:贵州大学,2018.
[3]赵群丽.酱香大曲中酿酒微生物的筛选及发酵工艺研究[D].贵阳:贵州大学,2016.
[4]王晓丹,陈美竹,班世栋,等.茅台大曲中酵母的分离、鉴定及其功能初探[J].食品科学,2017,38(4):51-57.
[5]朱治宇,黄永光.基于高通量测序对茅台镇酱香白酒主酿区域霉菌菌群结构多样性的解析[J].食品科学,2021,42(8):150-156.
[6]周晓龙.北派酱香大曲的细菌群落分析及增香芽孢杆菌的筛选及应用[D].济南:齐鲁工业大学,2020.
[7]印璇,冯英志,韩兴林,等.北方酱香大曲培曲过程中微生物变化的分析研究[J].酿酒科技,2015(1):1-6,11.
[8]周森,王成,朱绍宾,等.基于高通量测序技术分析浓香型白酒大曲真菌菌群多样性[J].中国酿造,2021,40(11):55-59.
[9]黎瑶依,胡小霞,黄永光.茅台镇酱香型白酒酿造环境中真菌菌群多样性分析[J].食品科学,2021,42(18):164-170.
[10]张永杰,崔宁波,张丽珍,等.基于DNA高通量测序分析生料酿醋过程中的真菌多样性[J].微生物学报,2020,60(7):1358-1369.
[11]夏围围,贾仲君.高通量测序和DGGE分析土壤微生物群落的技术评价[J].微生物学报,2014,54(12):1489-1499.
[12]任爱容,黄永光.茅台镇不同主酿区域酱香型白酒酿造大曲中细菌菌群结构分析[J].食品科学,2021,42(4):167-174.
[13]熊盈盈.第三代测序技术和培养法联合使用对酱香大曲细菌多样性及其功能的研究[D].贵阳:贵州大学,2021.
[14]ZUO Q C,HUANG Y G,MIN G.Evaluation of bacterial diversity during fermentation process: a comparison between handmade and machinemade high-temperature Daqu of Maotai-flavor liquor[J].Ann Microbiol,2020,70(1):57.
[15]WANG X,HAI D,YAN Z,et al.Environmental microbiota drives microbial succession and metabolic profiles during Chinese liquor fermen-tation[J].Appl Environ Microb,2017,84(4):002369.
[16]XIONG X,HU Y,YAN N,et al.PCR-DGGE Analysis of the microbial communities in three different Chinese "Baiyunbian" liquor fermentation starters[J].World J Microb Biot,2014,24(8):1088.
[17]REN Q,SUN L,SUN Z,et al.Bacterial succession and the dynamics of flavor compounds in the Huangjiu fermented from corn[J].Arch Microbiol,2020,202(2):1-10.
[18]关统伟,王鹏昊,邓奥宇,等.郫县豆瓣发酵过程可培养细菌多样性及其演化分析[J].食品与发酵工业,2017,43(4):22-27.
[19]DU F M,ZHANG X Y,GU H R,et al.Dynamic changes in the bacterial community during the fermentation of traditional Chinese fish sauce(TCFS)and their correlation with TCFS quality[J].Microorganisms,2019,7(9):371.
[20]张宗启.酱香型白酒大曲中功能微生物菌群及其酶系研究进展[J].酿酒科技,2021(3):92-99.
[21]赵驰,苏伟,母应春,等.不同原料对酱香大曲微生物群落结构及多样性的影响[J].食品科学,2022,43(10):133-141.
[22]唐佳代,刘力萍,龙亚飞,等.不同感官特性酱香大曲细菌群落结构与理化特性研究[J].中国酿造,2022,41(1):138-142.
[23]ZHANG M,PURI A K,WANG Z X,et al.A unique xylose reductase from Thermomyces lanuginosus:effect of lignocellulosic substrates and in hibitors and applicability in lignocellulosic bioconversion[J].Bioresource Technol,2019,102(2):374-381.
[24]MAKOLOMAKWA M,PURI A K,PERMAUL K,et al.Thermo-acidstable phytase-mediated enhancement of bioethanol production using Colocasia esculenta[J].Bioresource Technol,2017,235:396-404.
[25]JAIN K K,DEY T B,KUMAR S,et al.Production of thermostable hydrolases(cellulases and xylanase)from Thermoascus aurantiacus RCKK:a potential fungus[J].Bioproc Biosyst Eng,2015,38(4):787-796.
[26]孙利林,李立郎,胡萍,等.酱香型白酒第四轮次酒酿造过程中真菌多样性分析[J].中国酿造,2019,38(11):24-30.
[27]孙利林,李立郎,胡萍,等.酱香型白酒大曲的微生物菌群结构及风味成分分析[J].现代食品科技,2020,36(8):299-306.
[28]HE G Q,HUANG J,ZHOU R Q,et al.Effect of Fortified Daqu on the microbial community and flavor in Chinese strong-flavor liquor brewing process[J].Front Microbiol,2019,10:56.
[29]LENG Y W,XU Y.Improvement of flavour compound synthesis in a mixed culture system at high temperature by solid-state fermentation[J].J I Brewing,2015,121(4):609-613.
[30]JIN Y,LI D Y,AI M,et al.Correlation between volatile profiles and microbial communities: A metabonomic approach to study Jiang-flavor liquor Daqu[J].Food Res Int,2019,121:422-432.