白酒是我国传统的蒸馏酒,其酿造历史悠久。在白酒酿造过程中,多种白酒微生物利用糖、纤维素等原料进行生长繁殖,并代谢产生百种以上的风味化合物,得以酿造出不同香型的白酒[1]。其中,微生物的来源以酒曲、酒醅和窖泥为主,以环境微生物为辅,共同影响白酒的酿造过程和风味品质[2-3]。
确定白酒微生物种属是微生物多样性的重要研究方向,研究初期采用传统培养技术,该技术以平板划线分离法和稀释涂布平板法等分离、纯化微生物,操作简单易于实现[4],但工作量大、需要消耗大量培养基。宋连宝[5]研究发现,在显微镜下观察到的细菌细胞数量与在琼脂平板上形成的菌落数量不匹配,菌群数量的差异证明部分微生物不能在琼脂平板上培养,无法全面地了解微生物菌群结构等信息,限制了研究白酒微生物多样性的进展。
经过微生物分析技术不断的发展,非培养技术应运而生,其是通过从微生物的遗传因子脱氧核糖核酸(deoxyribonucleic acid,DNA)\核糖核酸(ribonucleic acid,RNA)层面分析微生物基因序列、鉴定种属和功能基因表达等,如变性梯度凝胶电泳(denaturing gel gradient electrophoresis,DGGE)、聚合酶链式反应(polymerase chain reaction,PCR)、聚合酶链反应-单链构象多态(polymerasechainreaction-single strand conformation polymorphism,PCR-SSCP)和高通量测序等[5-6]。近年来,高通量测序技术应用于多种食品的微生物菌群多样性研究,如发酵制品中酒、醋、茶和奶等[6]。传统培养与非培养微生物的方法相结合能明显提高微生物种属检测的准确性,且降低时间与成本[7]。本文在介绍高通量测序技术的基础上,对其在分析白酒酿造工艺和不同香型白酒中微生物多样性的研究进行综述,旨在为白酒微生物的研究提供参考。
1 高通量测序技术概述
高通量测序(high throughput sequencing,HTS)技术称为下一代测序技术,该技术能在短时间内对几十万到几百万条微生物基因序列进行测定,并分析出微生物群落结构[8]。在第一代基因测序技术中,测序原理采用1977年SANGER提出的链终止法,在4个DNA合成反应体系中分别加入4种双脱氧核苷三磷酸(dideoxyribonucleoside triphosphate,ddNTP),利用DNA聚合酶与待测核苷酸相结合,直至掺入一种链终止核苷酸为止,经过凝胶电泳处理确定碱基顺序[9]。第一代测序技术具有测序准确性高的优势,但其通量低、时间长和成本高,不利于大规模基因测序的应用[9]。经过测序技术的发展,第二代测序技术在测序通量、序列读长和测序时间上有较大的提升,能得到更丰富的生物学信息,实现测序技术的创新[10]。
高通量测序技术在白酒微生物多样性研究中的基本流程为基因提取、PCR扩增及纯化基因序列、上机测序和信息数据分析[11-12](图1)。根据微生物测定的种属和数据量选择高通量测序平台。目前,高通量测序平台主要有454焦磷酸测序平台(Roche公司)、Illumina测序平台(Solexa公司)、SOLiD和Ion Torrent测序平台(ABI公司)[13]。这4种主要测序平台在测序原理、序列读长、通量大小和错误率等方面都存在差异[14-17](表1)。
表1 4种高通量测序平台的测序原理、序列读长、通量大小和错误率
Table 1 Sequencing principle,sequence read length,throughput size and error rate of 4 high-throughput sequencing platforms

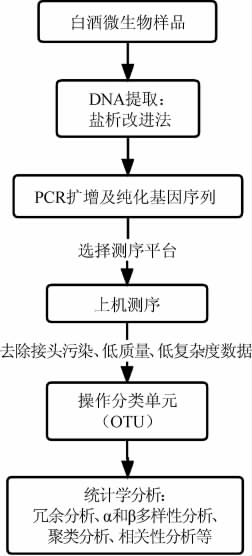
图1 高通量测序技术在白酒微生物多样性研究中的基本流程
Fig.1 Basic flow of high-throughput sequencing technology in microbial diversity study of Baijiu
然而,第二代测序技术准确率降低、读长变短[18],且因其需要PCR扩增,会影响测序的准确性。经过测序技术不断发展,第三代测序技术诞生。目前,第三代测序技术有真单分子测序(true single molecular sequencing,tSMS)、单分子实时测序(single molecule real time sequencing,SMRT)以及纳米孔单分子技术[19-20]。第三代测序技术优势是不需进行PCR扩增,避免了碱基替换及偏置等错误出现,弥补了第二代测序技术不足,测序准确性和序列读长明显提高和基因数据库不断完善[21],有着广泛的应用前景。目前,随着高通量测序技术的快速发展,白酒微生物多样性等研究逐渐增加,主要是对微生物菌群结构及其作用机制两方面的研究,如采用高通量测序技术研究白酒酿造微生物结构变化,采用多组学分析方法解析微生物间复杂的相互作用关系[22-23]。在第二代测序技术中,由于白酒微生物的特定核酸片段序列长度一般在1 000 bp以内[17],且结合序列读长、通量大小和成本价格等情况,常采用Illumina测序平台对白酒微生物多样性进行研究。
2 高通量测序技术在白酒微生物多样性中的应用
2.1 白酒酿造工艺中微生物多样性的应用
白酒是由多种微生物共同发酵而成,在其酿造过程中,酒曲、酒醅、窖泥和酿造环境等的微生物呈现多样性[24]。利用高通量测序技术,能快速高效地分析出白酒微生物菌群的种属及其相对丰度,精准监测菌群结构的动态变化规律,为白酒酿造产业的发展奠定重要的理论基础。
2.1.1 酒曲中微生物分析
酒曲是白酒酿造过程中的发酵剂,为白酒酿造提供所需微生物[25]。在酒曲微生物的研究中,利用高通量测序技术,确定酒曲优势菌群及其相对丰度。与此同时,通过微生物菌群结构和酒曲理化指标之间的关系,揭示微生物菌群结构变化的原因。杨旭等[26]通过Illumina Miseq测序平台对白酒中高温大曲微生物多样性进行研究,并分析其与酒曲温度间的关系。结果表明在最高曲温下,克罗彭斯特菌属(Kroppenstedtia)的相对丰度高达60.67%,并发现该生物是贾湖白酒大曲中的特殊微生物之一。值得注意的是,乳杆菌属(Lactobacillus)的相对丰度降至最低为15.41%,但当温度降低后其重新占据优势。李静心等[27]采用Illumina HiSeq 2500 2×250 bp测序平台,比较白酒高温和中高温大曲的真菌菌群结构差异,得出疏绵状嗜热丝孢菌(Thermomyces lanuginosus)和东方伊萨酵母(Issatchenkia orientalis)分别是构成高温大曲和中高温大曲的优势真菌,其相对丰度分别为80.49%和38.22%。结果表明,在利用高通量测序技术获取到大量的微生物菌群结构等信息的基础上,比较不同酒曲间微生物菌群结构的多样性、优势微生物及其相对丰度的差异,有利于为白酒大曲微生物多样性提供参考。在白酒酿造过程中,JIANG Q N等[28]利用IlluminaHiSeq 2500测序平台对6个关键发酵时期内微生物群落结构及其演替规律进行研究,发现6个发酵时期内的微生物相对丰度显著不同。综上,利用高通量测序技术,检测出酒曲中菌群结构及其优势菌群,得出关键时间点及其演替规律,有利于精准调控酒曲生产。
2.1.2 培曲方法中微生物多样性分析
在酒曲制作过程中,酒曲的品质优劣会受培曲工艺的影响,其中,堆曲方式、翻曲时间和机械制曲等培曲方法影响白酒菌群结构,进而影响酒曲的品质。林钰宽等[29]通过改变覆盖稻草和翻曲的时间,得出新型曲坯制备工艺,并利用Illumina MiSeq测序分析常规和新型工艺下曲坯微生物多样性,结果表明,在新型工艺下,具有产香能力的丝孢毕赤酵母(Hyphopichia)[30]和分泌酯酶的假丝酵母(Candida)[31]相对丰度升高,这是由于推迟第一次翻曲的时间,减缓了曲坯升温速度,延长微生物生长繁殖的时间,进一步影响微生物菌群结构,提高白酒风味物质的含量。王宇良等[32]利用Illumina MiSeq测序分析传统和机械制曲方法对酒曲细菌菌群结构的影响,发现两种方法的核心细菌属种类相似,但其相对丰度占比不同;在机械制曲中,芽孢杆菌属(Bacillus)的相对丰度为71.2%,显著高于传统制曲(0.38%);该研究揭示了机械与传统制曲下菌群结构差异,证实了圆盘式机械制曲提高了酒曲生产效率,降低了生产成本[33]。因此,通过高通量测序技术,分析不同培曲方法中微生物菌群结构的多样性,进而提高白酒酒曲的品质,对推动白酒产业的发展具有重要意义。
2.1.3 酒醅中微生物多样性分析
白酒酒醅是将谷物原料蒸煮摊凉后,接种酒曲并发酵的粮醅。酒醅的发酵方式有堆积发酵和窖池发酵,其区别是微生物生存环境的含氧量不同[34]。在酒醅发酵前期,堆积发酵为微生物提供有氧环境,有利于好氧微生物生长繁殖。经过固态堆积发酵后,酒醅中富集了大量优势菌群,为入窖发酵创造良好的菌群条件[35]。曹润洁等[36]对酒醅细菌16S rDNA的V3-V4区和真菌ITS2区的基因序列进行PCR扩增,并通过Illumina MiSeq PE300平台测序,分析在堆积发酵过程中,堆积初期的原核优势菌属是芽孢杆菌属(Bacillus)和醋酸杆菌属(Acetobacterium),优势真菌属是毕赤酵母属(Pichia)和曲霉属(Aspergillus)。堆积后期的原核微生物魏斯氏菌(Weissella)的比例降低,醋酸杆菌属(Acetobacterium)的比例显著增加,真核微生物曲霉属(Aspergillus)的比例下降。结果表明堆积初期与后期的微生物菌群结构变化显著,这是由于堆积初期酒醅内营养物质丰富,且有氧环境能促进好氧微生物生长繁殖,而后期营养物质含量降低、氧气减少,厌氧微生物增加,菌群结构逐渐集中,为微生物后续入窖发酵奠定基础。
在酒醅的不同空间位置中,不同的氧气含量和温度高低会影响微生物的生长繁殖,其中,酒醅表层接触氧气多、温度偏低,深层则相反[35]。为了更全面地分析酒醅菌群结构,王雪山等[37]采用Illumina Miseq平台对不同位置的酒醅微生物进行研究。其中,该研究将微生物的基因进行双端测序,其是把DNA片段的两端各测序一次,有利于提高测序的准确性[38]。测序分析得出在堆积发酵初期,上层菌群发酵15 d与中、下层发酵8 d的菌群相接近,而发酵后期的三层菌群结构趋于一致。结果表明,在不断发酵后酒醅微生物菌群结构差异降低逐渐集中,有利于白酒品质的稳定。总的来说,酒醅发酵是白酒酿造的重要部分,利用高通量测序技术研究酒醅微生物多样性,揭示其菌群结构和演替规律,对白酒微生物的研究具有重要意义。
2.1.4 窖泥中微生物多样性分析
堆积发酵的下一步是酒醅入窖发酵,在窖池内窖泥经过长期且连续发酵生产使其逐渐成熟,其成熟的标志是窖龄达到一定时间后,窖泥中形成了独有和稳定的微生物菌群结构[39]。因此,探究不同窖龄的窖泥微生物多样性是主要的研究方向。邓杰等[40]通过Roche GS junior高通量测序平台,对5年和30年窖龄的白酒窖泥微生物进行测序,得出其细菌菌群主要有8个门,13个科,16个属,优势菌门均为厚壁菌门(Firmicutes)(79%)和放线菌门(Actinobacteria)(4.9%)。张明珠等[41]采用Illumina MiSeq PE300平台测序,得出在2年窖泥样本中,优势菌门为厚壁菌门(Firmicutes),而在20、30年窖泥中增加了拟杆菌门(Bacteroidetes)、互养菌门(Synergistetes)。
除了窖泥微生物多样性的研究外,入窖发酵过程中菌群结构的演替规律也是研究的重点。TAO Y等[42]通过高通量测序分析窖泥原核微生物菌群结构的变化情况,并结合pH和酸度等理化指标,提出了一个三阶段菌群变化模型来描述窖泥的成熟过程。WANG Q等[43]采用Illumina NovaSeq 6000测序平台分析白酒小曲样品在入窖发酵7 d内原核微生物菌群的变化情况,结果发现,酿造2 d内以魏斯氏菌(Weissella)和不明立克次体菌属(unidentified Rickettsiales)为优势菌,3 d以乳杆菌属(Lactobacillus)为优势菌,直至酿造结束。同时,研究发现乳酸杆菌属(Lactobacillus)会产生大量乳酸[44],形成高酸低氧的环境,为优势菌群结构的形成提供条件,进而促进窖泥成熟。因此,该研究揭示了小曲白酒酿造过程中微生物群落的多样性,为研究小曲白酒酿造过程中微生物演替规律提供了理论基础,从而促进小曲白酒产业的发展。
目前,窖泥主要以时间、感官、产酒量等指标来评价其品质优劣。这些指标主要以经验来评判,没有明确的标准和数据,并且产酒量受窖池的位置、维护和状态等因素影响,限制了白酒窖泥的研究[45]。随着高通量测序技术被应用于白酒微生物的研究,得到白酒窖泥菌群种属等详细的微生物信息,该结果也可作为窖泥品质优劣的参考依据,丰富窖泥的评价指标,并为培养优质人工窖泥技术提供一定的理论基础,对白酒微生物多样性的研究具有重要意义[46]。
2.1.5 酿造环境中微生物多样性分析
在白酒酿造过程中,通过高通量测序技术分析环境微生物,探究其对酿造菌群结构及其演替规律的影响,并调控环境因素使菌群向着有利的方向发展。左乾程等[47]在堆积发酵过程中,采用Illumina MiSeq测序分析未发酵的酒醅、酒曲和环境样品的细菌菌群结构,结果发现,在属水平上,酒醅中有19个细菌属来源于环境(31.67%),30个细菌属来源于酒曲(50%),环境优势细菌属是氧化葡糖杆菌(Gluconobacter),并发现环境和酒醅的优势细菌属具有较高相似性。该研究通过测序得到环境和酒醅中共有或特有的微生物,证实了环境微生物对白酒菌群多样性有重要影响。在相似研究中,黎瑶依等[48]采用Illumina MiSeq PE300平台对酱香型白酒在不同酿造轮次中环境真菌菌群进行研究,得出在7个发酵轮次的环境样品中有相同真菌属56个,但标志性真菌属存在差异,节担菌属(Wallemia)、复膜孢酵母属(Saccharomycopsis)是各轮次的优势真菌属,揭示了不同轮次的酱香型白酒酿造环境中微生物菌群多样性。在高通量测序技术与多种技术相结合的研究中,WANG X S等[49]采用Illumina Miseq高通量测序结合气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)技术得到微生物菌群结构及其代谢产物含量,并利用Source Tracker软件来判断环境微生物对白酒发酵的贡献程度,结果发现,环境微生物对细菌群落贡献率为62.61%~90.90%,真菌群落贡献率为20.00%~38.94%,表明环境菌群是发酵菌群的重要来源,对白酒发酵过程中的微生物演替和代谢具有重要影响。
2.2 不同香型白酒中微生物多样性的应用
近年来,高通量测序技术在不同香型白酒的研究中得到了越来越多的关注,包括白酒的香型类别、优势菌群和高通量测序平台(见表2)。白酒的香型类别受酿造工艺、生产原料和发酵剂种类等因素的影响,这些因素决定了白酒微生物的多样性[50]。此外,不同的微生物会代谢产生特殊的风味物质,其组成和含量差异较大,进而酿造出不同香型的白酒[51]。对于风味物质,白酒中含有酯类、醇类和酸类等多种风味物质[52-54]。其中,己酸是浓香型白酒主体香味己酸乙酯的前体物质[55-56],ZHU X Y等[57]通过Illumina MiSeq测序技术对富含己酸盐的浓香型白酒窖泥进行研究,鉴定出产己酸盐的微生物属于梭菌簇IV(clostridium cluster IV),该研究揭示己酸盐的形成过程,对追溯白酒风味物质来源具有重要意义。然而,不是所有的风味物质都有利于白酒品质,过高的酸度和高级醇含量会抑制根霉属(Rhizopus)、芽孢杆菌属(Bacillus)和曲霉属(Aspergillus)微生物的生长繁殖[58]。有研究发现,利用高通量测序技术筛选产高级醇含量低的酿酒酵母微生物,用于建立特异性发酵剂,能降低白酒中高级醇和酸度的含量,进而提高白酒的风味品质[59]。
表2 高通量测序技术在不同香型白酒优势菌群中的应用情况
Table 2 Application of high-throughput sequencing technology in dominant microflora of different flavors of Baijiu production

在不同香型白酒中,其风味物质的组成和含量差异较大,运用多种检测技术确定白酒的风味物质,并结合高通量测序得到微生物菌群信息,有利于阐明微生物与风味物质之间的联系,促进不同香型的白酒微生物多样性的研究。在酱香型白酒中,CAI W C等[60]采用高通量测序技术,结合能模仿人类嗅觉和味觉的电子舌(electronictongue,E-tongue)、电子鼻(electronic nose,E-nose),从酱香型白酒的口感和香气方面识别出整体的风味信息,结果得出3种高温大曲的香气主要受曲霉属(Aspergillus)、绵毛嗜热丝孢菌属(Thermomyces)和嗜热子囊菌属(Thermoascus)等优势真菌的影响,并且真菌菌群与白酒感官相关性显著,有利于阐明微生物与风味物质之间的联系。王琪等[61]利用不同工艺来培养浓香型白酒窖泥微生物,并通过高通量测序技术(Illumina Miseq)测定其微生物菌群结构。结果表明,在优化工艺下,驯化后的微生物菌群多样性降低,其优势菌群是具有降乳酸能力的梭菌属(Clostridium),并测得己酸浓度较初始浓度提高了289.20%,乳酸利用率最高达41.25%,有效降低了乳酸含量和提高己酸含量,促使酒体香味协调。DENG Y K等[62]采用高通量测序技术和气相色谱-质谱联用分析大曲发酵过程中的微生物和风味物质,得出优势细菌属为假单胞菌属(Pseudomonas)、魏斯氏菌属(Weissella)和芽孢杆菌属(Bacillus),优势真菌属为链格孢属(Alternaria)、根霉属(Rhizopus)和毕赤酵母属(Pichia),并检测到有32种差异显著的风味物质。结果表明,糖多孢菌属(Saccharopolyspora)和12种差异代谢物显著相关,根毛霉属(Rhizomucor)和13种不同的挥发性代谢物之间呈正相关。
总的来说,利用高通量测序技术对白酒微生物菌群结构进行分析,结合气相色谱-质谱联用等测定风味物质的技术,得到微生物与风味物质之间的相关性,致力于揭示白酒风味物质的形成和改变的原因,有利于开发出独特香型或多种香型结合的白酒,促进白酒产业的发展。
3 结论与展望
在白酒微生物研究中,高通量测序技术对鉴定微生物门和属、明确酿造过程中菌群结构的动态变化、丰富白酒微生物基因序列信息库,以及发现未知微生物等方面发挥重要作用,并且该技术弥补了传统微生物培养方法的众多缺陷。高通量测序技术结合多组学和气相色谱-质谱联用等多种分析检测技术,并运用聚类分析和主成分分析等多种统计学分析方法,揭示微生物菌群结构、环境因素及其代谢物质的联系。研究结果阐明白酒微生物菌群之间的相互作用,有目的地调控微生物菌群结构和白酒风味特性,酿造出更多风味香型的白酒,满足消费者对口感和风味的需求。
随着高通量测序技术的不断发展,该测序技术将以更高的准确率和更详细的生物学信息,应用于更多的微生物多样性研究。目前,白酒产业的发展主要是优化酿造工艺和提高风味品质。其次,我国也越来越重视食品中营养物质的含量,通过高通量测序技术,分析出能代谢产生人体健康物质的微生物种类,并对其富集培养来提高白酒的价值,也是今后发展的重点方向。
[1]田德雨,闫子茹,危晶晶,等.清香型白酒酿造微生物和风味物质的研究进展[J].中国酿造,2021,40(4):20-25.
[2]章肇敏,吴生文.特香型白酒酿造工艺分析[J].中国酿造,2012,31(5):164-167.
[3]尹雅洁,王晓军,姜欣,等.多粮清香型白酒酿造工艺的优化[J].食品与发酵工业,2021,47(19):140-145.
[4]张超,李俊薇,刘占奇,等.浓香型白酒窖泥中一株产己酸功能菌的研究[J].酿酒科技,2019(12):50-53.
[5]宋连宝.白酒窖泥中细菌微包埋培养的研究[D].哈尔滨:黑龙江大学,2016.
[6]HE G Q,LIU T J,SADIQ F A,et al.Insights into the microbial diversity and community dynamics of Chinese traditional fermented foods from using high-throughput sequencing approaches[J].Journal of Zhejiang University-Science B,2017,18(4):289-302.
[7]刘雪婷,王子媛,刘继明,等.清香型白酒酒醅发酵菌株分离鉴定及细菌群落结构分析[J].中国酿造,2021,40(1):39-43.
[8]张丁予,章婷曦,王国祥.第二代测序技术的发展及应用[J].环境科学与技术,2016,39(9):96-102.
[9]崔玉娟.基因测序技术在食品安全检测中的应用[J].食品安全导刊,2021(23):173-174.
[10]梁欢,许长峰,唐伟斌,等.泥坑浓香型白酒窖泥中微生物群落结构与多样性分析[J].现代农业科技,2021(3):203-206,220.
[11]米其利,李雪梅,管莹,等.高通量测序在食品微生物生态学研究中的应用[J].食品科学,2016,37(23):302-308.
[12]蔡凤娇,蒋燕明,饶建军,等.白酒酿造微生物分析方法研究进展[J].食品研究与开发,2021,42(18):211-218.
[13]郑艺,张家超,郭壮,等.基于高通量测序技术分析肠道菌群及其影响因素的研究进展[J].中国食品学报,2014,14(11):157-164.
[14]LIU L,LI Y H,LI S L,et al.Comparison of next-generation sequencing systems[J].J Biomed Biotechnol,2012,2012:https://doi.org/10.1155/2012/251364.
[15]OZSOLAK F.Third-generation sequencing techniques and applications to drug discovery[J].Expert Opin Drug Discov,2012,7(3):231-243.
[16]QUAIL M A,SMITH M,COUPLAND P,et al.A tale of three next generation sequencing platforms: comparison of Ion Torrent,Pacific Biosciences and Illumina MiSeq sequencers[J].BMC Genomics,2012,13(1):1-13.
[17]吴成,王春晓,王晓丹,等.高通量测序技术在酿酒微生物多样性研究中的应用[J].食品科学,2019,40(3):348-355.
[18]杨晓玲,施苏华,唐恬.新一代测序技术的发展及应用前景[J].生物技术通报,2010(10):76-81.
[19]REGINA T,VOLKER D.Recent advances in single-molecule sequencing[J].Curr Opin Biotech,2010,21(1):4-11.
[20]SCHADT E E,TURNER S,KASARSKIS A.A window into third-generation sequencing[J].Hum Mol Genet,2010,19(R2):R227-R240.
[21]曹晨霞,韩琬,张和平.第三代测序技术在微生物研究中的应用[J].微生物学通报,2016,43(10):2269-2276.
[22]万兵.酱香型白酒酿造过程中酿酒酵母和面包乳杆菌交互作用机制解析[D].无锡:江南大学,2022.
[23]麻颖垚.宏基因组学对酱香型白酒第四轮次窖内发酵微生物代谢通路的研究[D].贵阳:贵州大学,2020.
[24]WANG L,WANG Y Y,WANG D Q,et al.Dynamic changes in the bacterial community in Moutai liquor fermentation process characterized by deep sequencing[J].J I Brewing,2015,121(4):603-608.
[25]陈彬,何宏魁,刘国英,等.大小曲及发酵方式对清香型白酒风味的影响[J].食品与发酵工业,2018,44(8):166-171.
[26]杨旭,马歌丽,王光路,等.高通量测序解析白酒中高温大曲细菌和真菌群落结构[J].中国酿造,2020,39(6):119-123.
[27]李静心,王艳丽,何宏魁,等.基于高通量测序技术解析高温大曲和中高温大曲的真菌群落结构[J].食品与发酵工业,2018,44(12):52-59.
[28]JIANG Q N,WU X Y,XU Y Q,et al.Microbial composition and dynamic succession during the Daqu production process of Northern Jiang-flavored liquor in China[J].3 Biotech,2021,11(5):224.
[29]林钰宽,吴生文,游勇,等.不同培曲工艺对特香型大曲微生物群落结构的影响[J].食品与发酵工业,2022,48(6):188-194.
[30]王晓丹,陈美竹,班世栋,等.茅台大曲中酵母的分离、鉴定及其功能初探[J].食品科学,2017,38(4):51-57.
[31]张建敏,杨康卓,刘芳,等.一株产香假丝酵母的筛选及其特征代谢风味物质分析[J].酿酒科技,2020(12):34-37,43.
[32]王宇良,李志溥,苏泽佳,等.不同制曲方式对豉香型白酒酒曲理化因子及细菌群落的影响[J/OL].食品科学:1-12[2023-03-10].http://kns.cnki.net/kcms/detail/11.2206.TS.20221229.1905.008.html
[33]曹敬华,张明春,朱正军,等.圆盘制曲机在浓酱兼香型白酒生产中的应用[J].中国酿造,2017,36(1):70-74.
[34]张静,陈臣,孙骏飞,等.十里香酒酒醅发酵过程中风味物质的变化及菌群分类学组成的研究[J].酿酒,2020,47(3):36-38,43.
[35]赵才贤.酱香型白酒大曲和酒醅的微物群落结构特征及其变化规律研究[D].贵阳:贵州大学,2021.
[36]曹润洁,何宏魁,葛向阳,等.芝麻香型酒醅堆积过程中微生物结构变化分析[J].微生物学通报,2019,46(6):1371-1380.
[37]王雪山,杜海,徐岩.清香型白酒发酵过程中微生物种群空间分布[J].食品与发酵工业,2018,44(9):1-8.
[38]崔竞松,薛慧,王兰兰,等.LEDA:一种基于Levenshtein距离的DNA序列拼接算法[J].武汉大学学报(理学版),2022,68(3):271-278.
[39]邓杰.基于高通量测序的浓香型白酒窖泥微生物群落结构研究[D].自贡:四川理工学院,2015.
[40]邓杰,黄治国,卫春会,等.基于高通量测序的浓香型白酒窖池细菌群落结构分析[J].现代食品科技,2015,31(7):50-55.
[41]张明珠,吴学凤,穆冬冬,等.基于高通量测序的窖泥原核微生物群落结构及其理化因子相关性分析[J].食品科学,2021,42(18):111-118.
[42]TAO Y,LI J B,RUI J P,et al.Prokaryotic communities in pit mud from different-aged cellars used for the production of Chinese strong-flavored liquor[J].Appl Environ Microbiol,2014,80(7):2254-2260.
[43]WANG Q,WANG C Y,XIANG X Q,et al.Analysis of microbial diversity and succession during Xiaoqu Baijiu fermentation using high-throughput sequencing technology[J].Eng Life Sci,2022,22(7):495-504.
[44]ZHANG M Z,WU X F,MU D D,et al.Profiling the effects of physicochemical indexes on the microbial diversity and its aroma substances in pit mud[J].Lett Appl Microbiol,2020,71(6):667-678.
[45]高占争,吴正云,张文学.浓香型白酒窖泥微生物群落研究进展[J].中国酿造,2020,39(6):1-7.
[46]郭小蛟,唐玉明,任道群,等.培养原料种类的减少对人工窖泥发酵剂菌群结构的影响[J].中国酿造,2020,39(9):157-162.
[47]左乾程,黄永光,朱家合,等.清酱香型白酒冬季发酵细菌群落演替及堆积过程细菌来源解析[J].食品科学,2021,42(12):145-152.
[48]黎瑶依,胡小霞,黄永光.茅台镇酱香型白酒酿造环境中真菌菌群多样性分析[J].食品科学,2021,42(18):164-170.
[49]WANG X S,DU H,ZHANG Y,et al.Environmental microbiota drives microbial succession and metabolic profiles during Chinese liquor fermentation[J].Appl Environ Microbiol,2017,84(4):e02369-17.
[50]朱开宪,胡雪,邓静,等.基于GC-MS技术对不同香型白酒的判别分析[J].中国酿造,2023,42(1):213-218.
[51]HE G Q,HUANG J,ZHOU R Q,et al.Effect of fortified Daqu on the microbial community and flavor in Chinese strong-flavor liquor brewing process[J].Front Microbiol,2019,10:56.
[52]赵东瑞,张丽末,张锋国,等.固相微萃取、液液萃取结合气相色谱-质谱法分析芝麻香型白酒中的含硫化合物[J].食品科学,2016,37(22):99-106.
[53]刘凡,仇钰莹,周新虎,等.洋河浓香型白酒酒醅中产酸细菌与有机酸合成的相关性研究[J].食品与发酵工业,2018,44(12):22-29.
[54]LI X R,MA E B,YAN L Z,et al.Bacterial and fungal diversity in the traditional Chinese liquor fermentation process[J].Int J Food Microbiol,2011,146(1):31-37.
[55]赵辉,敞颜,王葳,等.浓香型白酒窖泥中高产己酸兼性厌氧细菌的分离鉴定[J].食品科学,2012,33(5):177-182.
[56]LIU M K,TANG Y M,GUO X J,et al.Deep sequencing reveals high bacterial diversity and phylogenetic novelty in pit mud from Luzhou Laojiao cellars for Chinese strong-flavor Baijiu[J].Food Res Int,2017,102:68-76.
[57]ZHU X Y,TAO Y,LIANG C,et al.The synthesis of n-caproate from lactate: a new efficient process for medium-chain carboxylates production[J].Sci Rep,2015,5(1):1-9.
[58]韩国强,孙协平,吴鹏飞,等.基于高通量测序分析复配小曲白酒发酵过程中微生物群落结构及多样性[J].食品科学,2021,42(18):80-85.
[59]WANG C X,TANG J D,QIU S Y.Profiling of fungal diversity and fermentative yeasts in traditional Chinese Xiaoqu[J].Front Microbiol,2020,11:2103.
[60]CAI W C,XUE Y A,WANG Y R,et al.The fungal communities and flavor profiles in different types of high-temperature Daqu as revealed by high-throughput sequencing and electronic senses[J].Front Microbiol,2021,12:3591.
[61]王琪,李一关,许长山,等.窖泥中降乳增己菌群的驯化及其在白酒发酵中的应用[J].食品与发酵工业,2020,46(24):167-174.
[62]DENG Y K,HUANG D,HAN B L,et al.Correlation: Between autochthonous microbial diversity and volatile metabolites during the fermentation of Nongxiang Daqu[J].Front Microbiol,2021,12:688981.
[63]谭崇尧,徐军.高通量测序法对不同地域浓香型大曲微生物结构的分析[J].酿酒科技,2018(9):118-122.
[64]唐清兰,周利,徐姿静.浓香型白酒大曲制曲过程真菌群落结构变化的研究[J].酿酒科技,2021(9):27-30,35.
[65]李斌,闫志鹏,李慧星,等.基于高通量测序技术的浓香型和芝麻香型白酒酒曲细菌群落结构分析[J].中国酿造,2018,37(8):148-152.
[66]LIN B,TANG J,YANG Q,et al.Microbial succession and its effect on key aroma components during light-aroma-type Xiaoqu Baijiu brewing process[J].World J Microb Biot,2022,38(10):166.
[67]胡晓龙,王康丽,余苗,等.浓香型酒醅微生物菌群演替规律及其空间异质性[J].食品与发酵工业,2020,46(10):66-73.
[68]韩兴林,崔磊,常强,等.浓香白酒发酵过程中酒醅微生物结构分析[J].酿酒,2021,48(1):81-86.
[69]唐贤华.高通量测序技术初步解析浓香型白酒窖泥细菌群落结构[J].中国酿造,2020,39(1):160-164.
[70]王春艳,宋建阳,吕慧鑫,等.基于高通量测序的宋河浓香型白酒不同窖龄窖泥细菌群落结构分析[J].中国酿造,2019,38(9):163-166.
[71]王春艳,付博辰,郭书贤,等.宋河浓香型白酒不同窖龄窖壁泥与窖底泥真菌菌群结构分析[J].中国酿造,2021,40(2):88-91.
[72]郭莹,惠明,田青,等.新老窖泥细菌群落结构差异及其对基酒主要香味成分的影响[J].河南师范大学学报(自然科学版),2021,49(2):63-69.
[73]ZHENG Q,LIN B R,WANG Y B,et al.Proteomic and high-throughput analysis of protein expression and microbial diversity of microbes from 30-and 300-year pit muds of Chinese Luzhou-flavor liquor[J].Food Res Int,2015,75:305-314.
[74]陈申习,宿智新,张磊,等.基于高通量测序的清香型和酱香型酒曲真菌群落特征研究[J].中国酿造,2021,40(7):49-53.
[75]张双燕,廖永红,纪南,等.基于高通量测序技术分析北京清香型大曲微生物多样性[J].中国酿造,2016,35(11):49-53.
[76]刘雪婷,王子媛,刘继明,等.清香型白酒酒醅发酵菌株分离鉴定及细菌群落结构分析[J].中国酿造,2021,40(1):39-43.
[77]黄怡,邓晓茜,钟吉安,等.石花清香型白酒大茬和二茬酒醅真菌类群的比较[J].中国酿造,2021,40(9):87-91.
[78]李欣,王彦华,林静怡,等.高通量测序技术分析酱香型白酒酒醅的微生物多样性[J].福建师范大学学报(自然科学版),2017,33(1):51-59.
[79]TANG J,TANG X X,TANG M,et al.Analysis of the bacterial communities in two liquors of soy sauce aroma as revealed by high-throughput sequencing of the 16S rRNA V4 hypervariable region[J].BioMed Res Int,2017,2017:6271358.
[80]XIE M W,LV F X,MA G X,et al.High throughput sequencing of the bacterial composition and dynamic succession in Daqu for Chinese sesame flavour liquor[J].J I Brewing,2020,126(1):98-104.
[81]KANG J M,ZHENG X W,YANG X,et al.Contrasting summer versus winter dynamic microbial communities and their environmental driving factors in the solid-state saccharification process of Fuyu-flavor Baijiu[J].Food Res Int,2022,154:111008.
[82]黄莹娜,熊小毛,胡远亮,等.基于PCR-DGGE和高通量测序分析白云边酒窖泥细菌群落结构与多样性[J].微生物学通报,2017,44(2):375-383.