高级醇是白酒的重要风味物质,其含量的高低会影响白酒的品质和饮用舒适度。异戊醇是白酒主要的高级醇之一,适量的异戊醇可以使酒体醇厚,并可在乙酰基转移酶作用下与乙酸形成乙酸异戊酯,赋予酒体幽雅的香味[1-2]。如果白酒中异戊醇的含量过高,会使酒体口感苦涩。此外,异戊醇在人体中氧化需要的时间比乙醇更长,因此异戊醇在人体中留存时间长,增加了饮用白酒后出现“上头”、“易醉”的风险[3]。适度减控白酒发酵过程中异戊醇的合成利于减少消费者饮用白酒后的不适感,提高白酒的饮用舒适度。本文系统阐述了白酒发酵过程中异戊醇的合成途径、与异戊醇合成相关的微生物和影响异戊醇合成的因素,并对在发酵过程中减控异戊醇合成和积累的策略进行了综述,以期为解析白酒发酵过程中异戊醇合成与积累机制和实现异戊醇的工业减控提供参考。
1 白酒发酵过程中异戊醇主要合成途径
目前的研究表明,白酒发酵过程中异戊醇的合成途径有两条:分别是氨基酸分解代谢途径(Ehrlich途径)和氨基酸合成代谢途径(Harris途径)(见图1)。Ehrlich途径是缬氨酸或亮氨酸在氨基转移酶的催化作用下生成α-酮酸(α-酮异戊酸/α-酮异已酸),α-酮酸进一步在脱羧酶的作用下生成异戊醛,再经醇脱氢酶还原成异戊醇[4-8]。Harris途径是指葡萄糖经过糖酵解途径(embden meyerhof pathway,EMP)生成丙酮酸,丙酮酸在乙酰乳酸合酶(acetolactate synthase,ALS)(ILV2编码)、乙酰羟酸还原异构酶(acetohydroxyacid reductoisomerase,AHRI)(ILV5编码)和二羟酸脱水酶(di hydroxyacid dehydratase,DHAD)(ILV3编码)的作用下生成α-酮异戊酸,α-酮异戊酸在2-异丙基苹果酸合成酶(2-isopropylmalate synthase,IPMS)(LEU4编码)、3-异丙基苹果酸脱水酶(3-isopropylmalate dehydratase,IPMD)(LEU1编码)和3-异丙基苹果酸脱氢酶(3-isopropylmalate dehydro genase,IPMDH)(LEU2编码)的作用下生成α-酮异己酸。当体系中氨基供应不足时,α-酮异己酸则通过脱羧、还原反应生成异戊醇[9]。
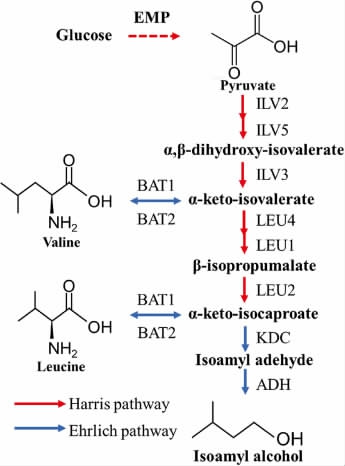
图1 异戊醇的微生物合成途径[10]
Fig.1 Microbial synthesis pathways of isoamyl alcohol
ILV2:线粒体乙酰乳酸合酶;ILV5:羟酸还原异构酶;ILV3线粒体二羟酸脱水酶;LEU4:2-异丙基苹果酸合酶;LEU1:3-丙基苹果酸水解酶;LEU2:3-异丙基苹果酸脱氢酶;KDC:酮酸脱羧酶;ADH:醇脱氢酶;BAT1/BAT2:支链氨基酸转氨酶。
微生物合成高级醇的原因主要是它们在氨基酸代谢过程中产生了多余碳骨架,即α-酮酸。在微生物的生长阶段,由于合成代谢旺盛需要消耗大量的氨基酸来合成蛋白质。如果环境中的氨基酸供应不能完全满足其对蛋白质合成的需求,则需要无机氮源或其他氨基酸提供氨基,并利用碳代谢合成亮氨酸碳骨架来合成所需的亮氨酸。当其合成的碳骨架过量而氨基供给有限时,前者流入合成异戊醇的代谢通路,这就是微生物通过Harris途径合成异戊醇的代谢机制。如果环境中亮氨酸或缬氨酸含量高,而其他氨基酸含量较低时,微生物可将亮氨酸和缬氨酸作为氮源并通过转氨获得氨基,剩余的碳骨架则通过Ehrlich途径合成异戊醇。
2 与异戊醇合成相关的微生物
白酒发酵过程中异戊醇的合成与多种微生物的代谢相关。研究表明,酵母属(Saccharomyces)、毕赤酵母属(Pichia)、威克汉姆酵母属(Wicherhamomyces)、Naumovozyma、念珠菌属(Candida)、Kazachstania、德巴利酵母属(Debaryomyces)、有孢圆酵母属(Torulaspora)、克鲁维酵母属(Kluyveromyces)等的代谢通路中都有异戊醇合成代谢途径[10-13]。来源于清香型白酒大曲的酿酒酵母(Saccharomyces cerevisiae)、库德毕赤酵母(Pichia kudriavzevii)及分离自白云边发酵体系的膜醭毕赤酵母(Pichia membranifaciens)、盔状毕赤酵母(Pichia galeiformis)均可以合成异戊醇,但它们合成异戊醇的水平存在较大差异[14-15]。分离自浓香型白酒酿造环境中的季也蒙迈耶氏酵母(Meyerozyma guilliermondii)、发酵毕赤酵母(Pichia fermentans)、卡斯特利纳氏酵母(Naumovozyma castellii)和汉逊德巴利酵母(Debaryomyces hansenii)都具有合成异戊醇的能力,其中D.hansenii合成能力最强[16-18]。在白酒混菌发酵体系中,除了酵母菌之外的其他微生物也能直接或参与合成异戊醇。如毛霉属(Mucor)、拟青霉属(Paecilomyces)等可利用高粱浸出液合成少量异戊醇[19],黄曲霉(Aspergillus flavus)利用淀粉、蔗糖等原料可合成微量的异戊醇[20],棘孢木霉(Trichoderma asperellum)的挥发性次级代谢产物中也含有异戊醇[21]。此外,芽孢杆菌、乳酸菌等多种细菌参与了异戊醇的形成[10,22],其中乳杆菌属(Lactobacillus)、片球菌属(Pediococcus)、链球菌(Streptococcus)等具有合成异戊醇的能力,但它们合成异戊醇的水平不足酵母菌的10%[10,23-24]。有研究证实,来自窖泥的互营球菌属(Syntrophococcus)、丁酸梭菌(Clostridium butyricum)等细菌也能合成异戊醇[25-26]。
在浓香型白酒发酵过程中,异戊醇主要由酵母菌体蛋白质经微生物代谢生成。浓香型白酒的发酵初期是异戊醇的主要合成时期(1~7 d)[27],酵母菌是最主要的合成微生物。这也符合微生物在酒醅中演替和代谢的规律,发酵初期酒醅优势真菌大多为酵母菌,包括Saccharomyces、伊萨酵母属(Issatchenkia)、Candida、汉逊酵母属(Hansenula)等[28-29],它们大都具备完整的异戊醇合成代谢途径。其中,S.cerevisiae和P.kudriavzevii是浓香型白酒发酵前期异戊醇合成主要菌株,且S.cerevisiae主要通过Harris途径合成异戊醇,而P.kudriavzevii主要通过Ehrlich途径合成异戊醇[10]。浓香型白酒的发酵中期(14~21 d)是异戊醇合成的第二阶段,此时异戊醇的合成量相对较低,合成异戊醇的主要微生物并不明确。研究表明,在发酵14 d之后,Lactobacillus属微生物的Ehrlich途径关键基因BAT表达量相对较高,而Saccharomyces、Naumovozyma的微生物异戊醇合成途径下游基因PDC、ADH表达量都较高,这表明是前者为后两者提供了异戊醇合成前体,即Lactobacillus与酵母菌协同生成异戊醇[10]。
3 影响酵母菌合成异戊醇的因素
白酒发酵过程是一个复杂的物质能量交换过程,来源于曲、环境或窖泥的微生物在发酵池或发酵容器中实现能量与物质的交换,微生物群落结构不断演替[30]。随着发酵体系中营养物质和环境条件的变化,这种物质交换始终处于动态平衡,而这种物质能量交换过程也影响着白酒的风味物质。因此,白酒发酵过程体系中环境因素的改变、营养物质含量的变化以及微生物的相互作用等都会对酵母的生长和代谢产生影响,进而影响酵母合成异戊醇的能力。
3.1 环境因素和营养物质对酵母合成异戊醇的影响
在白酒的发酵过程中,酒醅中的温度、酸度等环境因素的改变会影响酵母菌的生长代谢活动[31-33]。白酒窖内的发酵温度随着发酵的进行动态变化,当窖内温度较低为20℃时,酵母菌的生长不受影响,但异戊醇的合成水平较高,这可能是因为较低的温度延长了酵母菌代谢异戊醇的时间。升高发酵温度,拜耳接合酵母(Zygosaccharomyces bailii)异戊醇的合成量下降了47.6%[34]。当发酵温度升至36 ℃时会使酵母过早衰亡,此时异戊醇的合成量最低[35-36]。随着白酒发酵的进行,乳酸菌、芽孢杆菌等细菌代谢产酸,提高了窖内酸度,一定程度上抑制了酵母菌的生长代谢,可以减少异戊醇的合成[37]。白酒生产中量水或稻壳的添加量都会影响窖内溶氧量,而酵母是兼性厌氧菌,窖内的溶氧会影响酵母的生长,进而影响异戊醇的合成量[38]。
白酒窖内还原糖、淀粉、粗蛋白、氨基酸态氮等营养物质含量的变化与异戊醇的含量显著相关[31],且发酵体系中的碳氮比(C/N)是影响高级醇(以异丁醇、异戊醇总量计)合成量的关键因素[39]。在酒精发酵过程中多糖的水解速度和发酵糖的释放速度影响高级醇的合成量,如玉米、菜籽、黑麦的水解反应液中葡萄糖的含量越高,馏出液中高级醇的含量也会越高[40]。酵母可同化氮(yeast assimilable nitrogen,YAN)是指能够被酵母利用的含氮物质,主要包括α-氨基酸(除脯氨酸外)、小分子多肽等[41]。白酒发酵过程中,可同化氮既会影响酵母的生长也会影响酵母的氮代谢[42-43],故在白酒发酵过程中添加氮源能有效的降低酒醅中异戊醇的含量。另外,在黄酒、高粱汁糖化液、合成葡萄汁培养基等酒精发酵体系中添加氮源,均可不同程度地降低体系中异戊醇的合成水平[44-46]。因此,在白酒发酵过程中通过添加糖化酶、α-淀粉酶和蛋白酶等酶制剂调整白酒发酵体系中还原糖和游离氨基酸的含量以控制白酒发酵体系中的C/N,可以降低白酒中异戊醇的含量[47]。
3.2 微生物相互作用对酵母合成异戊醇的影响
固态白酒发酵体系是混菌发酵体系,菌株之间通过相互作用影响白酒中异戊醇的合成水平。浓香型白酒发酵的前期,优势酵母菌包括S.cerevisiae、N.castellii、P.fermentans、德氏乳杆菌(T.delbrueckii)、P.membranifaciens、腐殖假丝酵母(Candida humilis);优势细菌包括芽孢杆菌属(Bacillus)、Lactobacillus、魏斯氏菌属(Weissella)等[48,49],这些微生物会通过菌株间的互作影响酵母合成异戊醇。地衣芽孢杆菌(Bacillus licheniformis)、巴氏醋杆菌(Acetobacter pasteurianus)等菌株与S.cerevisiae共培养时,发酵体系中异戊醇的含量相对于单菌发酵有着显著提高[50-51]。植物乳杆菌(Lactobacillus plantarum)JMRS4 对P.kudriavzevii MJ14合成异戊醇也有促进作用[52]。另外,细菌的代谢产物可影响酵母合成异戊醇的水平。在高粱汁培养基中添加L.plantarum发酵上清液,异戊醇的合成量降低了8.4%[53]。己酸菌的代谢产物会抑制S.cerevisiae MY-15合成异戊醇,可能是因为己酸菌的代谢产物影响了S.cerevisiae MY-15的糖酵解、氨基酸生物合成途径,降低了S.cerevisiae MY-15合成异戊醇水平[54]。
霉菌与酵母之间的相互作用也会影响酵母合成异戊醇的水平。来源于酱香型白酒发酵体系的米曲霉(Aspergillus oryzae)XJ10与S.cerevisiae MT1-1共同接入高粱培养基时,发酵液中异戊醇的含量提高了4~100倍不等[55],这可能是因为Aspergillus水解原料中淀粉的同时增加了发酵体系中还原糖的含量,促使酵母利用葡萄糖合成了更多的异戊醇[10]。除此之外,两个不同种属的酵母也会通过相互作用影响发酵体系中异戊醇的合成量。在粟酒裂殖酵母(Schizosaccharomyces pombe)Scc7和B.licheniformis LS9共培养体系中添加东方伊萨酵母(Issatchenkia orientalis)Z1后,体系中异戊醇的含量增加了46.44倍[56]。将S.cerevisiae与异常毕赤酵母(Pichia anomala)共同接入麸皮汁培养基发酵一段时间后,发酵液中异戊醇的含量相较于S.cerevisiae单独培养时提高了2倍[57]。大多数情况下发酵体系中接种非酿酒酵母会降低体系中异戊醇的合成量。如S.cerevisiae AY15与球拟圆酵母(Torulopsis globosa)WY2共培养时异戊醇的合成量降低了19.07%[58]。P.kudriavzevii JN-JY-2可调控S.cerevisiae JN-JY-1在模拟白酒固态发酵体系中合成异戊醇的量,最终影响体系中异戊醇的含量[59]。
3.3 基因表达调控对酵母合成异戊醇的影响
环境变化、营养物质和微生物相互作用最终都是通过影响酵母合成异戊醇途径中相关基因的表达量来影响酵母合成异戊醇的量。编码支链氨基酸渗透酶和支链氨基酸转运酶的相关基因的表达量会影响S.cerevisiae对支链氨基酸的吸收,进而影响发酵体系中亮氨酸的含量,最终影响发酵体系中异戊醇的合成量。S.cerevisiae中的支链氨基酸渗透酶由BAP编码,异戊醇的主要合成前体亮氨酸需要在支链氨基酸渗透酶的作用下进入细胞,当该基因缺失时,亮氨酸的吸收会减少20%~50%;当该基因过表达时,异戊醇的含量会增加[60]。S.cerevisiae的转运氨基酸酶由GAP1编码,GAP1基因的表达强度会受到氨基酸含量的影响[61]。
当Harris途径中相关基因的表达量发生变化时,微生物合成异戊醇的能力也会受到影响。葡萄糖合成α-酮异戊酸会受到ILV基因表达量的影响,敲除ILV1双等位基因会使得异戊醇合成量增加57.6%[62]。由LEU1基因编码的酶可催化α-酮异戊酸和α-酮异己酸之间的转化,LEU2基因编码的β-丙基苹果酸脱氢酶可催化β-丙基苹果酸合成α-酮异己酸[63]。由BAT基因编码的S.cerevisiae的支链氨基酸转氨酶,其中BAT1基因主要负责支链氨基酸的生物合成,BAT2基因主要负责支链氨基酸的生物降解[64]。BAT1的基因表达量和氨基供给共同影响着由α-酮异己酸合成亮氨酸的含量;BAT2基因的表达量是影响S.cerevisiae合成异戊醇的关键基因[65]。在发酵体系中添加可同化氮素时,会使S.cerevisiae中BATI、GAP1基因的表达量上调,减少体系中异戊醇的合成量[44]。因此,当发酵体系中营养物质的组成发生改变时,会通过调控微生物异戊醇合成途径中相关基因的表达量影响体系中异戊醇的合成量。来源于葡萄糖或亮氨酸的α-酮异己酸在丙酮酸脱羧酶或类丙酮酸脱羧酶的作用下生成异戊醇,其中丙酮酸脱羧酶由PDC1、PDC5、PDC6编码,类丙酮酸脱羧酶由THI3和ARO10编码。THI3是调控α-酮异己酸合成异戊醇的关键酶,调整THI3基因的表达量对S.cerevisiae合成异戊醇的影响会因S.cerevisiae菌株的不同遗传背景而有所差异[66]。缺失THI3基因的S.cerevisiae经过常压室温等离子体诱变后,ILV5基因表达量上调,而ADH1基因表达量下调,使S.cerevisiae合成异戊醇的含量减少了21.5%[67]。因此,通过调整异戊醇合成途径中相关基因的表达量可以影响发酵体系中S.cerevisiae合成异戊醇的含量(见表1)。
表1 基因表达调控对酿酒酵母合成异戊醇的影响
Table 1 Effect of regulation of gene expression in Saccharomyces cerevisiae on the synthesis of isoamyl alcohol

4 异戊醇减控研究进展
白酒发酵过程中异戊醇的合成不仅与酵母菌的氨基酸代谢有关,也受多种环境因素和营养物质含量的影响。目前已报道的减控异戊醇合成策略主要包括微生物干预和优化发酵工艺两类。微生物干预是利用低产异戊醇酵母菌株代替原菌株、采用产酯酵母协同发酵以及增加发酵起始酵母菌数量等,目前常用添加商业活性干酵母改变酵母菌起始含量[76]。优化发酵工艺可以调整异戊醇合成前体含量,通常用于黄酒、果酒等发酵微生物种类较单一的酒类[9,77-79]。固态发酵白酒的发酵周期长且体系和工艺都比较复杂,可通过调控大曲、酶等调控异戊醇的前体[80-81]。另外,可通过调整发酵条件来优化发酵工艺,包括调整温度、水分、酸度等理化条件。
4.1 选育低产异戊醇菌株减少异戊醇合成
S.cerevisiae、P.kudriavzevii、Kazachstania是白酒发酵过程合成异戊醇的主要微生物[10,49,82-83]。选育低产异戊醇的酵母菌是减少单一菌种发酵酒中异戊醇合成的有效方法之一。目前已通过诱变选育和野生菌株的筛选获得了低产异戊醇的酵母菌株(见表2)。诱变育种和筛选亮氨酸缺陷型可获得有效减少异戊醇合成的菌株[9,71,84-85]。利用重氮染色平板方法筛选低乙酸异戊酯水解酶活力的突变菌株,可通过将异戊醇转化为乙酸异戊酯从而实现异戊醇的减控[86]。天然的低产异戊醇菌株的筛选常常选择一些非酿酒酵母,如扁平云假丝酵母(C.humilis)、粟酒裂殖酵母(S.pombe)、P.kudriavzevii等。这些酵母也拥有优良的发酵性能,产乙醇能力基本与普通酿酒酵母持平,且低产异戊醇,有应用于白酒发酵的潜能[87-90]。
表2 低产异戊醇酵母菌筛选
Table 2 Screening of yeast strains with low production of isoamyl alcohol

续表

4.2 利用产酯酶菌株协同发酵减少异戊醇积累
产酯酶酵母通常为非酿酒酵母,它们与酿酒酵母混合发酵时有助于合成酯类香味物质,改善酒的香气和风味。葡萄汁有孢汉逊氏酵母(Hanseniaspora uvarum)、星形假丝酵母(Candida stellata)、P.fermentans、P.membranifaciens等都是产酯酵母[91-93],这类酵母中的醇乙酰基转移酶(alcohol acetyltransferase,ATF)有利于乙酸酯类物质如乙酸乙酯、乙酸异戊酯的合成[94-95],因此也可通过选育高效合成异戊酯的菌株减少白酒中异戊醇的积累。但由于这类酵母中的部分菌株发酵能力弱、耐酒精能力差、对氧的需求高等不宜单独作为酒类的主发酵酵母,常需与酿酒酵母或多种非酿酒酵母共同发酵,在增加酯类香味物质的同时降低异戊醇的含量(见表3)。对于固态发酵则需要加大发酵起始时产酯酶酵母菌的接种量,以保证其在发酵体系中的优势地位,获得较好的异戊醇减控效果[96-97]。
表3 产酯酶菌协同发酵减控白酒发酵过程中异戊醇合成
Table 3 Reduction and control of isoamyl alcohol synthesis during Baijiu synergistic fermentation with esterase-producing strains

4.3 优化发酵工艺减少异戊醇生成
在白酒的生产过程中,通过优化发酵工艺也可以在一定程度上减少异戊醇的合成。原料、糖化酶添加量、蛋白酶添加量、曲添加量等是影响异戊醇合成的重要因素[101]。原料中的糖类和含氮物质通过影响微生物代谢而改变微生物群落,特别是还原糖丰富的发酵环境,可促进微生物的群落更替[102-103],从而影响白酒的风味。由于原料种类的差异,相同产地的浓香型白酒高级醇含量在92.6~3 536.8 mg/L之间[104-105]。通过改变原料组成可以降低异戊醇的合成水平,例如高粱发酵小曲酒的异戊醇合成水平较使用玉米、小麦等原料的低10.0%~50.0%[99,104]。这是因为高粱的蛋白质组成中亮氨酸含量较低,约为1.0 g/100 g,缬氨酸含量约为0.37 g/100 g[106],因此各类白酒都以高粱为主要发酵原料。根据原料中氮源浓度对异戊醇合成水平的影响[107],采用增加氮源或碳氮源供给的方法能达到减控异戊醇的效果,如提高α-氨基酸态氮含量可使高粱汁发酵体系中高级醇含量降低31.8%[45],添加快速氮源可使黄酒发酵体系中异戊醇含量降低23.0%~27.9%[77-78],在葡萄酒发酵体系中提高一倍以上的氮源含量也可降低异戊醇含量的40.0%~65.0%[79]。提高用曲量或添加酶制剂能使液态法发酵的大曲酒的异戊醇含量降低52.2%[108],但是此方法的效果不稳定,有时会导致异戊醇含量升高[109]。
5 结语
白酒中的微量风味成分是影响白酒整体风格的主要因素。异戊醇不仅会影响白酒的呈香,还可能影响饮用者的健康。虽然目前以酿酒酵母为主要合成微生物的异戊醇合成和积累机制是较为清楚的,但是白酒发酵过程微生物组成和物质代谢受体系中微生物组成、发酵工艺和环境因素的影响较大,今后还需更系统地解析白酒发酵过程中异戊醇的合成代谢机制。此外,目前有效的异戊醇合成减控方法主要针对采用单一菌株发酵的酒,不适用于白酒这类混菌固态发酵体系,且通过诱变或筛选的菌株可能在混菌体系中发挥的作用有限。通过优化发酵工艺条件减少异戊醇的合成也会受季节、地域的影响,其有效性和稳定性尚无法保证。因此,深入研究调控策略的内在调控机制,有利于进一步加深对白酒异戊醇形成机制的理解与解析,对研究白酒发酵过程中异戊醇合成的精准调控具有重要意义,为促进白酒生产技术革新和保障白酒品质提供重要的参考价值。
[1]马金鸣.酵母乙酸异戊酯水解酶和V型ATP酶F亚基的结构生物学研究[D].合肥:中国科学技术大学,2010.
[2]VERSTREPEN K J,LAERE S D M V,VANDERHAEGEN B M P,et al.Expression levels of the yeast alcohol acetyltransferase genes ATF1, Lg-ATF1,and ATF2 control the formation of a broad range of volatile esters[J].Appl Environ Microb,2003,69(9):5228-5237.
[3]格绒泽仁,皇甫洁,韩兴林,等.浓香型白酒饮后不适感关键高级醇类物质关联性判定新方法[J].食品与发酵工业,2019,45(14):191-195.
[4]HAZELWOOD L A,DARAN J M,VAN MARIS A J A,et al.The Ehrlich pathway for fusel alcohol production: a century of research on Saccharomyces cerevisiae metabolism[J].Appl Environ Microb,2008,74(12):3920-3920.
[5]李维青.闲话醇香[J].酿酒科技,2008(10):121-125.
[6]EHRLICH F.Concerning the conditions for fusel oil formation and concerning its connection with the protein formation of yeast[J].Ber Dtsch Chem Ges,1907,40:1027-1047.
[7]PIRES E J,TEIXEIRA J A,BRÁNYIK T,et al.Yeast:The soul of beer's aroma-a review of flavour-active esters and higher alcohols produced by the brewing yeast[J].Appl Microbiol Biotechnol,2014,98:1937-1949.
[8]SENTHESHANUGANATHAN S.The mechanism of the formation of higher alcohols from amino acids by Saccharomyces cerevisiae[J].Biochem J,1960,74(3):568-576.
[9]ZHEN D,LV M,CHEN M B,et al.Effects of a mutated yeast plus addition of sucrose and nitrogen on the total higher alcohol levels of a plum wine fermentation[J].J I Brewing,2014,120(4):571-574.
[10]田源.浓香型白酒发酵过程高级醇形成机制解析[D].无锡:江南大学,2020.
[11]卢延想,梁慧珍,陈鹏,等.高温大曲中产香酵母的筛选及特征香气分析[J].食品研究与开发,2021,42(11):167-174.
[12]张霞,雷学俊,刘芳,等.五粮液车间空气中的特征酵母菌及其挥发性风味物质分析[J].食品与发酵工业,2021,47(17):242-249.
[13]刘梦,缪礼鸿,刘蒲临,等.马克斯克鲁维酵母与酿酒酵母混合发酵对液态法黄酒风味的影响[J].食品与发酵工业,2021,47(9):160-167.
[14]张双燕.清香型白酒风味物质形成与大曲微生物相关性研究[D].北京:北京理工大学,2016.
[15]刘婷婷.白云边酒酿造微生物分析及东方伊萨酵母发酵特性研究[D].武汉:武汉工业学院,2011.
[16]游玲,蒲岚,王涛,等.1株毕赤氏属酵母的酿造特性[J].食品与发酵工业,2012,38(2):52-56.
[17]刘宇,管桂坤,万自然,等.浓香型白酒酿造环境中酵母的筛选及其组合发酵特性[J].酿酒科技,2021(10):140-144.
[18]黄治国,彭思婕,李浩,等.浓香型白酒酿造车间空气中酵母菌的分离鉴定及生长特性研究[J].食品与机械,2021,37(3):7-11.
[19]肖敏,王贵银,刘复今.高粱固态白酒发酵中菌类产生高级醇的研究[J].食品与发酵工业,1996,22(3):1-7.
[20]黄丹,方春玉,尚志超,等.一株酯化酶霉菌的分离、鉴定及代谢产物特征[J].中国酿造,2010,29(6):62-64.
[21]陶玲芸,张怡雯,李雅乾,等.棘孢木霉挥发性次级代谢产物检测及抑菌活性分析[J].生物工程学报,2020,36(6):1181-1189.
[22]HU Y L,DUN Y H,LI S A,et al.Changes in microbial community during fermentation of high-temperature Daqu used in the production of Chinese"Baiyunbian liquor"[J].J I Brewing,2017,123(4):594-599.
[23]文鹏程,曹磊,杨敏,等.牦牛曲拉源乳酸菌的产香性能比较[J].食品科学,2020,41(12):99-105.
[24]张煜晨,张丹丹,林可,等.苹果酸-乳酸发酵中乳酸菌的分离及其对葡萄酒香气成分的影响[J].食品与发酵工业,2020,46(15):84-92.
[25]徐鹏翔.泸型酒窖泥中梭菌群落发酵演替及代谢特性分析[D].无锡:江南大学,2019.
[26]马箭.泸型酒窖池丁酸菌群落结构初步解析[D].无锡:江南大学,2016.
[27]HU Y L,YANG Q,CHEN D,et al.Study on microbial communities and higher alcohol formations in the fermentation of Chinese Xiaoqu Baijiu produced by traditional and new mechanical technologies[J].Food Res Int,2021,140:109876.
[28]刘念,刘绪,张磊,等.浓香型白酒糟醅中真菌菌群的研究[J].食品与发酵科技,2011,47(2):28-31.
[29]马冰涛,范恩帝,李泽霞,等.老白干香型白酒酿造微生物菌群及其与微量成分的关系[J].食品科学技术学报,2020,38(2):20-33,40.
[30]张文学,乔宗伟,向文良,等.中国浓香型白酒窖池微生态研究进展[J].酿酒,2004,31(2):31-35.
[31]唐洁,陈申习,林斌,等.清香小曲白酒新工艺中微生物及环境因子对酒体风味变化的影响[J].食品与发酵工业,2019,45(17):40-47.
[32]邹明鑫,吴凤智,高文龙.温度控制下浓香型白酒窖池温度变化及酵母数量变化趋势研究[J].食品与发酵科技,2015,51(2):82-86.
[33]SUN Z G,WANG M Q,WANG Y P,et al.Identification by comparative transcriptomics of core regulatory genes for higher alcohol production in a top-fermenting yeast at different temperatures in beer fermentation[J].Appl Microbiol Biotechnol,2019,103:4917-4929.
[34]许焰,吴群,徐岩.酱香型白酒酿造主要功能菌株对拜耳接合酵母的作用[J].微生物学通报,2018,45(1):42-53.
[35]应静,游玲,邱树毅,等.温度对浓香型白酒发酵的影响[J].中国酿造,2018,37(8):75-81.
[36]STYGER G,JACOBSON D,BAUER F F.Identifying genes that impact on aroma profiles produced by Saccharomyces cerevisiae and the production of higher alcohols[J].Appl Microbiol Biotechnol,2011,91:713-730.
[37]PIELECH-PRZYBYLSKAK,BALCEREKM,DZIEKON′SKA-KUBCZAK U,et al.Effect of starch liberation method and initial pH of sweet mashes on higher alcohols content in distillates obtained from different starchy raw materials[J].Process Biochem,2018,73:29-37.
[38]罗惠波,苟云淩,叶光斌,等.影响白酒中高级醇生成的工艺条件研究[J].中国酿造,2011,30(8):87-90.
[39]JIANG J,LIU Y C,LI H H,et al.Modeling and regulation of higher alcohol production through the combined effects of the C/N ratio and microbial interaction[J].J Agri Food Chem,2019,67(38):10694-10701.
[40]KLOSOWSKI G,MIKULSKI D,MACKO D,et al.Influence of various yeast strains and selected starchy raw materials on production of higher alcohols during the alcoholic fermentation process[J].Eur Food Res Technol,2015,240:233-242.
[41]黄桂东,徐珊珊,刘惠,等.降黄酒高级醇无机氮源的筛选[J].食品与生物技术学报,2018,37(1):82-87.
[42]ARIAS-GIL M,GARDE-CERDÁN T,ANCÍN-AZPILICUETA C.Influence of addition of ammonium and different amino acid concentrations on nitrogen metabolism in spontaneous must fermentation[J].Food Chem,2006,103(4):1312-1318.
[43]雷宏杰.高浓麦汁氮源组成对酵母氨基酸同化及发酵调控影响的研究[D].广州:华南理工大学,2014.
[44]LIU S P,MA D L,LI Z H,et al.Assimilable nitrogen reduces the higher alcohols content of huangjiu[J].Food Control,2021,121:107660.
[45]WANG Y P,SUN Z G,ZHANG C Y,et al.Comparative transcriptome analysis reveals the key regulatory genes for higher alcohol formation by yeast at different α-amino nitrogen concentrations[J].Food Microbiol,2021,95:103713.
[46]BARBOSA C,FALCO V,MENDES-FAIA A,et al.Nitrogen addition influences formation of aroma compounds,volatile acidity and ethanol in nitrogen deficient media fermented by Saccharomyces cerevisiae wine strains[J].J Biosci Bioeng,2009,108(2):99-104.
[47]宗绪岩,边名鸿,李丽,等.生物制剂调控浓香型白酒高级醇产量[J].食品与机械,2012,28(4):5-7,46.
[48]刘凡,周新虎,陈翔,等.洋河浓香型白酒发酵过程酒醅微生物群落结构解析及其与有机酸合成的相关性[J].微生物学报,2018,58(12):2087-2099.
[49]杨建刚,苏畅,窦晓,等.泸型酒发酵过程中酵母菌演替规律及其对部分风味分子形成的影响[J].食品科学,2018,39(18):166-172.
[50]孟醒.酱香型白酒酿造来源的酿酒酵母与地衣芽孢杆菌相互作用特征及机制的初步解析[D].无锡:江南大学,2015.
[51]吴轩德,李洲,周世水.白酒酿造中酿酒酵母与巴氏醋杆菌相互作用的研究[J].现代食品科技,2017,33(12):61-67.
[52]熊君燕,李小东,谢圣凯,等.清香型白酒中乳酸菌和酵母菌的相互作用[J].微生物学通报,2017,44(8):1767-1776.
[53]张华东,韩经,魏晓庆,等.植物乳杆菌对高产酯酿酒酵母酒精发酵及酯醇代谢的影响[J].中国酿造,2019,38(11):85-89.
[54]张华东,李霄霄,任雪,等.己酸菌对高产酯酿酒酵母酒精发酵及酯醇代谢的影响[J].中国调味品,2020,45(5):83-87,99.
[55]陈笔.酱香型白酒酿造过程中霉菌群落结构以及霉菌与酵母相互作用的研究[D].无锡:江南大学,2014.
[56]王霜.产酱香功能芽孢杆菌的筛选及浓酱兼香型白酒复合功能强化曲的研究[D].武汉:武汉轻工大学,2017.
[57]唐洁,王海燕,徐岩.酿酒酵母和异常毕赤酵母混菌发酵对白酒液态发酵效率和风味物质的影响[J].微生物学通报,2012,39(7):921-930.
[58]周钰涵,崔丹瑶,闫昕,等.酿酒酵母与球拟酵母混合发酵对白酒风味物质的影响[J].食品研究与开发,2021,42(17):169-175.
[59]曲冠颐,唐洁,姜健,等.小曲清香型白酒发酵过程微生物菌群合成高级醇代谢特征[J].食品与发酵工业,2021,47(11):32-37.
[60]KODAMA Y,OMURA F,MIYAJIMA K,et al.Control of higher alcohol production by manipulation of the BAP2 gene in brewing yeast[J].J Am Soc Brew Chem,2001,59(4):157-162.
[61]DONATON M C V,HOLSBEEKS I,LAGATIE O,et al.The Gap1 general amino acid permease acts as an amino acid sensor for activation of protein kinase A targets in the yeast Saccharomyces cerevisiae[J].Mol Microbiol,2003,50(3):911-929.
[62]LI W,CHEN S J,WANG J H,et al.Genetic engineering to alter carbon flux for various higher alcohol productions by Saccharomyces cerevisiae for Chinese Baijiu fermentation[J].Appl Microbiol Biotechnol,2018,102:1783-1795.
[63]刘灿珍,秦伟帅,孙玉霞,等.酿酒酵母高级醇合成路径及关键基因[J].中国酿造,2018,37(8):9-13.
[64]COL M,HERNANDEZ F,LOPEZ K,e al. Saccharomyces cerevisiae Bat1 and Bat2 aminotransferases have functionally diverged from the ancestral-like Kluyveromyces lactis orthologous enzyme[J].PLoS One,2011,6(1):e16099.
[65]YOSHIMOTO H,FUKUSHIGE T,YONEZAWA T,et al.Genetic and physiological analysis of branched-chain alcohols and isoamyl acetate production in Saccharomyces cerevisiae[J].Appl Microbiol Biotechnol,2002,59:501-508.
[66]郝欣,肖冬光,张翠英.酿酒酵母类丙酮酸脱羧酶基因缺失对高级醇生成量的影响[J].微生物学报,2010,50(8):1030-1035.
[67]王国正,吴群,徐岩.低产高级醇酿酒酵母突变菌株的差异蛋白组分析及高级醇合成相关蛋白的差异表达[J].微生物学通报,2015,42(12):2407-2416.
[68]佐一含,朱旭东,陈叶福,等.LEU2基因敲除对工业啤酒酵母高级醇生成量的影响[J].中国酿造,2011,30(3):27-30.
[69]PARK S H,KIM S,HAHN J S.Metabolic engineering of Saccharomyces cerevisiae for the production of isobutanol and 3-methyl-1-butanol[J].Appl Microbiol Biotechnol,2014,98:9139-9147.
[70]杨青.构建基因THI3和LEU2缺失的低异戊醇工程酵母及其应用研究[D].广州:华南理工大学,2017.
[71]王鹏银,郝欣,郭学武,等.离子注入诱变选育低产高级醇酿酒酵母菌株[J].酿酒科技,2008(2):17-22.
[72]孙中贯,王孟祺,王亚平,等.GAP1基因缺失对上面发酵酵母高级醇代谢能力的影响[J].天津科技大学学报,2020,35(1):10-17.
[73]刘芳志,张翠英,李维,等.BAT基因改造对酿酒酵母高级醇生成量的影响[J].现代食品科技,2016,32(6):142-147.
[74]张雨.酿酒酵母转录差异基因敲除对高级醇生成量的影响[D].天津:天津科技大学,2020.
[75]张翠英,张艳英,齐亚楠,等.低产高级醇酿酒酵母工程菌株在小曲酒酿造中的应用[J].酿酒科技,2013(7):62-64.
[76]孙金旭.酱香型白酒发酵过程中异戊醇的控制研究[J].现代食品科技,2012,28(11):1541-1544.
[77]GODILLOT J,BACONIN C,SANCHEZ I,et al.Analysis of volatile compounds production kinetics:A study of the impact of nitrogen addition and temperature during alcoholic fermentation[J].Front Microbiol,2023,14:1124970.
[78]ZHONG X F,WANG A L,ZHANG Y B,et al.Reducing higher alcohols by nitrogen compensation during fermentation of Chinese rice wine[J].Food Sci Biotechnol,2020,29:805-816.
[79]HERNÁNDEZ-ORTE P,IBARZ M J,CACHO J,et al.Effect of the addition of ammonium and amino acids to musts of Airen variety on aromatic composition and sensory properties of the obtained wine[J].Food Chem,2005,89(2):163-174.
[80]王晓丹,庞博,陆安谋,等.酱香型白酒堆积过程中酵母变化趋势研究[J].食品工业,2014,35(12):42-44.
[81]宗绪岩,边名鸿,李丽,等.生物制剂调控浓香型白酒高级醇产量[J].食品与机械,2012(4):5-7,46.
[82]游玲,周荣清,谭壹,等.Kazachstania属酵母在浓香型白酒糟醅中的分布特征及发酵功能[J].生物技术通报,2021,37(6):108-116.
[83]LI W,WANG J H,ZHANG C Y,et al.Regulation of Saccharomyces cerevisiae genetic engineering on the production of acetate esters and higher alcohols during Chinese Baijiu fermentation[J].J Ind Microbiol Biot,2017,44(6):949-960.
[84]王国正,吴群,徐岩.低产高级醇酿酒酵母突变菌株的差异蛋白组分析及高级醇合成相关蛋白的差异表达[J].微生物学通报,2015(12):2407-2416.
[85]韩涛.啤酒酿造中高温发酵低产杂醇油酵母菌种的选育[D].天津:天津科技大学,2004.
[86]郑玲艳,杨建刚,郭学武,等.低产异戊醇清酒酵母菌株的选育[J].酿酒科技,2008(10):17-19.
[87]季方,吴建峰,袁小转,等.一种低产异戊醇、高产β-苯乙醇的酵母及其分离培养方法和应用:CN201910539397.4[P].2019-09-06.
[88]游玲,赵东,谭壹,等.高产乙酸异戊酯的酵母及其应用:CN202010879643.3[P].2020-11-17.
[89]游玲,赵东,谭壹,等.固态发酵高产乙酸异戊酯的酵母及其应用:CN 202010878649.9[P].2020-11-20.
[90]陈良强,吴群,徐岩.酱香型白酒低产杂醇油粟酒裂殖酵母特性的研究[J].工业微生物,2013(3):1-6.
[91]JOLLY N P,AUGUSYNO P H,PRETORIUS I S.2006.The role and use of non-Saccharomyces yeasts in wine production[J].S Afr J Enol Vitic,27(1):15-39.
[92]PEETERS A S.Wine:types,production and health[M].New York:Nova science publishers,2012:300-406.
[93]卜光明,周化斌,周茂洪,等.酿造酒中非酿酒酵母的研究进展[J].食品工业科技,2019,40(14):346-352.
[94]徐晓裕,万瑞琪,马延琴,等.非酿酒酵母菌的分离鉴定及产酯关键酶活性的研究[J].中国酿造,2021,40(7):58-64.
[95]徐亚男.非酿酒酵母菌的筛选及产酶研究[D].石河子:石河子大学,2016.
[96]李秋志,刘姣,王国明,等.不同添加量高产酯低产高级醇酵母菌在芝麻香白酒酿造中的作用[J].现代食品,2019(10):56-60.
[97]简晓平,简章容,余丽辰,等.1株Wickerhamomyces酵母菌对浓香型白酒发酵的影响[J].酿酒科技,2017(9):33-38.
[98]ZHANG B Q,TANG C,YANG D Q,et al.Effects of three indigenous non-Saccharomyces yeasts and their pairwise combinations in co-fermentation with Saccharomyces cerevisiae on volatile compounds of Petit Manseng wines[J].Food Chem,2022,368:130807.
[99]熊小毛,刘婷婷,杨团元,等.不同酵母菌及芽孢杆菌混合菌株液态白酒发酵特征分析[J].酿酒科技,2015(2):17-20.
[100]师俊玲,朱静.利用白地霉降低酒中高级醇含量同时提高酯类物质含量的方法:CN201310359885.X[P].2014-01-01.
[101]肖丽琼.米香型白酒苦味物质形成机理及控制措施研究[D].广州:仲恺农业工程学院,2014.
[102]LIU C C,FENG S B,WU Q,et al.Raw material regulates flavor formation via driving microbiota in Chinese liquor fermentation[J].Front Microbiol,2019,10:1520.
[103]TAN Y W,ZHONG H P,ZHAO D,et al.Succession rate of microbial community causes flavor difference in strong-aroma Baijiu making process[J].Int J Food Microbiol,2019,311:108350.
[104]黄连美,胡晓,袁宏伟,等.原料及小曲对川法小曲白酒酿造特性的影响研究[J].酿酒科技,2021(1):28-35.
[105]HE X,GACA A,JELEN′ H H.Determination of volatile compounds in Baijiu using simultaneous chromatographic analysis on two columns[J].J I Brewing,2020,126(2):206-212.
[106]吴海静,钟继仁,田晓林,等.大黄米白酒高级醇产生规律的研究[J].中国酿造,2016,35(11):99-102.
[107]董书甲.氮源对酿酒酵母代谢产物的影响[D].济南:齐鲁工业大学,2018.
[108]王亚平,邢爽,孙中贯,等.液态法大曲酒发酵过程中高级醇影响因素的研究[J].天津科技大学学报,2019,34(5):39-44.
[109]罗惠波,苟云凌,饶家权,等.酶制剂对浓香型白酒发酵过程中高级醇生成的影响[J].四川理工学院学报(自然科学版),2011,24(2):186-189.