茶叶含有丰富的儿茶素、茶黄素、茶氨酸等成分,具有助消化、抗炎症、延缓衰老等功能[1]。由于茶树在生长过程中容易遭受病虫害的侵害[2],茶农会对茶树喷洒相关农药,这可能使茶叶产生农药残留,不仅影响茶叶的品质,也将严重危害人体健康[3-4]。近两年来,我国出口欧盟的茶叶因农药残留超标而被欧盟食品饲料类快速预警系统(rapid alert system for food and feed,RASFF)通报累计26次,其中毒死蜱、氯氟氰菊酯、呋虫胺、唑虫酰胺出现频次较高。我国GB 2763—2021《食品安全国家标准食品中农药最大残留限量》[5]制定的茶叶最高残留限量(maximum residue limit,MRL)远不如欧盟[6]严格,如毒死蜱的MRL为2 mg/kg,而欧盟仅为0.01 mg/kg。我国和欧盟在茶叶MRL上的差异,严重阻碍了茶叶贸易的发展[7]。因此,建立茶叶中农药残留量的快速检测方法,对茶叶的质量安全具有重要作用。
茶叶中农药残留的检测方法有气相色谱(gas chromatography,GC)法[8-9],高效液相色谱(high performance liquid chromatography,HPLC)法[10-11],高效液相色谱-质谱(mass spectrometer,MS)联用法[12-13],气相色谱-质谱联用法[14-16]以及拉曼光谱法[17-18]等,由于气相色谱法和液相色谱法的检测器选择性较强,通用性较差,无法同时检测多种农药残留。色谱-质谱联用法因质谱抗干扰能力强,灵敏度高,定性准确,近年来在农药残留检测领域得到广泛的应用。样品的前处理方法有QuEChERS(Quick、Easy、Cheap、Effective、Rugged、Safe)、传统的净化萃取柱及FaPEx柱,GB23200.113—2018《食品安全国家标准植物源性食品中208种农药及其代谢物残留量的测定气相色谱-质谱联用法》[19]中QuEChERS方法具有简便、快捷等优点,对蔬菜和水果样品净化效果好,但对于茶叶等复杂基质的样品净化效果较差,应用石墨化炭黑(graphitized carbon black,GCB)吸附色素会导致平面型结构农药回收率降低。传统的净化萃取柱有TPT固相萃取柱、NH2固相萃取柱及Florisil固相萃取柱等,分析周期较长。FaPEx柱由C18、乙二胺-N-丙基硅烷(primary secondary amine,PSA)、GCB等填料混装,是一种可通过一步法净化农药残留的前处理方法,其操作步骤更简单,净化效果更好。罗廷武等[13]使用FaPEx柱与液相色谱-串联质谱检测茶叶中的农药残留,周勇等[16]使用FaPEx柱与气相色谱-串联质谱检测保健食品中农药残留均得到良好的效果,但目前还没有FaPEx柱结合GC-MS法同时检测茶叶中农药残留的研究报道。
本研究建立FaPEx柱萃取净化结合GC-MS同时测定绿茶中20种农药残留的方法,采用FaPEx柱对茶叶中的农药进行提取净化,对其提取溶剂和净化方式进行优化,并采用GC-MS联用仪对农药化合物进行检测,旨在解决同时测定绿茶中不同农药残留的问题,对茶叶中农药残留的评价具有重要意义。
1 材料与方法
1.1 材料与试剂
绿茶:市售;乙腈、冰醋酸、丙酮、正己烷(均为分析纯):天津市科密欧化学试剂有限公司;FaPEx柱:巨研科技股份有限公司;TPT固相萃取柱、NH2固相萃取柱、Florisil固相萃取柱:天津博纳艾杰尔科技有限公司;环氧七氯B(纯度>98%):农业部环境保护科研监测所;20种农药标准品(质量浓度均为1 000 μg/mL,纯度>98%):农业部环境质量监督检验测试中心。
1.2 仪器与设备
TRACE 1300/ISQ7000型气相色谱-质谱联用仪:美国Thermo scentific公司;BSM-220.4型电子天平:上海卓精电子科技公司;B100250型多管旋涡混合器:上海月旭科技公司;Auto EVA-30Plus型平行浓缩仪:睿科集团股份有限公司;L550型离心机:湖南湘仪实验室仪器开发有限公司;Milli-Q超纯水系统:美国Millipoer公司。
1.3 实验方法
1.3.1 标准溶液的配制
内标溶液:采用丙酮配制质量浓度为100 μg/mL环氧七氯B溶液,移取0.2 mL环氧七氯B溶液到10 mL容量瓶中,用丙酮定容至刻度,得到质量浓度为2.00 μg/mL的标准溶液。
标准溶液储备液:分别移取质量浓度为1 000 μg/mL的20种农药标准液各0.10 mL于10 mL容量瓶中,用丙酮定容混匀,得到质量浓度为10 μg/mL的标准溶液储备液。
标准溶液中间液:吸取1 mL质量浓度为10 μg/mL的标准溶液于10 mL容量瓶中,用丙酮定容混匀,得到质量浓度为1 μg/mL的标准溶液,于冰箱4 ℃保存。
空白基质溶液:取1.00 g不含目标物农药的绿茶样品,经过方法1.3.1提取和净化后得到。
标准溶液使用液:分别吸取质量浓度为1 μg/mL的标准溶液中间液0.01 mL、0.02 mL、0.05 mL、0.10 mL、0.20 mL、0.50 mL于1 mL容量瓶中,用氮气(N2)吹至近干,加入1 mL空白基质溶液,同时加入2.00 μg/mL环氧七氯B内标溶液20μL,得到质量浓度为0.01μg/mL、0.02μg/mL、0.05μg/mL、0.10μg/mL、0.20μg/mL、0.50μg/mL的标准工作液,临用现配。
1.3.2 样品前处理
取绿茶样品500 g,用粉碎机粉碎并通过40目筛,于0~4 ℃保存。称取粉碎后绿茶样品1.00 g置于50 mL塑料离心管中,加入2 mL的去离子水混匀浸泡30 min[20],加入10 mL 1%醋酸-乙腈,2 500 r/min旋涡2 min,4 200 r/min离心5min,取5 mL上清液到FaPEx柱中,置于自动压注机,设置流速为每秒一滴,将提取液挤压通过FaPEx柱,用移液管准确取滤液2 mL,用氮气(N2)吹至近干,加入1 mL乙酸乙酯复溶,加入20 μL内标溶液,混合均匀,过0.22 μm微孔滤膜,供GC-MS测定。
1.3.3 前处理条件优化
提取溶剂的选择:考察不同提取溶剂(乙腈、0.1%醋酸-乙腈、1.0%醋酸-乙腈、2.0%醋酸-乙腈)对20种农药的回收率的影响。
净化柱的选择:分别用4种净化柱(FaPEx柱、TPT固相萃取柱、NH2固相萃取柱、Florisil固相萃取柱)对20种目标物农药进行测定。其中FaPEx柱上样后采用自动压柱机过滤,无需洗脱,TPT固相萃取柱、NH2固相萃取柱、Florisil固相萃取柱则采用30 mL乙腈∶甲苯(V∶V=3∶1)洗脱,考察4种净化柱对20种农药的回收率的影响。
1.3.4 基质效应的考察
绿茶基质较复杂,基质效应(matrix effect,ME)可能为增强或者抑制效应,以绿茶样品为基质,按照方法1.3.1制备基质溶液,分别用基质溶液和纯溶剂配制一系列混合基质标准工作溶液和纯溶剂标准工作液,用于标准曲线测定,利用基质标准曲线测算出基质中目标物质本底浓度的峰面积,再用纯溶剂标准曲线测算出对应浓度纯溶剂中目标物质的峰面积,参考文献[21]公式计算基质效应。
1.3.5 气相色谱-质谱分析
气相色谱条件:DB-5MS UI色谱柱(30 m×0.25 mm×0.25 μm);进样口温度250 ℃;不分流进样;进样量1 μL;升温程序为初始温度90 ℃,保持1.4 min;以30 ℃/min升至210 ℃,保持1 min,以6 ℃/min升至250 ℃,保持4 min,以30 ℃/min升至300 ℃,保持6 min。
质谱条件:离子源温度300 ℃;电子能量70 eV;传输线温度:280 ℃;溶剂延迟6.2 min;选择离子监测(selected ion monitoring,SIM)模式;20种农药标准品定性离子及定量离子见表1。
表1 20种农药标准品的定性、定量离子
Table 1 Qualitative and quantitative ions of 20 pesticide standards
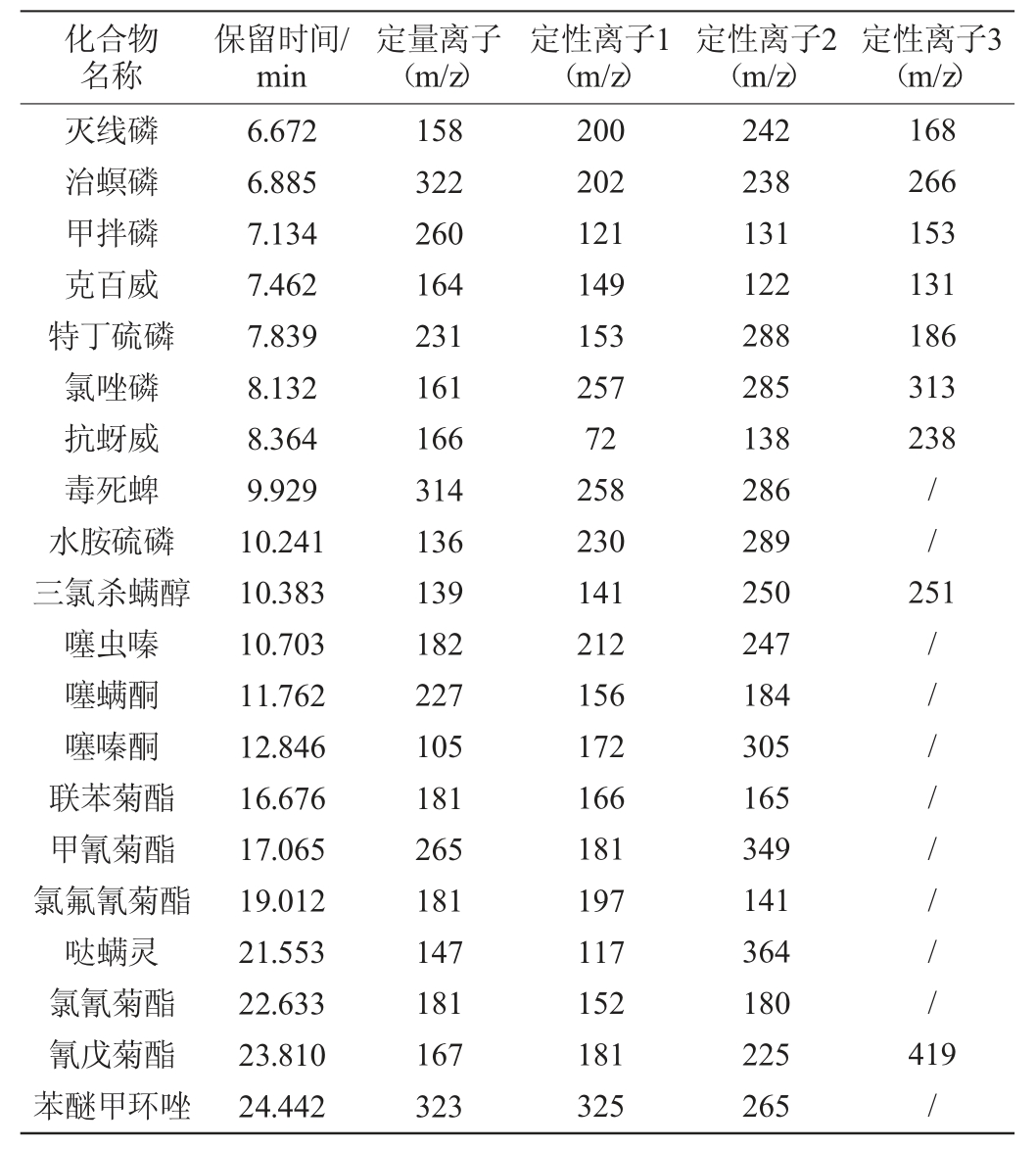
注:“/”表示没有定性离子。
定性及定量分析:采用保留时间、定量离子与定性离子丰度比进行定性,内标法进行定量。
1.3.6 方法学考察
方法线性范围、检出限及定量限:将配制好的标准溶液进行色谱分析,以标准溶液与内标物的色谱峰面积比值(Y)作为纵坐标,以标准溶液与内标物的浓度比值(X)作为横坐标,绘制农药标准品的标准曲线,获得20种农药标准品的线性回归方程,以信噪比为3和10对应的空白样品添加浓度为方法检出限(limit of detection,LOD)和方法定量限(limit of quantification,LOQ)。
加标回收率试验和精密度试验:选择不含有目标物的空白样品,加入不同质量浓度的农药标准品进行加标回收试验,添加水平分别是0.05 mg/kg、0.1 mg/kg、0.50 mg/kg,将3种添加水平下样品进行6次重复实验,计算平均回收率及精密度试验结果相对标准偏差(relative standard deviations,RSD)。
1.3.7 实际样品检测
利用本方法对市售18批次绿茶20种目标物农药进行分析。
1.3.8 数据处理
利用Chromeleon 7.2.10软件进行数据采集和处理,Excel 2016软件进行图表绘制。
2 结果与分析
2.1 前处理条件优化
2.1.1 提取溶剂的选择
GB/T 23204—2008《茶叶中519种农药及相关化学品残留量的测定气相色谱-质谱法》[22]中采用乙腈提取茶叶中农药残留,但是本研究的目标农药残留物包含甲拌磷、毒死蜱、水胺硫磷、克百威等酸性农药,在提取溶剂添加适量的酸,可以增加目标农药的溶解度,提高提取效率,而且抗蚜威[23]、克百威等农药遇碱易发生碱解反应,故在提取溶剂中加入适量的酸,有利于稳定目标物农药,提高检测效果。已有研究表明,使用酸化乙腈做提取溶剂,可以提高克百威、杀扑磷等农药的提取效果[24]。不同提取溶剂对20种农药回收率的影响见图1。
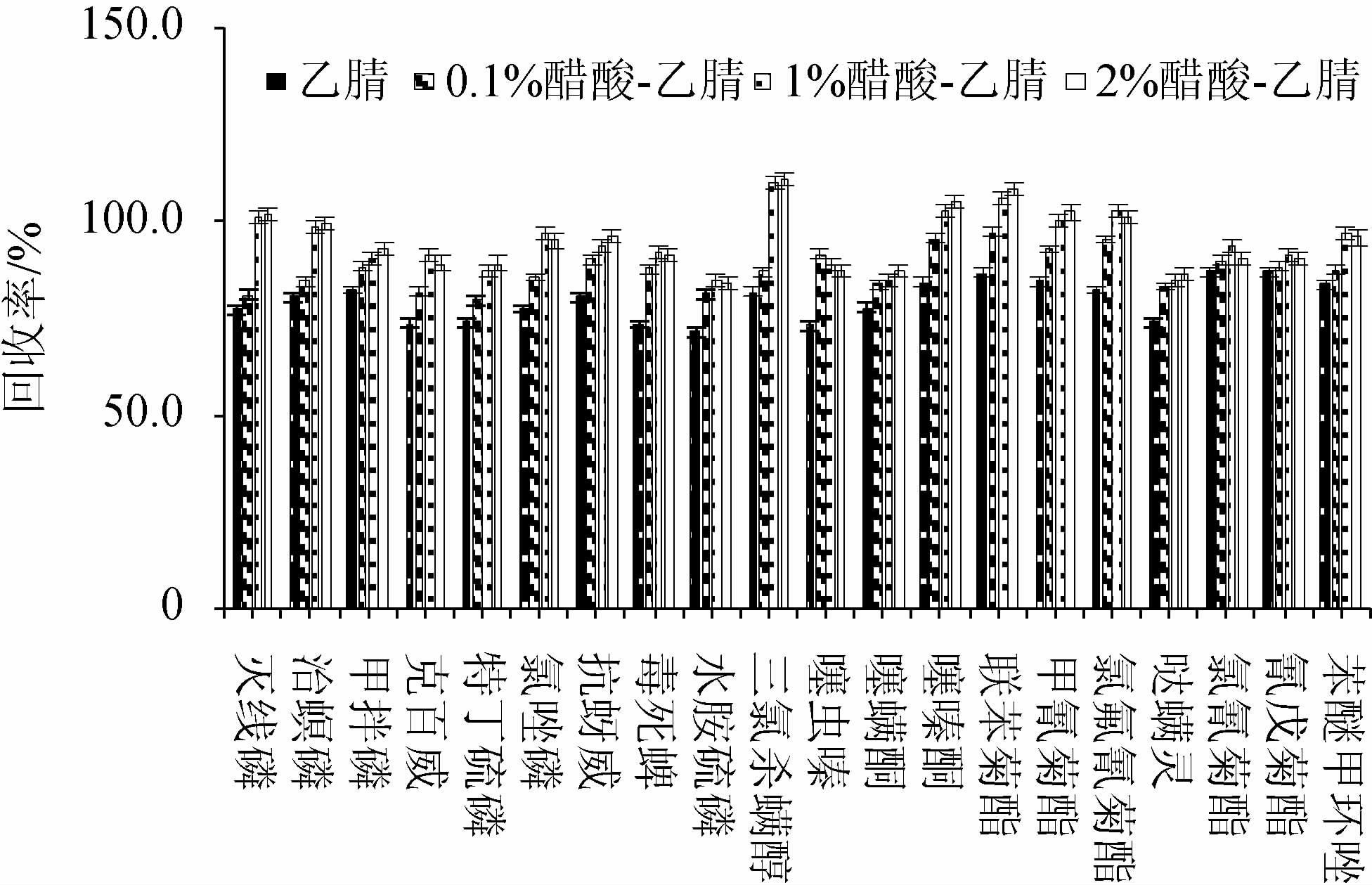
图1 不同提取溶剂对20种农药回收率的影响
Fig.1 Effect of different extraction solvents on recovery rates of 20 pesticides
由图1可知,以1%醋酸-乙腈为提取溶剂时,农药回收率范围为85%~110%,而乙腈和0.1%醋酸-乙腈作为提取溶剂时的回收率分别为71%~87%和80%~97%,2.0%醋酸-乙腈作为提取溶剂时的回收率为86%~110%,其与1.0%醋酸-乙腈作为提取溶剂时的回收率相差不大,但是醋酸沸点较高,考虑后期浓缩过程的顺利进行,选择较低浓度的醋酸。因此,本研究选用1%醋酸-乙腈作为提取溶剂。
2.1.2 净化柱的选择
TPT固相萃取柱为混合填料,且容量较大,对茶叶中的色素、有机酸及非极性物质净化效果较好。NH2固相萃取柱和Florisil固相萃取柱为单一填料净化柱,NH2固相萃取柱对有机酸和碳水化合物有很好的净化效果,但是对色素吸附效果较差;Florisil固相萃取柱能吸附极性较低的色素,对色素的净化效果较好,但吸附容量较低。不同净化柱对20种农药回收率的影响见图2。
由图2可知,Florisil固相萃取柱对20种农药的回收率为58%~101%,效果最差,其对菊酯类农药的回收率相对较高,回收率为96%~101%,但是对于部分有机磷和氨基甲酸酯类农药的回收效果较差(回收率57.8%~87.2%)。FaPEx柱、TPT固相萃取柱和NH2固相萃取柱对20种农药的回收率分别为85%~110%、81%~107%、85%~103%,而NH2固相萃取柱对色素净化效果不佳,颜色较深,FaPEx固相萃取柱和TPT固相萃取柱净化效果较好,但由于TPT固相萃取柱需要使用乙腈-甲苯洗脱,洗脱体积较大,净化和浓缩过程消耗时间较长,且甲苯具有一定的毒性。因此,本研究采用高效、环保、安全的FaPEx柱净化样品。
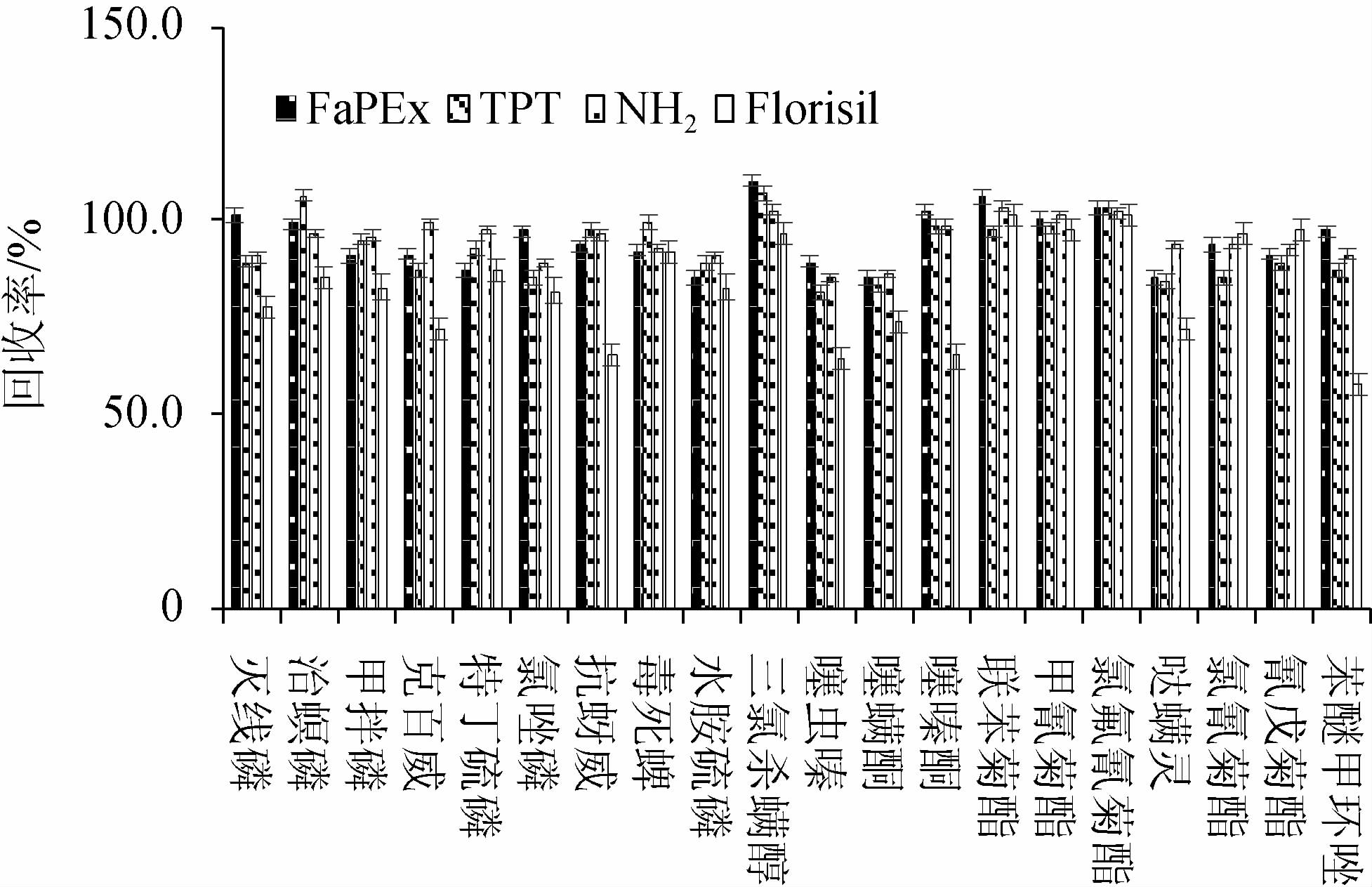
图2 不同净化柱对20种农药回收率的影响
Fig.2 Effect of different purification columns on pesticide recovery
2.2 基质效应
抗蚜威表现为基质抑制效应(ME=46%<85%),其他19种农药表现为基质增强效应(115%<ME<698%,均>105%)。因此,本研究采用空白基质匹配标准曲线进行定量分析,能有效减小基质效应带来的干扰,提高定量准确性。气相色谱-质谱联用法检测农药残留时,主要为基质增强效应[25],在分析样品时,基质能有效地抢占进样口和色谱柱内的活性位点,使进入检测器的目标化合物相对增加,从而导致基质增强效应。基质效应一般不能被完全消除,只能通过一定的途径减小,比如通过基质配制标准减小基质效应[26-27]。
2.3 方法学考察
2.3.1 标准曲线线性回归方程、线性范围、相关系数、检出限、定量限及最大残留限量
将配制好的标准溶液进行色谱分析,以标准溶液与内标物峰面积比值(Y)作为纵坐标,以标准溶液和内标物的浓度比值(X)作为横坐标绘制标准曲线,获得20种农药标准品的线性回归方程。线性回归方程、线性范围、相关系数、检出限、定量限及最大残留限量见表2。
表2 20种农药标准品的线性方程、线性范围、相关系数、检出限、定量限及最大残留限量
Table 2 Linear equation,linear range,correlation coefficient,limits of detection,limits of quantification and maximum residue limit of 20 pesticide standards

注:“/”表示抗蚜威和治螟磷在茶叶中MRL未做规定。
由表2可知,20种农药在0.01~0.50 μg/mL质量浓度范围内具有良好的线性关系,线性相关系数R2均>0.99,可满足定量的要求。20种农药检出限(LOD)在0.001 2~0.020 0 mg/kg之间,定量限(LOQ)在0.003 9~0.060 0 mg/kg之间。根据GB 2763—2021《食品安全国家标准食品中农药最大残留限量》[5]要求,抗蚜威和治螟磷在茶叶中MRL未做规定,其他18种农药的检出限和定量限均低于规定的允许最大残留限量,满足检测要求。
2.3.2 加标回收率试验及精密度试验结果
20种农药化合物的加标回收率试验及精密度试验结果见表3。
表3 20种农药化合物的加标回收率试验及精密度试验结果
Table 3 Results of standard recovery tests and precision tests of 20 pesticides compounds

续表
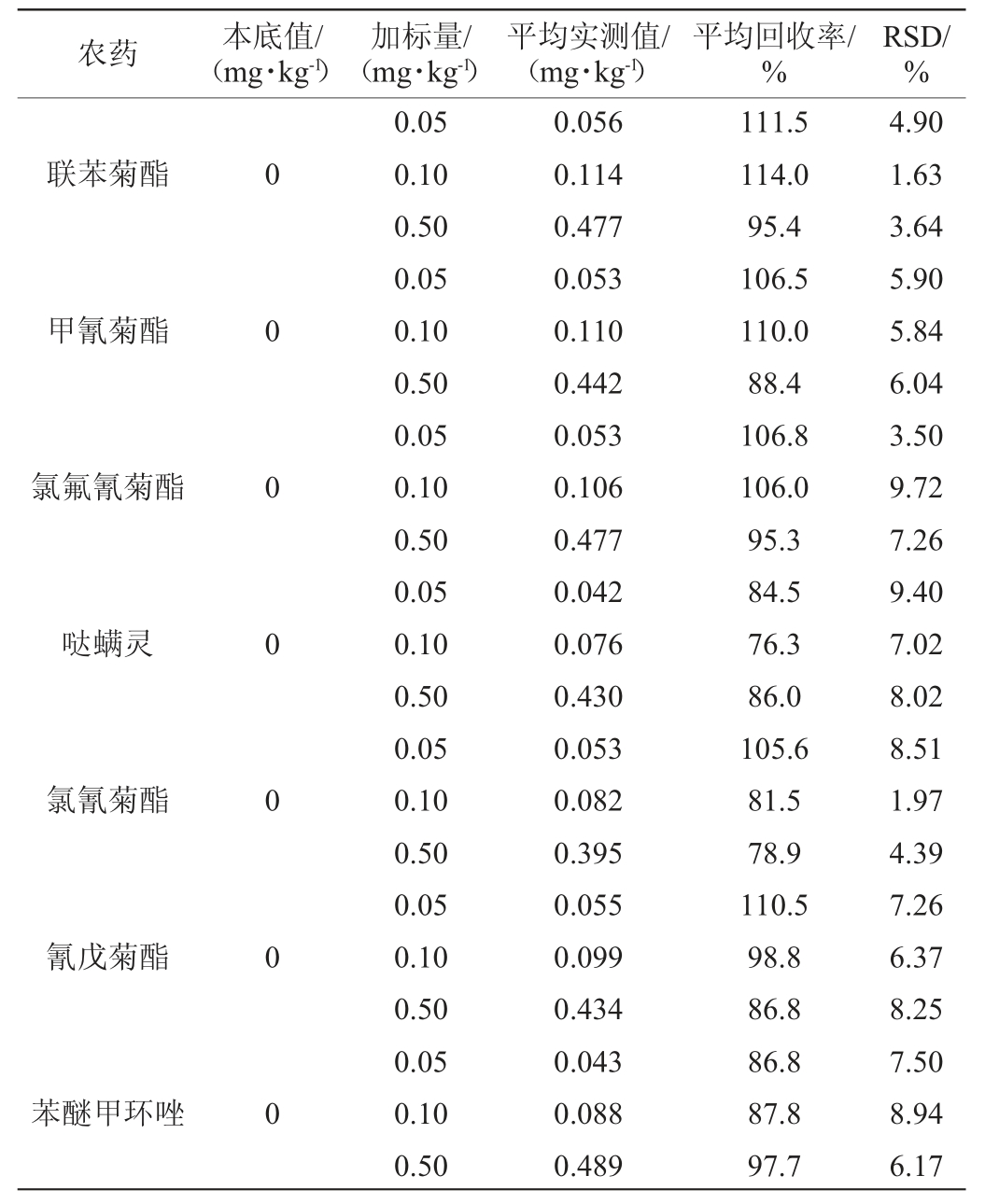
由表3可知,20种农药的平均加标回收率在71.8%~118.2%之间,精密度试验结果相对标准偏差(n=6)为1.63%~11.50%,满足标准GB/T 27404—2008《实验室质量控制规范食品理化检测》要求[28],表明该方法的准确度高、精密度良好。因此,使用本研究优化的色谱条件测定绿茶中20种农药可以满足试验要求。
2.4 绿茶样品中农药化合物的检测
采用该方法对市售的18批次绿茶的20种农药残留进行检测,结果见表4。
表4 18批次绿茶样品农药化合物检测结果
Table 4 Detection results of pesticide compounds in 18 batches of green tea samples
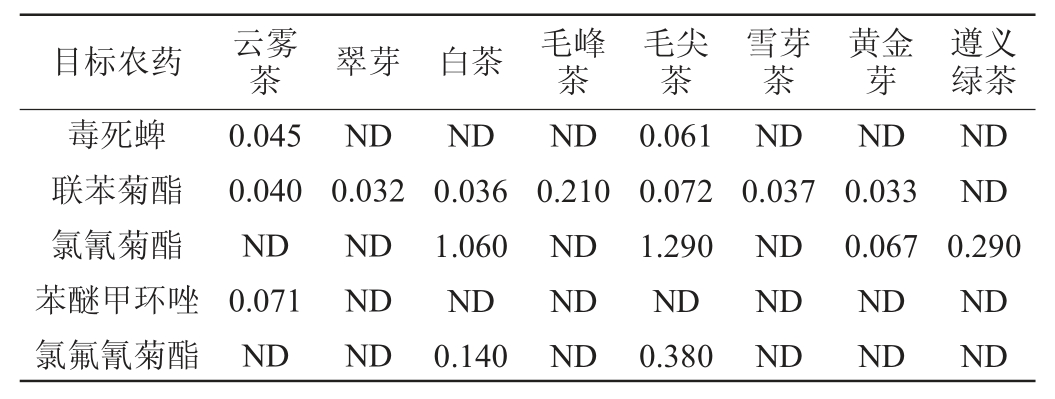
注:“ND”表示未检出。
由表4可知,有7批次绿茶检出联苯菊酯,含量为0.032~0.210 mg/kg,有2批次绿茶检出毒死蜱,含量为0.045~0.061 mg/kg,有4批次绿茶检出氯氰菊酯,含量为0.067~1.290 mg/kg,有1批次绿茶检出苯醚甲环唑,含量为0.071 mg/kg,有2批次绿茶检出氯氟氰菊酯,含量为0.140~0.380 mg/kg,其他批次绿茶均未检出20种目标农药。18批次绿茶检出的目标农药残留量均低于GB 2763—2021《食品安全国家标准食品中农药最大残留限量》[5]规定的MRL。
3 结论
本研究建立了采用FaPEx柱萃取净化结合GC-MS同时测定绿茶中20种农药残留的方法,采用FaPEx柱对茶叶中的农药进行提取净化,并对其提取溶剂和净化方式进行优化后采用GC-MS联用仪对农药化合物进行检测。结果表明,20种农药在质量浓度0.01~0.50 μg/mL线性范围内线性关系良好,相关系数R2均>0.99,平均回收率为71.8%~118.2%,精密度试验结果的RSD为1.63%~11.50%,方法检出限(LOD)为0.006~0.015 mg/kg,方法定量限(LOQ)为0.020~0.050 mg/kg。该方法准确可靠,分析周期短,稳定性高,精密度好,适用于绿茶中多种农药残留的定性定量分析,为茶叶中农药多残留快速检测提供技术参考。
[1]刘仲华,黄建安,龚雨顺,等.茶叶功能成分的健康作用研究新进展[J].中国茶叶,2021,43(9):1-11.
[2]蓝金珠.茶叶主要病虫害的发生特点及防治措施[J].农村实用技术,2020(3):73.
[3]张钦部.茶叶品质危害因素及预防机制分析[J].福建茶叶,2022,44(9):36-38.
[4]李单单.我国农产品中农残的危害现状及去除方法的研究进展[J].农产品加工,2021(17):80-83.
[5]中华人民共和国国家卫生健康委员会,中华人民共和国农业农村部,国家市场监督管理总局.GB 2763—2021 食品安全国家标准食品中农药最大残留限量[S].北京:中国标准出版社,2021.
[6]European Commission.EU pesticide residue limit standard database[EB/OL].https://ec.europa.eu/food/plant/pesticides/eu-pesticides-database/mrls/?event=search.pr.
[7]赵丽,陈瑞,岑铭松,等.我国出口欧盟茶叶农药残留状况与控制对策[J].中国植保导刊,2021,41(5):69-74.
[8]朱雪琴,赵薇,陈坦林,等.改良QuEChERS法提取-气相色谱-火焰光度检测同时测定茶叶中5种有机磷农药残留[J].分析科学学报,2018,34(2):176-180.
[9]邓桂添,邹苑眉,张琼,等.气相色谱法对茶叶中有机磷农药不同净化方法的研究[J].安徽农学通报,2019,25(7):7876-7887.
[10]丁怡,李荣玉,刘世江,等.高效液相色谱法测定茶叶中的5种农药残留[J].中国农学通报,2020,36(29):132-138.
[11]SEEBUNRUENG K,SANTALADCHAIYAKIT Y,SRIJARANAI S.Vortex-assisted low density solvent based demulsified dispersive liquidliquid microextraction and high-performance liquid chromatography for the determination of organophosphorus pesticides in water samples[J].Chemosphere,2014,103:51-58.
[12]郑坤明,林瑶,吴晓萍,等.超高效液相色谱-质谱法测定茶叶中4种农药残留[J].农药,2022,61(10):743-746.
[13]罗廷武,付春燕,于以竹,等.FaPEx-LC/MSMS法测定茶叶中28种农药残留[J].食品安全导刊,2019(9):165-168.
[14]ZHU B Q,XU X Y,LUO J W,et al.Simultaneous determination of 131 pesticides in tea by on-line GPC-GC-MS/MS using graphitized multiwalled carbon nanotubes as dispersive solid phase extraction sorbent[J].Food Chem,2019,276:202-208.
[15]LY T K,HO T D,BEHRA P,et al.Determination of 400 pesticide residues in green tea leaves by UPLC-MS/MS and GC-MS/MS combined with QuEChERS extraction and mixed-mode SPE clean-up method[J].Food Chem,2020,326:126928.
[16]周勇,马永龙,赵凯,等.FaPEx柱快速萃取净化-GC/MS/MS同时检测保健食品原料中多残留农药[J].食品工业,2018,39(12):299-303.
[17]ZHU X Y,LI W J,WU R M,et al.Rapid detection of chlorpyrifos pesticide residue in tea using surface-enhanced Raman spectroscopy combined with chemometrics[J].Spectrochim Acta A Mol Biomol Spectrosc,2021,250:119366.
[18]ZHU J J,SHARMA A S,XU J,et al.Rapid on-site identification of pesticide residues in tea by one-dimensional convolutional neural network coupled with surface-enhanced Raman scattering[J].Spectrochim Acta A Mol Biomol Spectrosc,2021,246:118994.
[19]中华人民共和国国家卫生健康委员会,中华人民共和国农业农村部,国家市场监督管理总局.GB 23200.113—2018 食品安全国家标准植物源性食品中208种农药及其代谢物残留量的测定气相色谱-质谱联用法[S].北京:中国标准出版社,2018.
[20]罗俊霞,赵建波,张刚,等.茶叶农药残留色谱质谱法分析中常规前处理方法对检测结果的影响[J].茶叶学报,2022,63(3):189-198.
[21]朱颖洁,曹燕卿,毛劼,等.QuEChERS前处理结合超高效液相色谱-串联质谱法同时检测茶叶中14种农药残留[J].食品工业科技,2022,43(12):283-290.
[22]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 23204—2008 茶叶中519种农药及相关化学品残留量的测定气相色谱-质谱法[S].北京:中国标准出版社,2008.
[23]干兴利,秦岳军,陈灿,等.碱解法降解抗蚜威废水中COD和抗蚜威的研究[J].精细化工中间体,2020,50(1):70-72.
[24]李自强,杨梅,张新忠,等.超高效液相色谱-串联质谱法检测绿茶中16种农药残留[J].茶叶科学,2022,42(4):537-548.
[25]HU S P,ZHAO M,MAO Q Q,et al.Rapid one-step cleanup method to minimize matrix effects for residue analysis of alkaline pesticides in tea using liquid chromatography-high resolution mass spectrometry[J].Food Chem,2019,299:125146.
[26]田培,金银银,刘之炜,等.气相色谱-质谱联用仪测定果蔬中农药残留的基质效应[J].浙江农业科学,2022,63(3):610-613,618.
[27]QIN J A,FU Y W,LU Q,et al.Matrix-matched monitoring ion selection strategy for improving the matrix effect and qualitative accuracy in pesticide detection based on UFLC-ESI-MS/MS:A case of Chrysanthemum[J].Microchem J,2021,160:105681.
[28]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 27404—2008 实验室质量控制规范食品理化检测[S].北京:中国标准出版社,2008.