中国白酒具有悠久的历史,是世界著名六大蒸馏酒之一。白酒独特的生产工艺使其具有丰富的风味物质和生物活性成分[1,2]。目前对白酒中功能因子的报道主要包括酸类[3]、醇类[4]、酚类[5]、酯类[3]、醛酮类[6]、活性肽[7]、氨基酸[8]、多糖[9]和吡嗪化合物[10]等,而对甾醇类物质的报道较少。经过文献检索,在酒糟[11]和大曲[3]中检测出一些甾醇类化合物,王晨慧等[12]对山药酒中甾醇类物质进行了报道,但其前处理较为复杂,白酒用量较大,且未检测出麦角甾醇。
甾醇是以环戊烷多氢菲为骨架的一类化合物,广泛存在于生物体内的一种重要的天然活性物质。按其原料来源分为动物性甾醇、植物性甾醇和菌类甾醇三大类。近年来,甾醇类物质因在各项研究中表现出较好的疗效,已逐渐成为基础研究的焦点之一。研究表明,植物甾醇可以降低高胆固醇血症、冠状动脉硬化性心脏病的危险性[13],具有预防心脑血管、免疫调节等作用[14-16]。目前对甾醇的相关报道主要集中在甾醇的提取分离、生物活性和检测方法的开发。传统测定甾醇的方法有比重法、比色法及酶法[17]等,但此类方法只能测定甾醇的总量。目前用精密仪器对甾醇进行准确定量测定的方法有气相色谱法[18-19]、液相色谱法[20-21]、气相色谱-质谱法[22-24]、液相色谱离子肼质谱法[25]、超高压液相色谱质谱法[26]、近红外法[27]等。气相色谱-质谱法选择性好、灵敏度高、抗干扰能力强,日渐成为检测甾醇常用的方法。
本研究基于固相萃取结合气相色谱-质谱法,建立同时测定白酒中麦角甾醇、菜油甾醇、豆甾醇和β-谷甾醇4种甾醇含量的方法,可评估白酒中甾醇的含量,旨在为白酒中生物活性物质的研究提供一定的技术基础。
1 材料与方法
1.1 材料与试剂
白酒(52%vol 2018年浓香型白酒1#~3#、53%vol 2015年酱香型白酒4#、53%vol 2019年清香型白酒5#、52%vol 2018年米香型白酒6#):市售。
麦角甾醇(纯度≥90%)、菜油甾醇(纯度≥98%)、豆甾醇(纯度≥95%)、β-谷甾醇(纯度≥98%):百灵威公司;甲醇(色谱纯):国药集团化学试剂公司。
1.2 仪器与设备
8890/7000D 气相色谱串联质谱(gas chromatography tandem mass spectrometer,GC-MS)联用仪、HP-5MS毛细管色谱柱(30 m×0.25 mm,0.25 μm):美国Agilent公司;6 mL CNWBONDLC-C18小柱:上海安谱实验科技股份有限公司;Eppendorf5810R型离心机:德国Eppendorf公司;YM-060S型超声波:深圳市方奥微电子有限公司;ML1602/02 型电子天平:梅特勒-托利多仪器有限公司。
1.3 方法
1.3.1 标准工作曲线
混合标准储备液(1.0 mg/mL):分别称取麦角甾醇、菜油甾醇、豆甾醇和β-谷甾醇各10 mg于10 mL容量瓶中,用乙醇稀释并定容至刻度,4 ℃保存。准确吸取四种甾醇的标准储备液(1.0 mg/mL),稀释成质量浓度为100 mg/L,50 mg/L,20 mg/L,5 mg/L,1 mg/L,0.75 mg/L,0.50 mg/L,0.25 mg/L,0.10 mg/L的混合标准工作液。
1.3.2 白酒样品前处理
取10 mL酒样,用超纯水稀释到酒精度为10%vol;分别用5 mL二氯甲烷和5 mL甲醇对固相萃取小柱进行活化;将处理后的酒样匀速(1~2 L/min)流经固相萃取小柱上,静置10 min;用5 mL超纯水匀速(1~2 L/min)淋洗小柱;抽干后用10 mL甲醇以约1 mL/min的流速进行洗脱,收集于10 mL的刻度试管中,室温下用氮气缓慢吹至约0.5 mL,用甲醇定容至1.00 mL,振荡混匀后经0.45 μm滤膜过滤,4 ℃保存待测。
1.3.3 色谱条件
色谱柱:HP-5MS毛细管色谱柱(30m×0.25mm,0.25μm);程序升温:200 ℃保持0 min,以15 ℃/min 升至300 ℃,保持15 min;采用恒流模式,载气(He)流速1.0 mL/min,不分流进样,进样量1 μL,进样口温度300 ℃。
1.3.4 质谱条件
电子电离(electron ionization,EI)源:电子能量70 eV;离子源温度230 ℃;传输线温度230 ℃;四极杆温度150 ℃。定性采用全扫描模式,质量扫描范围45~500 m/z,溶剂延迟5 min,定量采用多反应检测(multiple reaction monitoring,MRM)模式,每个化合物选择一个定量离子,一个定性离子。
1.3.5 数据分析
本方法采用外标法定量,按梯度添加一定量的甾醇标准品于空白溶剂中,在与被测样品相同的色谱条件下单独测定。对不同浓度的标准品进样分析,以峰面积为响应值绘制标准曲线,从而推算出未知样品中被测组分的浓度。
2 结果与分析
2.1 前处理方法评价
白酒中甾醇类化合物含量较低,沸点高且难挥发,样品前处理方法的选择对分析结果具有较大的影响。固相萃取(solid-phase extraction,SPE)技术在食品分析领域是常见的前处理方法,具有节省有机溶剂、污染较小等优点,近年来也逐渐应用于白酒检测领域[28-29]。聂庆庆等[28]采用固相萃取结合气相色谱-质谱技术定量了白酒中8种γ-内酯。吴子阳等[29]采用固相萃取结合高效液相色谱测定清香型白酒中5种酚类活性化合物,并对17种青稞酒原酒和29种商品酒中酚类化合物进行了测定。所以本研究选用固相萃取对甾醇类化合物进行富集和浓缩,前处理操作简单,能较好的分离目标化合物。
2.2 白酒中甾醇组分的定性分析
通过标准物质的出峰时间和质谱信息进行定性,定量采用MRM,该模式只对目标化合物进行检测,极大地避免了白酒中其他物质的干扰,提高了分析检测的灵敏度。四种甾醇标准品的MRM色谱图结果见图1,其出峰时间及MRM离子对见表1。
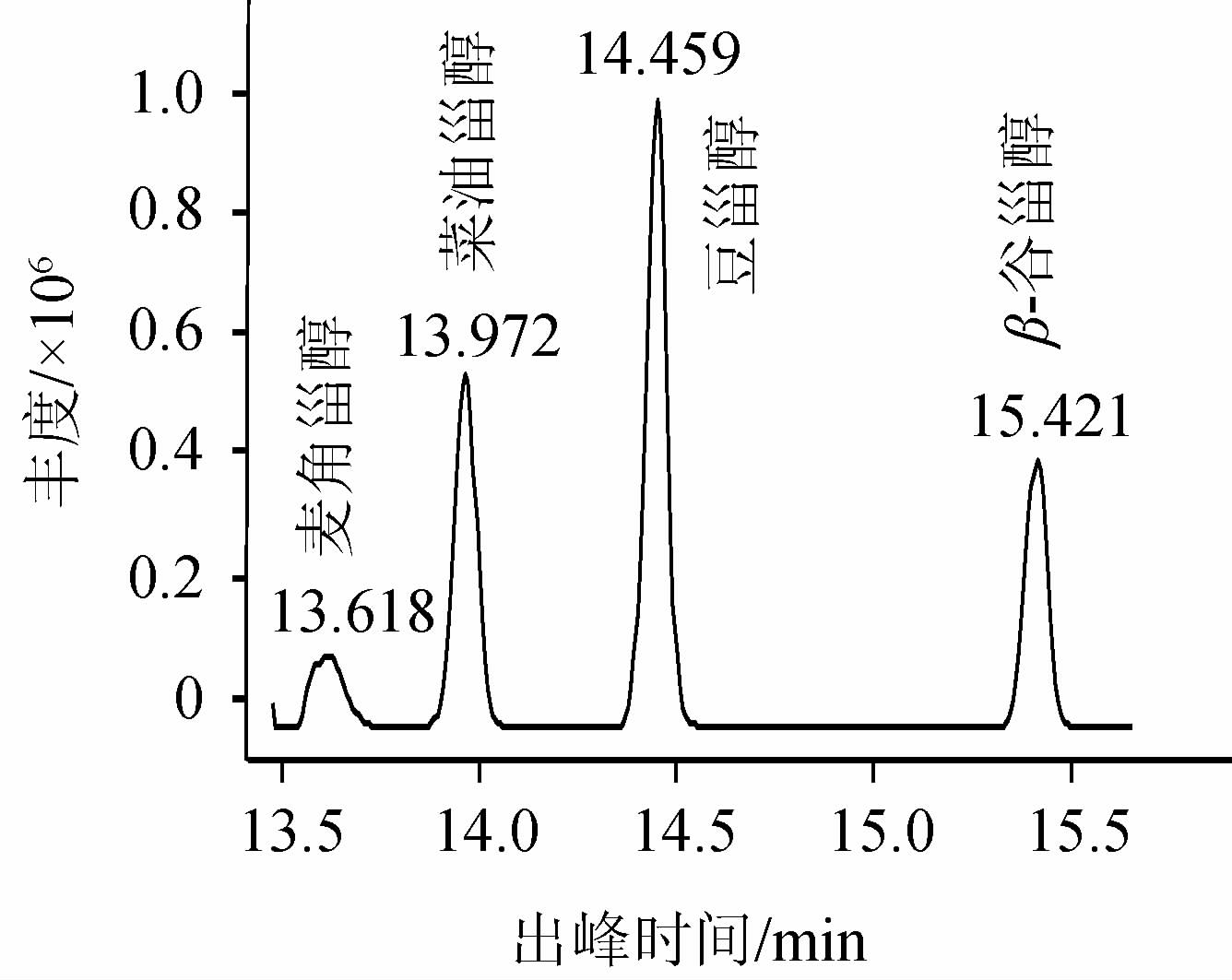
图1 甾醇标准物质的MRM色谱图
Fig.1 MRM chromatogram of sterol standard substance
表1 甾醇标准物质的出峰时间及MRM离子对
Table 1 Peak time of sterol compounds and MRM ion pairs
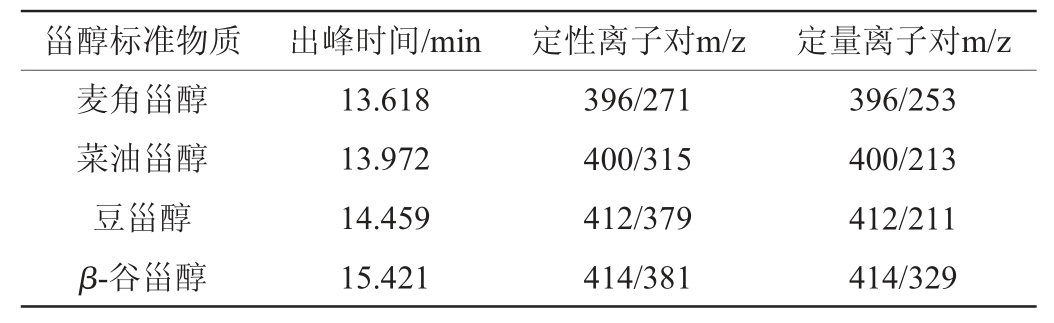
由图1可知,不经过衍生化处理,通过合适的程序升温和色谱条件,直接进样也可以实现对麦角甾醇、菜油甾醇、豆甾醇和β谷甾醇的分离检测,HP-5MS色谱柱对甾醇类物质有较好的分离效果。四种甾醇化合物的出峰时间相近,在16 min内能实现较好的分离。由表1可知,选择不同甾醇特异性的母离子,筛选合适的碰撞电压,对其进行碰撞诱导,再选择特异性的子离子进行质谱信号的采集。通过两对母离子-子离子对的选择,可以去除干扰离子,降低化学背景,提高检测灵敏度。
2.3 白酒中甾醇组分的标准曲线回归方程,线性关系,定量限及检出限
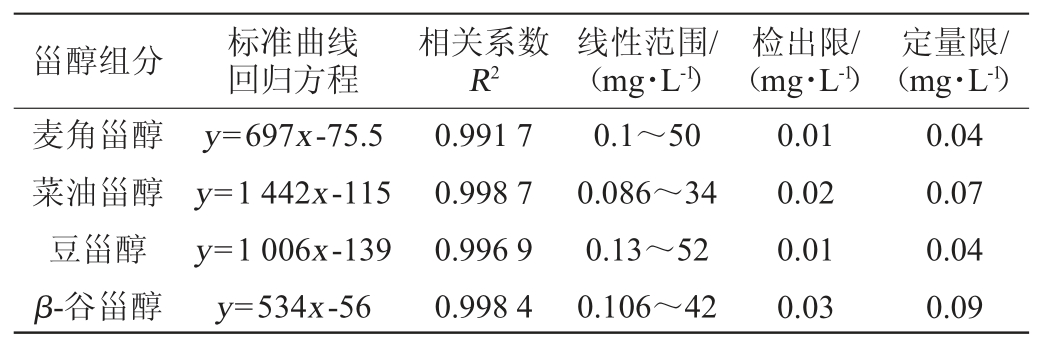
用乙醇配制4种甾醇的混合标准溶液,以质量浓度-峰面积建立标准曲线,结果见表2。由表2可知,白酒中四种甾醇的标准曲线线性范围在0.086~52 mg/L,相关系数R2均在0.991以上,表明其线性关系良好;将色谱峰信噪比大于3的质量浓度确定为检出限,信噪比大于10确定为定量限,其检出限为0.01~0.03 mg/L,定量限为0.04~0.09 mg/L,表明能满足甾醇的检测分析要求。
表2 白酒中4种甾醇的标准曲线回归方程、线性范围、检出限以及定量限
Table 2 Regression equation standard curve,linear range,detection limit and quantitative limit of four sterols in Baijiu
2.4 方法的精密度试验和加标回收率试验
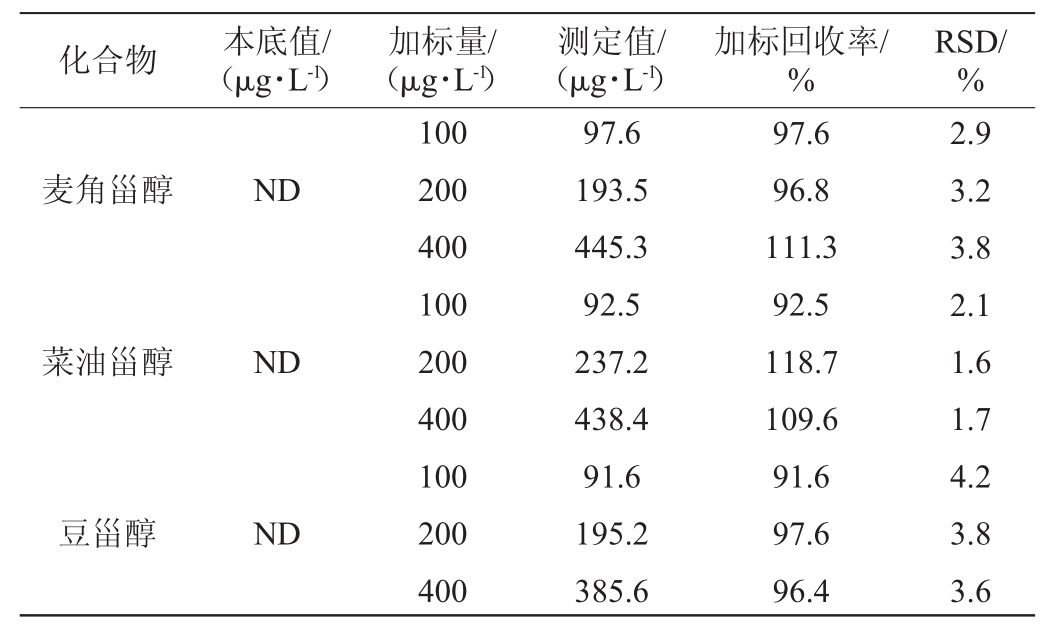
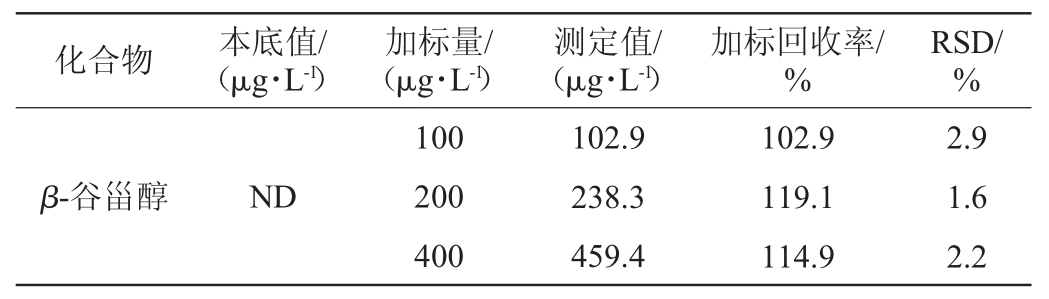
利用无水乙醇和水配制成不含甾醇类化合物、酒精度10%vol的空白酒样,分别向空白酒样中添加100 μg/L、200 μg/L和400 μg/L的甾醇混合标样,每个浓度水平平行测定6次,计算精密度试验结果相对标准偏差(relative standard deviation,RSD)和加标回收率,结果见表3。
表3 白酒中4种甾醇的精密度和加标回收率试验结果
Table 3 Results of precision and standard recovery tests of four sterols in Baijiu
续表
注:“ND”代表未检出。下同。
由表3可知,各指标精密度试验结果的RSD均<5%,表明该方法的精密度良好,适合定量分析,加标回收率为91.6%~119.1%,能够满足实际样品的检测需要,说明该检测方法精密度及准确性良好。
2.5 白酒样品的测定
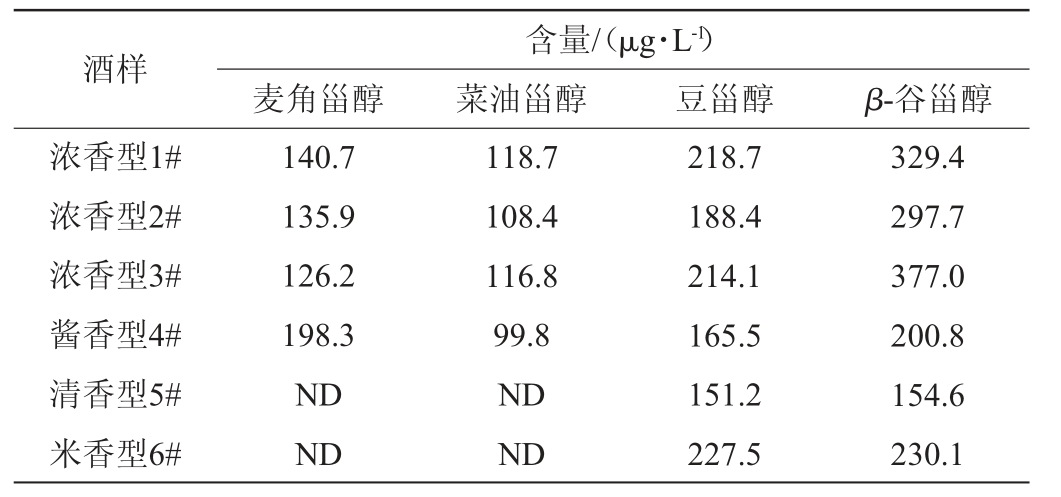
利用本研究建立的方法,对3种浓香型白酒和3种其他香型的白酒中甾醇类化合物进行分析,结果见表4。由表4可知,麦角甾醇在酱香型白酒中含量最高,达到198.3 μg/L,而在清香型和米香型白酒中未检测到。这可能与其所用的曲药有关,酱香型白酒用的是高温大曲,浓香型白酒采用中高温大曲,而清香型白酒使用的是低温大曲,米香型白酒使用的是小曲,麦角甾醇主要是来源于微生物代谢,中高温大曲和高温大曲在生产过程中会捕集到更多的耐高温的微生物,从而产生了较多的麦角甾醇。菜油甾醇在浓香型和酱香型白酒中含量差别不大,在清香型和米香型白酒中未检测到。豆甾醇在米香型白酒中含量较高,达到227.5μg/L。相比其他三种甾醇,β-谷甾醇在四种香型的白酒中含量均较高。
表4 白酒中甾醇含量的测定结果
Table 4 Determination results of sterol contents in Baijiu
3 结论
白酒是我国最重要的传统发酵食品之一,在世界蒸馏酒中独树一帜,由于其独特的生产工艺,白酒中含有许多对人体健康有益的物质,多项研究表明,甾醇具有抗炎、抗氧化、抗肿瘤、抗菌等生物活性。本研究建立的麦角甾醇、菜油甾醇、豆甾醇和β-谷甾醇的气相色谱-质谱法可有效地分离检测白酒中的甾醇组分,采用MRM模式进行定量分析,不受样品本底的干扰,各组分线性关系较好,R2>0.99,方法的精密度良好,RSD均<5%,加标回收率为91.6%~119.1%,能够满足实际样品的检测需要。通过对部分市售的浓香型、酱香型、清香型和米香型白酒中甾醇化合物进行分析,结果表明浓香型和酱香型白酒中均检测到4种甾醇,而在清香型和米香型白酒中未检测出麦角甾醇和菜油甾醇。β-谷甾醇在四种香型的白酒中含量均较高,其具有较好的抗氧化能力,为白酒中其他高沸点难挥发性健康功能因子的研究奠定了基础。
[1]黄莹琪,阳飞,王伟平,等.中国白酒活性功能因子及其研究进展[J].酿酒科技,2017(8):17-21.
[2]霍嘉颖,黄明泉,孙宝国,等.中国白酒中功能因子研究进展[J].酿酒科技,2017(9):17-23.
[3]胡光源,陈宗校,杨理章,等.茅台酒糟中生育酚类、甾醇类和三萜类物质的发现及其溯源分析[J].食品科学,2022,43(8):297-302.
[4]罗丹,罗强,刘杰,等.酱香型白酒醇类活性成分抗幽门螺杆菌损伤胃黏膜上皮细胞活性的研究[J].食品与发酵工业,2021,47(7):102-108.
[5]李青卓,王嘉瑞,张小龙,等.风味物质4-乙烯基愈创木酚的研究进展[J].中国酿造,2021,40(4):15-19.
[6]司波,陆洋,卢永翎,等.酒类产品中活性羰基化合物的研究[J].食品与发酵工业,2022,48(7):312-318.
[7]郅岩,吴群,徐岩.传统白酒中生物活性物质脂肽类化合物及其产生机制[J].酿酒科技,2017(10):17-23.
[8]吴钱弟,周榆林,王久明,等.酱香型白酒第四、五轮次基酒中游离氨基酸分析[J].中国酿造,2020,39(5):54-59.
[9]王晓丹,向玉萍,印丽,等.老白干白酒中糖和糖醇类物质研究[J].中国酿造,2021,40(1):70-74.
[10]孙惜时,李文华,李荣,等.芝麻香型白酒中硫化物和吡嗪类成分的抗氧化活性[J].酿酒,2013,40(4):57-60.
[11]米娇,陈翔,吴林蔚,等.洋河大曲中螺甾醇健康因子研究[J].酿酒科技,2017(5):31-34.
[12]王晨慧,李春杨,张晓磊,等.山药酒中甾醇含量测定及清除DPPH自由基活性研究[J].中国酿造,2020,39(11):62-65.
[13]ARIENNE D J,JOGCHUM P,RONALD P.Mensink.Metabolic effectsof plant sterols and stanols[J].J Nutr Biochem,2003,14(7):362-369.
[14]刘雅谦,李琳,孙万成,等.植物甾醇的抗炎性研究进展[J].中国油脂,2022,47(5):93-99.
[15]吴力超,李俊峰,张婷婷,等.基于网络药理学和细胞实验探讨豆甾醇抗炎作用[J].中成药,2022,44(2):609-615.
[16]DAVID K,SHIRLEY C C.Phytosterols-health benefits and potential concerns:a review[J].Nutr Res,2005,25:413-428.
[17]梁博,郭璇华.分光光度法测定火龙果茎中的植物甾醇[J].分析实验室,2008,27(5):279-281.
[18]闫宁环.采用GC测定调制乳中4种植物甾醇的检测方法[J].食品研究与开发,2014,35(19):103-105.
[19]林晨.气相色谱法测定保健食品中3种植物甾醇的含量[J].中国实验方剂学杂志,2014,20(15):69-71.
[20]张协光.HPLC法同时测定12种植物油中的3种甾醇含量[J].食品工业,2019,40(1):327-330.
[21]尹君,胡鹏辉,舒畅.高效液相色谱法同时检测油脂类药用辅料中胆甾醇、豆甾醇和β-谷甾醇的含量[J].中国药学,2022,20(3):609-612.
[22]李涛.气相色谱-质谱法测定热带水果中植物甾醇的含量[J].热带作物学报,2018,39(12):2486-2490.
[23]周蕾.气相色谱-质谱法测定植物蛋白饮料中植物甾醇和胆固醇[J].分析与检测,2021,40(5):177-181.
[24]林晨,黄丽英.GC-MS分析不同栽培模式金线莲药材中的甾醇类物质的含量[J].海峡药学,2022,34(4):112-115.
[25]LAURA M,CARMEN S.Determination of phytosterols in oenological matrices by liquid chromatography-atmospheric pressure chemical ionization and ion-tap mass spectrometry[J].J Food Compsos Anal,2015,42:171-178.
[26]彭祖茂.超高效液相色谱-串联质谱同时测定植物油中14种营养成分[J].色谱,2018,36(11):1140-1146.
[27]LIU Y,WANG Y X,GONG Z Y.Rapid determination of phytosterols by NIRS and chemometirc methods[J].J Mol Spectrosc,2019,211:336-341.
[28]聂庆庆,徐岩,范文来.固相萃取结合气相色谱-质谱技术定量白酒中的γ-内酯[J].食品与发酵工业,2012,38(4):159-164.
[29]吴子阳,何菲,李贺贺,等.采用固相萃取结合高效液相色谱测定清香型白酒中酚类活性化合物[J].分析化学,2020,48(10):1400-1408.