鹰嘴豆(Cicer arietinum L.),别称桃豆,是世界上栽培面积较大的豆科作物[1],具有耐旱、耐寒、耐盐等特点,新疆是我国鹰嘴豆主产区[2]。鹰嘴豆种子含有20.6%的蛋白质,61.2%的碳水化合物和2.2%的脂肪[3]。因此,它是相对便宜的能源、蛋白质和潜在有益健康的植物化学物质的良好来源。鹰嘴豆可以通过与有效和兼容的根瘤菌的高度特异性的共生关系获得其大量(4%~85%)的氮需求,这对根瘤的形成和N2固定至关重要[4-6]。相关研究表明,当豆科植物接种适当的根瘤菌时,结瘤效率提高,进而促进植物生长,导致籽粒产量增加[7-8]。近些年随着我国吉林、甘肃和宁夏等地区大面积引种鹰嘴豆,发现土壤中缺乏与鹰嘴豆共生的土著根瘤菌。为了满足鹰嘴豆的生长和对氮素的需求,应选择适宜的高效根瘤菌菌株并制备相应的菌剂。
获得制备高浓度的发酵液对高效的根瘤菌菌剂来说十分重要,不同来源的根瘤菌对培养基的选择有所不同[9-10]。高密度发酵的关键是在于为微生物生长提供最佳的生长环境及发酵条件。不同培养基的组成成分是有区别的,根瘤菌的生长繁殖也会受到影响。氮源和碳源是根瘤菌培养基中不可缺少的组成成分,影响着根瘤菌的生长发育[11]。合适的培养条件可以促进根瘤菌的繁殖速率,接种量对发酵过程溶氧量及培养基营养物质消耗有一定的影响[12]。选择适宜的接种量使得根瘤菌充分利用培养基中的营养,接种量过大,导致根瘤菌竞争吸收营养,对根瘤菌生长造成负面作用。培养基优化方法主要包括单因素试验、正交试验和响应面试验,但应用最广泛的方法是单因素与响应面试验的结合。响应面法利用数学统计方法来对因素与响应面的函数关系快速建模,能够在最短的时间及最经济的方法进行试验研究,得到的实验数据最全面且精确[13]。郭海玉等[14]采用响应面法优化苜蓿根瘤菌XGL026培养条件,优化条件下的活菌数可达3.47×1012CFU/mL。目前国内对根瘤菌培养基优化的研究主要集中于紫云英[15]、紫花苜蓿[16]和大豆[17]等经济作物,对鹰嘴豆的研究较少。因此,加大鹰嘴豆根瘤菌菌剂的研究与开发力度,筛选高效的根瘤菌菌剂,推广根瘤菌菌剂的使用面积,对引种鹰嘴豆生产及经济具有重要意义。
本研究以固氮效率高、抗逆性强的鹰嘴豆根瘤菌(Mesorhizobium ciceri)USDA3378为供试菌株,通过比较菌株USDA 3378在酵母甘露醇琼脂(yeast mannitol agar,YMA)、酵母蛋白胨(tryptoneyeast,TY)及修正YMA(MYMA)培养基中的生长情况,筛选最佳培养基。通过单因素试验和响应面试验,优化鹰嘴豆根瘤菌发酵条件,并通过发酵罐扩大培养评价优化发酵条件后菌株USDA 3378的生长效果,以期为鹰嘴豆根瘤菌剂在国内鹰嘴豆种植区域大规模施用提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
供试菌株为中慢生根瘤菌(Mesorhizobiumciceri)USDA 3378:中国农业大学根瘤菌研究中心提供,菌株USDA 3378是前期从日本种植的鹰嘴豆根瘤中分离筛选而出[18]。
1.1.2 试剂
KH2PO4、K2HPO4、无水MgSO4、NaCl、CaCl2、葡萄糖(均为分析纯):天津市永大化学试剂有限公司;甘露醇(分析纯)、琼脂粉(生化试剂):北京市索莱宝科技有限公司;胰蛋白胨、酵母浸粉(均为生化试剂):北京奥博星生物技术有限责任公司。
1.1.3 培养基
酵母甘露醇琼脂(YMA)培养基[19]:甘露醇10 g/L,酵母粉3 g/L,KH2PO4 0.25 g/L,K2HPO4 0.25 g/L,MgSO40.1 g/L,NaCl 0.l g/L,pH 6.8~7.2。121 ℃灭菌20 min。固体YMA培养基:YMA液体培养基中加入18 g/L琼脂粉。
酵母胰蛋白胨(TY)培养基[20]:CaCl2 0.53 g/L,胰蛋白胨5 g/L,酵母粉3 g/L,pH 6.8~7.0。121 ℃灭菌20 min。
修正YMA(MYMA)培养基[21]:葡萄糖15 g/L,酵母粉4 g/L,K2HPO4 0.5 g/L,MgSO4·7H2O 0.2 g/L,NaCl 0.1 g/L,CaCl2 0.05 g/L,pH 6.8~7.2。121 ℃灭菌20 min。
1.2 仪器与设备
AE224电子天平:上海舜宇恒平科学仪器有限公司;DH-600A电热恒温培养箱:北京中兴伟业仪器有限公司;ZWY-100H恒温摇床:上海智城分析仪器制造有限公司;LDZX-50KBS立式高压蒸汽灭菌锅:上海申安医疗器械厂;T6新世纪紫外可见分光光度计:北京普析通用仪器有限责任公司;BLBIO-5GJ机械搅拌发酵罐:上海百伦生物科技有限公司;XY-LS-300W循环水泵:上海欣谕仪器有限公司;QTS-750x2:台州市奥突斯工贸有限公司。
1.3 方法
1.3.1 种子液制备
将菌株USDA 3378接种于YMA平板上,28 ℃静置培养3 d后,接种到5 mLYMA液体培养基中,28 ℃、180 r/min的条件下振荡培养36 h,得到菌株USDA 3378种子液。
1.3.2 发酵培养基的筛选
以发酵液OD600nm值为评价指标,按照1%(V/V)接种量分别接入装液量均为50 mL/250 mL YMA、TY及修正YMA(MYMA)培养基中,在温度28 ℃、180 r/min的条件下振荡培养50 h,培养期间每2 h测定菌液OD600nm值[22],每个处理3次重复。绘制菌株USDA 3378在不同培养基下的生长曲线并选择最适合生长的培养基。
1.3.3 发酵条件优化单因素试验
在筛选出最适合菌株USDA 3378生长的培养基基础上,以甘露醇添加量(6 g/L、8 g/L、10 g/L、12 g/L、14 g/L)、酵母粉添加量(1 g/L、3 g/L、5 g/L、7 g/L、9 g/L)和接种量(1%、2%、3%、4%、5%)(V/V)为试验因素,培养基其他组分添加量保持不变,菌株USDA 3378于28 ℃、180 r/min振荡培养至稳定期(60 h),每3 h测定检测菌体生长量(OD600nm值),每组试验3次重复。OD600nm值越大,表明菌体的生物量越大[23]。以菌体生长量(OD600nm值)作为评价指标,分析各因素对菌株生长量(OD600nm值)的影响。
1.3.4 发酵条件优化响应面试验[24]
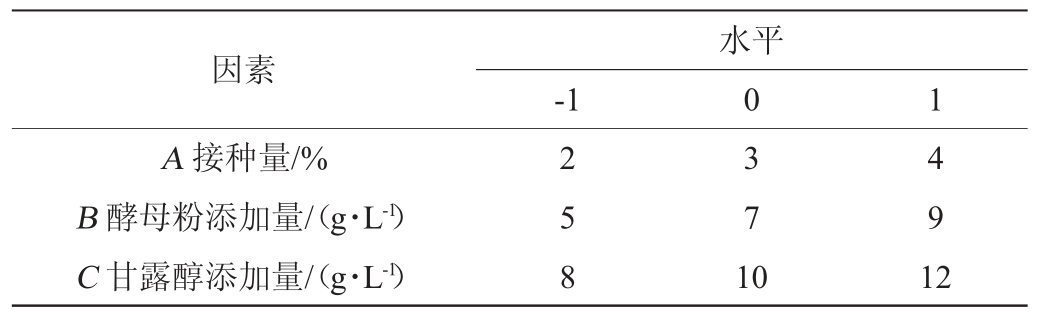
在单因素试验基础上,以接种量(A)、酵母粉添加量(B)、甘露醇添加量(C)为自变量,OD600nm值(Y)为响应值,设计3因素3水平的Box-Behnken试验,响应面试验因素与水平表见表1。
表1 发酵条件优化Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken experiments design for fermentation conditions optimization
1.3.5 发酵罐扩大培养
在优化发酵条件下,进行菌株USDA 3378发酵罐(3 L)扩大培养,以YMA培养基作为对照。将培养好的菌株USDA 3378种子液,按照4%(V/V)接种量接入总体积3 L的发酵罐中,设定发酵条件:培养温度为28 ℃,搅拌速率为100 r/min,pH值为7.0,培养40 h,每4 h测定菌体生长量(OD600nm值)。
1.3.6 数据分析
采用Origin 9.0、SPSS 17.0和Design-Expert 8.0.6软件进行响应面试验数据分析和作图。
2 结果与分析
2.1 不同培养基对鹰嘴豆根瘤菌USDA 3378生长的影响
由图1可知,菌株USDA 3378在YMA、TY和修正YMA(MYMA)培养基中的生长量表现出较大差异。YMA培养基培养的菌株生长效果最佳,培养45 h时OD600nm值最高,为1.629;其次为优化YMA培养基,培养50 h时OD600nm值最高,为1.270;在TY培养基生长速度最慢,培养45 h时OD600nm值为1.131。YMA和修正YMA(MYMA)培养基中营养物质丰富,相比TY培养基更适合根瘤菌生长,但修正YMA(MYMA)培养基的配方是针对大豆根瘤菌的生长优化的[21],不同来源的根瘤菌生长情况不一致。因此,初步筛选YMA培养基作为鹰嘴豆根瘤菌USDA 3378生长的最佳培养基。
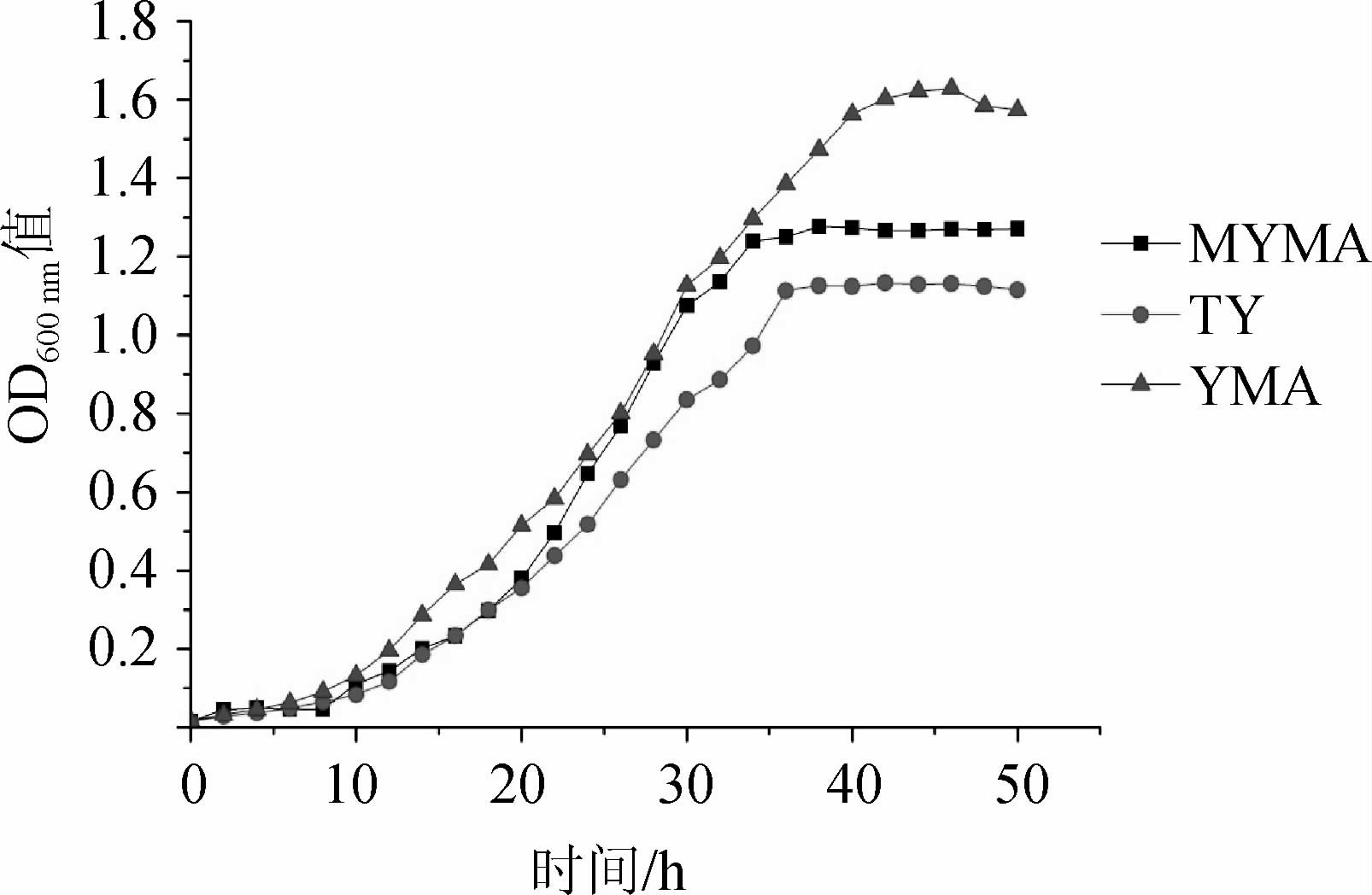
图1 不同培养基对鹰嘴豆根瘤菌USDA 3378生长的影响
Fig.1 Effect of different medium on the growth of Mesorhizobium ciceri USDA3378
2.2 发酵条件优化单因素试验结果
2.2.1 接种量对鹰嘴豆根瘤菌USDA 3378生长的影响
由图2可知,不同接种量对菌株USDA3378生长具有不同的影响。当接种量为1%(V/V)和2%(V/V)时,菌株进入对数期时间比其他接种量推迟约9 h。菌株USDA 3378菌株在接种量为3%时生长速度最好,经过60 h的培养,OD600nm值最高,为1.888;接种量为1%(V/V)时菌株USDA3378的最终OD600nm值最低,为1.683。接种量为5%时,菌株在对数生长期明显高于其他接种量,但最终OD600nm值低于3%(V/V)和2%(V/V)。接种量过高不利于根瘤菌的培养,这可能是由于根瘤菌对培养基中的营养物质的竞争吸收。因此,选择最佳接种量为3%(V/V)。
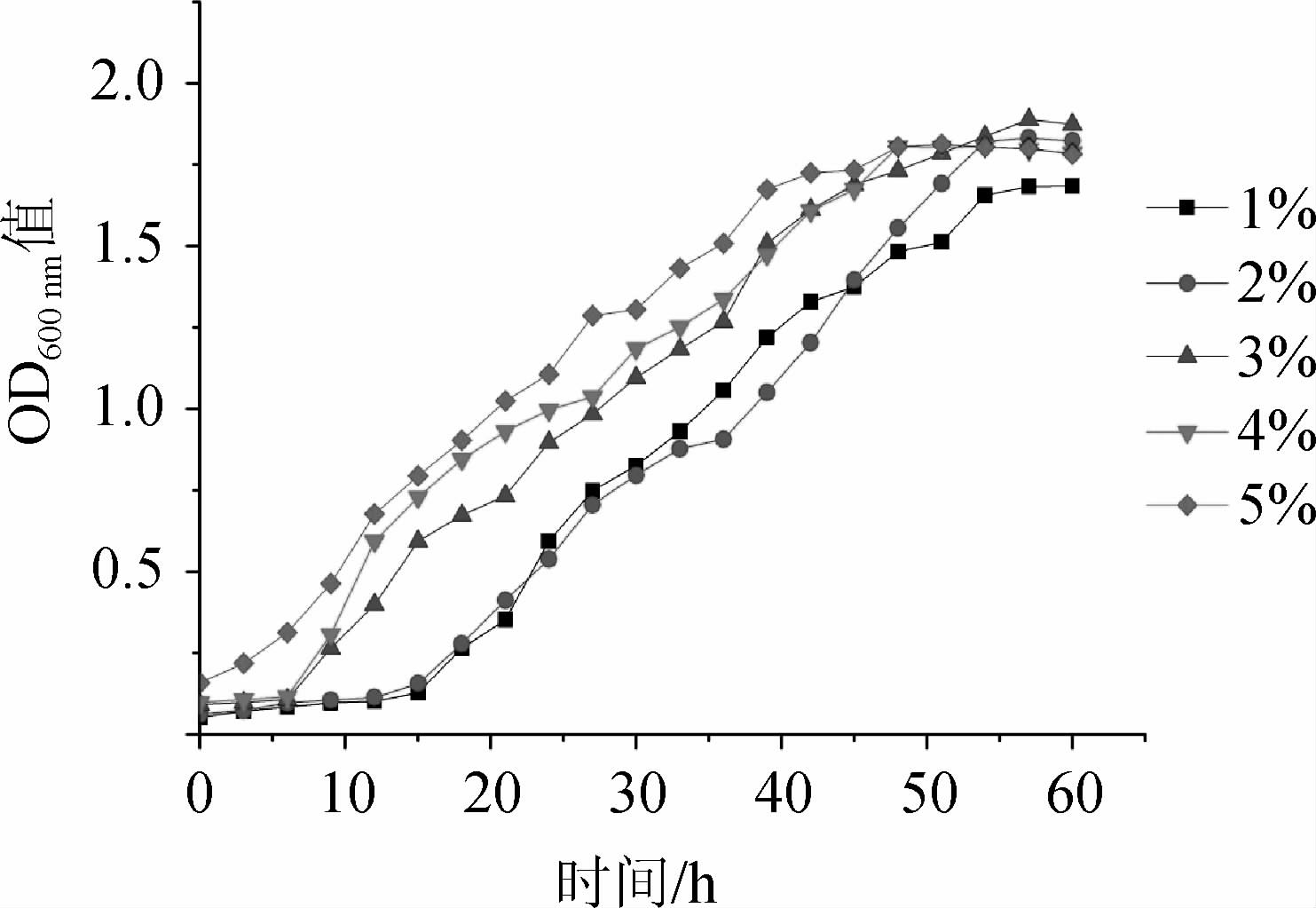
图2 不同接种量对鹰嘴豆中慢生根瘤菌USDA 3378生长的影响
Fig.2 Effect of different inoculum on the growth of Mesorhizobium ciceri USDA3378
2.2.2 酵母粉添加量对鹰嘴豆根瘤菌USDA3378生长的影响
由图3可知,菌株USDA3378在酵母粉添加量为7 g/L时生长效果最好,其OD600nm值在稳定期时最高,为1.873。在酵母粉添加量为1 g/L时,菌株USDA3378生长最差,最终OD600nm值仅为1.038。不同酵母粉添加量条件下,菌株USDA3378的最终生长量结果顺序依次为:7 g/L>5 g/L >9 g/L>3 g/L>1 g/L。酵母粉添加量过低可能是由于营养物质不足以根瘤菌吸收利用影响了根瘤菌的生长,添加量过高反而会影响根瘤菌代谢产物的积累。因此,选择最适酵母粉添加量为7 g/L。
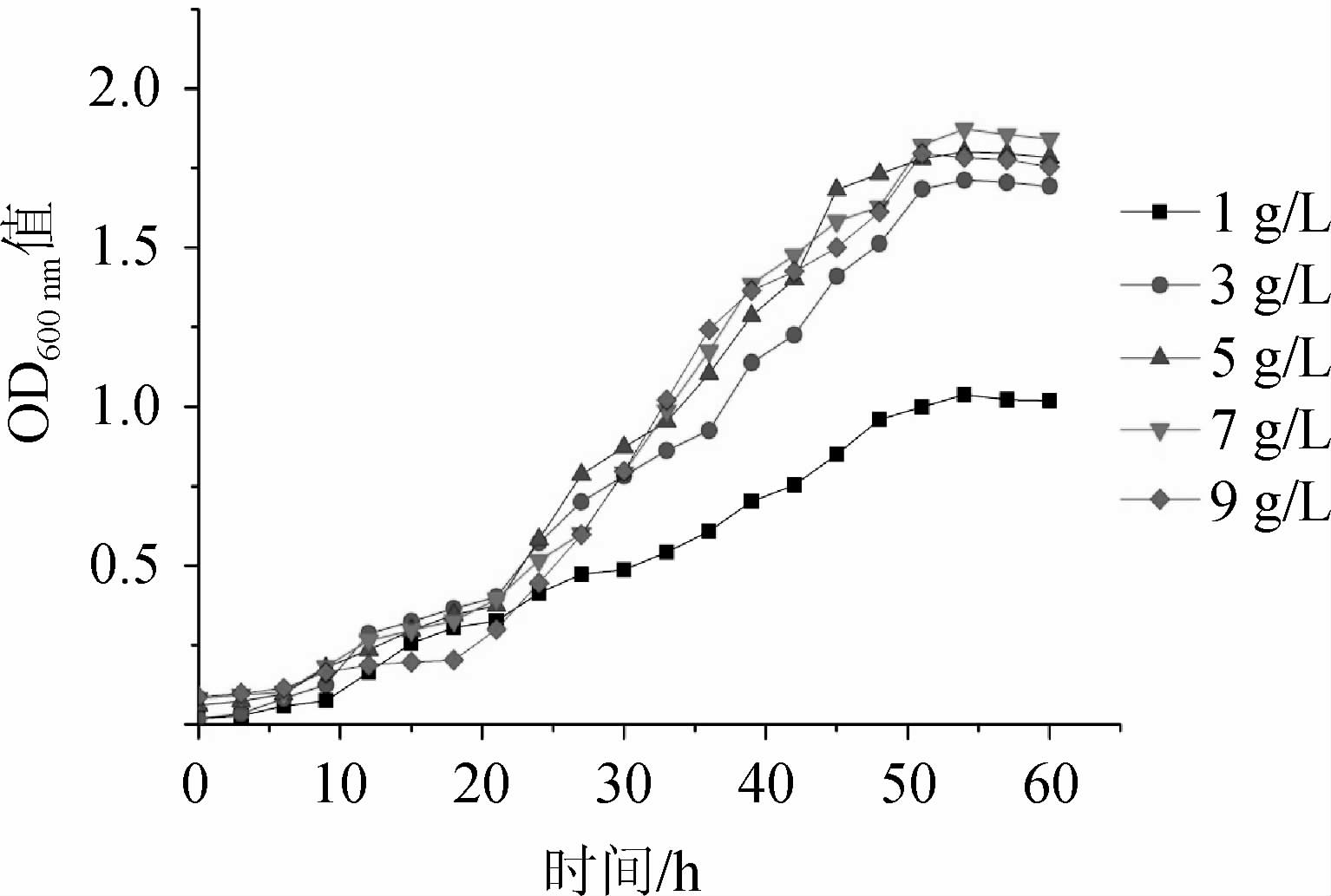
图3 不同酵母粉添加量对鹰嘴豆根瘤菌USDA 3378生长的影响
Fig.3 Effect of different yeast powder addition on the growth of Mesorhizobium ciceri USDA3378
2.2.3 甘露醇添加量对鹰嘴豆根瘤菌USDA 3378生长的影响
由图4可知,甘露醇添加量为6 g/L时,菌株USDA3378生长速度最慢,其OD600nm值仅为1.204。随着甘露醇添加量的增加,菌株USDA3378生长速度也提高,在甘露醇添加量为10 g/L时的生长情况最好,其OD600nm值最高,为1.537;但甘露醇添加量>10 g/L之后,菌株生长量有所下降。适宜的甘露醇添加量能够促进根瘤菌的生长,过高或过低都不适合根瘤菌的培养。因此,选择最适甘露醇添加量为10 g/L。
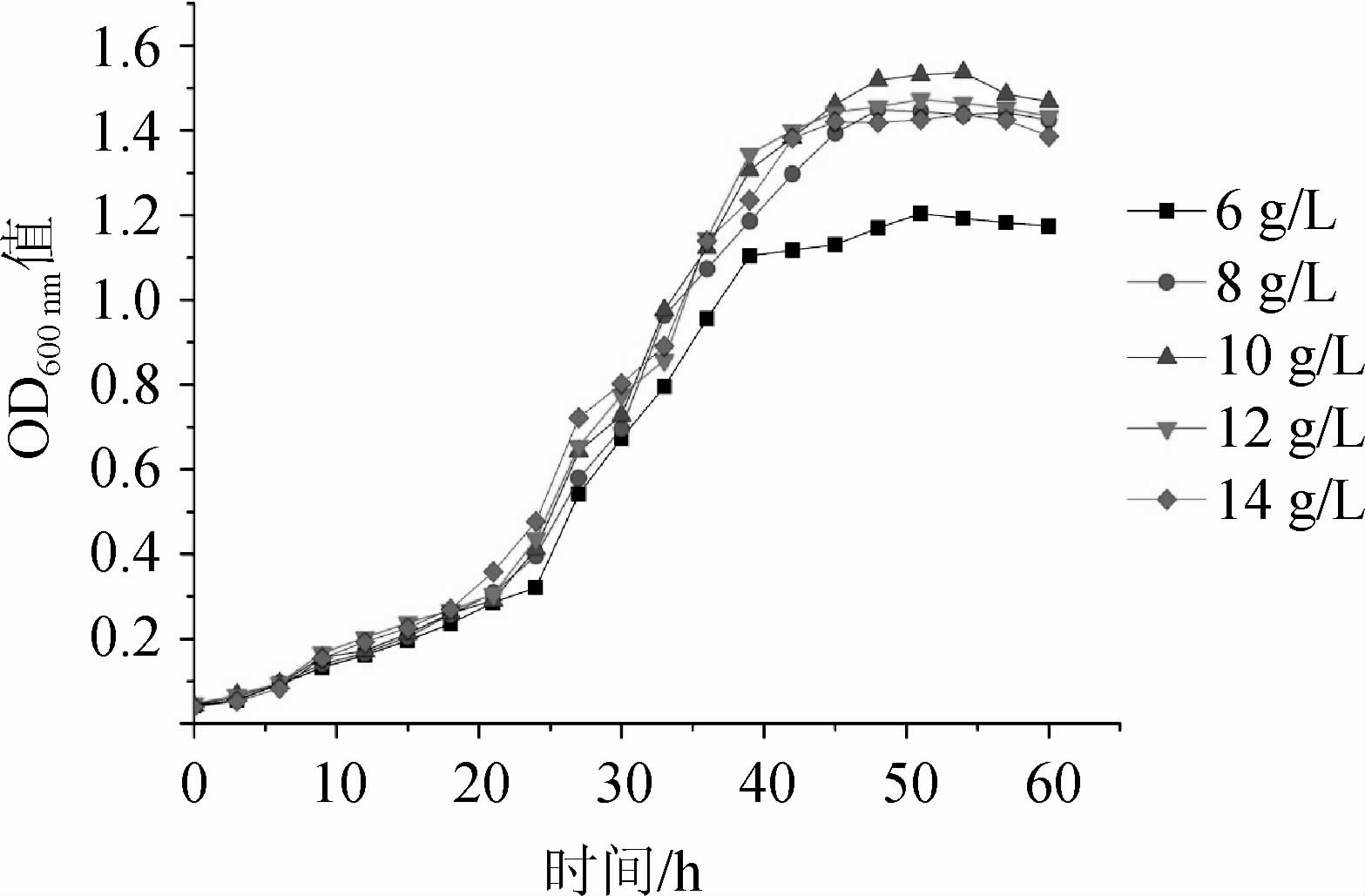
图4 不同甘露醇添加量对鹰嘴豆根瘤菌USDA 3378生长的影响
Fig.4 Effect of different mannitol addition on the growth of Mesorhizobium ciceri USDA3378
2.3 发酵条件优化响应面试验结果
2.3.1 响应面模型回归分析
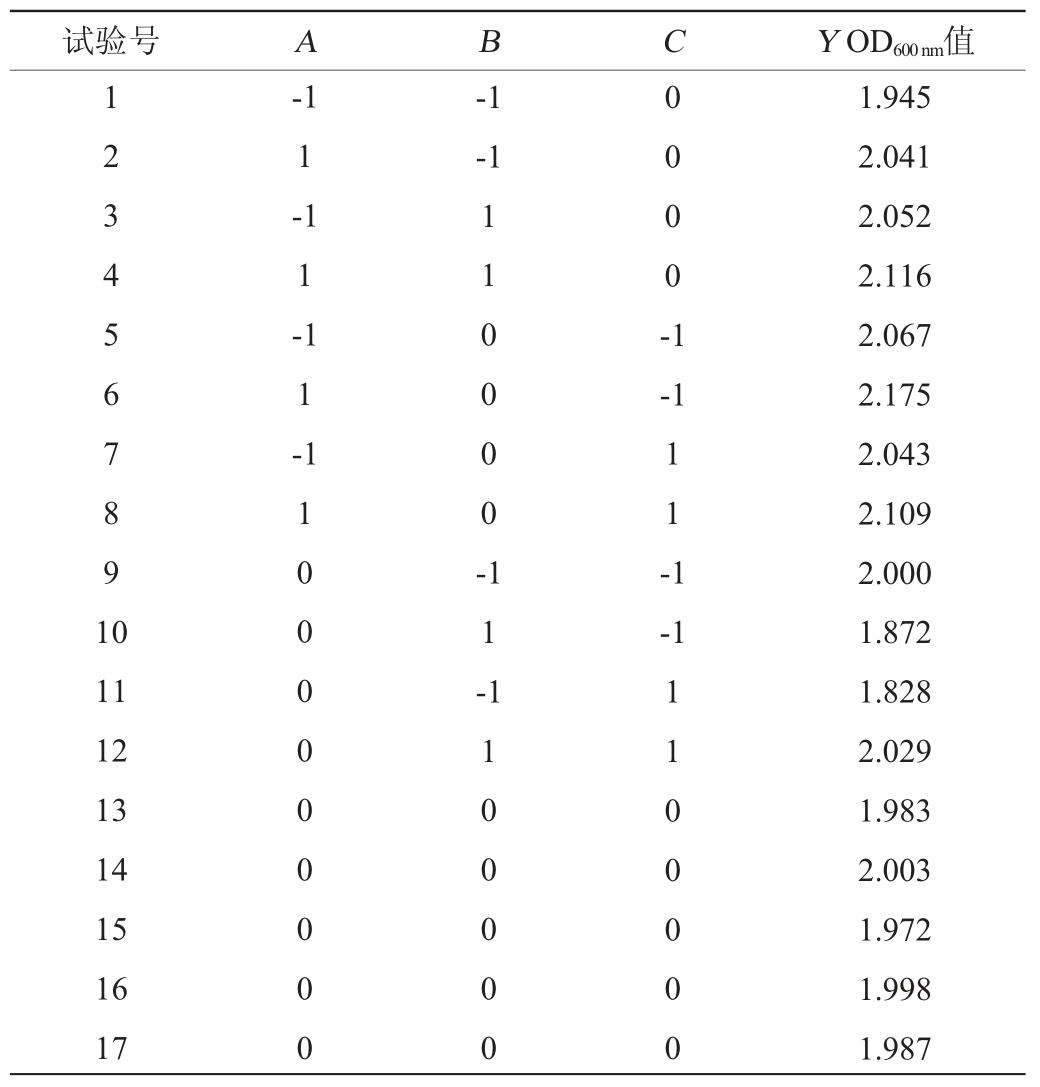
在单因素试验结果基础上,以接种量(A)、酵母粉添加量(B)、甘露醇添加量(C)为自变量,OD600nm值(Y)为响应值,按响应面软件Design-Expert 8.0.6提供Box-Behnken试验设计进行试验,响应面设计方案及结果见表2,方差分析结果见表3。
表2 发酵条件优化Box-Behnken试验设计及结果
Table 2 Design and results of Box-Behnken experiments for fermentation conditions optimization
采用Design-Expert 8.0.6软件对表2试验结果进行多元回归拟合,得出OD600nm值的回归方程为:
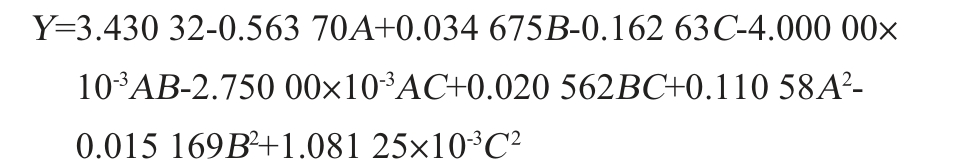
由表3可知,建立的回归模型中F值=34.69,P值<0.000 1,表明该回归模型极显著(P<0.01);而失拟项检验F值=4.22,P值为0.092 4>0.05,失拟项检验不显著,表明该模型可靠[23-24];其决定系数R2=0.992 7,说明回归方程与实际试验拟合程度好,99.27%的数据可用此方程解释[25]。变异系数(coefficient of variation,CV)值=0.96%,说明本试验置信度较高,能够用来对试验结果进行分析和预测。
表3 回归模型方差分析
Table 3 Variance analysis of regression model
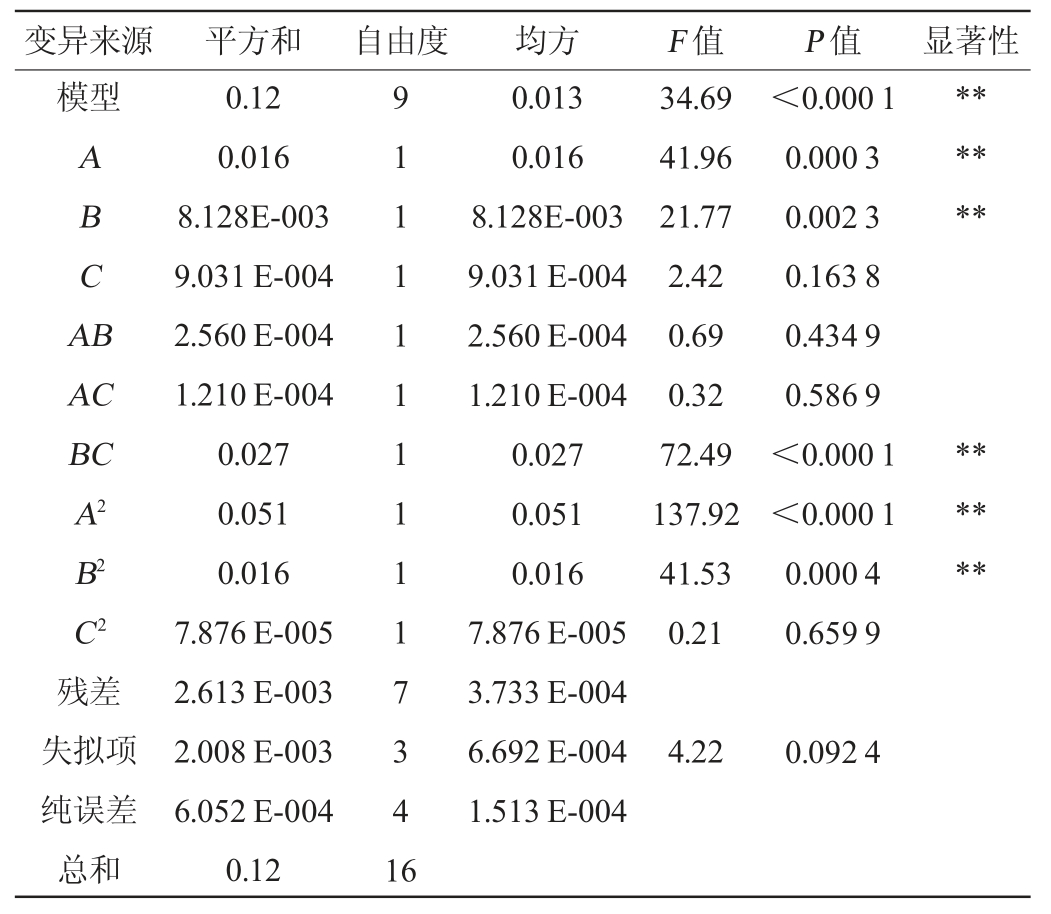
注:“*”表示对结果影响显著(P<0.05),“**”表示对结果影响极显著(P<0.01)。
由P值可知,一次项A、B,交互项BC,二次项A2、B2对OD600nm值的影响极显著(P<0.01);一次项C,交互项AB、AC,二次项C2对OD600nm值的影响均为不显著(P>0.05)。由F值可知,各因素对根瘤菌OD600nm值的影响程度依次为:接种量(A)>酵母粉添加量(B)>甘露醇添加量(C)。
2.3.2 响应曲线分析
运用Design-Expert 8.0.6软件得到甘露醇添加量与酵母粉添加量交互作用对菌株USDA3378生长量(OD600nm值)影响的响应面及等高线见图5。由图5可知,在固定接种量为3%的情况下,甘露醇添加量水平较高时,菌株USDA3378的OD600nm值随着酵母粉添加量的升高,也呈现出先升高后降低的趋势,响应面图较陡,二者互作用对结果影响极显著(P<0.01)。这与表3方差分析结果一致。
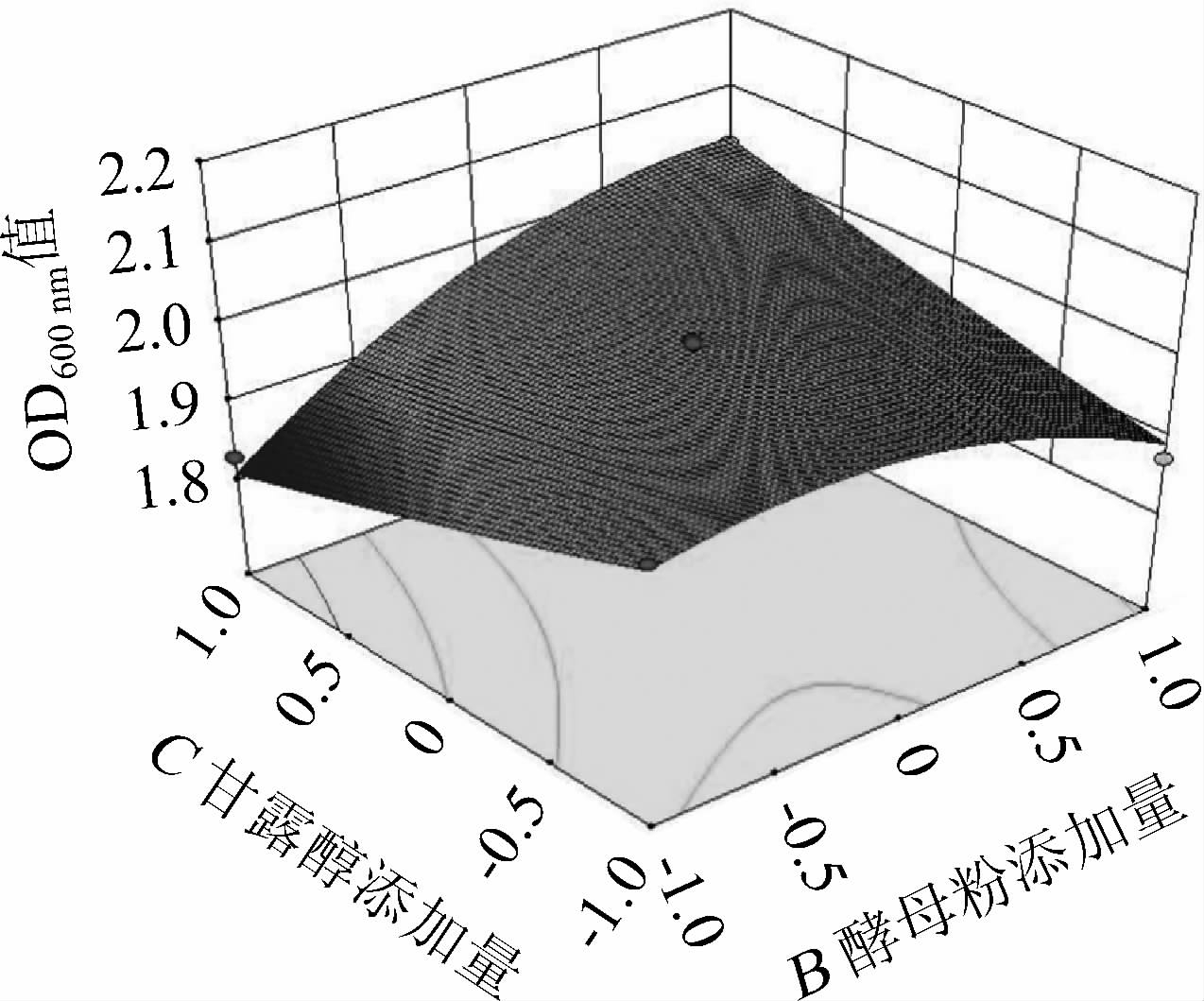
图5 酵母粉添加量与甘露醇添加量交互作用对菌株USDA3378生长量(OD600nm值)影响的响应面及等高线
Fig.5 Response surface plots and contour lines of effects of interaction between yeast powder addition and mannitol addition on the growth(OD600nm value)of strain USDA3378
2.3.3 验证试验
通过Design-Expert 8.0.6软件分析,得到理论最佳发酵条件为:接种量4%,酵母粉添加量8.75 g/L,甘露醇添加量12 g/L。在此优化发酵条件下,菌株USDA3378 OD600nm值的理论值为2.178。在此条件下进行3次平行验证试验,得到菌株USDA3378 OD600nm值的实际值为2.208±0.021,与理论值相差0.03,使用SPSS 17.0软件进行显著性分析,证明实际值与理论值无显著性差异(P=0.210>0.05),表明优化参数可靠。优化后菌株USDA 3378 OD600nm值比优化前提高了35.54%。
2.4 发酵罐扩大培养
与摇瓶培养菌液生长情况相比,菌株USDA 3378在3 L发酵罐中的OD600nm值均有所增加。发酵条件优化后供试菌株的OD600nm值最高可达2.341,比优化前提高了10.42%,这不仅提高了发酵效率,这与摇瓶发酵的OD600nm值(2.208)基本相符,从而验证了摇瓶发酵中优化的发酵条件在发酵罐中高密度发酵的稳定性。
3 结论
本研究通过酵母甘露醇琼脂(YMA)、酵母胰蛋白胨(TY)及修正YMA(MYMA)培养基比较试验,初步筛选鹰嘴豆根瘤菌USDA 3378生长的最佳培养基为YMA培养基通过单因素试验及响应面试验,得到菌株USDA 3378的最佳发酵条件为:甘露醇12 g/L,酵母粉8.75 g/L,KH2PO4 0.25 g/L,K2HPO4 0.25 g/L,无水MgSO4 0.1 g/L,NaCl 0.l g/L;接种量为4%(V/V),28 ℃、180 r/min振荡培养50 h。在此优化条件下,菌株USDA3378 OD600nm值达2.208,比优化前OD600nm值提高了35.54%。菌株USDA 3378在3 L发酵罐中的OD600nm值均有所增加,更快进入对数期和稳定期,OD600nm值最高可达2.341,这验证了优化的发酵条件在高密度发酵中的稳定性。后续研究会将鹰嘴豆根瘤菌菌剂发酵工艺进一步完善,为鹰嘴豆根瘤菌菌剂产业化生产提供技术支持。
[1]GUNNABO A H,VAN HEERWAARDEN J,GEURTS R,et al.Phylogeography and symbiotic effectiveness of rhizobia nodulating chickpea(Cicer arietinum L.)in Ethiopia[J].Microb Ecol,2021,81(3):703-716.
[2]库尔班·尼扎米丁,玉山江·吐尼亚孜.农牧区食饲兼用保健作物鹰嘴豆及其栽培技术[J].新疆畜牧业,2022,37(1):42-45.
[3]GEBREMARIAM M,TESFAY T.Effect of P application rate and Rhizobium inoculation on nodulation,growth,and yield performance of chickpea(Cicer arietinum L.)[J].Int J Agron,2021,21(1):1-14.
[4]KHAITOV B,KARIMOV A,ABDIEV A,et al.Beneficial effect of Rhizobium inoculation on growth and yield of chickpea(Cicer arietinum L.)in saline soils[J].Bulg J Agr Sci,2020,26(1):96-104.
[5]WALLEY F L,KYEI-BOAHEN S,HNATOWICH G,et al.Nitrogen and phosphorus fertility management for desi and kabuli chickpea[J].Can J Plant Sci,2005,85(1):73-79.
[6]SINGH Z,SINGH G,SARAVAIYA S N.Role of Rhizobium in chickpea(Cicer arietinum L.)production-A review[J].Agr Rev,2018,38(1):31-39.
[7]KHAITOV B.Salinity tolerance of chickpea genotypes (Cicer arietinum L.) and symbiotic performance in arid saline environment[J].Legume Genomics Genet,2016,7(10):1-12.
[8]ABDIEV A,KHAITOV B,TODERICH K,et al.Growth,nutrient,uptake and yield parameters of chickpea(Cicer arietinum L.)enhance by Rhizobium and Azotobacter inoculations in saline soil[J].J Plant Nutr,2019,42(20):2703-2714.
[9]李正鹏,何庆元,史钧,等.大豆根瘤菌AWCS13-4菌株培养条件的筛选与优化[J].安徽科技学院学报,2016,30(3):14-19.
[10]吴萍,李正鹏,何庆元,等.大豆根瘤菌AHM2B菌株培养条件的筛选与优化[J].大豆科学,2014,33(6):953-956.
[11]杨晓蕾,李建宏,姚拓,等.复合促生菌剂发酵条件优化及其对青稞促生效果评价[J].草地学报,2022,30(1):212-219.
[12]LI R F,XU Y.Fermentation optimization to improve production of antagonistic metabolites by Bacillus subtilis strain BS501a[J].J Cent South Univ T,2011,18(4):1047-1053.
[13]李勤,余彩霞,邓林.微生物培养基的设计优化探讨[J].轻工科技,2020,36(4):5-6.
[14]郭海玉,罗明,何媛,等.新疆紫花苜蓿根瘤菌XGL026发酵条件的响应面法优化筛选[J].草地学报,2016,24(3):624-631.
[15]吕黎,王蕾,周艳,等.响应面法优化紫云英根瘤菌发酵条件[J].江苏农业科学,2014,42(4):323-326.
[16]闫洪雪,刘露,李丽,等.苜蓿根瘤菌的发酵工艺优化[J].北方农业学报,2016,44(4):53-55.
[17]肖亦农,徐琼.大豆根瘤菌HH103菌株培养基的筛选与优化[J].微生物学杂志,2011,31(6):92-95.
[18]TAN Z,HUREK T,VINUESA P,et al.Specific detection of Bradyrhizobium and Rhizobium strains colonizing rice(Oryza sativa)roots by 16S-23S ribosomal DNA intergenic spacer-targeted PCR[J].Appl Environ Microb,2001,67(8):3655-3664.
[19]张欣,杨旭升,程国立,等.苜蓿根瘤菌菌株发酵生产工艺优化[J].黑龙江科学,2015,6(9):44-45.
[20]张俊杰.新疆鹰嘴豆根瘤菌的生物学特征研究[D].北京:中国农业大学,2013.
[21]吴红慧,周俊初.根瘤菌培养基的优化和剂型的比较研究[J].微生物学通报,2004(2):14-19.
[22]闫洪雪,刘露,李丽,等.苜蓿根瘤菌的发酵工艺优化[J].北方农业学报,2016,44(4):53-55.
[23]钱文静,胡永红,杨文革.响应面法优化生物活菌剂解淀粉芽孢杆菌JT-84发酵工艺[J].河北农业科学,2018,22(6):65-72.
[24]甄涛,王玉霞,赵晓宇,等.慢生型大豆根瘤菌HW-05高密度发酵条件优化[J].生物技术,2021,31(5):503-507.
[25]张朝正,李意,赵华.响应面法优化壳聚糖酶发酵培养基[J].中国酿造,2022,41(1):197-203.
[26]李盼盼,张庆芳,刘春莹,等.鼠李糖乳杆菌LP216高密度发酵培养基优化[J].中国酿造,2022,41(4):87-92.
[27]张俊杰,郭晨,刘毅飞,等.响应面法优化卡布里鹰嘴豆蛋白提取工艺[J].食品工业科技,2018,39(17):167-172.