胞外多糖(exopolysaccharides,EPS)是微生物在生长代谢过程中分泌到周围环境中的一类复杂的高分子聚合物,往往通过多个单糖以糖苷键的形式连接而成[1]。根据单糖组成的不同将胞外多糖分为同质多糖和异质多糖。同质多糖仅由一种单糖分子重复聚合而成,而异质多糖一般由两种及以上不同单糖重复单元聚合而成[2]。相比于动植物多糖,微生物多糖因生产周期短、产量较高、获取条件易于控制且不受外界环境(季节和地区)条件的限制,同时在各个领域均有巨大的应用潜力,而备受关注[3]。
乳酸菌(lactic acid bacteria,LAB)在食品领域中有着几千年应用的历史,一直被公认为安全(generally recognized as safe,GRAS)的微生物,其代谢产物EPS也被认为是可食用且安全无害的[4]。在生理活性方面,乳酸菌胞外多糖(LAB-EPS)具有抗氧化、抗癌、免疫调节、降低胆固醇、调节胃肠道菌群和维持微生态平衡等功效[5]。在理化功能方面,LAB-EPS可作为一种新的天然食品添加剂,用于改善部分食品(酸乳和豆制品)的质构、黏稠度和流变性能,从而大大提高口感和风味。LAB-EPS因具有双重功效,被越来越广泛应用于食品和医疗领域中。截止目前,常见产胞外多糖的乳酸菌主要有明串珠菌(Leuconostoc)[6]、链球菌(Streptococcus)[7]、乳杆菌(Lactobacillus)[8]、双歧杆菌(Bifidobacterium)[9]等。王艳等[10]从乳制品中筛选出3株高产EPS的发酵乳杆菌(Lactobacillus fermentum)RJ2-1-4、发酵乳杆菌TG4-1-1和粪肠球菌(Enterococcus faecium)TG12-1-5,其EPS产量分别为206.88 mg/L、199.46 mg/L、198.57 mg/L。ZHANG G H等[11]从传统酸面团筛选出51株乳酸菌,旧金山乳酸菌(L.sanfranciscensis)Ls-1001的产胞外多糖的能力最强,优化后产量达到249.30 mg/L。挖掘高产胞外多糖的乳酸菌资源,并获得多样的结构和功能特性,对于进一步揭秘胞外多糖的构效关系和探索应用潜力具有重要的意义。
本研究从实验室保藏的17株乳酸菌中筛选出高产胞外多糖菌株,结合形态学观察与分子生物学对其进行鉴定,采用单因素试验和响应面法优化其产胞外多糖发酵条件,并考察其结构和抗氧化活性,以期为产胞外多糖乳酸菌资源的开发利用提供参考,为EPS的工业化生产以及应用鉴定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
17株乳酸菌(分别编号为A2、B3、Y4、C3、D5、E8、H1、H3、H4、H9、H2、C7、K5、K3、F4、I2和J2):分离自四川传统发酵食品中(谷物醋、泡菜、豆豉),并保存于四川大学轻工科学与工程学院生物技术实验室。
1.1.2 试剂
无水乙醇、硫酸、苯酚、三氯乙酸(trichloroacetic acid,TCA)、1,1二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonicacid),ABTS)(均为分析纯):天津致远化学试剂有限公司;细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技有限公司。
1.1.3 培养基
MRS液体培养基[12]:蛋白胨10 g,牛肉膏10 g,酵母浸粉5 g,柠檬酸氢二铵2 g,葡萄糖20 g,乙酸钠5 g,磷酸氢二钾2 g,七水硫酸镁0.25 g,硫酸锰0.25 g,吐温80 1 mL,蒸馏水1 000 mL,pH 6.2~6.5。MRS固体培养基:在MRS液体培养基基础上添加1.8%琼脂。改良MRS培养基:在MRS液体培养基基础上使用蔗糖代替葡萄糖。
以上培养基均于115 ℃高压蒸汽灭菌25 min。
1.2 仪器与设备
PCDX-F-30纯水仪:成都品成科技有限公司;ETV-50SK蒸汽灭菌锅:北京申安有限公司;PH-140A电热恒温培养箱:上海恒一科学仪器有限公司;S1000TM Thermal Cycle聚合酶链式反应(polymerase chain reaction,PCR)仪:美国BIO RAD有限公司;TG16-W微量高速离心机:长沙湘仪离心机仪器有限公司;UV-1300D型紫外-可见分光光度计:北京光谱设备有限公司;DYY-6D电泳仪:北京六一生物科技有限公司;JS-2000全自动凝胶成像分析仪:上海培清科技有限公司;is10傅里叶变换红外光谱仪、Apreo 2C扫描电子显微镜:美国赛默飞世尔科技有限公司。
1.3 方法
1.3.1 产胞外多糖乳酸菌的筛选
将实验室保藏于-80 ℃冰箱中的17株乳酸菌接种于MRS液体培养基,在30 ℃培养24 h进行活化。活化后的菌株分别转接至250 mL改良MRS液体培养基中,在30 ℃条件下发酵48 h后,通过离心(10 000 r/min、10 min)收集产糖发酵液;加入3倍预冷体积分数95%乙醇,搅拌均匀后,放置在4 ℃冰箱中过夜沉淀,弃上清,收集沉淀物。随后加入适量的超纯水溶解沉淀物,并用4%三氯乙酸和Sevage试剂相结合的方法去除蛋白[13],上清液装入透析袋中(8~14 kDa),在流动的超纯水中透析72 h,每隔4 h换一次水,以去除杂质,得到粗多糖溶液,并测定胞外多糖含量。
1.3.2 高产胞外多糖菌株的鉴定
(1)形态学观察
将分离纯化得到的单菌落进行革兰氏染色,并于光学显微镜下进行观察;同时取少量菌体,使用磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤,离心后收集细胞;经2.5%戊二醛固定后,采用不同体积分数(10%、30%、50%、70%、90%和100%)的乙醇脱水,干燥,喷金后使用扫描电子显微镜观察其形态。
(2)分子生物学鉴定
提取菌株DNA并进行16S rDNA PCR扩增,扩增体系(25 μL):引物1492R和27F各2 μL,Mix 20 μL,DNA模板1.0 μL。扩增条件:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,30个循环,72 ℃延伸10 min,并4 ℃保存。将扩增产物进行1.0%琼脂糖凝胶电泳,在150 V电压下电泳30 min。扩增产物送至成都擎科生物科技有限公司进行测序,将得到的菌株E8的16S rDNA序列上传至美国国家生物技术信息中心(national center for biotechnology information,NCBI)网站进行基本局部比对搜索工具(basic localalignmentsearchtool,BLAST)同源性对比。使用MEGA 7.0软件中的邻接(neighbor-joining,NJ)法建立菌株的系统发育树[14]。
1.3.3 乳酸菌产胞外多糖发酵条件优化
(1)单因素试验
以MRS培养基为基础培养基,固定培养基中柠檬酸氢二铵乙酸钠、磷酸氢二钾、七水硫酸镁、硫酸锰、和吐温80的含量。分别考察不同的碳源(葡萄糖、乳糖、蔗糖、麦芽浸粉、半乳糖、甘露糖、甘油、麦芽糖)(添加量均为2%)、最佳碳源添加量(1%、2%、3%、4%、5%、6%)、不同的复合氮源(牛肉膏和蛋白胨、牛肉膏和大豆蛋白胨、牛肉膏和胰蛋白胨、蛋白胨和大豆蛋白胨、胰蛋白胨和蛋白胨、胰蛋白胨和大豆蛋白胨、牛肉膏和酪蛋白胨、酪蛋白胨和蛋白胨)(比例均为1∶1,添加量均为2%)、最佳氮源添加量(0.5%、1.0%、1.5%、2.0%、2.5%、3.0%、3.5%、4.0%)、初始pH值(4.0、4.5、5.0、5.5、6.0、6.5、7.0)、接种量(0.5%、1.0%、1.5%、2.0%、2.5%、3.0%、3.5%、4.0%、4.5%、5.0%)、发酵时间(12 h、24 h、36 h、48 h、60 h、72 h、84 h)和发酵温度(25 ℃、30 ℃、37 ℃、40 ℃、45 ℃)对胞外多糖产量的影响。
(2)响应面试验
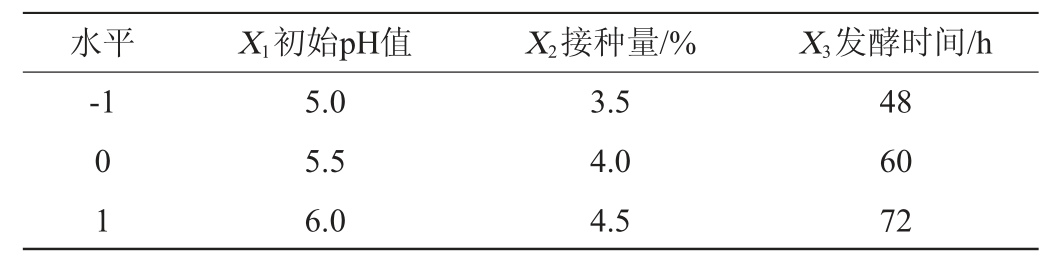
在单因素试验的基础上,选取初始pH值(X1)、接种量(X2)和发酵时间(X3)为考察因素,以胞外多糖产量(Y)为响应值,采用软件Design Expert 12.0的Box-Behnken试验设计3因素3水平的响应面试验,对乳酸菌产胞外多糖发酵条件进行优化,试验因素与水平见表1。
表1 乳酸菌产胞外多糖发酵条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for fermentation conditions optimization of exopolysaccharides by lactic acid bacteria
1.3.4 胞外多糖的结构表征(1)紫外光谱分析
将去除蛋白的EPS样品冷冻干燥(-80 ℃、48 h)后溶于去离子水中,制备质量浓度为1 mg/mL的EPS溶液。在波长200~350 nm范围对样品进行全扫描,检测样品中是否存在蛋白和核酸。
(2)红外光谱分析
红外光谱分析参照ZHOU Y等[15]的方法进行,称取适量的EPS样品与干燥的KBr粉末混匀,并研磨压片,通过is10傅立叶变换红外光谱仪在4 000~500 cm-1范围记录样品的红外光谱图。
(3)扫描电镜分析
称取5mgEPS样品固定在载物台上,并在表面镀上导电金膜。通过扫描电子显微镜(scanning electron microscopy,SEM)拍照记录不同倍数下(500×,3 000×)的微观结构。
1.3.5 胞外多糖含量的测定
通过苯酚-硫酸法[13]测定胞外多糖含量,以无水葡萄糖作为标准品,以葡萄糖含量(X)为横坐标,以吸光度值(Y)为纵坐标绘制葡萄糖标准曲线,建立标准曲线回归方程为:Y=0.017 88X-0.015 772,相关系数R2=0.999 15。取粗多糖溶液以同样的方法进行测定,获得其在波长490 nm处的吸光度值,通过标准曲线回归方程计算样品的胞外多糖含量,从而确定高产胞外多糖菌株。
1.3.6 胞外多糖的抗氧化活性
参照DONG Z等[16-17]的方法并做了修改,分别考察了EPS对于DPPH自由基、ABTS自由基、羟自由基清除能力,并以VC水溶液(质量浓度为0、1 mg/mL、3 mg/mL、5 mg/mL、7 mg/mL、9 mg/mL)作为阳性对照。
DPPH自由基清除能力的测定:将EPS溶解在去离子水中,制备不同质量浓度(0、1 mg/mL、3 mg/mL、5 mg/mL、7 mg/mL、9 mg/mL)的EPS溶液,取10 mg的DPPH溶解到体积分数95%乙醇中,配备0.1 mmol/L DPPH溶液。取1 mL不同质量浓度EPS溶液和1 mL DPPH溶液(1∶1)混合均匀,避光反应30 min后,在波长517 nm处测量吸光度值。DPPH自由基清除率计算公式如下:
式中:A0是阳性对照组的吸光度值;A为样品溶液的吸光度值。
ABTS自由基清除能力的测定:吸取等体积ABTS溶液(7 mmol/L)和过硫酸钾(2.45 mmol/L)混合均匀,在室温条件下避光保存16 h,得到混合液。使用磷酸盐缓冲液(pH 7.4)将混合液稀释至在波长734 nm处吸光度值为0.7±0.02,获得ABTS工作液。取不同质量浓度(0、1 mg/mL、3 mg/mL、5 mg/mL、7 mg/mL、9 mg/mL)的EPS溶液与ABTS工作液混合(1∶10),避光反应30 min后,在波长734 nm处测定吸光度值。ABTS自由基清除率计算公式如下:
式中:A1和A2分别代表样品和空白对照(去离子水代替样品)的吸光度值。
羟自由基清除能力的测定:吸取水杨酸溶液(9 mmol/L)0.5 mL、H2O2(8.8 mmol/L)5 mL、FeSO4溶液(9 mmol/L)0.5 mL和不同浓度EPS样品1 mL充分混合,在室温条件下避光反应30 min,随后在510 nm处测定吸光度值。羟自由基清除率计算公式如下:
式中:A3、A4和A5分别代表样品组、等体积无菌水代替FeSO4溶液组和等体积无菌水代替样品组的吸光度值。
1.3.7 数据处理
每组平行测定3次,结果以“平均值±标准差”表示,使用SPSS 20和Origin 9.0软件进行数据处理和图表绘制,采用方差分析进行显著性差异分析,P<0.05表示差异显著。
2 结果与分析
2.1 产胞外多糖菌株的筛选
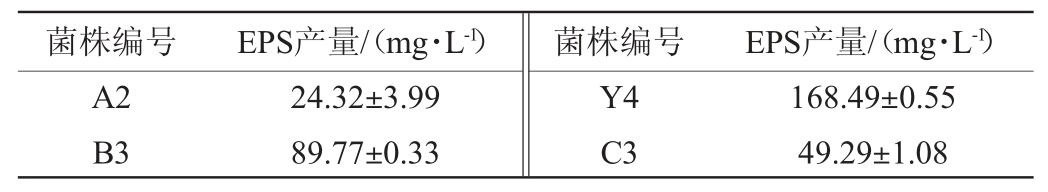
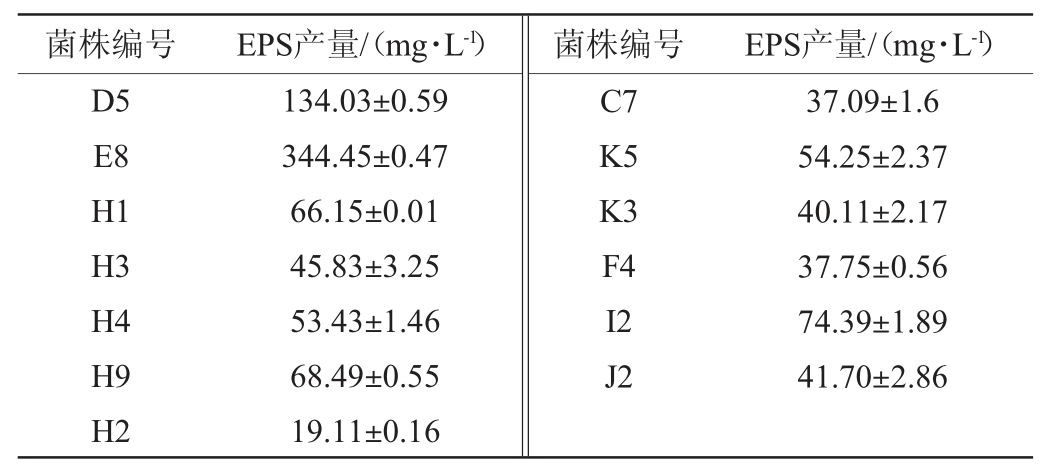
不同菌株胞外多糖产量结果见表2。由表2可知,17株菌株的EPS产量范围为19.11~344.45 mg/L,其中来源于谷物醋中的菌株E8 EPS产量最高(344.45 mg/L)。因此选择菌株E8进行后续试验。
表2 不同菌株的胞外多糖产量
Table 2 Exopolysaccharides yield of different strains
续表
2.2 产胞外多糖菌株的鉴定
2.2.1 形态学观察
菌株E8的菌落与细胞形态见图1。由图1A可知,菌落的形态为乳白色凸起,由图1B可知,菌株E8呈球状,无芽孢,革兰氏染色颜色呈蓝紫色,为革兰氏阳性;由图1C可知,细胞呈现出成对的椭球状。
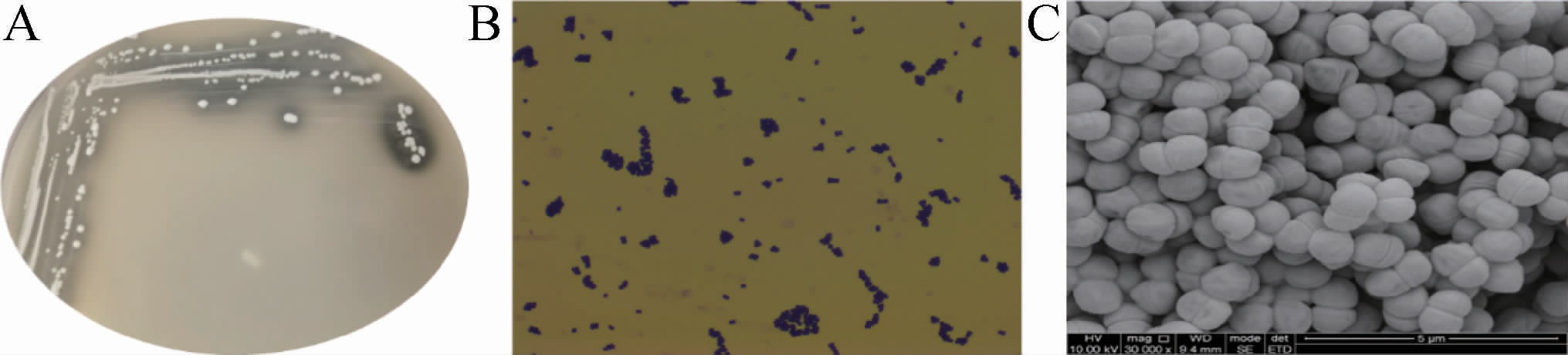
图1 菌株E8的菌落形态(A)、革兰氏染色结果(B)及细胞形态(C)
Fig.1 Colony morphology (A),gram staining results (B) and cell morphology (C) of strain E8
2.2.2 分子生物学鉴定
基于16S rDNA基因序列,菌株E8的系统发育树见图2。由图2A可知,在1 500 bp出现一条明显的荧光条带,表明PCR扩增成功。由图2B可知,菌株E8与戊糖片球菌(Pediococcus pentosaceus)聚于一支,亲缘关系最近,同源性最高为100%。结合形态特征,将菌株E8鉴定为戊糖片球菌(Pediococcus pentosaceus)。
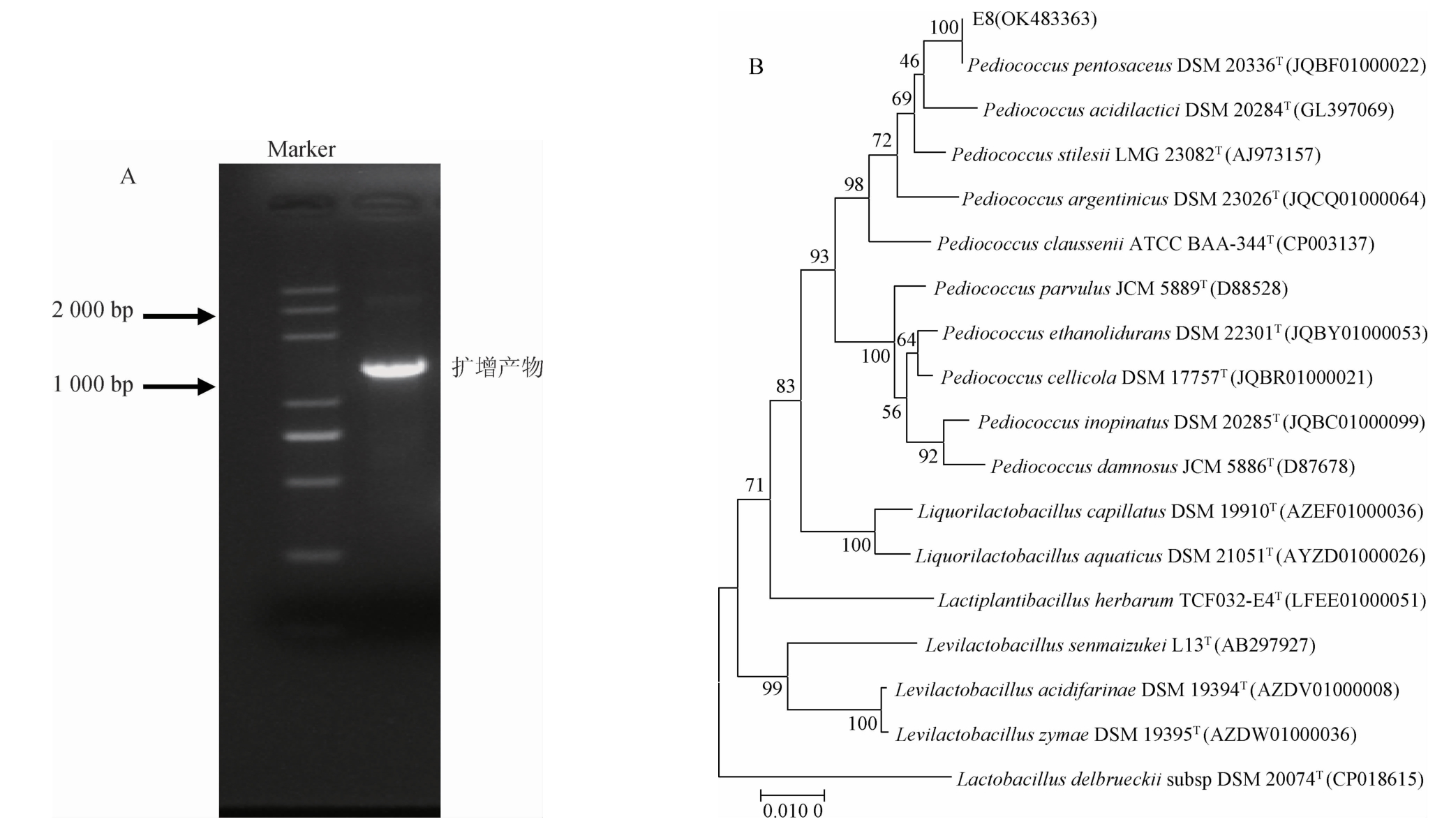
图2 菌株E8的PCR扩增产物电泳图(A)及基于16S rDNA序列构建的系统发育树(B)
Fig.2 Electrophoresis of PCR amplification products (A) and phylogenetic tree based on 16S rDNA gene sequence (B) of strain E8
2.3 菌株产胞外多糖发酵条件优化单因素试验结果
2.3.1 培养基的优化
(1)碳源种类及最佳碳源添加量的确定
碳源种类及最佳碳源添加量对EPS产量的影响见图3。由图3A可知,蔗糖作为碳源,EPS的产量显著高于其他碳源(P<0.05),EPS产量达到417.07 mg/L。姜云芸等[18]考察植物乳杆菌K25产胞外多糖能力时发现,葡萄糖为最佳碳源时,其产量达到最大值(235.40 mg/L)。而LAKRA A K等[19]研究结果表明,以甘露糖为碳源时,菌株Weissella cibaria MD2的胞外多糖产量达到最大值。结果表明,不同的菌株对优势碳源的需求存在一定的差异。因此,选取蔗糖作为最佳碳源。
由图3B可知,随着蔗糖添加量在1%~5%范围内的增加,菌株E8的EPS产量逐渐升高;当蔗糖添加量为5%时,EPS产量达到最大值,为722.95 mg/L;当蔗糖添加量>5%之后,EPS产量逐渐下降。因此,选择最适的蔗糖添加量为5%。
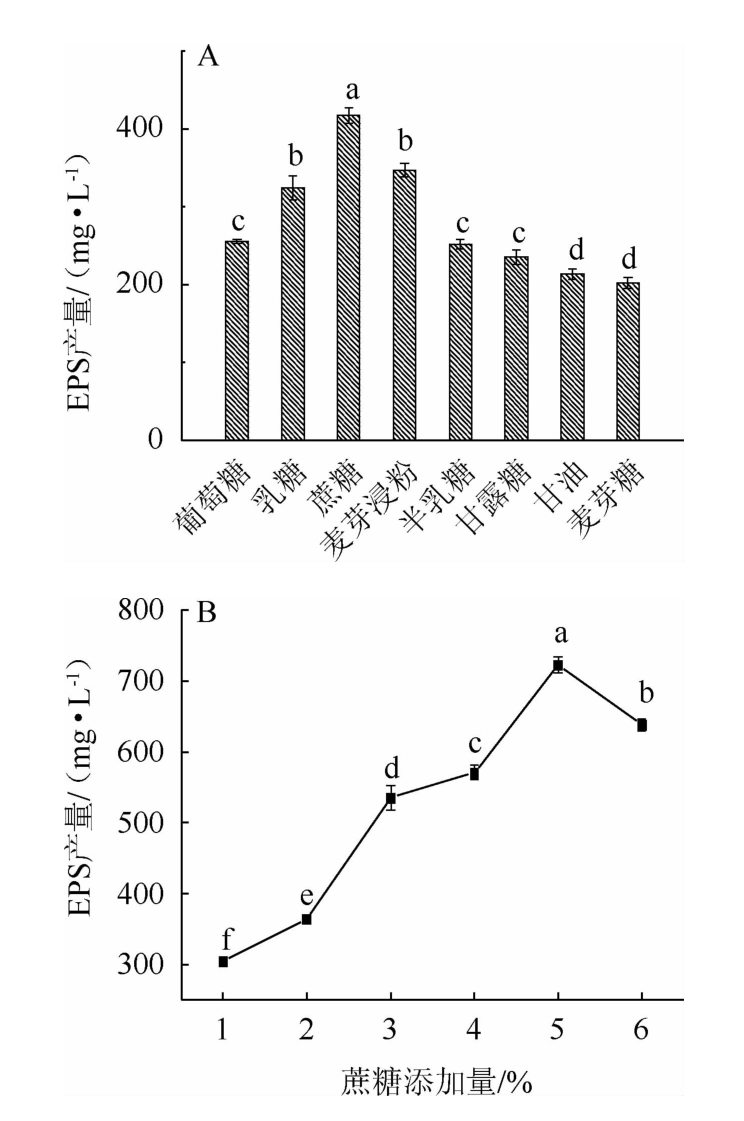
图3 碳源种类(A)及蔗糖添加量(B)对胞外多糖产量的影响
Fig.3 Effects of carbon sources (A) and sucrose addition (B)on the yield of exopolysaccharides
不同字母代表差异显著(P<0.05)。下同。
(2)氮源种类及添加量的确定
氮源种类及蛋白胨和大豆蛋白胨(1∶1)添加量对EPS产量的影响见图4。由图4A可知,当氮源为蛋白胨和大豆蛋白胨(1∶1)时,菌株E8的EPS产量达到最大值,为830.69 mg/L,显著高于其他氮源组合的EPS产量(P<0.05),由此可知,蛋白胨和大豆蛋白胨能够明显促进EPS合成。这与一些研究报道的蛋白胨和大豆蛋白胨能够显著提高菌株EPS产量的结论一致[20-21]。因此,选取蛋白胨和大豆蛋白胨(1∶1)作为氮源。由图4B可知,随着蛋白胨和大豆蛋白胨(1∶1)添加量在0.5%~2.5%范围内的不断升高,EPS产量呈升高的趋势;当蛋白胨和大豆蛋白胨(1∶1)添加量为2.5%时,菌株E8的EPS产量达到最高值,为853.92 mg/L;蛋白胨和大豆蛋白胨(1∶1)添加量>2.5%时,EPS产量逐渐下降。综合上述分析,选择最适蛋白胨和大豆蛋白胨(1∶1)添加量为2.5%。
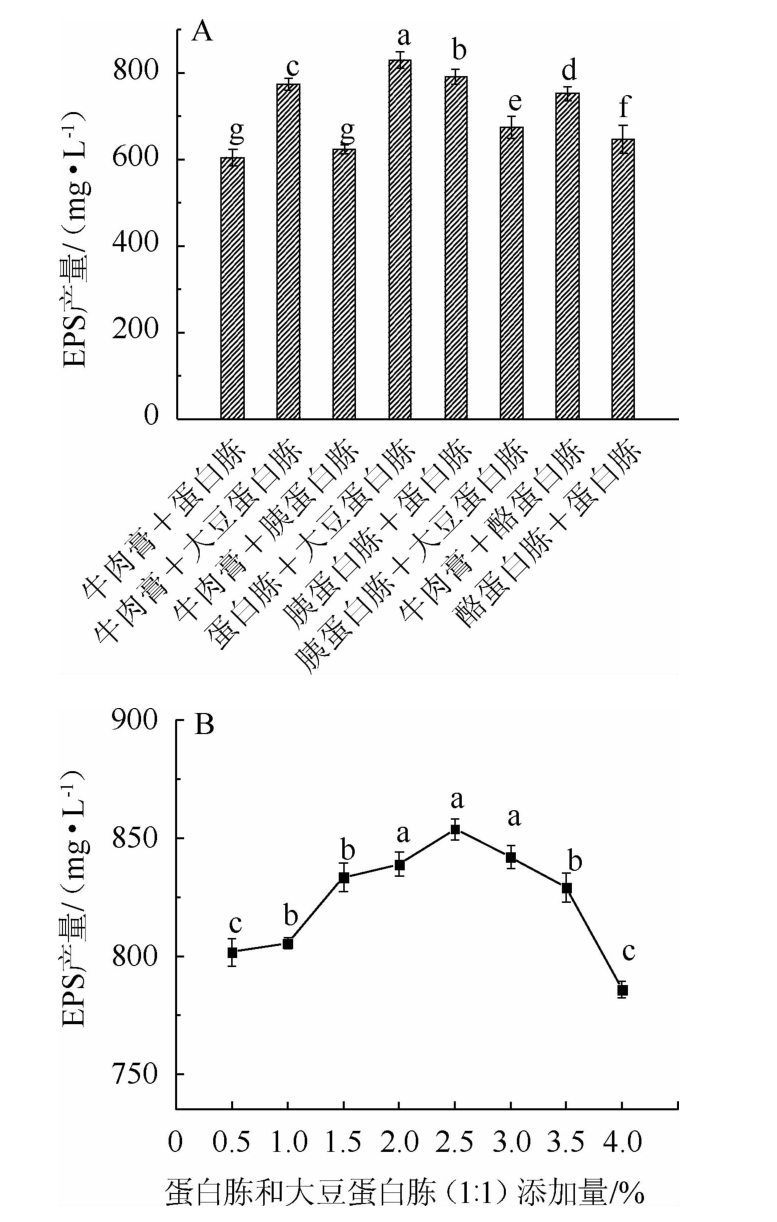
图4 氮源种类(A)和蛋白胨和大豆蛋白胨(1∶1)添加量(B)对胞外多糖产量的影响
Fig.4 Effect of nitrogen sources (A) and peptone and soy peptone(1∶1) addition (B) on the yield of exopolysaccharides
2.3.2 发酵条件的优化
发酵条件对EPS产量的影响见图5。由图5A可知,当接种量在0.5%~4%范围内增加,EPS产量逐渐增加;当接种量为4.0%时,EPS产量达到最大值,为821.34 mg/L;当接种量>4.0%时,EPS的产量降低。这可能归因于随着接种量的增加,相应的代谢产物也增加;而当接种量过高时,培养液中营养物质不能满足菌株的正常生长代谢,使得代谢产物减少[22]。因此,选择最适接种量为4%。
由图5B可知,随着发酵时间在12~60 h增加,EPS的产量逐渐增加,当发酵时间为60 h时,EPS产量达到最高值,为872.16 mg/L;当发酵时间>60 h时,EPS产量逐渐下降。表明此时菌株E8的生长和代谢稳定,导致代谢产物不断积累,但随着发酵时间的延长,菌体自身会分泌一些能够降解胞外多糖的相关酶类从而使得产量开始出现下降[23]。因此,选择最适发酵时间为60 h。
由图5C可知,当发酵温度在25~30 ℃范围内时,EPS的产量逐渐增加;当发酵温度为30 ℃时,EPS的产量达到最高值,为1 064.08 mg/L。当发酵温度>30 ℃时,EPS产量均出现降低的趋势。当发酵温度处于较低水平时,酶促反应的速率降低,菌株生长缓慢和代谢不活跃,但发酵温度过高,酶活受到抑制,从而降低了代谢产物的含量[24]。因此,选择最适发酵温度为30 ℃。
由图5D可知,初始pH值对菌株E8合成EPS影响较大,当初始pH值在4.0~5.5范围内增加时,EPS产量逐渐增加;当初始pH值为5.5时,EPS的产量达到最大值,为1075.39mg/L;当初始pH值>5.5时,EPS产量逐渐下降。由此表明,在酸性环境条件下更利于菌株E8合成EPS。WANG Y等[6]研究发现,柠檬色明串珠菌(Leuconostoc citreum)B-2合成EPS的最适初始pH值为6.12。此外,MATHIVANAN K等[25]报道了蜡样芽孢杆菌(Bacillus cereus)KMS3-1在初始pH值为7.0时,EPS的产量达到最大值。因此,选择最适初始pH值为5.5。
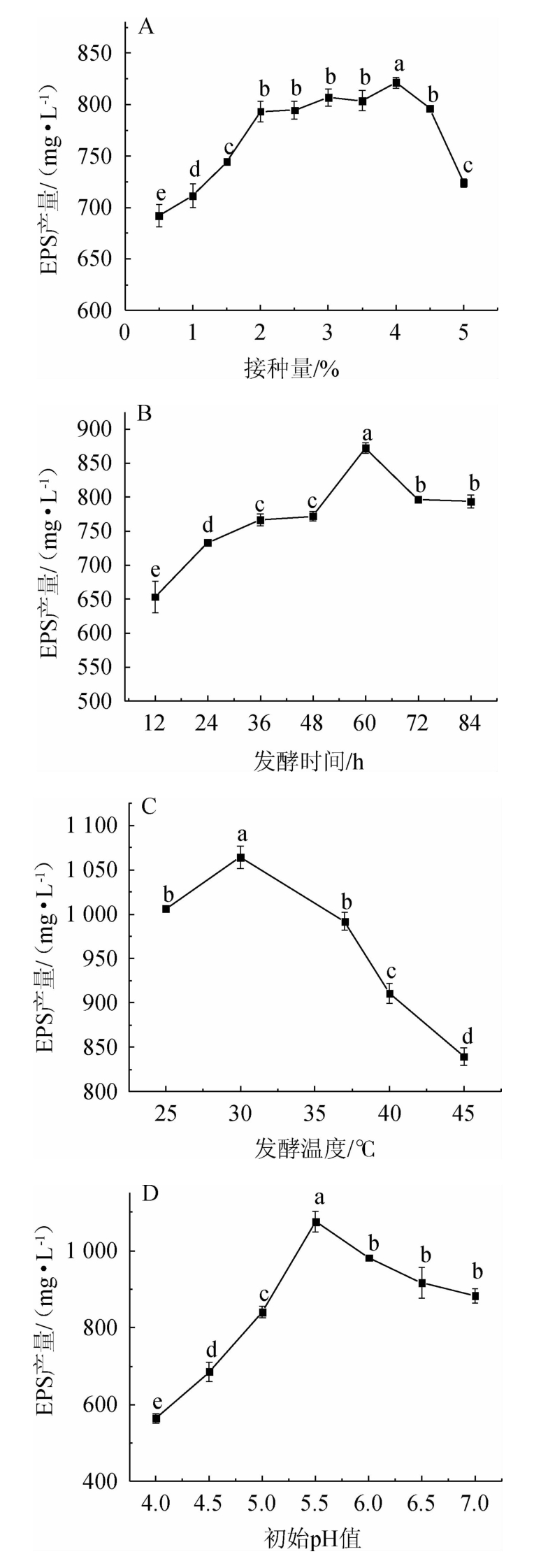
图5 接种量(A)、发酵时间(B)、发酵温度(C)和初始pH值(D)对胞外多糖产量的影响
Fig.5 Effect of inoculum (A),fermentation time (B),fermentation temperature (C) and initial pH (D) on the yield of exopolysaccharides
2.4 响应面试验结果
根据单因素试验结果,以初始pH值(X1)、接种量(X2)和发酵时间(X3)为自变量,以EPS产量(Y)为响应值进行3因素3水平的响应面试验。响应面试验设计及结果见表3,方差分析见表4。
表3 乳酸菌产胞外多糖发酵条件优化响应面试验设计及结果
Table 3 Design and results of response surface tests for fermentation conditions optimization of exopolysaccharides by lactic acid bacteria
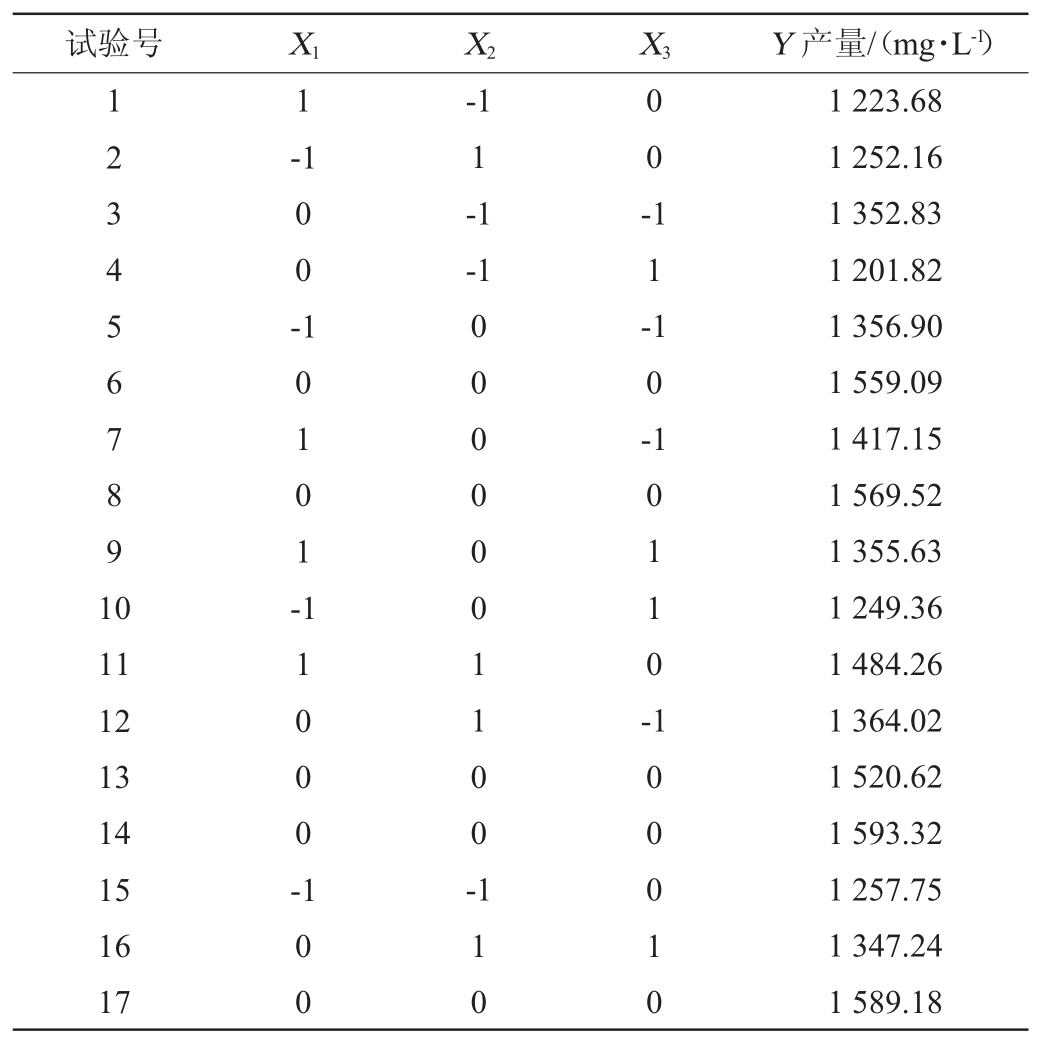
表4 回归模型方差分析
Table 4 Variance analysis of regression model

注:“**”表示差异极显著(P<0.01);“*”表示差异显著(P<0.05)。
采用Desigh-Expert 8.0.6对表3数据进行多元回归拟合,得到乳酸菌胞外多糖产量对试验因素的二次多项回归方程为:Y=1 566.35+45.57X1+51.45X2-42.11X3+66.54X1X2+11.51X1X3+33.56X2X3-116.8X12-145.08X22-104.79X32。
由表4可知,模型P值<0.000 1,表明模型极显著,而失拟项不显著(P值为0.689 5>0.05),说明模型模拟性良好,试验结果可靠。该模型的决定系数R2和调整决定系数R2Adj值分别为0.983 9和0.963 1,表明模型的预测结果与实际值拟合度高,能够很好地运用于响应值EPS产量的预测和分析。由P值可知,一次项X1、X2,X3、交互项X1X2和二次项X12、X22、X32对乳酸菌产EPS含量影响极显著(P<0.01)。交互项X2X3对乳酸菌产EPS含量影响显著(P<0.05),但X1X3影响不显著(P>0.05),由F值可知,对EPS产量影响的因素主次顺序是X2>X1>X3,即接种量>初始pH值>发酵时间。
各因素间交互作用对EPS产量影响的响应曲面及等高线见图6。由图6可知,随着各因素的增加,EPS的产量呈现先增加后降低的趋势。pH与接种量相关的响应曲面走势最陡峭,表明pH与接种量的交互作用对EPS的产量有极为显著的影响(P<0.01);接种量和发酵时间对EPS的产量也有显著的影响(P<0.05),该结果与表4中的显著性分析结果一致。

图6 各因素间交互作用对胞外多糖产量影响的响应曲面和等高线
Fig.6 Response surface plots and contour lines of effects of interaction of various factors on the yield of exopolysaccharides
根据Design Expert12.0.8软件分析得到菌株E8产EPS的最佳发酵工艺条件为:发酵时间58.71 h,接种量3.71%,初始pH值5.85,此时,EPS产量的预测值为1 566.35 mg/L。考虑到实际生产的可操作性,将最佳工艺条件修正为:发酵时间58 h,接种量3.7%,初始pH值5.85,进行3次平行验证试验,EPS产量实际值为1 516.62 mg/L,该结果达到预测值的96.8%,与模型的预测值接近,说明该模型可行。
2.5 EPS的结构表征
胞外多糖的紫外-可见光谱全扫描结果见图7A。由图7A可知,EPS在波长260 nm和280 nm处均无明显的特征吸收峰,表明样品中核酸和蛋白的含量较低,说明EPS的纯化效果较好。通过红外光谱图对EPS的特征官能团进行分析,结果见图7B。由图7B可知,EPS在波数3 413.9 cm-1处存在着明显的O—H的伸缩振动峰;波数2 935.5 cm-1处吸收峰归因于糖类不对称C—H的伸缩振动峰;波数1 647.4 cm-1为O—H的弯曲振动吸收峰,表明有部分结合水的存在[26];波数1 131.8 cm-1、1 057.3 cm-1、1 031.2 cm-1为C—O—C和C—O—H的伸缩振动,同时表明EPS样品中吡喃糖环的存在[27];波数916.5 cm-1和810.9 cm-1处的特征吸收峰表明存在α糖苷键[28]。扫描电镜放大500×,3 000×后的微观形貌见图7C和图7D。由图7C和图7D可知,在低倍镜(500×)下,EPS呈现出片状结构,且周围有着许多的分支;而在高倍镜(3 000×)下,出现明显的分支结构表面有一些孔洞,且周围散落着一些颗粒。AYYASH M等[29]研究发现,来自格氏乳球菌(L.garvieae)C47的EPS呈现为片状且分层的结构。VINOTHKANNA A等[30]研究发现,地衣芽孢杆菌(B.licheni-formis)AG-06产生的EPS呈现出不规则的网状结构。这些微观结构的不同可能是由于单糖组成的差异,以及EPS的提取方式而导致的[31]。
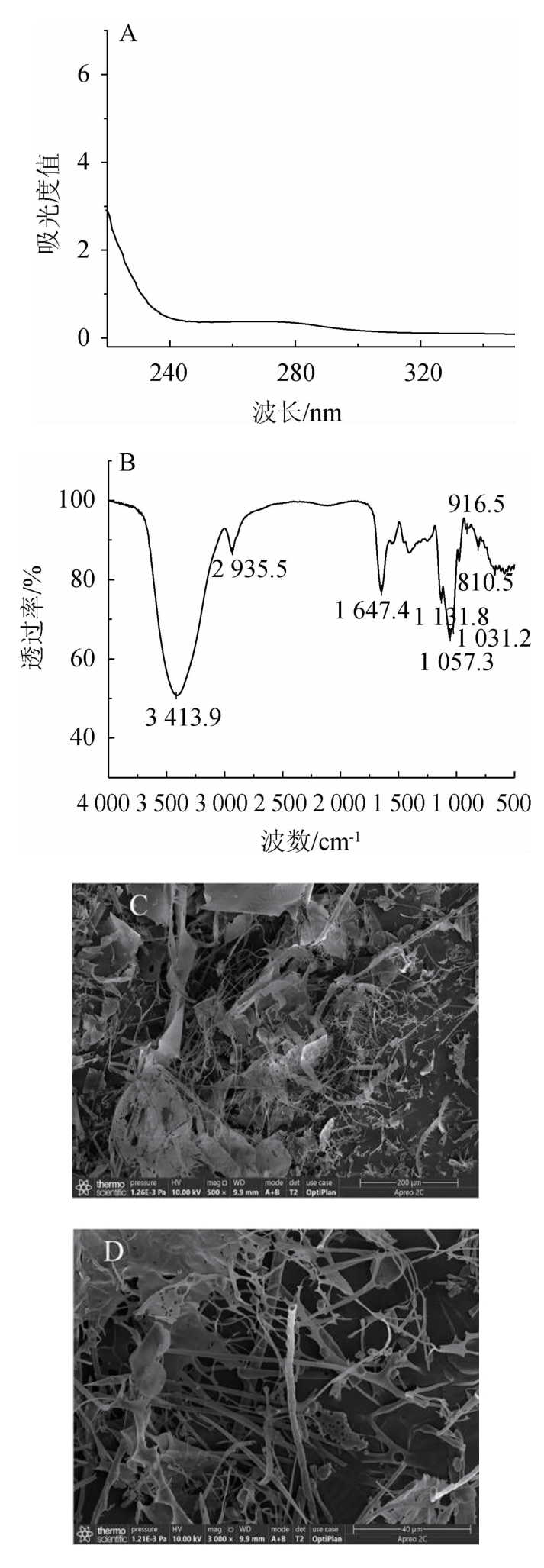
图7 胞外多糖的结构表征结果
Fig.7 Structural characterization results of exopolysaccharides
A.紫外光谱;B.红外光谱;C.扫描电镜(500×);D.扫描电镜(3 000×)
2.6 EPS的抗氧化活性
由图8A~图8C可知,EPS质量浓度为0~9 mg/mL范围内,EPS对DPPH、ABTS和OH自由基的清除能力呈现剂量依赖性升高,当EPS质量浓度达到9 mg/mL时,EPS对DPPH、ABTS和OH自由基的清除率达到最大值,分别为(62.62±1.52)%、(55.17±1.44)%和(63.91±2.71)%。表明EPS的抗氧化能力与其质量浓度呈正相关,具有明显的剂量效应。但是,EPS的抗氧化能力始终低于VC。BOMFIM V B等[32]研究发现,LactobacillusplantarumCNPC003胞外多糖抗氧化能力也是随其浓度的升高而增强,呈剂量依赖型。在相同浓度条件下,P.pentosaceus E8的EPS对DPPH自由基的清除能力高于来自L.plantarum YW32(30%)[33]和L.plantarum KX041(37.48%)[34]的胞外多糖。这些结果意味着P.pentosaceus E8的EPS在抗氧化方面具有潜在的应用前景。
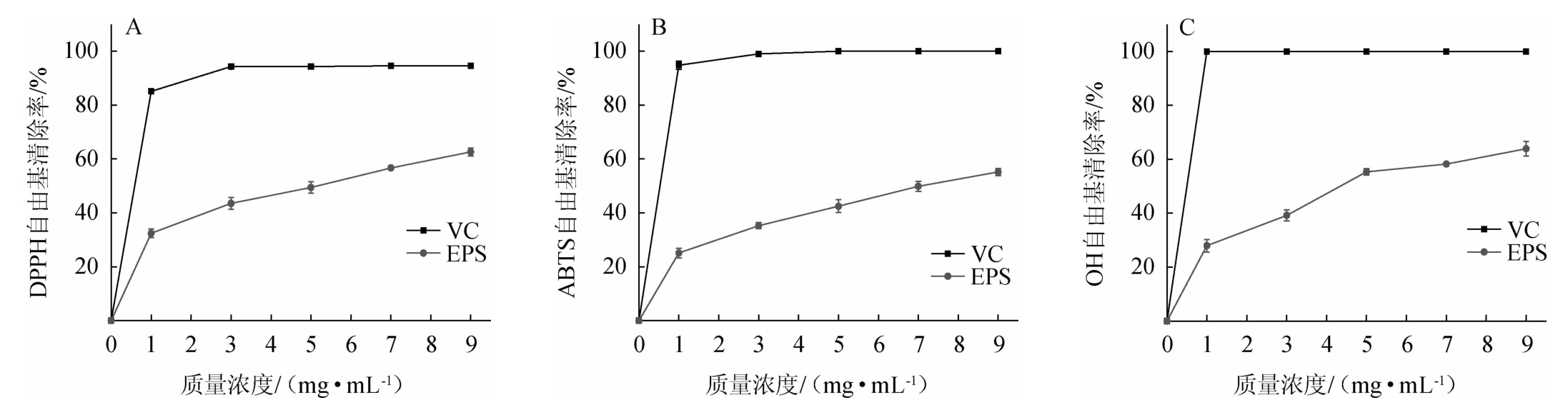
图8 不同质量浓度胞外多糖对DPPH(A)、ABTS(B)和OH自由基(C)清除率的影响
Fig.8 Effect of different mass concentration of exopolysaccharides on the scavenge capacities of DPPH (A),ABTS (B) and -OH free radical(C)
3 结论
本研究从17株乳酸菌中筛选得到一株高产胞外多糖的菌株E8,结合其形态特征和分子生物学试验,将其鉴定为戊糖片球菌(Pediococcus pentosaceus)。菌株E8产EPS的最佳发酵工艺条件为:蔗糖添加量5%、蛋白胨和大豆蛋白胨(1∶1)添加量2.5%、发酵时间58 h、接种量3.7%、初始pH值5.85。在此优化条件下,EPS产量为1 516.62 mg/L,与优化前初始产量相比提高了4.4倍。EPS结构表征结果表明,EPS主要含有吡喃糖环残基和α-型糖苷键,其微观结构呈片状,且周围伴有许多的分支。抗氧化活性实验表明,EPS对DPPH、ABTS和OH自由基均具有一定的清除能力,当EPS的质量浓度为9 mg/L时,对DPPH、ABTS和OH自由基的清除率分别为(62.62±1.52)%、(55.17±1.44)%和(63.91±2.71)%,表现出作为天然抗氧化剂的巨大潜力。本研究为P.pentosaceus EPS的工业化生产、研究和实际应用提供一定的参考,同时为深入探究其精细结构和潜在功能提供理论依据。
[1]RAJOKA M S R,WU Y G,MEHWISH H M,et al. Lactobacillus exopoly-saccharides: New perspectives on engineering strategies,physiochemical functions,and immunomodulatory effects on host health[J].Trends Food Sci Tech,2020,103:36-48.
[2]ANGELIN J,KAVITHA M.Exopolysaccharides from probiotic bacteria and their health potential[J].Int J Biol Macromol,2020,162:853-865.
[3]李彬.产胞外多糖菌株的筛选及胞外多糖性质和结构分析[D].南京:南京理工大学,2016.
[4]PENG K D,KOUBAA M,BALS O,et al.Recent insights in the impact of emerging technologies on lactic acid bacteria: A review[J].Food Res Int,2020,137:109544.
[5]SAADAT Y R,KHOSROUSHAHI A Y,GARGARI B P.A comprehensive review of anticancer,immunomodulatory and health beneficial effects of the lactic acid bacteria exopolysaccharides[J].Carbohyd Polym,2019,217:79-89.
[6]WANG Y,DU R P,QIAO X X,et al.Optimization and characterization of exopolysaccharides with a highly branched structure extracted from Leuconostoc citreum B-2[J].Int J Biol Macromol,2020,142:73-84.
[7]XU Z Y,GUO Q B,ZHANG H,et al.Structural characterisation of EPS of Streptococcus thermophilus S-3 and its application in milk fermentation[J].Int J Biol Macromol,2021,178:263-269.
[8]HU S M,ZHOU J M,ZHOU Q Q,et al.Purification,characterization and biological activities of exopolysaccharides from Lactobacillus rhamnosus ZFM231 isolated from milk[J].LWT-Food Sci Technol,2021,147:111561.
[9]SALAZAR N,GUEIMONDE M,HERNÁNDEZ-BARRANCO A M,et al.Exopolysaccharides produced by intestinal Bifidobacterium strains act as fermentable substrates for human intestinal bacteria[J].Appl Environ Microbiol,2008,74(15):4737-4745.
[10]王艳,郑砚学,张悦,等.西藏牦牛乳制品中高产胞外多糖乳酸菌的筛选及多糖抗氧化特性研究[J].食品科技,2022,47(1):1-7.
[11]ZHANG G H,ZHANG W Z,SUN L J,et al.Preparation screening,production optimization and characterization of exopolysaccharides produced by Lactobacillus sanfranciscensis Ls-1001 isolated from Chinese traditional sourdough[J].Int J Biol Macromol,2019,139:1295-1303.
[12]司天昭,柳陈坚,秦晓萌,等.植物乳杆菌YM-2菌株胞外多糖生物合成工艺优化[J].食品科学,2017,38(10):24-30.
[13]JIANG G,GAN L,LI X,et al.Characterization of structural and physicochemical properties of an exopolysaccharide produced by Enterococcus sp.F2 from fermented soya beans[J].Front Microbiol,2021,12:744007.
[14]GAN L,LI X,WANG H,et al.Structural characterization and functional evaluation of a novel exopolysaccharide from the moderate halophile Gracilibacillus sp.SCU50[J].Int J Biol Macromol,2020,154:1140-1148.
[15]ZHOU Y,WANG S,FENG W,et al.Structural characterization and immunomodulatory activities of two polysaccharides from Rehmanniae Radix Praeparata[J].Int J Biol Macromol,2021,186:385-395.
[16]DONG Z,DONG G,LAI F,et al.Purification and comparative study of bioactivities of a natural selenized polysaccharide from Ganoderma lucidum mycelia[J].Int J Biol Macromol,2021,190:101-112.
[17]BAI Y,LUO B,ZHANG Y,et al.Exopolysaccharides produced by Pediococcus acidilactici MT41-11 isolated from camel milk: Structural characteristics and bioactive properties[J].Int J Biol Macromol,2021,185:1036-1049.
[18]姜云芸,蔡淼,邵淑娟,等.植物乳杆菌K25发酵产胞外多糖的影响因素及其应用[J].食品科学技术学报,2018,36(1):25-34.
[19]LAKRA A K,RAMATCHANDIRANE M,KUMAR S,et al.Physicochemical characterization and aging effects of fructan exopolysaccharide produced by Weissella cibaria MD2 on Caenorhabditis elegans[J].LWTFood Sci Technol,2021,143:111100.
[20]WANG X,SHAO C,LIU L,et al.Optimization,partial characterization and antioxidant activity of an exopolysaccharide from Lactobacillus plantarum KX041[J].Int J Biol Macromol,2017,103:1173-1184.
[21]JIANG G,HE J,GAN L,et al.Optimization of exopolysaccharides production by Lactiplantibacillus pentosus B8 isolated from Sichuan PAOCAI and its functional properties[J].Appl Biochem Microbiol,2022,58:195-205.
[22]孔德卉,蒋家璇.高产胞外多糖能力的乳酸菌筛选及其培养条件的优化[J].兰州文理学院学报(自然科学版),2020,34(3):53-59.
[23]张文平,赵英杰,罗晟,等.高产胞外多糖植物乳杆菌筛选及其发酵工艺优化[J].食品与发酵工业,2019,45(21):38-45.
[24]谢莹,蔡国林,刘逸凡,等.双歧杆菌BB12胞外多糖发酵条件优化及抗氧化活性研究[J].食品与发酵工业,2019,45(23):55-59.
[25]MATHIVANAN K,CHANDIRIKA J U,MATHIMANI T,et al.Optimization,compositional analysis,and characterization of exopolysaccharides produced by multi-metal resistant Bacillus cereus KMS3-1[J].Carbohyd Polym,2020,227:115369.
[26]NIU Y G,YAN W,LV J L,et al.Characterization of a novel polysaccharide from tetraploid Gynostemma pentaphyllum makino[J].J Agr Food Chem,2013,61(20):4882-4889.
[27]DING X,HOU Y L,HOU W R.Structure feature and antitumor activity of a novel polysaccharide isolated from Lactarius deliciosus Gray[J].Carbohyd Polym,2012,89(2):397-402.
[28]HU X Y,PANG X,WANG P G,et al.Isolation and characterization of an antioxidant exopolysaccharide produced by Bacillus sp.S-1 from Sichuan Pickles[J].Carbohyd Polym,2019,204:9-16.
[29]AYYASH M,ABU-JDAYIL B,ITSARANUWAT P,et al.Exopolysaccharide produced by the potential probiotic Lactococcus garvieae C47:Structural characteristics,rheological properties,bioactivities and impact on fermented camel milk[J].Food Chem,2020,333:127418.
[30]VINOTHKANNA A,SATHIYANARAYANAN G,BALAJI P,et al.Structural characterization,functional and biological activities of an exopolysaccharide produced by probiotic Bacillus licheniformis AG-06 from Indian polyherbal fermented traditional medicine[J].Int J Biol Macromol,2021,174:144-152.
[31]JI X L,HOU C Y,YAN Y Z,et al.Comparison of structural characterization and antioxidant activity of polysaccharides from jujube(Ziziphus jujuba Mill.)fruit[J].Int J Biol Macromol,2020,149:1008-1018.
[32]BOMFIM V B,PEREIRA LOPES NETO J H,LEITE K S,et al.Partial characterization and antioxidant activity of exopolysaccharides produced by Lactobacillus plantarum CNPC003[J].LWT-Food Sci Technol,2020,127:109349.
[33]WANG J,ZHAO X,YANG Y W,et al.Characterization and bioactivities of an exopolysaccharide produced by Lactobacillus plantarum YW32[J].Int J Biol Macromol,2015,74:119-126.
[34]XU Y M,CUI Y L,WANG X,et al.Purification,characterization and bioactivity of exopolysaccharides produced by Lactobacillus plantarum KX041[J].Int J Biol Macromol,2019,128:480-492.