柿子属于柿科(Ebenaceae)柿属(Diospyros L.)落叶大乔木[1],因富含类胡萝卜素、黄酮类化合物(槲皮素、山奈酚、异槲皮苷及其苷类)、类固醇、酚类物质(没食子酸、香豆素、儿茶素和单宁)等活性成分而成为有发展潜力的水果[2-4],但其难以储存及独特涩味等特点限制着柿子产业的发展[5]。因此,开发柿子制品成为了柿子产业发展的主要方向。目前,有柿子饼、柿子酒、柿子醋等产品[6-7],其中,柿子酒是以优质鲜柿为原料,经脱涩、破碎、发酵、陈酿、调配而成的果酒。刘秀华等[8]设计了柿子酒生产工艺,生产出的柿子酒为金黄色或浅黄色,酒液澄清透亮,果香饱满浓郁,酒体爽口顺滑,稳定性好。
果酒具有浓郁的果香、清爽的口感,还具有营养丰富、酒精度数低等特点[9]。一般果酒发酵常采用发酵能力强的酿酒酵母菌种,酒样中醇类物质主要由酵母代谢合成,但对滋味影响较大的有机酸和酯类,主要来源于原料本身或是曲霉代谢[10]。红曲霉(Monascus ruber)在代谢中可产生多种酶类[11-12],同时具有较高的糖化酶、酯化酶及蛋白酶活力,常用于发酵酒类和酱油[13]。红曲具有的特殊功能性会给酒体增色和增香,例如红曲色素可以增添果酒的色泽,红曲当中的代谢产物Monacolin K等物质,可以提高果酒的保健功能性[14-15]。在我国,红曲霉已经广泛应用于酿酒工艺。王超萍等[16]使用红曲霉和酵母混合液态发酵生产红曲桑葚酒,其酒精度达到12.9%vol,红曲桑葚酒呈红棕色,酒体透亮,风格典雅,口感细腻,果香浓郁。谭晓林等[17]利用红曲霉对咂酒的制作工艺进行改良,酿造出的酒颜色淡红,透明澄清,香味醇厚,口感醇和。柿子是我国产量较大的水果,但综合利用率较低。由于柿子中含有较高的有机酸和单宁等物质,影响柿子果酒的发酵效率以及酒的香气和口感。红曲霉的加入可以为柿子酒增色、增香、增酯,带来更好的感官风味和绚丽的色彩,同时红曲的中有益的代谢产物能够提高柿子酒的营养保健功能[18]。
本研究以柿子为原料,以红曲霉及酵母菌为发酵菌种制备柿子酒,以酒精度为评价指标,通过单因素试验及正交试验对其发酵工艺条件进行优化,对其进行理化指标及微生物指标检测及感官评价,并采用气相色谱-质谱(gas chromatography-mass spectrometer,GC-MS)联用仪对其挥发性风味物质进行分析。以期开发风味独特的柿子酒,为柿子酒产业发展提供新思路。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与材料
柿子:购于济南市长清区农贸市场;酵母菌(yeast):齐鲁工业大学生物工程学院;红曲霉(Monascus ruber):齐鲁工业大学菌种保藏实验室;酿酒高活性干酵母:上海康禧食品饮业有限公司。
1.1.2 试剂
果胶酶(30 000 U/g):济南百斯杰生物工程有限公司;柠檬酸(分析纯):北京奥博星生物技术责任有限公司;蔗糖(分析纯):国贸集团化学试剂有限公司;无水碳酸钠、无水磷酸二氢钠、无水磷酸氢二钠、氢氧化钠、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、无水乙醇、苯酚(均为分析纯):天津富宇精细化工有限公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:先将马铃薯洗净去皮,再称取200 g切成小块,加水煮烂(煮沸20~30 min),用8层纱布过滤后加入15~20 g琼脂,继续加热控制温度在95 ℃以上,搅拌混匀,待琼脂溶解完后,加入葡萄糖20 g,搅拌均匀,稍冷却后再补足水分至1 000 mL。115 ℃灭菌20 min。
1.2 仪器与设备
YXQ-LS-50SII立式压力蒸汽灭菌器:上海博讯实业有限公司医疗设备厂;SW-CJ-2G无菌操作台:苏州净化设备有限公司;HNY-2102C恒温培养振荡器:天津欧诺仪器股份有限公司;XSP-2CA双目显微镜:上海光学仪器厂;SW-CJ-2D超净工作台:苏州净化设备有限公司;GCMS-QP2007气相色谱-质谱联用仪:岛津分析技术研发(上海)有限公司;酒精计:河北省河间市黎民居仪表厂;PHS-25pH计:浙江山海精密科学仪器有限公司。
1.3 方法
1.3.1 柿子酒加工工艺流程及操作要点
原料预处理:冻柿子常温解冻后挑选长势良好的柿子,清洗、去蒂,用小刀切掉不新鲜的果肉,剩余部分切成直径约2 cm小块,备用。
脱涩:将柿子果肉放在40 ℃左右水浴锅的温水中,密封,脱涩24 h[19],单宁色素(以鞣酸计)<4 mg/kg即脱涩完成。
打浆、调节糖度:将脱涩完成的果肉打浆,使用蔗糖将柿子浆糖度调整至20%,加入适量柠檬酸调节柿子浆pH值至4.70。
酶解:于浆液中加入0.03%果胶酶,50 ℃酶解2 h,升温至85 ℃,灭酶20 min。
酵母菌活化:将活性酵母菌按照0.2 g/L发酵液的添加量溶于10倍含1%蔗糖的水溶液(45 ℃)中活化40 min。
红曲霉活化:将红曲霉接种于PDA培养基活化24 h;然后从活化好的菌种用接种针刮取少许表面孢子,至装有玻璃珠的无菌水中打散,制作成孢子悬浮液,置于恒温培养箱中32 ℃培养60 h后观察红曲霉生长状况,将生长旺盛单菌落所产的孢子接种于斜面PDA培养基,32 ℃下培养7 d;用接种环刮取少量菌丝于无菌水中,放入摇床中,设置转速为180 r/min,在32 ℃下培养120 h。
发酵:单菌发酵按0.2 g/L发酵液质量的添加量加入活性酵母菌;混菌发酵按0.2 g/L发酵液质量的添加量加入活性酵母菌与10%红曲霉,发酵温度为31 ℃,发酵时间为3 d。
澄清、过滤:于发酵液中添加0.04 g/L明胶澄清7 d,采用硅藻土过滤。
灭菌、罐装:采用巴氏杀菌法灭菌后罐装至100 mL玻璃瓶中,即得柿子酒。
1.3.2 柿子酒发酵工艺优化单因素试验
固定发酵基本条件为:pH值4.70、发酵时间3 d、发酵温度31 ℃、按发酵液质量的0.2 g/L的活性酵母菌与10%红曲霉接种于发酵液进行复合菌发酵,以酒精度为评价指标,分别考察发酵温度(28 ℃、29 ℃、30 ℃、31 ℃、32 ℃、33 ℃)、初始pH值(4.00、4.35、4.70、5.05、5.40、5.75)、发酵时间(1 d、2 d、3 d、4 d、5 d、6 d),红曲霉接种量(8%、9%、10%、11%、12%、13%),对柿子酒酒精度的影响。
1.3.3 柿子酒发酵工艺优化正交试验
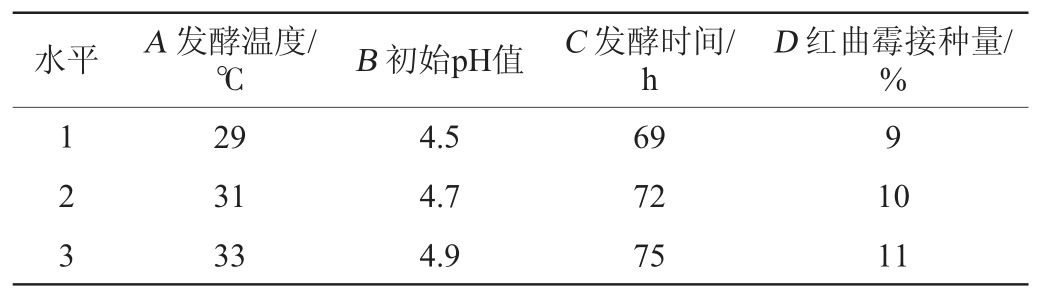
在单因素试验的基础上,以酒精度为评价指标,以发酵温度(A)、初始pH值(B)、发酵时间(C)、红曲霉接种量(D)为影响因素,进行4因素3水平正交试验,考察各因素对柿子酒酒精度的影响。正交试验因素与水平见表1。
表1 发酵工艺优化正交试验因素与水平
Table 1 Factors and levels of orthogonal tests for fermentation process optimization
1.3.4 分析检测
单宁色素(以鞣酸计)的测定:参照农业行业标准NY/T 1600—2008《水果、蔬菜及其制品中单宁含量的测定分光光度法》;酒精度的测定:采用酒精计;pH值的测定:采用PHS-25 pH计;糖含量、总酸含量、挥发酸含量、干浸出物的测定:参考GB/T 15038—2006《葡萄酒、果酒通用分析方法》;微生物指标的测定:参考国标GB/T 4789.25—2003《食品卫生微生物学检验酒类检验》。
1.3.5 挥发性风味物质检测
挥发性风味物质含量采用GC-MS法测定。
气相色谱条件:HP-5MS毛细管柱(30 m×0.25 mm×0.25 mm);载气为氦气(He);流速1 mL/min;分流比1∶300;柱头压100 KPa;进样口温度250 ℃;升温程序为40 ℃保持1 min,以5 ℃/min升温至180 ℃,保持5 min,再以10 ℃/min升温至240 ℃,保持15 min。
质谱条件:电子电离(electron ionization,EI)源,电子能量70 ev;离子源温度230 ℃;传输线能量250 ℃;四级杆温度230 ℃;扫描范围30~500 amu;连接口温度250 ℃;溶剂延迟3 min[20]。
定性和定量方法:经计算机数据工作站美国国家标准技术研究所(national institute of standards and technology,NIST)08标准质谱图库自动检索被分析组分的质谱,再结合有关文献资料进行人工谱图解析,确定其化学结构。采用面积归一法定量分析,即通过比较待测组分与总的峰面积的比值,计算出待测组分的相对百分含量。
1.3.6 感官评价
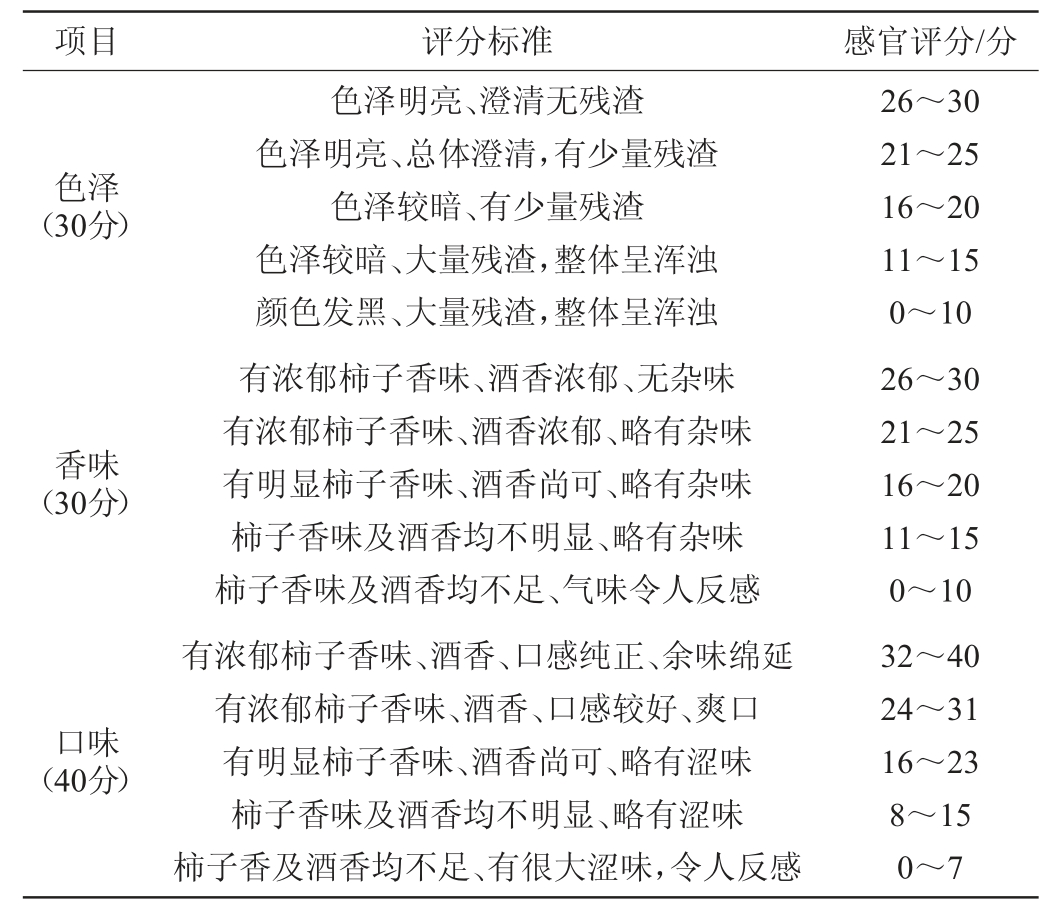
邀请20名人员根据感官评分标准从色泽、香味、口味3个方面对复合菌发酵的柿子酒与酵母单菌发酵的柿子酒进行感官评价,满分为100分,柿子酒感官评分标准见表2[21]。
表2 柿子酒感官评分标准
Table 2 Sensory evaluation standards of persimmon wine
1.3.7 数据处理与分析
试验重复3次,结果以“平均差±标准差”表示。使用Excel 2019进行图片、表格制作、使用SPSS 24.0进行数据统计与分析。
2 结果与分析
2.1 发酵工艺优化单因素试验结果
2.1.1 发酵温度的确定
发酵温度对复合菌发酵柿子酒酒精度的影响见图1。由图1可知,当发酵温度在28~31 ℃范围内增加,酒精度逐渐提高;当发酵温度为31 ℃时,酒精度达到最高值,为12.40%vol;当发酵温度>31 ℃,酒精度有所下降。其原因可能是,31 ℃均为红曲霉和酵母的适宜发酵温度[22-23]。因此,确定最适发酵温度为31 ℃。
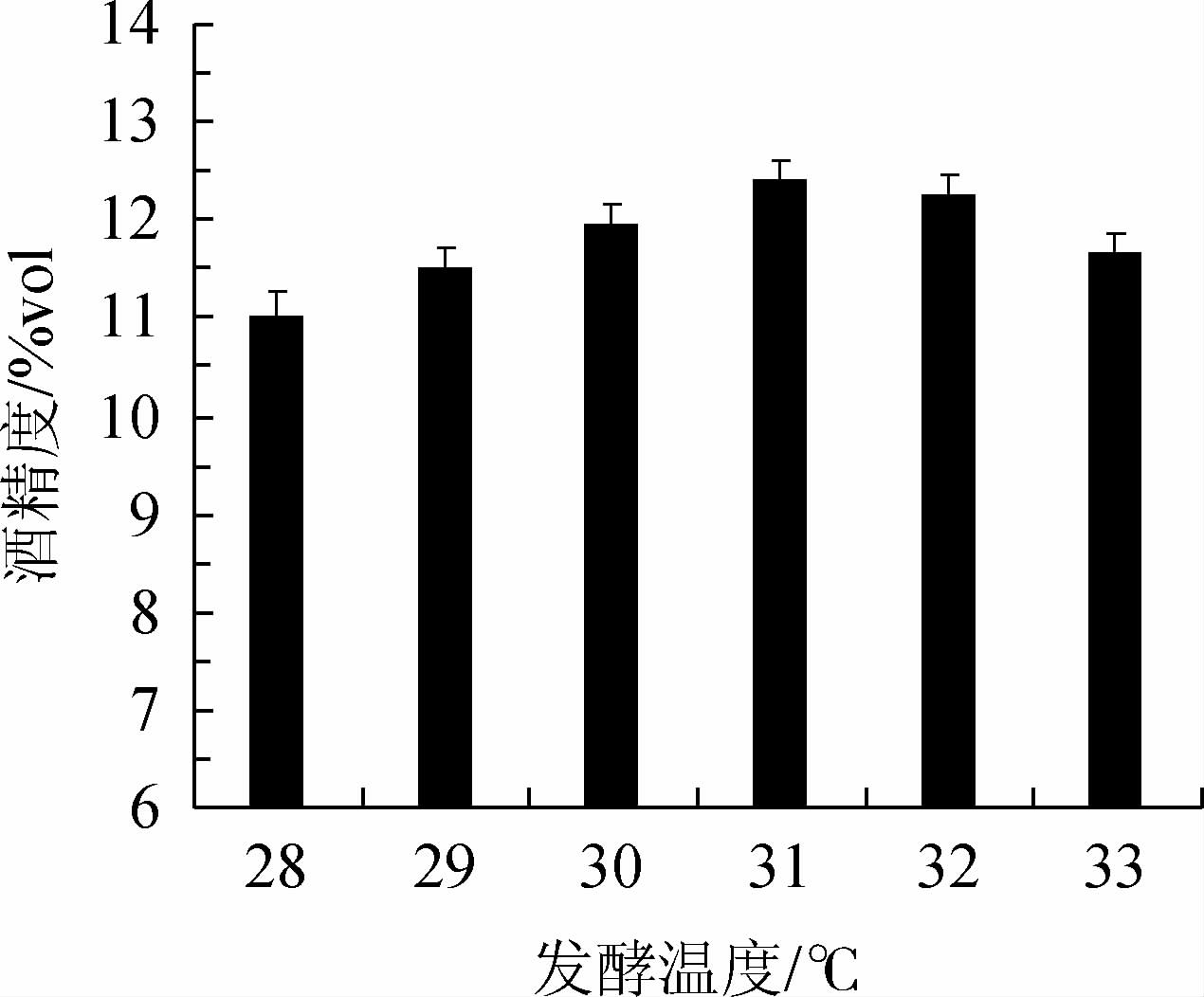
图1 发酵温度对柿子酒酒精度的影响
Fig.1 Effect of fermentation temperature on alcohol content of persimmon wine
2.1.2 初始pH值的确定
初始pH值对复合菌发酵柿子酒酒精度的影响见图2。由图2可知,随着初始pH值在4.00~4.70范围内的增加,酒精度逐渐增加;当初始pH值为4.70时,酒精度达到最大值,为12.54%vol;当初始pH值>4.70,酒精度逐渐下降。其原因可能是由于酵母菌能在pH值为3.0~7.5的范围内生长,最适pH值为3.5~5.0,而红曲霉发酵的最适pH值为5.75[23],而pH值在4.70时可以将二者的发酵水平充分发挥。因此,确定最适发酵pH值为4.70。
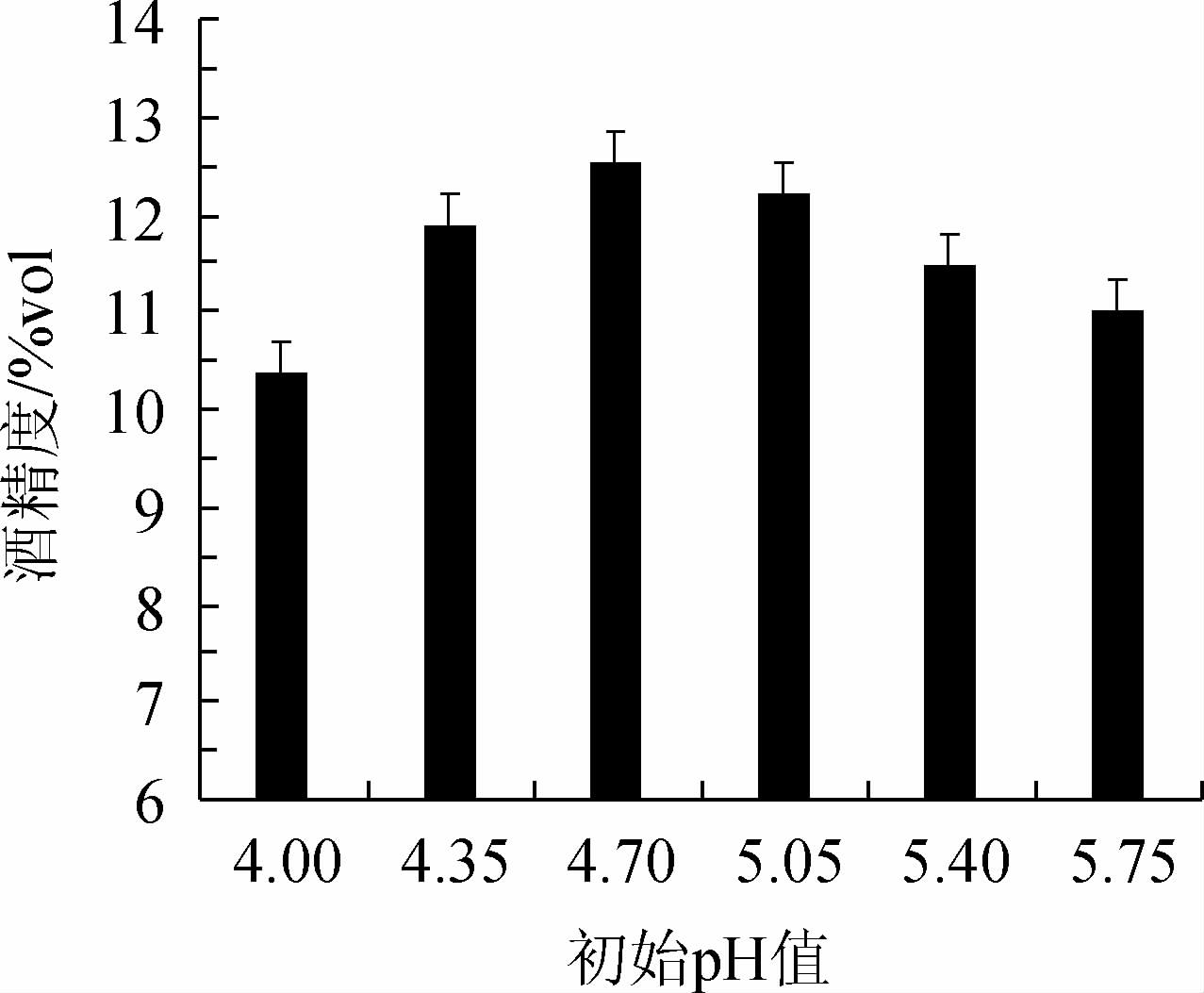
图2 初始pH值对柿子酒酒精度的影响
Fig.2 Effect of initial pH on alcohol content of persimmon wine
2.1.3 发酵时间的确定
发酵时间对复合菌发酵柿子酒酒精度的影响见图3。由图3可知,当发酵时间<3 d时,酒精度逐渐增加;当发酵时间为3 d时,酒精度达到为12.35%vol;当发酵时间>3 d时,酒精度变化趋于平稳。综合考虑,确定最适发酵时间为3 d。
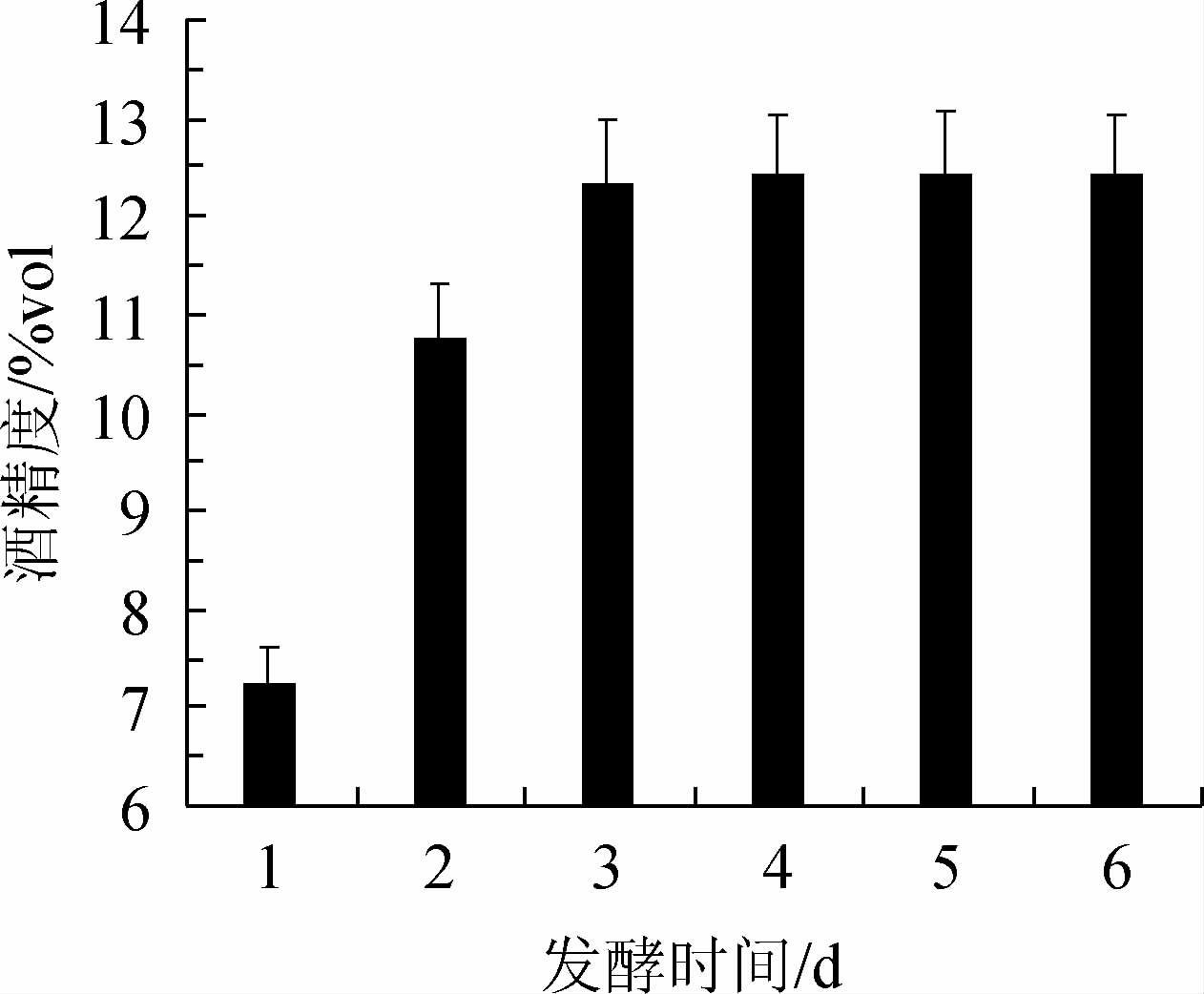
图3 发酵时间对柿子酒酒精度的影响
Fig.3 Effect of fermentation time on alcohol content of persimmon wine
2.1.4 红曲霉接种量的确定
红曲霉接种量对复合菌发酵柿子酒酒精度的影响见图4。由图4可知,当红曲霉接种量在8%~10%范围内增加,柿子酒酒精度逐渐提高;当接种量为10%时,酒精度达到最高,为12.29%vol;当接种量>10%,酒精度逐渐下降。其原因可能是,由于接种量过大,红曲霉与酵母菌争夺底物,从而影响了发酵的效率[22]。因此,确定最适红曲霉的接种量为10%。
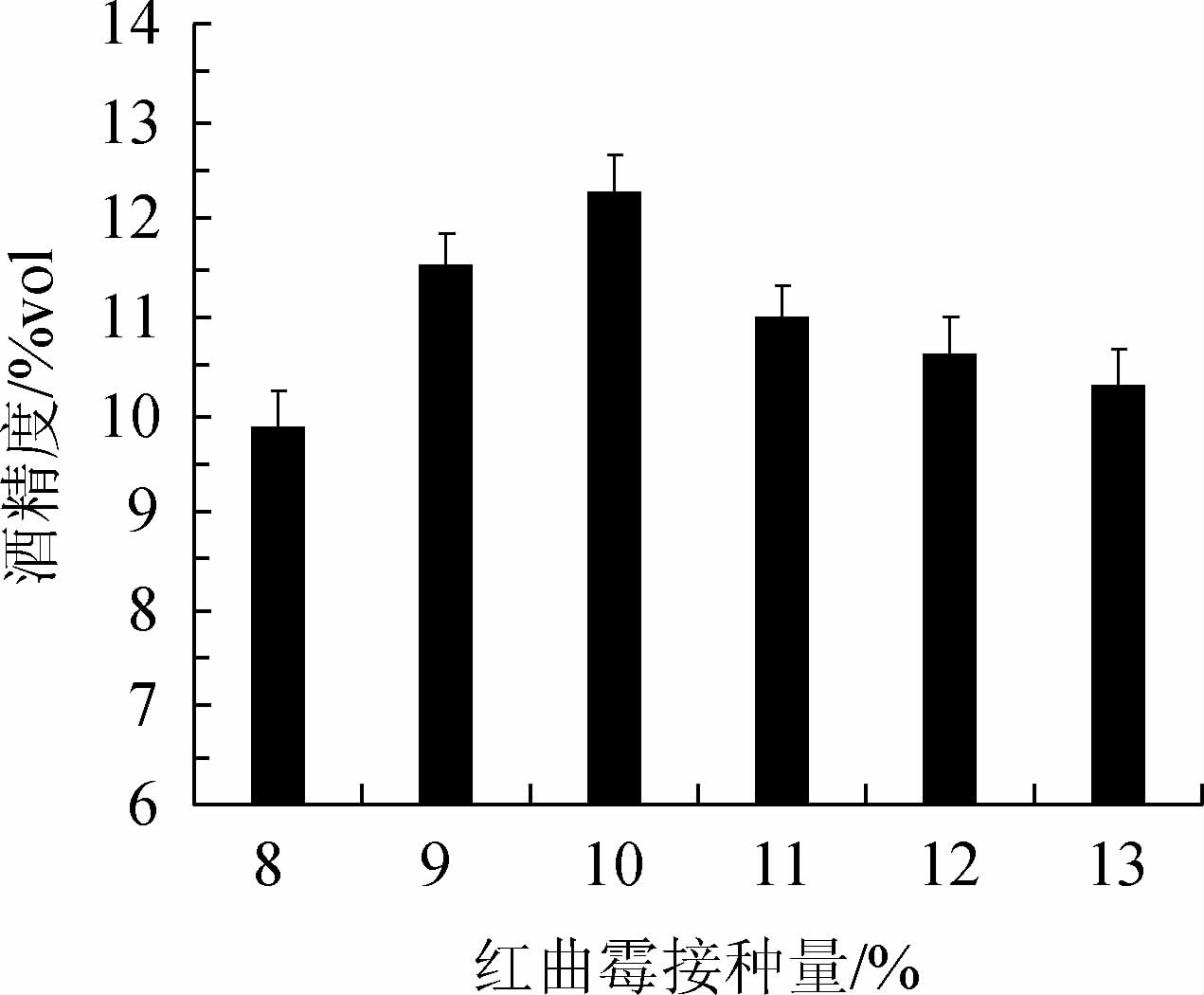
图4 红色红曲霉接种量对柿子酒酒精度的影响
Fig.4 Effect of Monascus ruber inoculum on alcohol content of persimmon wine
2.2 正交试验结果分析
在单因素试验的基础上,以发酵温度(A)、初始pH值(B)、发酵时间(C)、红曲霉接种量(D)为影响因素,以酒精度为评价指标,设计4因素3水平的正交试验,正交试验结果与分析见表3,方差分析见表4。
由表3可知,影响柿子酒酒精度的因素主次顺序为发酵温度(A)>初始pH值(B)>发酵时间(C)>接种量(D),根据极差分析结果,得到最佳工艺组合为A2B3C2D1。即发酵温度31 ℃、初始pH值4.90、发酵时间3 d、红曲霉接种量9%。经3组平行试验验证,复合菌发酵柿子酒酒精度平均可达12.45%vol。由表4可知,发酵温度对柿子酒酒精度的影响显著(P<0.05),其他因素对柿子酒酒精度的影响不显著(P>0.05)。
表3 发酵工艺优化正交试验结果与分析
Table 3 Results and analysis of orthogonal experiments for fermentation process optimization
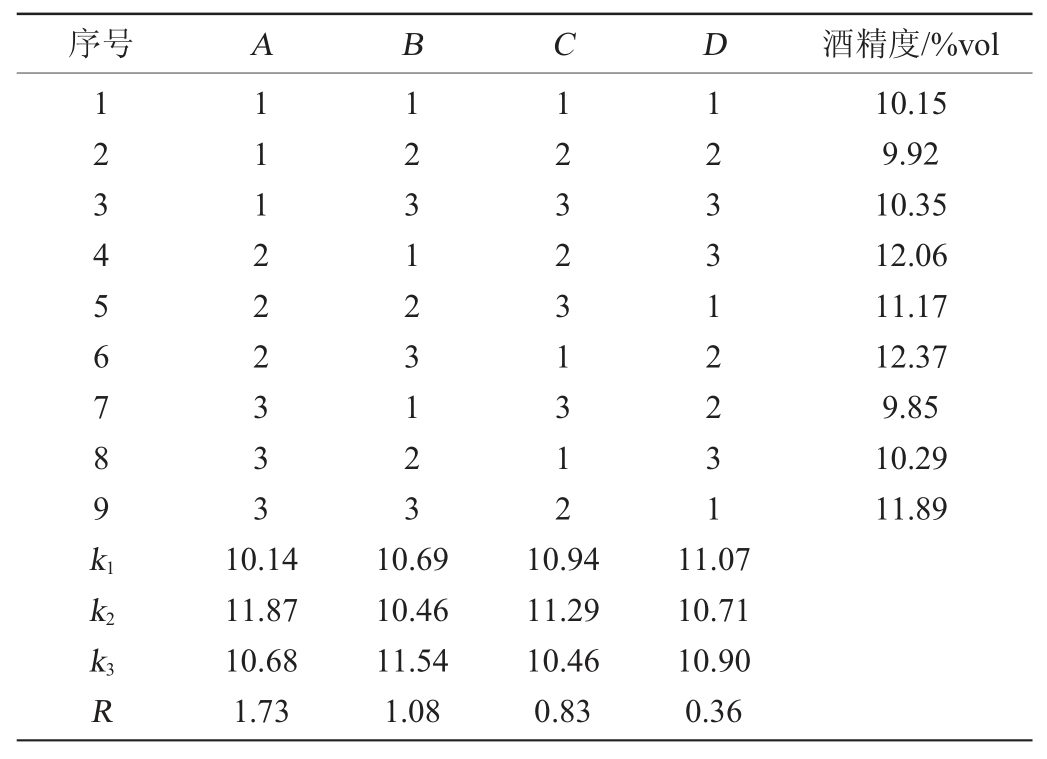
表4 正交试验结果方差分析
Table 4 Variance analysis of orthogonal experiments results
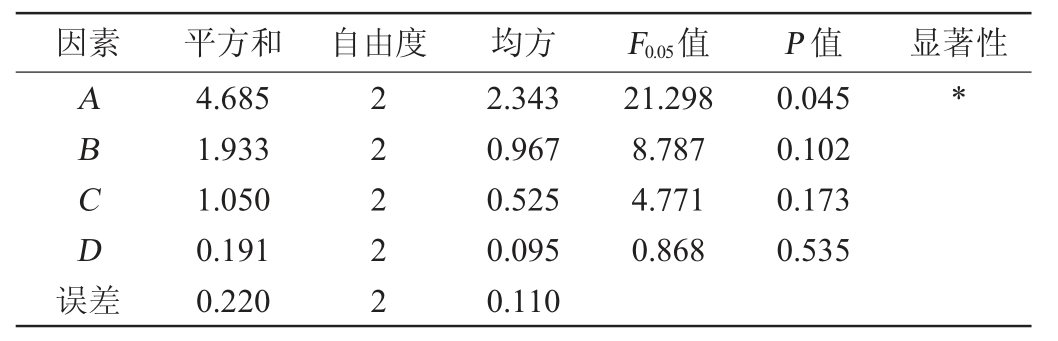
注:“*”表示对结果影响显著(P<0.05)。
2.3 柿子酒理化指标与微生物指标检测结果
参照农业行业标准NY/T 36—1986《柿子酒》、国标GB 2758—2012《食品安全国家标准发酵酒及其配制酒》,单菌发酵柿子酒与复合菌发酵柿子酒理化指标与微生物指标检测结果见表5。
表5 柿子酒理化指标及微生物指标测定结果
Table 5 Determination results of physicochemical indexes and microbiological indexes of persimmon wine
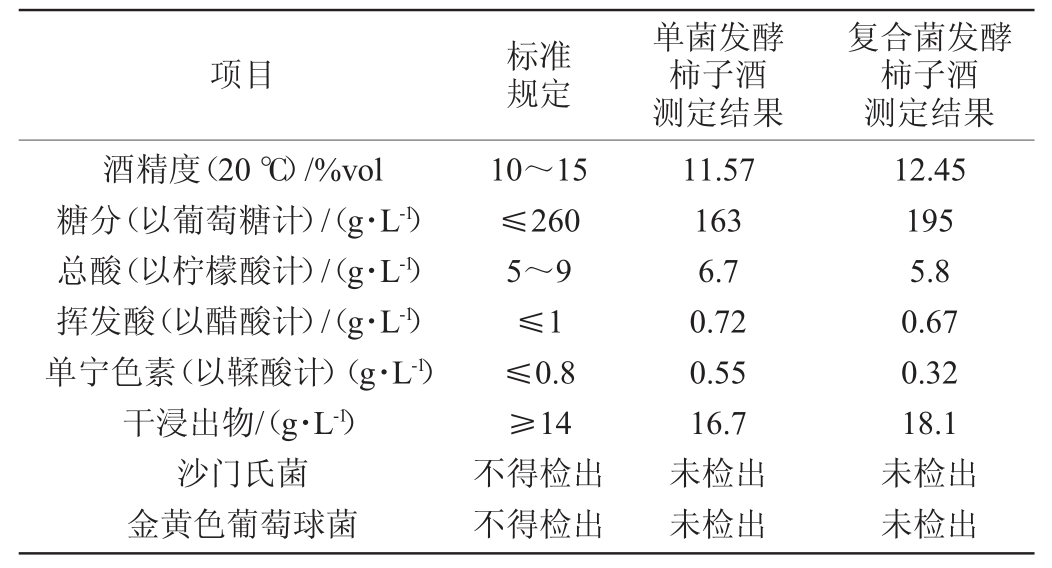
由表5可知,柿子酒理化指标与微生物指标的检测结果均符合相关标准。经感官评价,未添加红曲霉的酵母单菌发酵柿子酒感官评分为87.26分,复合菌发酵柿子酒感官评分为90.16分,酒香浓郁,呈现浅黄,具有柿子独特的香味,无异香,醇涩协调。
2.4 柿子酒中挥发性风味物质分析
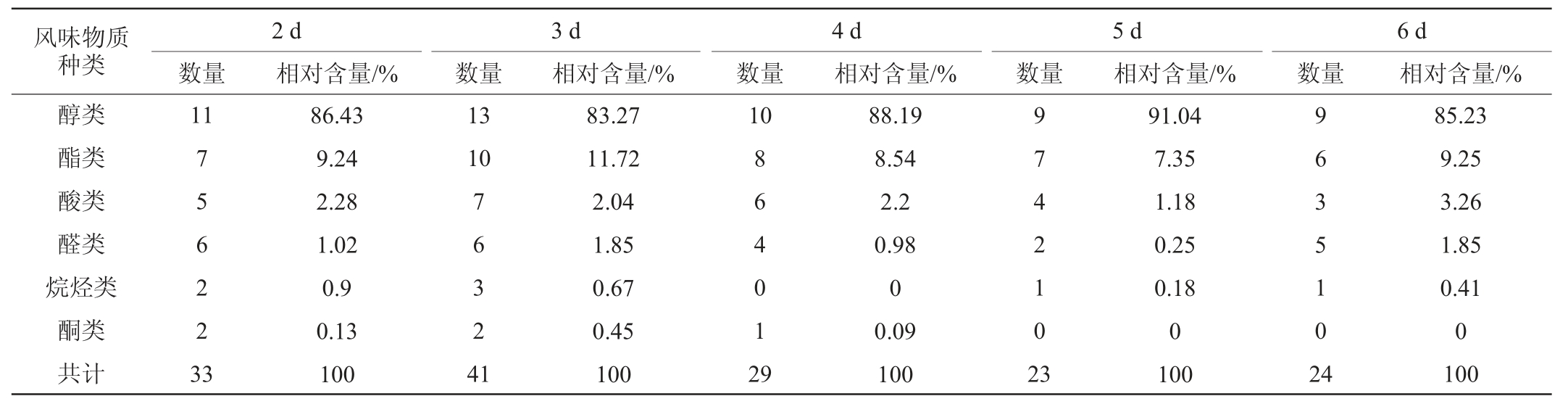
2.4.1 柿子酒复合菌发酵过程中挥发性风味物质的影响
发酵过程中复合菌发酵柿子酒中风味物质种类数量及相对含量见表6。由表6可知,当发酵时间<3 d时,风味物质数量不断增加;发酵至3 d时,柿子酒中风味物质达到了最多,为41种,其中,醇类13种、酯类10种、酸类7种、醛类6种、烷烃类3种、酮类2种。发酵时间>3 d时,风味物质种类开始逐渐呈现减少的趋势。结合酒精度进行分析,发酵时间为3 d时,柿子酒酒精度及风味物质种类数量均达到最高水平。
表6 柿子酒复合菌发酵过程中挥发性风味物质种类数量及相对含量
Table 6 Number of types and relative contents of volatile flavor substances in persimmon wine during mixed strains fermentation process
2.4.2 复合菌发酵柿子酒与单菌发酵柿子酒挥发性风味物质对比分析
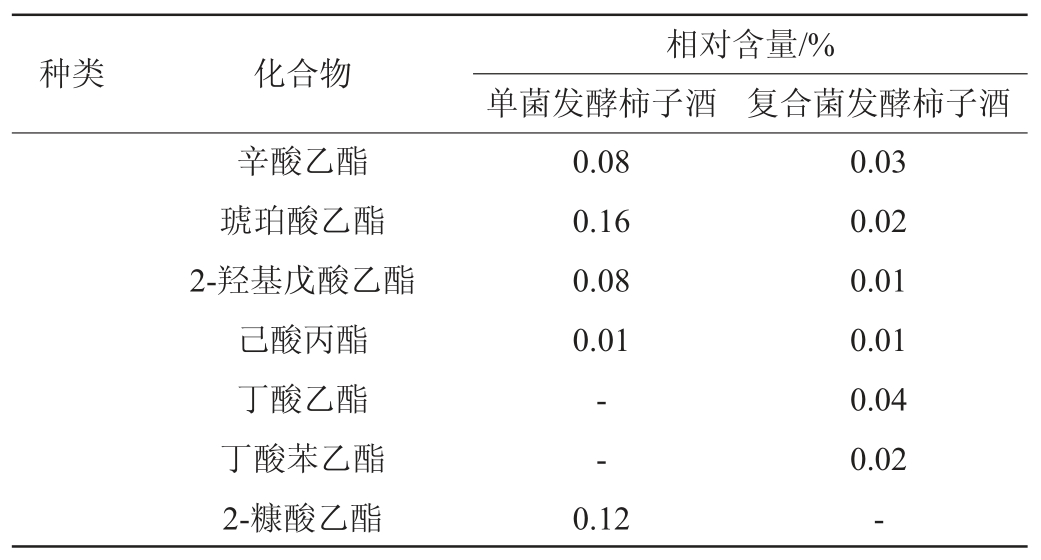
对这两种风味物质进行分析,复合菌发酵(3 d)柿子酒与单菌发酵(3 d)柿子酒中醇类和酯类风味物质检测结果见表7。
表7 复合菌及单菌发酵柿子酒中醇类及酯类物质含量检测结果
Table 7 Determination results of contents of alcohols and esters in persimmon wine by mixed strains and single strain fermentation

续表
注:“-”表示未检出。
由表7可知,单菌发酵柿子酒中检出风味物质20种,其中,醇类物质11种,酯类物质9种;混合发酵柿子酒中检出醇类和酯类风味物质23种,其中,醇类物质13种,酯类物质10种。其中,共有化合物有异戊醇、异丁醇、香茅醇、2,3-丁二醇、壬醇、3-甲硫基丙醇、芳樟醇、苯乙醇、橙花醇、2-乙基己醇、乙酸苯乙酯、乳酸乙酯、辛酸乙酯、琥珀酸乙酯、2-羟基戊酸乙酯、丙酮酸乙酯、乙酸乙酯、己酸丙酯。在差异化合物方面,相比单菌发酵的柿子酒,混合发酵柿子酒未检出2-糠酸乙酯,但检出了丁酸乙酯、丁酸苯乙酯、正庚醇和仲辛醇4种风味物质。由于红曲霉代谢过程中产生的酶类能够产生更多数量风味物质。与单菌发酵柿子酒相比,混合发酵柿子酒风味物质相对含量较高的化合物中,苯乙醇相对含量提高3.17%,具有玫瑰清香味,常作为增香剂用于多种食物中[24];丙酮酸乙酯相对含量提高0.40%,具有新鲜、甜润的花果香气,可用于白兰地酒、粕酒等酒类;乙酸乙酯相对含量提高了0.10%,具有水果香气,广泛存在于白酒、果酒、黄酒等各种酒类物质;丁酸乙酯的相对含量为0.04%,丁酸乙酯具有水果香、花香,在酱香型白酒中贡献很大[25];丁酸苯乙酯的相对含量为0.02%,丁酸苯乙酯有水果清香,并具有蜂蜜似甜香味,对酒类产品风味也有提升[26]。同时,乳酸乙酯的相对含量降低0.21%,使酒体香气更加协调,口感纯正、余味绵延。
3 结论
本研究采用酵母菌和红曲霉复合菌发酵的方式酿造柿子酒,通过单因素试验及正交试验对柿子酒酿造工艺进行了优化。确定最佳发酵条件为:初始pH值4.90,发酵温度31 ℃,酵母菌接种量0.2 g/L与9%红曲霉复合菌发酵3 d,最终发酵出的柿子酒,酒精度达到12.45%vol,糖分(以葡萄糖计)195 g/L,总酸(以柠檬酸计)5.8 g/L,挥发酸(以醋酸计)0.67 g/L,单宁色素(以鞣酸计)0.32 g/L,干浸出物18.1 g/L。微生物检测符合相关标准要求。发酵后的柿子酒中检出风味物质41种,包括醇类13种、酯类10种、酸类7种、醛类6种、烷烃类3种、酮类2种。且混菌发酵柿子酒单菌发酵柿子酒,主要风味物质中,丁酸乙酯、丁酸苯乙酯、正庚醇和仲辛醇4种风味物质为复合菌发酵柿子酒中独有,苯乙醇相对含量提高3.17%、丙酮酸乙酯相对含量提高0.40%、乙酸乙酯提高了0.10%。本研究对柿子资源开发具有一定意义,有助于改善柿子资源浪费的现状,有助于柿子产业的发展。
[1]杨恒,赵萍,刘裕慧,等.柿子资源现状及其开发利用[C].中国生物工程学会第十二届学术年会暨2018年全国生物技术大会.长沙:2018:322-329.
[2]杨健,裴艳玲.柿子资源综合利用的研究进展[J].安徽农学通报,2019,25(17):116-118.
[3]王天琪,孙晓东,王辉,等.天然柿霜上的真菌多样性研究[J].天津农业科学,2019,25(3):17-19.
[4]贾贵东.柿子皮乙醇提取物的体外抗氧化活性研究[D].西安:陕西师范大学,2010.
[5]冯娟,张鹏,李江阔,等.柿子加工产品研究进展[J].保鲜与加工,2020,20(3):204-209.
[6]陈颖,陈晓明,张志军,等.不同酵母发酵对柿子酒、柿子醋风味的影响[J].保鲜与加工,2021,21(11):79-86.
[7]雷亚青,王景岗,冯锁牢,等.富平柿饼加工工艺的改进[J].陕西林业科技,2020,48(5):56-57,62.
[8]刘秀华,尚宜良,阎兵.柿子酒生产新工艺[J].轻工科技,2021,37(12):13-14.
[9]丁莹,李亚辉,蒲青,等.我国果酒行业发展现状及前景分析[J].酿酒科技,2019(4):104-107.
[10]杨庆益,董明杰,龚福明,等.果酒的酿造工艺及其生理功能研究进展[J].食品安全导刊,2022(25):126-128.
[11]WANG N,JIA G,WANG C,et al.Structural characterisation and immunomodulatory activity of exopolysaccharides from liquid fermentation of Monascus purpureus(Hong Qu)[J].Food Hydrocolloids,2020(6):103.
[12]YANG Y,LIU B,DU X J,et al.Author correction: complete genome sequence and transcriptomics analyses reveal pigment biosynthesis and regulatory mechanisms in an industrial strain,Monascus purpureus YY-1[J].Sci Rep,2020,10(1):6699.
[13]李保英.多菌种酱油制曲工艺及其对酱油风味影响的研究[D].杭州:浙江工商大学,2013.
[14]林凤,李慧敏,王玉梅,等.红曲霉色素及代谢物研究进展[J].中国调味品,2019,44(12):188-191.
[15]岳倩倩,王先桂,田多.不同产品中红曲霉代谢产物的差异性研究[J].食品安全导刊,2022(25):47-50.
[16]王超萍,蒋锡龙.红曲桑葚酒的酿造技术[J].食品工业,2019,40(2):51-55.
[17]谭晓林,张华玲,刘绪,等.红曲霉在咂酒酿造中的应用研究[J].食品与发酵科技,2020,56(2):10-16.
[18]王辉,王丽,句荣辉,等.BBD响应面法优化食盐、明矾溶液对柿子脱涩工艺的研究[J].食品工业科技,2016,37(9):262-266.
[19]赵国庆.柿子脱涩原理及脱涩方法[J].科学种养,2018(9):27-28.
[20]王君.脱水甘蓝废液的综合开发与利用[D].济南:齐鲁工业大学,2017.
[21]陈凌波.柿子果酒的发酵工艺及残渣再利用的研究[D].天津:天津科技大学,2019.
[22]马岩石,刘韩,裴芳艺.产胞外多糖酵母菌的分离鉴定及其发酵条件优化[J].食品研究与开发,2020,41(14):68-76.
[23]夏培禹,袁宁,管桂坤,等.红曲霉的初筛及在黄酒酿造中的应用[J].酿酒科技,2020(2):121-124.
[24]王芮东,李楠,赵燕飞,等.草莓、柿子复合果酒发酵过程中香味成分比较分析[J].食品工业科技,2018,39(21):218-223,229.
[25]梁慧珍,李细芬,陈鹏,等.酱香型白酒骨架成分对感官香气的影响[J].酿酒,2022,49(3):38-42.
[26]崔东琦,罗小叶,班世栋,等.强化曲的制备及其在酱香型白酒中的应用[J].食品与发酵工业,2022,48(7):78-84.