发酵是最古老、最经济的食品加工和保存食品的方法之一,是一种利用多种不同益生菌保存食品的技术[1]。发酵食品可以提高原料的营养价值、口感、风味和益生功能[2]。因此,发酵食品已成为人民日常饮食不可或缺的一部分,同样也是许多国家当地文化和传统习俗的组成部分。
辣椒是全球农业最重要的经济作物之一,可作为食物、香料和药物的来源[3]。我国辣椒资源丰富,品种繁多,栽培历史悠久。各地不同的辣椒品种及气候环境差异导致发酵辣椒的品质各有千秋,独具地方特色,深受当地人民喜爱,尤其是自然发酵的五彩椒[4]。五彩椒中富含各种营养物质,如蛋白质、碳水化合物、氨基酸、矿物质、辣椒素,是微生物生长繁殖的理想栖息地[5]。乳酸菌作为果蔬自然发酵过程中的主要微生物,其通过独特的代谢系统促进营养物质积累和风味物质形成[6]。此外,乳酸菌可将自身的益生特性通过发酵技艺传递至发酵辣椒中,发酵辣椒可以防止脂肪积累,降低血糖和血脂溶度,并提高抗氧化活性[7]。目前,针对发酵辣椒的研究主要集中在营养物质分析、发酵工艺优化及风味调配[8],对其乳酸菌资源的开发研究较少。研究发现,发酵辣椒中蕴含着丰富的乳酸菌资源,优势菌群主要为魏斯氏菌属、明串珠菌属、乳杆菌属和片球菌属[9]。武亚婷等[10]从自然发酵辣椒酱中分离出3株具有耐高盐和产酸快等特性的植物乳杆菌,可用于提高自然发酵辣椒酱的品质。DE MEDEIROS J C等[11]从自然发酵辣椒中分离出2株短乳杆菌和1株红豆乳杆菌,且都具有抗菌活性和抗人工胃液活性。徐园园等[12]从自然发酵三樱椒中分离得到16株植物乳杆菌和3株赫伦魏斯氏菌,其中植物乳杆菌PLP-1的耐酸能力最强。然而,以自然发酵五彩椒作为原料进行耐酸和耐胆盐乳酸菌资源分离的相关研究尚未报道。因此,自然发酵五彩椒中耐酸和耐胆盐乳酸菌资源的开发对辣椒产业具有重要意义,有利于地域特色功能性食品的研发。
本研究以自然发酵五彩椒发酵液为原料,采用钙溶圈法对乳酸菌进行分离筛选,利用分子生物学方法对分离菌株进行鉴定,并评价菌株的耐酸、耐胆盐及益生特性,以期筛选出适合五彩椒发酵的优良乳酸菌菌株,为自然发酵食品中乳酸菌资源的进一步开发和地域特色功能性食品的研发奠定基础。
1 材料与方法
1.1 材料与试剂
自然发酵五彩椒发酵液:取自广西地区的7户农户家(均采用相同的传统发酵方式),位于东经105°46'~110°55',北纬21°12'~25°79'。对照菌株鼠李糖乳杆菌(Lactobacillus rhamnosus)LGG、肠道致病性大肠埃希氏菌(Escherichia coli),CICC 10411、鼠伤寒沙门氏菌(Salmonella typhimurium)CICC 21484、单核增生李斯特氏菌(Listeria monocytogenes)CICC 21639和金黄色葡萄球菌(Staphylococcus aureus)CICC 21676:均购于中国工业微生物菌种保藏管理中心。
MRS培养基、LB培养基、脑心浸液(brain heart infusion,BHI)培养基、蛋白胨酵母葡萄糖(peptone yeast glucose,PYG)培养基等:广东环凯微生物科技有限公司;细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)快速抽提试剂盒、2×Taq聚合酶链式反应(polymerase chain reaction,PCR)Master Mix预混液:上海生工生物工程股份有限公司;氯化钠、酚酞、氢氧化钠、氯化钾、碳酸氢钠、氯化镁、盐酸等(分析纯):国药集团化学试剂有限公司;庆大霉素、青霉素、红霉素、四环素、林可霉素、氯霉素、万古霉素、环丙沙星、利福平等(生化试剂):北京索莱宝科技有限公司。
1.2 仪器与设备
JC-TP160-5B型电子分析天平:青岛精诚仪器仪表有限公司;PHS-3C-02型pH计:上海三信仪表厂;SEDI G型聚合酶链式反应(polymerase chain reaction,PCR)仪、KETA G型全自动凝胶成像系统:美国Wealtec公司;BKQ-B100II型全自动高压蒸汽灭菌器:山东博宇医疗器械有限公司;TGL-18MC型台式高速冷冻离心机:长沙湘锐离心机有限公司;ZSH-100型生化培养箱、ZYC-100B型恒温振荡器:上海喆图科学仪器有限公司;UV-8000S型双光束紫外可见分光光度计:上海精密仪器仪表有限公司。
1.3 方法
1.3.1 五彩椒发酵液制备
称取适量新鲜无腐烂的五彩椒,清洗干净,沥干水分,晾晒风干5 h,装入无菌玻璃罐中,分别添加质量分数5%的冰糖和没过五彩椒量的生抽,置于阴暗处室温发酵30 d,收集五彩椒发酵液。
1.3.2 乳酸菌的分离纯化
将收集的五彩椒发酵液用适量无菌生理盐水进行稀释,混匀后用无菌生理盐水梯度稀释至10-4、10-5和10-6,分别吸取200 μL稀释液均匀涂布于含1.5 g/L CaCO3的MRS固体平板,37 ℃静置培养48 h。挑选生长良好、有溶钙圈的单菌落进行镜检,保留细胞形态为球状和杆状的单菌落,连续划线纯化3次,随后通过革兰氏染色和接触酶实验完成疑似乳酸菌的初步筛选、分离及纯化[13]。
1.3.3 耐酸性实验
将活化后的菌株以0.2%(V/V)接种量接种于pH 3.0 MRS液体培养基中,37 ℃静置培养24 h,测定培养前后的OD600nm值,筛选耐酸乳酸菌[12]。
1.3.4 16S rRNA基因序列分析
利用细菌基因组DNA快速抽提试剂盒提取耐酸乳酸菌的DNA,使用细菌16S rRNA通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGT TACGACTT-3')进行PCR扩增。PCR扩增体系:20 ng/μL DNA模板1 μL,10 μmol/L上下游引物各0.5 μL,2×Taq PCR Master Mix预混液10 μL,双蒸水13 μL;PCR扩增程序:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸60 s,35个循环,72℃末端延伸10min[12]。将扩增产物送至上海生工生物工程股份有限公司进行DNA测序。将测序结果提交至GenBank数据库,进行序列信息同源比对分析,选取同源性较高的参考菌株,利用MEGA 7.0软件构建系统发育树[13]。
1.3.5 产酸实验
将活菌数为1×108 CFU/mL的耐酸乳酸菌种子液以1%(V/V)接种量接种于MRS液体培养基中,37℃静置培养24 h,根据GB 12456—2021《食品安全国家标准食品中总酸的测定》测定各菌株产酸量。阳性对照为鼠李糖乳杆菌LGG。
1.3.6 耐胆盐实验
参考秦雅莉等[14]提供的方法,具体如下:将活化后的菌株以0.2%(V/V)接种量接种于含0.1 g/L牛胆盐的MRS液体培养基中,37 ℃静置培养4 h,分别测定0 h和4 h的活菌数[14]。阳性对照为鼠李糖乳杆菌LGG。存活率计算公式如下:
1.3.7 耐人工胃肠液实验
人工胃液配制:50 mmol/L NaCl、25 mmol/L NaHCO3、7 mmol/L KCl、1 mmol/L KH2PO4、0.5 mmol/L(NH4)2CO3、0.1 mmol/L MgCl2、0.1 mmol/L CaCl2和0.8 g/L胃蛋白酶(3 000 U/mg),用1 mol/L HCl溶液调至pH 3.0[14];人工肠液配制:90 mmol/L NaHCO3、40 mmol/L NaCl、7 mmol/L KCl、0.8 mmol/L KH2PO4、0.6 mmol/L CaCl2、0.3 mmol/L MgCl2、10 mmol/L C26H44NNaO7S和0.1 g/L胰蛋白酶(1 500 U/mg),用1 mol/L NaOH溶液调至pH 7.0[14]。所配溶液均过膜除菌,备用。
参考BRODKORB A等[15]的方法,将活化后的菌株以0.5%(V/V)接种量接种于MRS液体培养基中,37 ℃静置培养24 h,4 000 r/min离心10 min,收集菌体,用无菌生理盐酸反复洗涤3次,调节菌液活菌数为1×107 CFU/mL,分别以10%(V/V)接种量接种于人工胃液和肠液中,37 ℃静置培养3 h,分别测定人工胃液和肠液处理0 h和3 h的活菌数[15]。阳性对照为鼠李糖乳杆菌LGG。存活率计算公式如下:
1.3.8 抑菌实验
上清液制备:将活化后的菌株以0.5%(V/V)接种量接种于MRS液体培养基中,37 ℃静置培养24 h,10 000 r/min离心20 min,收集上清液,4 ℃保存,备用。
参考ANGMO K等[16]的方法,将肠道致病性大肠埃希氏菌(EC)和金黄色葡萄球菌(SA)接种于LB液体培养基中,鼠伤寒沙门氏菌(ST)接种于BHI液体培养基中,单核增生李斯特氏菌(LM)接种于PYG液体培养基中,37 ℃培养18 h,吸取适量培养液稀释至活菌数约为1×107 CFU/mL,分别吸取100 μL稀释液均匀涂布于对应固体培养基平板,平板表面放入4个牛津杯,加入200 μL上清液,37 ℃静置培养24 h,测定抑菌圈直径[13]。阳性对照为鼠李糖乳杆菌LGG。空白对照为灭菌的MRS培养基。
1.3.9 抗生素耐受性实验
参考SAMEDI L等[17]的方法,将活化后的菌株稀释至活菌数约为1×107 CFU/mL,吸取100 μL稀释液均匀涂布于MRS固体平板,5 min后平板表面贴上4个抗生素药片,37 ℃静置培养24 h,测定抑菌圈直径[13]。阳性对照为鼠李糖乳杆菌LGG。空白对照为灭菌的MRS培养基。
1.3.10 抗氧化活性实验
参考赵荣敏[18]提供的方法测定1,1-二苯基-2-三硝基苯肼(2,2-diphenyl-1-picrylhydrazyl,DPPH)自由基清除能力,具体如下:将2 mL 0.2 mmol/L DPPH甲醇溶液和2 mL 1.3.8部分制备的上清液混合均匀,置于室温黑暗条件下反应30 min,波长517 nm处测定吸光度值,分别以甲醇和去离子水代替样品作为阳性对照和空白对照[18]。菌株阳性对照为鼠李糖乳杆菌LGG。DPPH自由基清除率计算公式如下:

参考杨博等[13]提供的方法测定羟自由基清除能力,具体如下:吸取1 mL 1.3.8部分制备的上清液,依次加入1 mL 0.5 mmol/L H2O2溶液、1 mL 0.75 mmol/LFeSO4溶液、1 mL 0.75 mmol/L 1,10-邻菲咯啉溶液和1.5 mL 0.15 mol/L磷酸盐(pH 7.2)缓冲溶液,混匀后37 ℃反应30 min,波长536 nm处测定吸光度值,分别以H2O2和去离子水代替样品作为阳性对照和空白对照[13]。菌株阳性对照为鼠李糖乳杆菌LGG。羟自由基清除率计算公式如下:
1.3.11 数据处理
所有实验重复3次,实验结果以“平均值±标准差”的形式表示。使用GraphPad Prism 8.0和HemI 2.0软件绘图,采用SPSS 21.0软件进行差异显著分析(P<0.05)。
2 结果与分析
2.1 乳酸菌的分离纯化
根据溶钙圈大小、革兰氏阳性和接触酶阴性实验结果,从7份农户自然发酵五彩椒中共筛选得到32株疑似乳酸菌,均为乳白色,菌落形态呈短杆状或杆状。
2.2 乳酸菌的耐酸能力
乳酸菌发挥益生作用的前提是存活于人体胃肠道中,故需要一定的耐酸能力[14]。对32株菌株的耐酸能力进行测定,以ΔOD600nm值表示,结果见表1。
从表1可知,不同菌株的耐酸能力各有差异,只有菌株CA1-1、CA1-4、CA3-4、CA4-2、CA6-2的ΔOD600nm值>0.3,具有较强的耐酸能力。窦芳娇等[19]研究结果表明,其从长杆白菜泡菜中筛选得到植物乳杆菌RPC21和鼠李糖乳杆菌RCQ4在pH 3.0条件下培养18 h后的OD600nm值分别为0.349和0.302。乳酸菌生长繁殖会消耗大量的糖类物质,并将其代谢为各种酸类代谢产物,使发酵环境酸化,pH快速降低,在其表面形成生物膜以维持胞内稳态,从而具有较强的耐酸能力[6]。综上可知,本实验筛选得到的5株耐酸乳酸菌具有较强的耐酸能力,可存活于较低的pH环境下,故选择耐酸乳酸菌CA1-1、CA1-4、CA3-4、CA4-2、CA6-2进行后续的实验分析。
表1 32株乳酸菌在pH 3.0环境中的生长差异
Table 1 Growth differences of 32 strains of lactic acid bacteria in pH 3.0
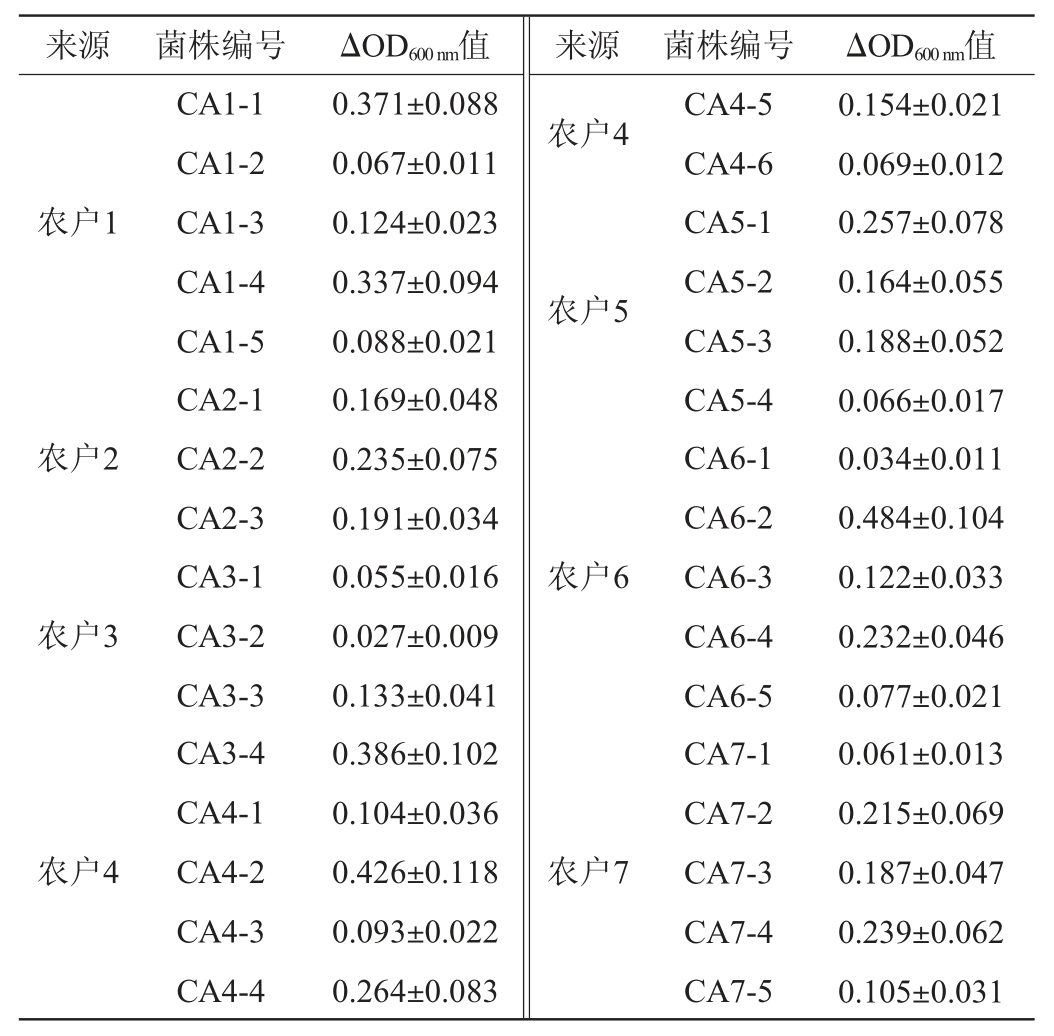
注:ΔOD600nm表示乳酸菌在0 h与24 h的OD600nm差值。
2.3 筛选乳酸菌的16S rRNA基因序列分析
5株耐酸乳酸菌菌株基于16S rRNA基因序列的系统发育树见图1。由图1可知,菌株CA4-2和CA1-4与植物乳杆菌(Lactobacillus plantarum)的亲缘关系最近,且序列相似性高达100%。同时,菌株CA1-1、CA3-4和CA6-2经鉴定为发酵乳杆菌(Lactobacillus fermentum)、类肠膜魏斯氏菌(Weissella paramesenteroides)和嗜酸乳杆菌(Lactobacillus acidophilus)。

图1 基于16S rRNA基因序列的筛选乳酸菌系统发育树
Fig.1 Phylogenetic tree of screened lactic acid bacteria based on 16S rRNA gene sequences
2.4 筛选乳酸菌的产酸和耐胆盐能力
乳酸菌的产酸能力是评价菌株生长代谢的重要指标之一,不同菌株产酸能力强弱会影响发酵产品的口感和品质[20]。对5株耐酸乳酸菌和鼠李糖乳杆菌LGG进行产酸实验,结果见图2。由图2可知,培养24 h后,菌株CA1-4、CA3-4和CA6-2的产酸量分别为6.65 g/L、5.17 g/L和3.25 g/L,显著低于鼠李糖乳杆菌LGG的产酸量(8.25 g/L)(P<0.05);菌株CA1-1和CA4-2在培养24 h后的产酸量分别为9.43 g/L和9.86 g/L,显著高于鼠李糖乳杆菌LGG的产酸量(P<0.05),说明这两株菌的产酸能力较强。
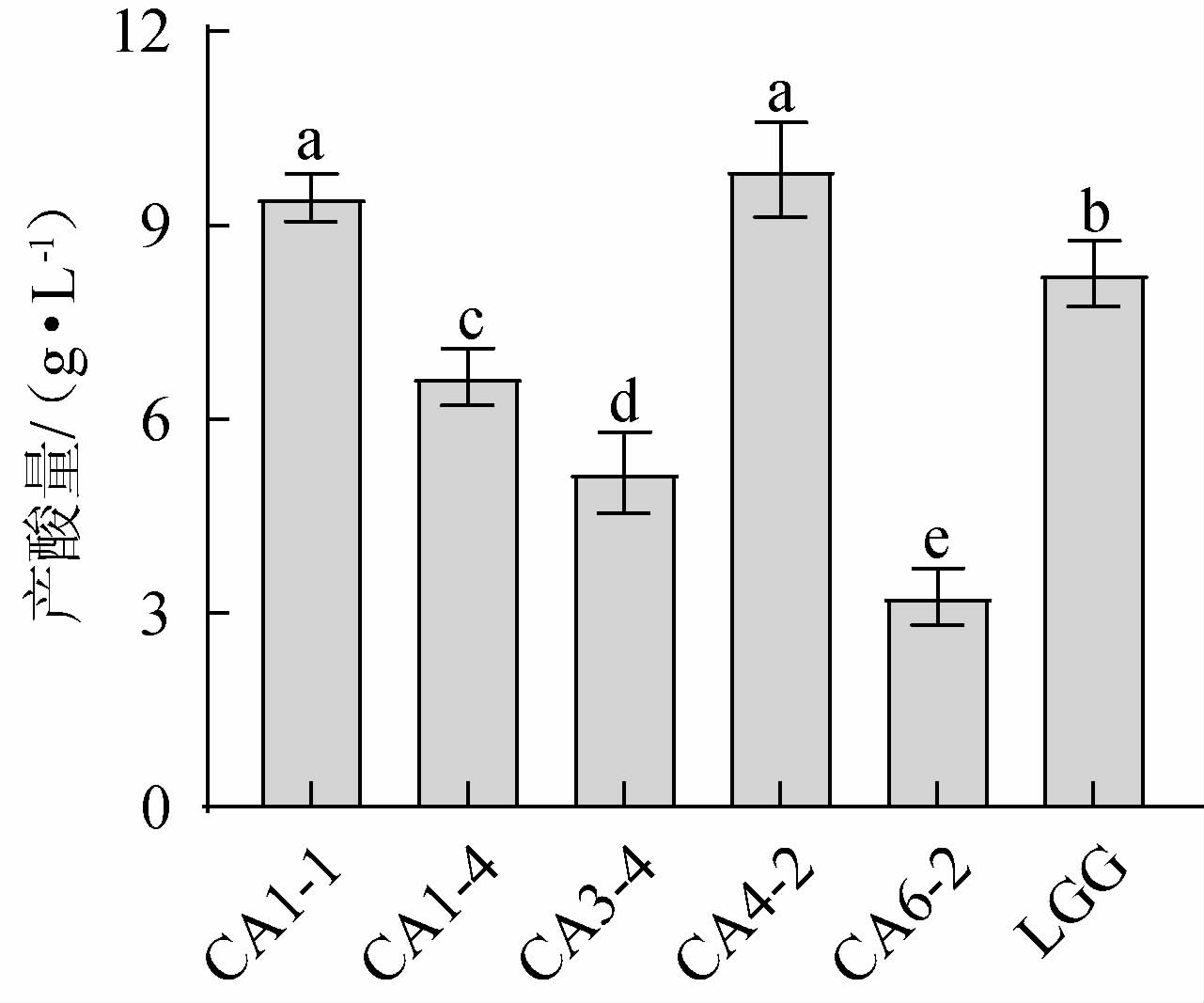
图2 筛选乳酸菌产酸能力的测定结果
Fig.2 Determination results of acid production ability of screened lactic acid bacteria
不同小写字母表示差异显著(P<0.05)。下同。
乳酸菌的耐胆盐能力是衡量优良乳酸菌的主要指标之一,通常人体肠道的胆盐溶度为0.03%~0.3%[21]。对5株乳酸菌和鼠李糖乳杆菌LGG进行耐胆盐实验,结果见表2。由表2可知,菌株CA3-4和CA6-2的存活率分别为64.83%和71.26%,显著低于鼠李糖乳杆菌LGG的存活率(P<0.05);菌株CA1-4和CA4-2的存活率分别为90.77%和96.51%,与鼠李糖乳杆菌LGG的存活率无显著差异(P>0.05);菌株CA1-1的存活率最高,可达108.1%,具有最高的胆盐耐受能力。胆盐可通过破坏细胞膜完整性引起细胞破裂死亡,而细胞生长过程中代谢的各种脂肪酸会进入细胞膜,进而影响菌株的胆盐耐受能力[22]。
表2 筛选乳酸菌耐胆盐能力的测定结果
Table 2 Determination results of bile salt tolerance ability of screened lactic acid bacteria
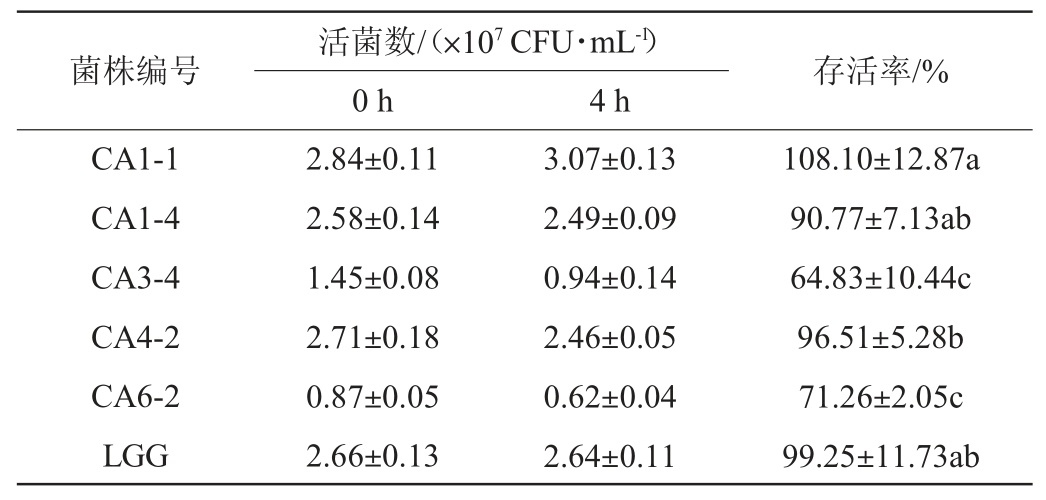
注:同列小写字母完全不同表示差异显著(P<0.05)。下同。
2.5 乳酸菌的耐胃肠道消化能力
胃肠道消化环境复杂,富含多种不同的酶系,能够分解菌体蛋白质,抑制微生物的生长繁殖[14]。乳酸菌的耐胃肠道消化能力是评判乳酸菌是否具有潜在益生特性的重要指标,通常,乳酸菌在受到胃酸和肠道环境影响后,其生长受到抑制,而菌株在胃肠道的存活情况是决定其益生特性的基础[13]。乳酸菌耐胃肠道消化能力的测定结果见表3。
表3 筛选乳酸菌耐胃肠道消化能力的测定结果
Table 3 Determination results of gastrointestinal digest tolerance ability of screened lactic acid bacteria
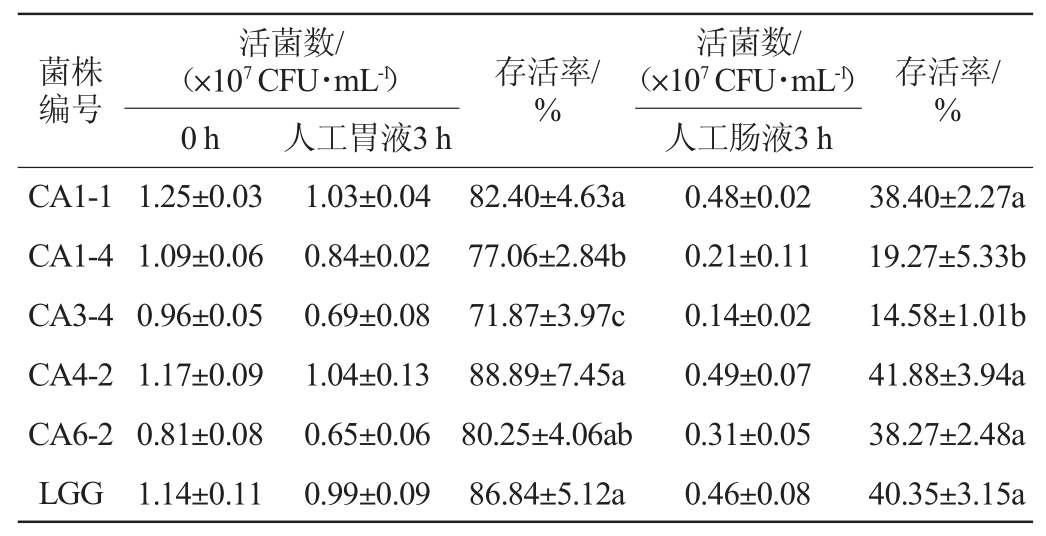
由表3可知,所有菌株在人工胃液处理3 h后活菌数均受到抑制,但存活率均在70%以上,其中菌株CA1-1、CA4-2、CA6-2和鼠李糖乳杆菌LGG的存活率均超过80%,尤其是菌株CA4-2存活率高达88.89%,表现出最高的人工胃液耐受能力。此外,相比人工胃液,人工肠液对菌株的影响更大,存活率更低。在人工肠液处理3 h后,菌株CA3-4和CA1-4的存活率分别仅为14.58%和19.27%,显著低于鼠李糖乳杆菌LGG的存活率(40.35%)(P<0.05)。其余耐酸菌株在3 h人工肠液处理后的存活率与鼠李糖乳杆菌LGG的存活率无明显差异(P>0.05),均表现出较强的人工肠液耐受能力。造成上述差异的原因是由于物种和菌株不同所导致,不同物种和菌株对胃肠液的耐受能力不同[23]。综上可知,相比鼠李糖乳杆菌LGG,菌株CA1-1、CA4-2和CA6-2能更好的在胃肠道环境中存活,保留更多的活菌数,从而发挥益生特性。
2.6 乳酸菌的抑菌能力
乳酸菌在生长代谢过程中会产生多种抑菌物质,如有机酸、抗菌肽和细菌素等[24]。对5株乳酸菌和鼠李糖乳杆菌LGG进行抑菌能力实验,结果见图3,颜色由蓝至红表示抑菌圈直径的逐渐增大。由图3可知,相比鼠李糖乳杆菌LGG,菌株CA1-1对肠道致病性大肠埃希氏菌的抑菌效果更好,菌株CA4-2和CA3-4对单核增生李斯特氏菌的抑菌效果更好,菌株CA6-2对金黄色葡萄球菌的抑菌效果更好。此外,菌株CA6-2、CA3-4、CA1-1和CA1-4对鼠伤寒沙门氏菌的抑菌效果均优于鼠李糖乳杆菌LGG。菌株CA6-2和CA1-4无深蓝色区域,说明这2株菌的抑菌谱较广。除菌株CA4-2对鼠伤寒沙门氏菌的抑菌效果较弱外,其他菌株对肠道致病性大肠埃希氏菌、鼠伤寒沙门氏菌、单核增生李斯特氏菌和金黄色葡萄球菌均有较好的抑菌效果。由于不同物种和菌株产生的抑菌物质组成及含量各有不同,导致其抑菌能力迥然有别[24]。综上,菌株CA1-1和CA3-4表现出较强的抑菌能力。
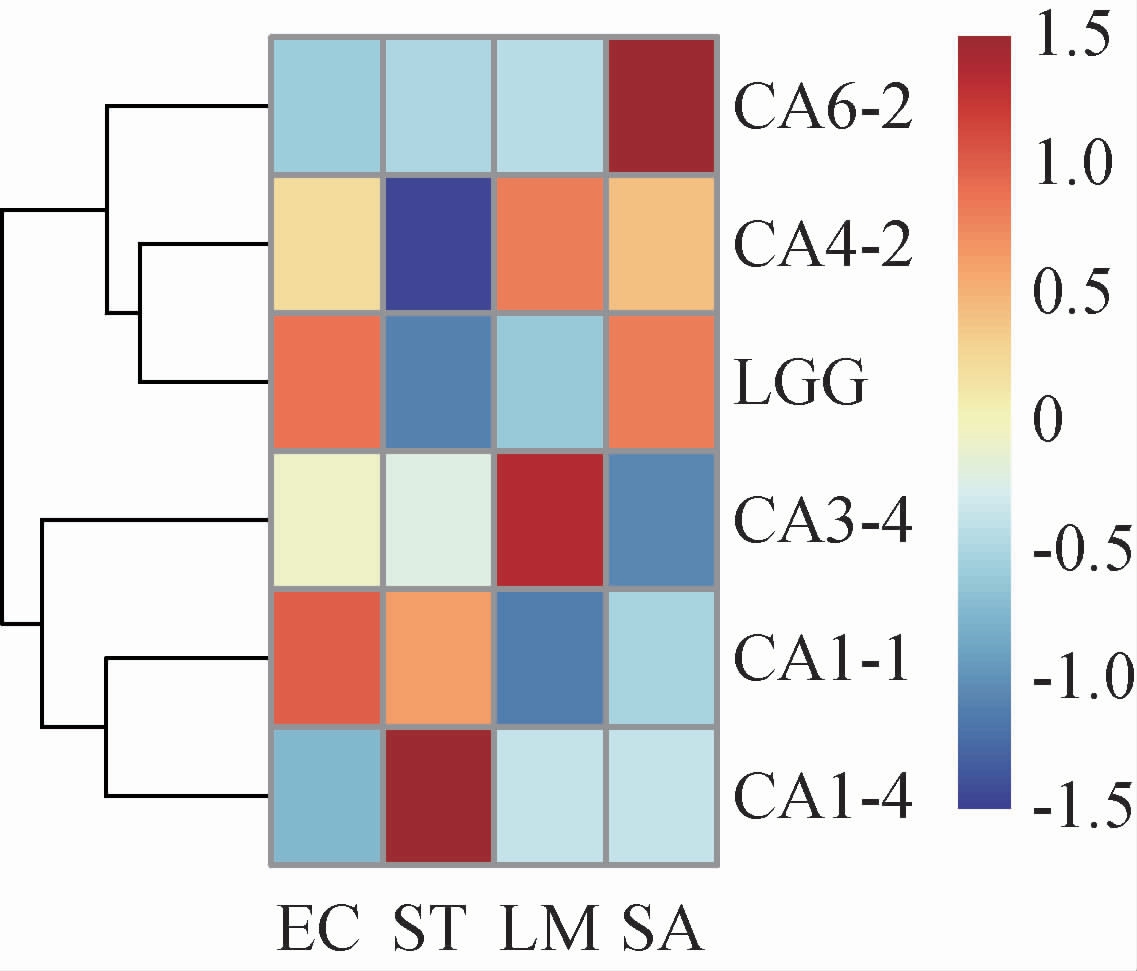
图3 筛选乳酸菌抑菌能力的热图
Fig.3 Heat map of bacteriostatic ability of screened lactic acid bacteria
EC表示肠道致病性大肠埃希氏菌,ST表示鼠伤寒沙门氏菌,LM表示单核增生李斯特氏菌,SA表示金黄色葡萄球菌,LGG表示鼠李糖乳杆菌。
2.7 乳酸菌的耐抗生素能力
乳酸菌对抗生素的耐药性会显著影响环境及人体安全,当乳酸菌携带耐药基因后,可通过基因水平转移将耐药基因转移至致病菌基因组上,使致病菌产生耐药[17]。通常,从发酵食品中分离的乳酸菌被认为是安全且不含耐药基因的,但仍有必要其安全性进行评价。选取9种常见不同分类的抗生素对5株乳酸菌和鼠李糖乳杆菌LGG进行抗生素耐受性实验,结果见图4,颜色由蓝至红表示抑菌圈直径的逐渐增大。
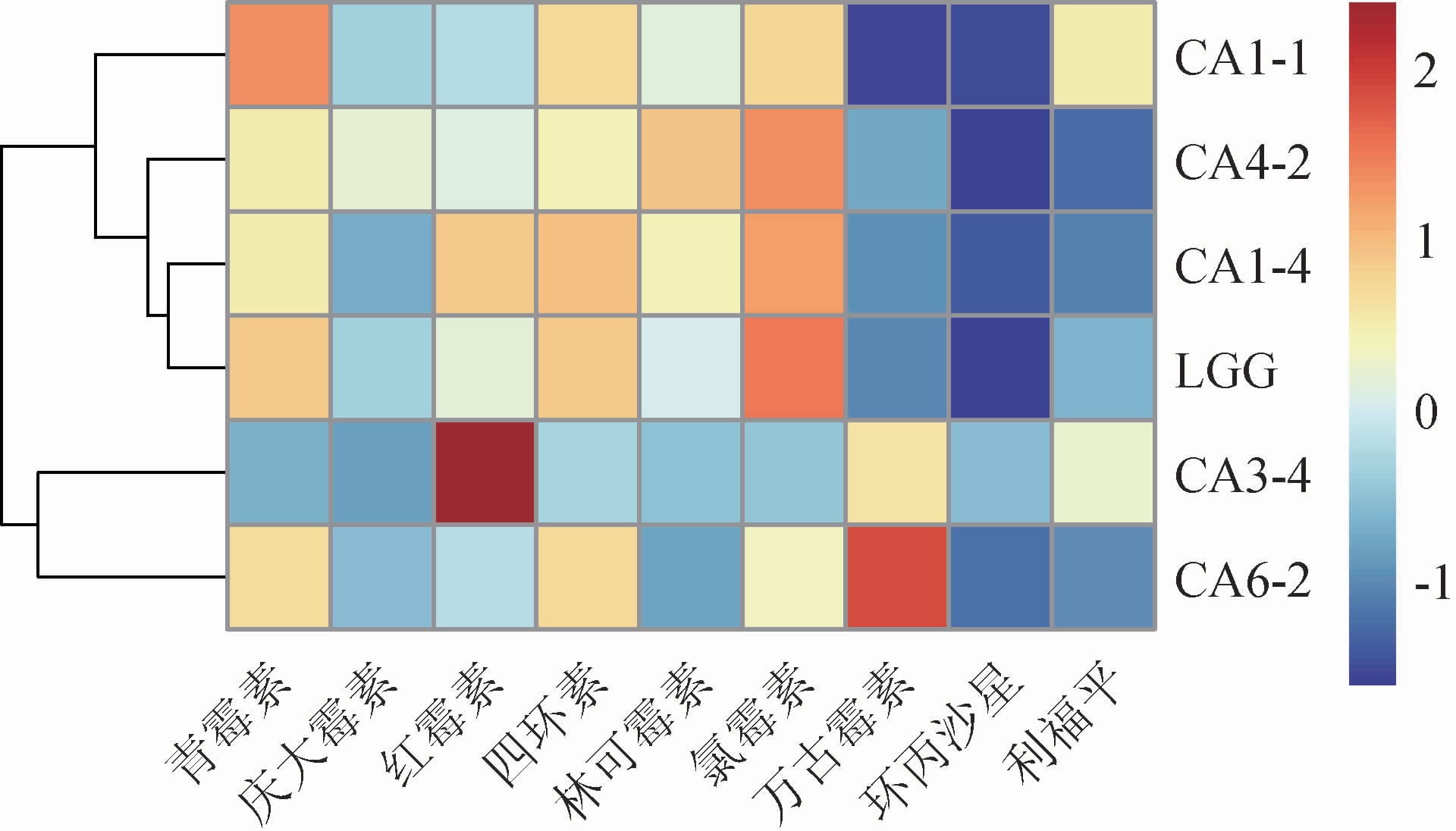
图4 筛选乳酸菌耐抗生素能力的热图
Fig.4 Heat map of antibiotic resistance of screened lactic acid bacteria
由图4可知,相比鼠李糖乳杆菌LGG,菌株CA1-1对青霉素、林可霉素和利福平的耐药性更差,菌株CA4-2对庆大霉素、林可霉素、万古霉素和环丙沙星的耐药性更差,菌株CA3-4对红霉素、万古霉素、环丙沙星和利福平的耐药性更差,而菌株CA6-2仅对万古霉素耐药性更差。通常,万古霉素耐药性是由于D-丙氨酸-D-乳酸复合物取代了位于肽聚糖的靶点D-丙氨酸-D-丙氨酸所导致的耐药,而其余抗生素的耐药性则可能是由于该抗生素在乳酸菌细胞内缺乏靶位[13,25]。菌株CA1-4、CA3-4和CA6-2无深蓝色区域,说明这3株菌的抗生素耐药性更窄,大部分抗生素可抑制这3株菌生长。青霉素、红霉素、四环素、林可霉素、氯霉素的大部分区域为橙色、黄色和浅蓝色,说明大部分菌株对其敏感,从而证实了乳酸菌对这些抗生素的耐药性较低,与杨博等[13]的研究结果相一致。其余抗生素的大部分区域为蓝色,表明这些菌株对其表现较强的耐药性。
2.8 乳酸菌的抗氧化能力
机体在衰老过程中会产生DPPH自由基和羟自由基等氧化性极强的自由基离子,导致发生氧化应激反应,从而引起DNA、蛋白质、小细胞分子等氧化损伤[26]。因此,对乳酸菌进行抗氧化能力评判尤为重要。通常,单一抗氧化能力的检测并不能准确评价乳酸菌的抗氧化能力,为增加抗氧化活性结果的准确性,因根据多种抗氧化活性实验的综合结果进行评定。本实验根据DPPH自由基和羟自由基的清除效果对乳酸菌的抗氧化能力进行评价,结果见图5。
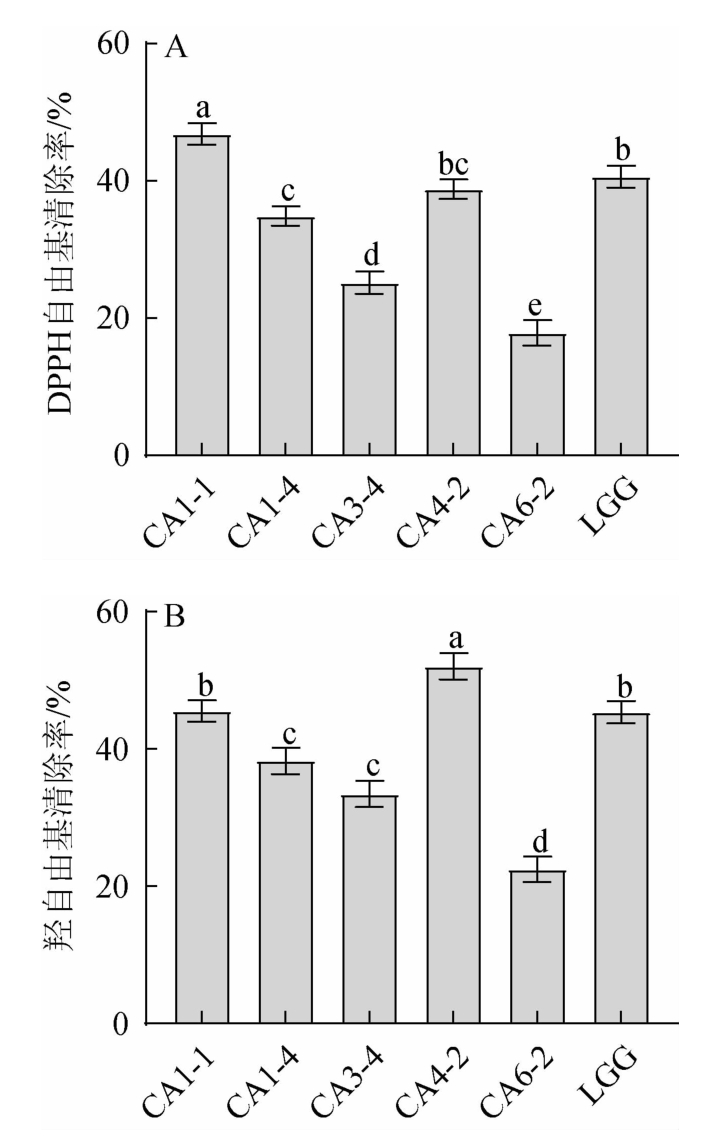
图5 筛选乳酸菌抗氧化能力的测定结果
Fig.5 Determination results of antioxidant ability of screened lactic acid bacteria
由图5A可知,菌株CA1-4、CA3-4和CA6-2的DPPH自由基清除率分别为34.9%、25.19%和17.88%,显著低于鼠李糖乳杆菌LGG的DPPH自由基清除率(40.61%)(P<0.05)。菌株CA4-2的DPPH自由基清除率与鼠李糖乳杆菌LGG无显著差异(P>0.05)。此外,菌株CA1-1的DPPH自由基清除率显著强于鼠李糖乳杆菌LGG(P<0.05),提高了6.23%。根据图5B可知,筛选菌株的羟自由基清除率均>20%,说明这些菌株都具有一定的羟自由基清除能力。菌株CA1-1的羟自由基清除率与鼠李糖乳杆菌LGG无显著差异(P>0.05)。菌株CA4-2的羟自由基清除率高达52.05%,显著强于鼠李糖乳杆菌LGG(P<0.05),提高了6.71%。由于不同物种和菌株产生的代谢产物组成及含量各不相同,导致其抗氧化能力迥然不同[18]。综上可知,菌株CA1-1和CA4-2具有一定的抗氧化能力。
3 结论
本研究利用传统微生物分离鉴定方法,从自然发酵五彩椒发酵液中分离纯化得到32株疑似乳酸菌,其中5株菌具有较强的耐酸能力。根据16S rRNA测序鉴定菌株CA1-1、CA1-4、CA3-4、CA4-2和CA6-2分别为发酵乳杆菌、植物乳杆菌、类肠膜魏斯氏菌、植物乳杆菌、嗜酸乳杆菌。比较了5株菌和鼠李糖乳杆菌LGG的产酸能力、耐胆盐能力、耐胃肠道消化能力、耐抗生素能力、抑菌能力和抗氧化能力等益生特性,结果表明,菌株CA1-1的各项益生特性指标均优于鼠李糖乳杆菌LGG,而菌株CA4-2的各项益生特性指标略低或无差异于鼠李糖乳杆菌LGG。本研究表明自然发酵五彩椒可作为筛选具有优良益生特性乳酸菌的天然来源,其中发酵乳杆菌CA1-1和植物乳杆菌CA4-2具有作为益生菌的潜力,可为后续研发具有较好益生功效的自然发酵制品提供了菌株资源和理论基础。
[1]S,ANLIER N,GÖKCEN B B,SEZGIN A C.Health benefits of fermented foods[J].Crit Rev Food Sci Nutr,2019,59(3):506-527.
[2]XU X X,WU B B,ZHAO W T,et al.Correlation between autochthonous microbial communities and key odorants during the fermentation of red pepper(Capsicum annuum L.)[J].Food Microbiol,2020,91:103510.
[3]刘颖,李晓燕,高静.韶关和衡阳地区自然发酵辣椒微生物群落多样性及功能差异[J].中国食品添加剂,2022,33(3):217-227.
[4]LIU S N,HAN Y,ZHOU Z J.Lactic acid bacteria in traditional fermented Chinese foods[J].Food Res Int,2011,44(3):643-651.
[5]吴星,王萌,赵曾菁,等.广西大棚五彩椒绿色高产栽培技术[J].中国蔬菜,2020(12):113-116.
[6]WANG Y Y,ZHANG C H,LIU F S,et al.Ecological succession and functional characteristics of lactic acid bacteria in traditional fermented foods[J].Crit Rev Food Sci Nutr,2022,91(1):1-15.
[7]SRICHAROEN P,LAMAIPHAN N,PATTHAWARO P,et al.Phytochemicals in Capsicum oleoresin from different varieties of hot chilli peppers with their antidiabetic and antioxidant activities due to some phenolic compounds[J].Ultrason Sonochem,2017,38:629-639.
[8]WANG Y R,ZHOU H,DING S H,et al.Changes in free amino acids of fermented minced peppers during natural and inoculated fermentation process based on HPLC-MS/MS[J].J Food Sci,2020,85(9):2803-2811.
[9]韩俊燕,赵国忠,赵建新,等.发酵辣椒细菌多样性的16S rDNA测序分析[J].中国食品学报,2018,18(5):246-251.
[10]武亚婷,杜木英,丁承焱,等.新疆地区自然发酵辣椒酱中耐盐乳酸菌的筛选鉴定[J].中国酿造,2019,38(12):43-47.
[11]DE MEDEIROS J C,LEANDRO E S,MALDONADE I R,et al.Characterization of the probiotic potential of lactic acid bacteria isolated from spontaneous fermentation of jalapeno peppers(Capsicum annuum L.)[J].J Food Process Pres,2021,45(12):e16025.
[12]徐园园,李静,王敏,等.自然发酵三樱椒中乳酸菌的分离及鉴定[J].中国酿造,2022,41(4):147-151.
[13]杨博,柏吉,靳亚梅,等.新疆地区驴乳源优良乳酸菌发酵剂的筛选及菌株益生特性[J].食品科学,2022,43(2):224-232.
[14]秦雅莉,赵笑颍,沈圆圆,等.酸笋中具有抗炎活性乳酸菌的筛选及鉴定[J].食品科学,2022,43(8):121-127.
[15]BRODKORB A,EGGER L,ALMINGER M,et al.INFOGEST static in vitro simulation of gastrointestinal food digestion[J].Nat Protoc,2019,14(4):991-1014.
[16]ANGMO K,KUMARI A,BHALLA T C.Probiotic characterization of lactic acid bacteria isolated from fermented foods and beverage of Ladakh[J].LWT-Food Sci Technol,2016,66:428-435.
[17]SAMEDI L,CHARLES A L.Isolation and characterization of potential probiotic Lactobacilli from leaves of food plants for possible additives in pellet feeding[J].Ann Agr Sci,2019,64(1):55-62.
[18]赵荣敏.不同益生菌发酵剂对复合果蔬汁品质的影响[J].食品研究与开发,2021,42(9):144-150.
[19]窦芳娇,苏昊,邓冬莲,等.低温长杆白菜泡菜中乳酸菌的分离鉴定与应用[J].食品工业科技,2021,42(5):113-118.
[20]许女,王佳丽,陈旭峰,等.优良乳酸菌的筛选、鉴定及在酸奶中的应用[J].中国食品学报,2019,19(2):98-107.
[21]YU H J,CHEN Y F,YANG H J,et al.Screening for Lactobacillus plantarum with potential inhibitory activity against enteric pathogens[J].Ann Microbiol,2015,65:1257-1265.
[22]胡斌,田丰伟,张灏,等.植物乳杆菌脂肪酸构成与胆盐耐受性的相关性分析[J].中国食品学报,2017,17(9):27-32.
[23]PLESSAS S,NOUSKA C,KARAPETSAS A,et al.Isolation,characterization and evaluation of the probiotic potential of a novel Lactobacillus strain isolated from Feta-type cheese[J].Food Chem,2017,226:102-108.
[24]GUTIÉRREZ S,MARTÍNEZ-BLANCO H,RODRÍGUEZ-APARICIO L B,et al.Effect of fermented broth from lactic acid bacteria on pathogenic bacteria proliferation[J].J Dairy Sci,2016,99(4):2654-2665.
[25]CAGGIA C,DE ANGELIS M,PITINO I,et al.Probiotic features of Lactobacillus strains isolated from Ragusano and Pecorino Siciliano cheeses[J].Food Microbiol,2015,50:109-117.
[26]MENEZES A G T,RAMOS C L,CENZI G,et al.Probiotic potential,antioxidant activity,and phytase production of indigenous yeasts isolated from indigenous fermented foods[J].Probiotics Antimicro,2020,12(1):280-288.