红酸汤是以红辣椒、西红柿为主要原料,添加食盐等辅料后由微生物分别发酵,经研磨、调配等工艺加工而成的半固态复合调味料,在贵州少数民族聚居区具有上千年的饮食文化渊源[1-2]。除了口味酸爽独特外,其在抗氧化[3]、降血脂[4]等方面也表现出积极的作用效果,这也是红酸汤能作为贵州生态特色食品,与麻辣和清汤调味底料三分火锅市场的重要原因之一。
与泡菜[5]、酸菜[6-7]类似,红酸汤是由乳酸菌(尤其是乳杆菌属)主导发酵,并通过微生物代谢产生乳酸、醋酸等特征风味物质的传统发酵食品[8-9]。研究表明,自然发酵红酸汤中乳酸菌区系会由于原料、产地、加工工艺或分析方法的差异而呈现出不同的种属特征。张璇[10]从凯里红酸汤半成品中分离出植物乳杆菌(L.plantarum)、马里乳杆菌(L.mali)等乳酸菌共计12种,这与王琪琪等[11]从丹寨辣椒酸汤和番茄酸汤中发现红酸汤优势乳酸菌分别为耐酸乳杆菌(L.acetotolerans)、Lactobacillus zymae和布氏乳杆菌(L.buchneri)的结果有所不同。另外,何扬波等[12]对自制红酸汤的微生物区系进行了系统研究,发现番茄、辣椒红酸汤的优势乳酸菌分别为戊糖乳杆菌(L.pentosus)和纳木雷氏乳杆菌(L.namurensis)。纵然对红酸汤微生物区系的已经有一些研究,但是其发酵工艺依然以自然发酵为主,发酵周期长、质量控制难等极大地限制了其产业发展。
乳酸菌选育技术较多,常见的有亚硝基胍、紫外、激光等化学和物理方法[13-15]。然而,传统的诱变方法具有低剂量效果不明显、高剂量负突变率高等缺点,选育效果较差,而激光、常温常压等离子体等诱变技术又需要专门设备,存在资源协调困难[16]。基于实验室具备60Co-γ射线辐照装置,且其在其他菌株改良过程中被证明具有正突变率高、不易发生回复突变、操作简便等特点[17-18]。本研究从自然发酵番茄和辣椒酸汤中分离筛选乳酸菌,并利用60Co-γ射线对筛选菌株进行辐照诱变选育。以期获得产酸能力强、发酵效果好的红酸汤工业菌株,对于红酸汤产业发展具有重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
番茄:贵阳中曹司大桥菜场;红辣椒:贵州黔之味生态农业有限公司。
1.1.2 化学试剂
碳酸钙(分析纯):成都金山化学试剂有限公司;甘油(分析纯):天津市富宇精细化工有限公司;溴甲酚紫(分析纯)、氢氧化钠分析滴定液(0.25 mol/L):上海阿拉丁生化科技股份有限公司;革兰氏染色试剂盒:北京索莱宝科技有限公司。
1.1.3 培养基
MRS 琼脂培养基、MRS 肉汤培养基:上海博微生物科技有限公司;MC培养基:青岛高科园海博生物技术有限公司。
1.2 仪器与设备
JE203型电子天平:上海浦春计量仪器有限公司;I-Pure Pro2型智能超纯水系统:杭州泽南科技有限公司;GI54DS型立式自动压力蒸汽灭菌锅:致微(厦门)仪器有限公司;SW-CJ-2FD净化工作台:上海博迅医疗生物仪器股份有限公司;KLH-250FD型精密生化培养箱:上海齐欣科学仪器有限公司;BSD-TF270型台式恒温振荡器:上海博迅实业有限公司医疗设备厂;ABI 3730型基因分析仪:美国PE ABI公司;60Co-γ射线动态辐照源:贵州金农辐照科技有限公司;PHSJ-4F型pH计:上海雷磁仪器厂;3020型酶标仪、Trace1300型气相色谱仪、TSQ8000型质谱仪:TG-5MS色谱柱(60 m×0.25 mm,0.25 μm):赛默飞世尔科技有限公司;固相萃取头(50/30 μm,DVB/CAR/PDMS):美国Supelco公司。
1.3 试验方法
1.3.1 红酸汤制备及样品采集
挑选无明显损坏或瘢痕的番茄、红辣椒,摘除柄蒂,经清水洗净后斩拌破碎。番茄、红辣椒分别装坛,室温、厌氧发酵一定时间得到红酸汤。其中,发酵番茄(fermentation tomato,FT)和发酵红辣椒(fermentation pepper,FP)的食盐添加量分别为4%和8%。根据前期研究结果[12],取发酵时间为28 d的发酵番茄和发酵红辣椒样品作为红酸汤发酵乳酸菌分离原料。
1.3.2 乳酸菌分离
发酵番茄及发酵红辣椒酸汤样品中乳酸菌分离、纯化参照《微生物学实验教程》及《食品微生物学检验乳酸菌检验》中相关方法进行[19-20]。取发酵番茄、红辣椒酸汤样品25.0 g,置于装有225 mL生理盐水的无菌三角瓶,适当梯度稀释后分别涂布于MRS和MC琼脂培养基上,37 ℃培养48 h。挑取单个菌落进行纯化,革兰氏染色阳性、过氧化氢酶阴性的菌株初步判定为疑似乳酸菌[21]。
1.3.3 筛选菌株鉴定
疑似乳酸菌株经分离、纯化后接种于斜面,分别采用革兰氏染色试剂盒、细菌微量生化鉴定管对其菌体形态、生理生化进行分析。同时,各疑似菌株送生工生物工程(上海)股份有限公司,以27F和1492R作为引物进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。PCR扩增体系(5 μL):取0.2 mL的PCR管,管插在颗粒冰中,按顺序加入BigDye Mix、待测脱氧核糖核酸(deoxyribonucleic acid,DNA)、待测DNA的正向引物、M13(-21)引物和灭菌去离子水各1 μL,总反应体积5 μL,不加轻矿物油或石蜡油,盖紧PCR管,混匀离心后置于BBI PCR仪上进行扩增。PCR扩增程序为:98 ℃变性2 min后进行PCR循环,PCR循环参数为96 ℃、10 s,50 ℃、5 s,60 ℃、4 min,25个循环,扩增结束后设置4 ℃保温。借助其ABI 3730型基因分析仪完成测序工作。基因序列在美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank数据库中与已知序列进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对,选取基因序列同源性较高的相关菌株的16S rDNA区域序列作为参比对象,借助MEGA5.0软件进行相似性分析并采用邻接(neighbor-joining,NJ)法绘制目标菌株和参比菌株之间的系统发育树[22]。
1.3.4 60CO-γ射线辐照诱变
取经甘油冷冻保藏(-20 ℃)的目标菌株,37 ℃、200 r/min条件下摇床培养24 h,活化后接种于新鲜斜面(每株菌准备3支斜面)。每支斜面中加入10 mL无菌生理盐水,振摇1 min,再转移至50 mL无菌三角瓶,再次振摇1 min后制得乳酸菌悬浮液。菌液无菌分装后转移至贵州金农辐照科技有限公司,进行60Co-γ射线辐照处理,吸收剂量率为1.0 Gy/min,吸收剂量分别为100 Gy、200 Gy、300 Gy、400 Gy、500 Gy、600 Gy、700 Gy、800 Gy。诱变结束后,各菌液稀释至10-7,接种于MRS选择培养基上,37 ℃培养24 h,培养结束后根据各平板上的菌株形态和溶钙圈大小进行标号筛选。
1.3.5 致死率及正向突变指标测定
参照王雨辰等[23]的研究方法,测定目标菌株的辐照致死率并对正向突变菌株进行筛选。具体而言,将对照组与辐照后的目标菌株悬浮液进行10-1~10-7梯度稀释,吸取0.1 mL菌悬液均匀涂布于MRS筛选培养基平板上(每个处理进行3个重复),37 ℃厌氧培养24~28 h后计算每皿菌落数,确定致死率(%);突变情况以菌株溶钙圈直径和菌落直径比值(HC值)作为判定标准,计为HC值,当辐照菌株的HC值比对照菌株HC值提高20%时记为正向突变。采用活菌平板计数,致死率计算公式如下:
式中:N1为对照组菌液接种在平板上长出的菌落数量,CFU/mL;N0为辐照组菌液接种于平板上长出的菌落数量,CFU/mL。
1.3.6 选育菌株产酸性能分析
将辐照选育菌株用MRS肉汤培养基增菌培养24 h后,得到菌体密度为109 CFU/mL的菌液,4 ℃、4 000 r/min条件下离心10 min,弃去上清液,下层菌泥用10 mL无菌磷酸盐缓冲液(phosphate buffer solution,PBS)(pH=7.2~7.4)冲洗2次,菌泥以2%接种量分别接种于番茄和红辣椒中[24]。
发酵番茄、发酵红辣椒总酸含量的测定:按照GB/T 12456—2008《食品中总酸的测定》[25]中的方法。
1.3.7 选育菌株发酵番茄和红辣椒的风味物质分析
发酵番茄、发酵红辣椒的风味物质分析采用气质联用(gas chromatography-mass spectrometry,GC-MS)法。参照XIE C Z等[26]的方法并有所调整。称取5.0 g样品于顶空瓶中,加入NaCl 1.0 g,压盖,置于70 ℃水浴中平衡20 min。插入固相微萃取针头,70 ℃吸附萃取40 min,上机解吸5 min后进样检测。
气相色谱条件:采用TG-5MS色谱柱(60 m×0.25 mm,0.25 μm),载气为高纯氦气(He),流速为1 mL/min,不分流进样。升温程序:50 ℃保持5 min,以3 ℃/min升温至120 ℃并保持3 min,然后以4 ℃/min升温至180 ℃保持3 min,最后以5 ℃/min升温至250 ℃保持20 min。
质谱条件:电离方式为电子电离(electronic ionization,EI)源,质量扫描范围为40~580 amu,接口温度为250 ℃,离子源温度为320 ℃。
定性、定量方法:质谱数据借助美国国家标准与技术研究院(national institute of standards and technology,NIST)05数据库进行检索,选取匹配度>90%的组分,结合文献进行定性鉴定;采用面积归一法计算各组分相对含量。
1.3.8 数据分析
数据处理及图表绘制由WPS Office及Origin 8.5软件实施。
2 结果与分析
2.1 菌株分离与初步鉴定
采集发酵周期为28 d的发酵番茄及红辣椒,梯度稀释至10-5后涂布于MRS和MC琼脂培养基上,37 ℃培养48 h。经分离、纯化,最终从MRS培养基上分离得到番茄发酵相关菌株5株,分别编号为MRS FT1、MRS FT2、MRS FT3、MRS FT4、MRS FT5;红辣椒发酵相关菌株4株,分别编号为MRS FP1、MRS FP2、MRS FP3、MRS FP4。从MC培养基上分离得到番茄和辣椒发酵相关菌株共7株,分别编号为MC FT1、MC FT2、MC FT3、MC FT4,MC FP1、MC FP2、MC FP3。参考国立东等[21]乳酸菌初筛方法,对筛选菌株进行革兰氏染色,过氧化氢酶初筛,结果见表1。结果表明,筛选菌株均为革兰氏阳性菌,菌株MRS FT1、MRS FT3、MRS FT5、MRS FP2、MRS FP4、MC FT1呈现出乳杆菌属典型的短杆、链条式形态。由表1可知,菌株MRS FT1、MRS FT3、MRS FT5、MRS FP2、MRS FP4、MC FT1过氧化氢酶试验中不产生气泡表现为阴性。结合乳酸菌革兰氏染色阳性、接触酶阴性的理论基础[27],初步判断MRS FT1、MRS FT3、MRS FT5、MRS FP2、MRS FP4、MC FT1共6株菌为乳酸杆菌属(Lactobacillus)。
表1 番茄及辣椒酸汤分离菌株过氧化氢酶初筛结果
Table 1 Preliminary screening results of catalase of isolated strains from tomato and pepper sour soup
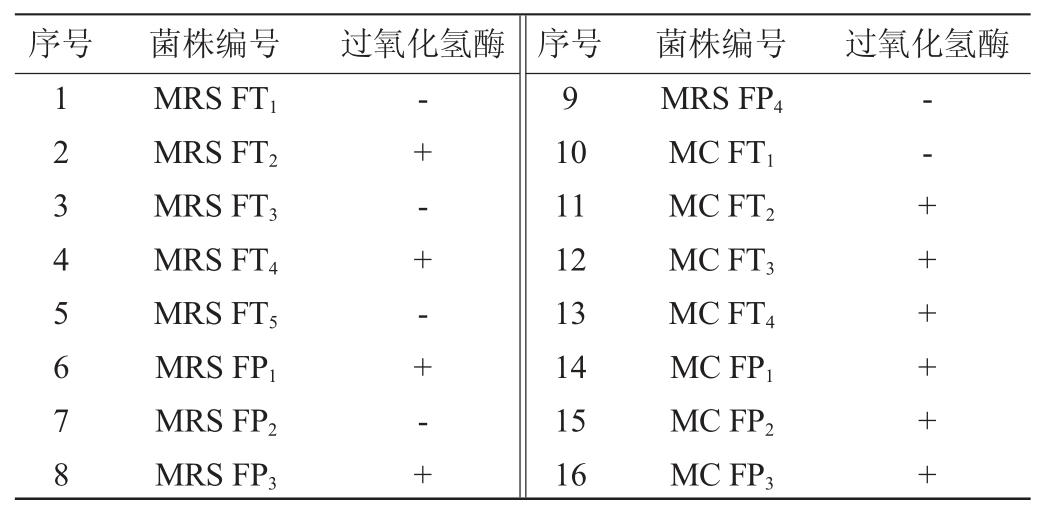
注:“-”表示结果为阴性,“+”表示结果为阳性。
2.2 16S rDNA基因序列对比分析
为进一步对初筛得到的乳酸菌进行分析和鉴定,将菌株MRS FP2、MRS FP4、MRS FT1、MRS FT3、MRS FT5、MC FT1的16S rDNA经PCR扩增、纯化后测序。经NCBI中基本局部比对搜索工具(basic local alignment search tool,BLAST)模块比对,借助MEGA5.0软件采用NJ法绘制筛选菌株系统发育树,结果见图1。由图1可知,菌株MRS FT1与Lactiplantibacillus plantarum LAB 01,菌株MRS FP2、MRS FT3与Lactobacillus plantarum MLG6-26,菌株MRS FT5、MC FT1与Lactiplantibacillus pentosus NR 029133.1,菌株MRSFP4与LactobacillusnamurensisLC483562.1的同源性最高,相似度均>99.80%。因此,菌株MRS FT5与MC FT1被鉴定为戊糖乳杆菌(Lactiplantibacillus pentosus),菌株MRS FP2、MRS FT3、MRS FT1被鉴定为植物乳杆菌(Lactiplantbacillus plantarum),菌株MRS FP4被鉴定为纳木雷氏乳杆菌(Lactobacillus na murensis)。该结果进一步验证了红酸汤发酵过程由乳酸杆菌主导的结论[12,28]。

图1 基于16S rDNA基因序列6株筛选菌株的系统发育树
Fig.1 Phylogenetic tree of 6 screened strains based on 16S rDNA gene sequence
2.3 60Co-γ吸收剂量对乳酸菌致死率及突变的影响
为了提高分离、纯化所得乳酸菌的产酸能力,基于筛选菌株鉴定结果,引入60Co-γ射线对MC FT1、MRS FT1、MRS FT3和MRS FP4进行辐照诱变(系统发育树亲缘关系最近的两株菌仅选择1株用于辐照试验)。60Co-γ射线辐照诱变乳酸菌致死曲线结果见图2。由图2可知,在100~800 Gy的吸收剂量范围内,除菌株MC FT1致死率呈马鞍型变化趋势外,其他菌株致死率均随着辐照吸收剂量的增加而增加,当吸收剂量>600 Gy之后,各参试菌株的致死率均>90%。另外,不同菌株对60Co-γ射线的耐受能力在不同吸收剂量条件下也呈现出不同的变化趋势。当辐照吸收剂量<300 Gy时,菌株MC FT1和MRS FT1辐照致死率显著高于菌株MRS FT3和MRS FP4,且各菌株都快速增大;当吸收剂量>400 Gy之后,参试菌株辐照致死率趋于平稳,菌株MRS FP4在整个辐照过程中都表现出较强的辐照抗性。
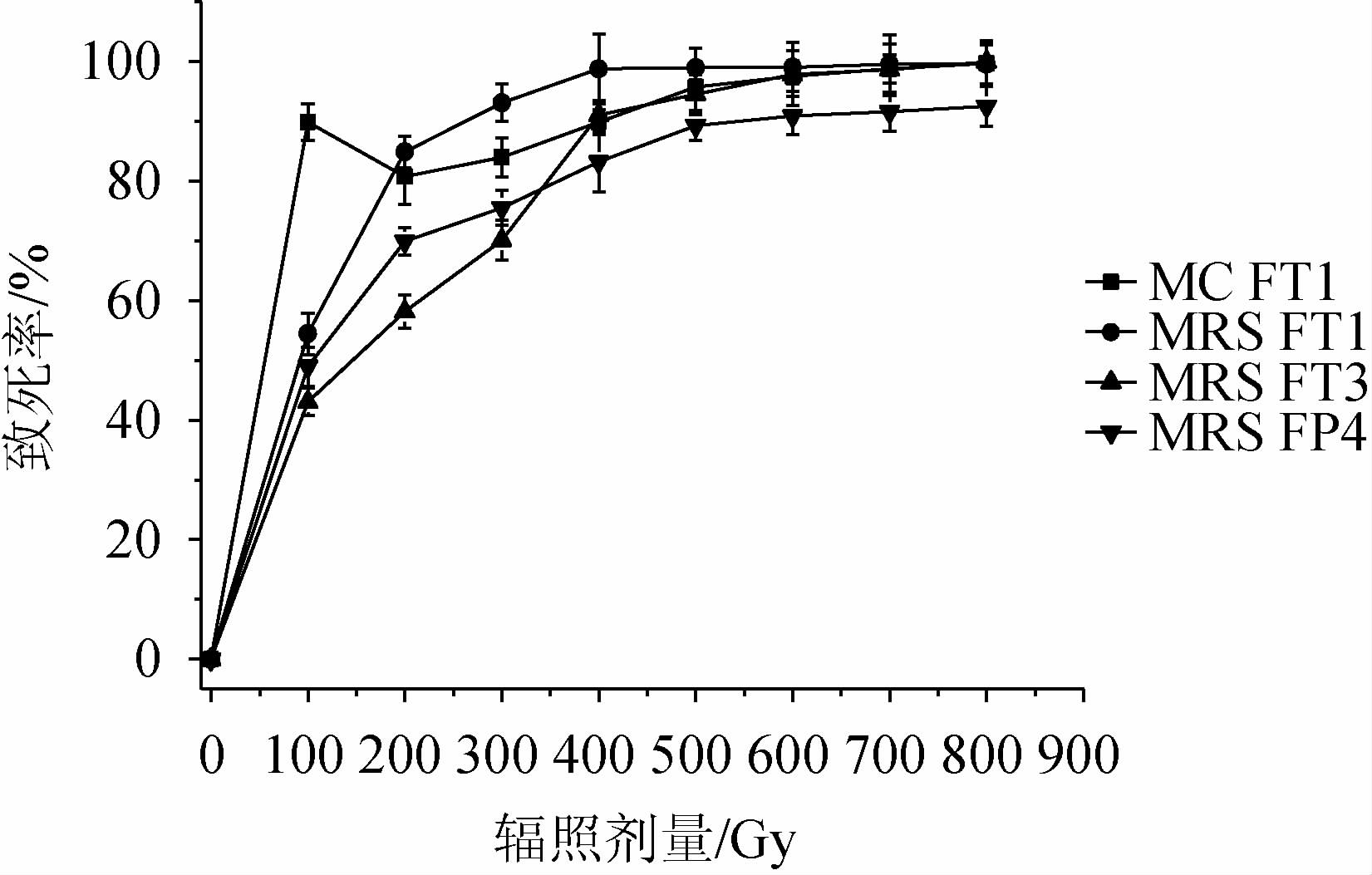
图2 60Co-γ射线辐照诱变乳酸菌致死曲线
Fig.2 Lethal curve of lactic acid bacteria mutated with 60Co-γ radiation
不同菌株辐照吸收剂量与HC值提升率结果见表2。由表2可知,不同菌株对辐照的耐受能力差异较大,以HC值提升率>20%作为正向突变指标,菌株MC FT1、MRS FT1、MRS FT3和MRS FP4在辐照吸收剂量为700 Gy、800 Gy、400Gy和300Gy时HC值提升率最大,分别为26.00%、21.00%、23.11%和46.46%,表明在上述剂量下可筛选出正向突变菌株。
表2 目标菌株辐照吸收剂量与HC值提升率
Table 2 Increase rate of irradiation absorption dose and HC value of target strains
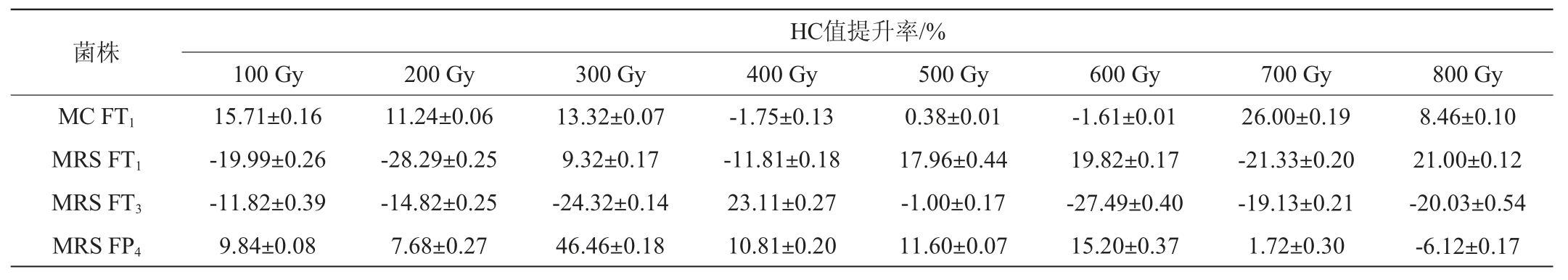
注:“-”表示负向突变。
通过DNA序列对比软件ApE 3.0.8比对辐照处理前后目标菌株的DNA序列,序列比对结果见图3。由图3可知,除MRS FT1外,其他菌株的DNA序列在辐照前后均发生了有效变化。菌株MCFT1辐照处理后在24和27号碱基上出现了突变,得到突变菌株MC FT1(700 Gy);菌株MRS FT3辐照处理后分别于32号和254号碱基上发生了变化,筛选到2株突变菌株(编号为MRS FT3(400 Gy-1)、MRS FT3(400 Gy-4));菌株MRS FP4序列发生了大量突变,得到突变菌株MRS FP4(300 Gy)。综合HC值和16S rDNA基因测序结果,最终筛选出突变菌株MC FT1(700 Gy)、MRS FT3(400 Gy-1)、MRS FT3(400 Gy-4)和MRS FP4(300 Gy)。

图3 辐照菌株与出发菌株的基因序列比对
Fig.3 Gene sequence comparison between irradiated strains and original strains
A、B、C、D分别代表MC FT1(700 Gy)、MRS FT3(400 Gy-1)、MRS FT3(400 Gy-4)和MRS FP4(300 Gy)与出发菌株的基因片段比对。
2.4 选育菌株产酸性能分析
由16S rDNA基因序列对比分析可知,菌株MC FT1和MRS FP4是分别从发酵番茄和红辣椒中分离、纯化得到的乳酸菌,而MRS FT3则在两种样品中均有分布。基于此,将菌株MC FT1、MRS FT3、MRS FP4的辐照选育菌株(MC FT1(700 Gy)、MRS FT3(400 Gy-1)、MRS FT3(400 Gy-4)和MRS FP4(300 Gy)按来源分别接种于番茄和红辣椒得到番茄酸汤和辣椒酸汤,以分析它们在实际生产中的产酸性能,结果分别见图4和图5。
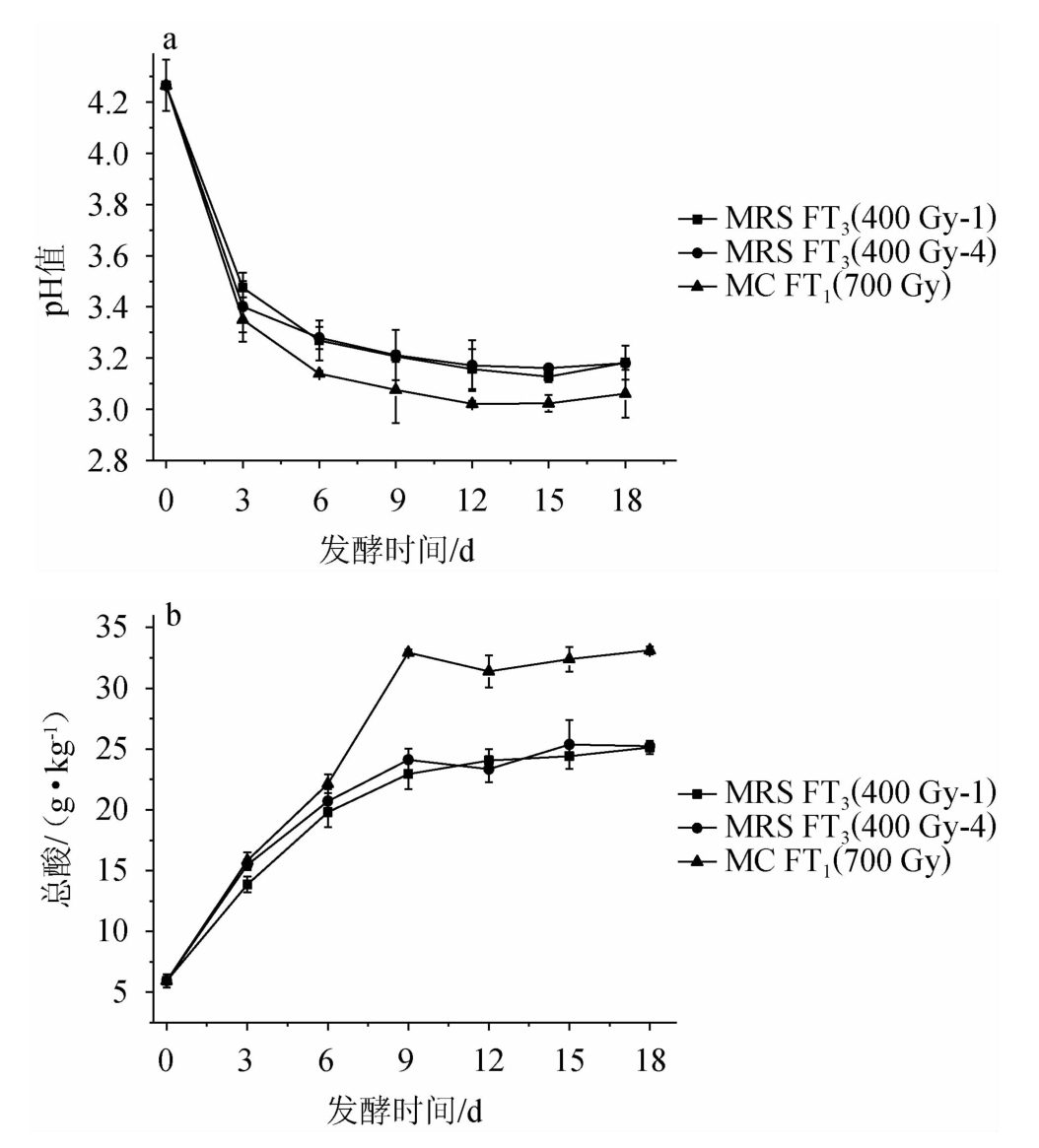
图4 选育菌株发酵番茄酸汤pH值(a)和总酸(b)变化趋势
Fig.4 Change trend of pH value (a) and total acid (b) of tomato sour soup fermented by breeding strain
由图4可知,番茄酸汤的pH值和总酸含量在发酵第12天时达到平稳状态,此时样品的pH值低于3.2,总酸含量>23.00 g/kg。MC FT1(700 Gy)是接种于番茄的三种菌株中产酸能力最强的菌株,其在番茄发酵第6天后表现出明显的领先优势,样品中的pH和总酸峰值时达到了3.021和32.94 g/kg,远高于MRS FT3诱变菌株的产酸能力。
由图5可知,辣椒酸汤的pH值和总酸含量的变化趋势较番茄酸汤缓慢,发酵第15天时才检测到峰值出现,且MRS FT3(400 Gy-1)和MRS FT3(400 Gy-4)的产酸性能在前15 d内高于MRS FP4(300 Gy),可能是因为番茄破碎后水分含量更高、加工颗粒更小以至于菌株繁殖速率更快、原料利用更充分。另外,相较于其他研究报道[30-32],本实验中番茄和辣椒酸汤pH和总酸达到极值的时间略迟缓,可能与采用单菌株发酵有关,具体原因还需进一步探究。
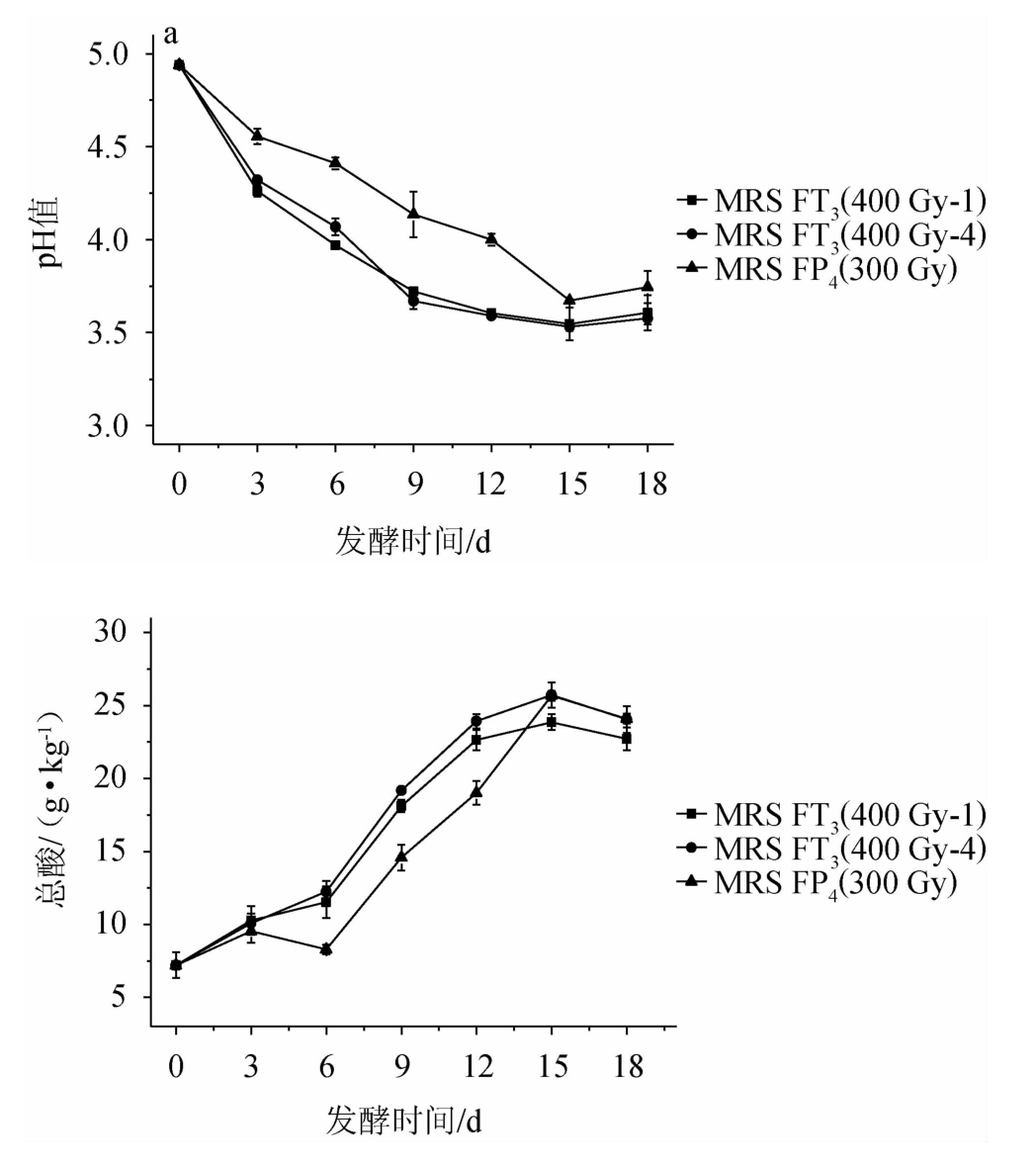
图5 选育菌株发酵辣椒酸汤pH值(a)和总酸(b)变化趋势
Fig.5 Change trend of pH value (a) and total acid (b) of pepper sour soup fermented by breeding strain
2.5 选育菌株发酵产品挥发性组分差异分析
采用气相色谱质谱联用技术,对自然发酵及不同菌株发酵制备的番茄酸汤和辣椒酸汤的产品挥发性组分进行分析,结果分别见表3和表4。
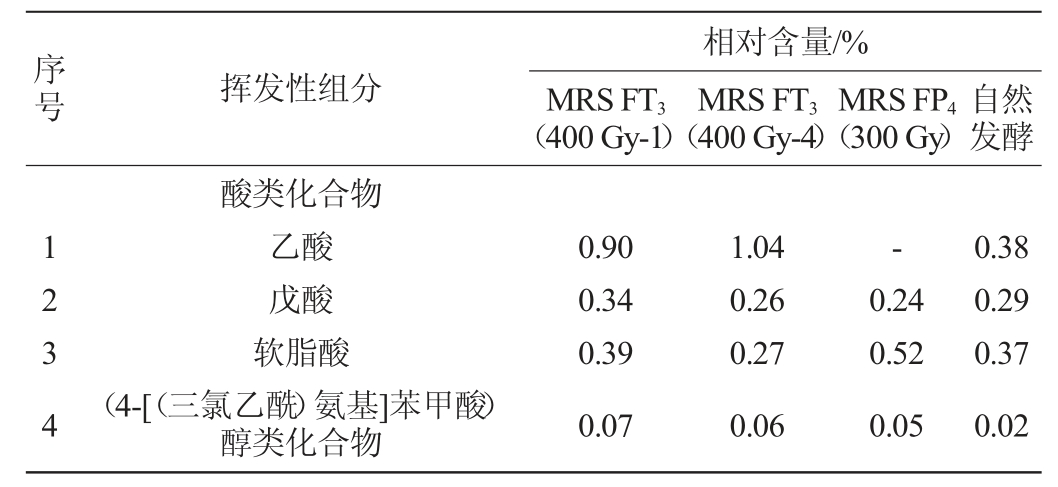
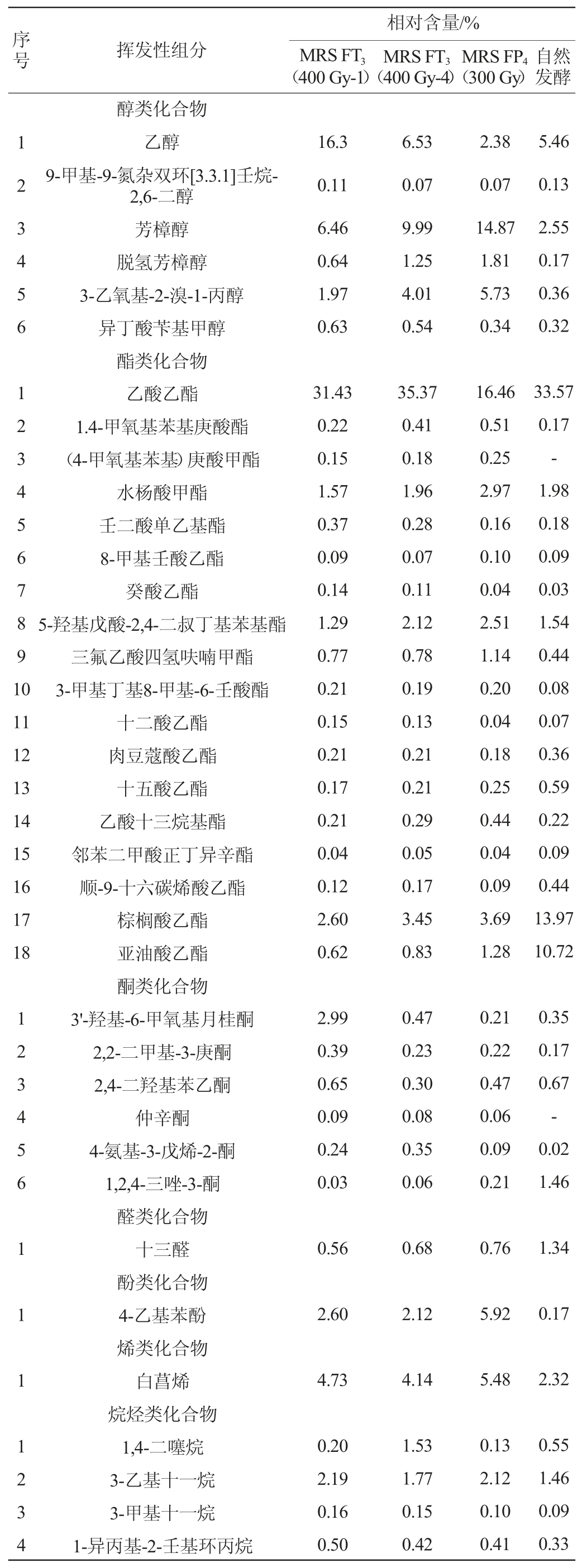
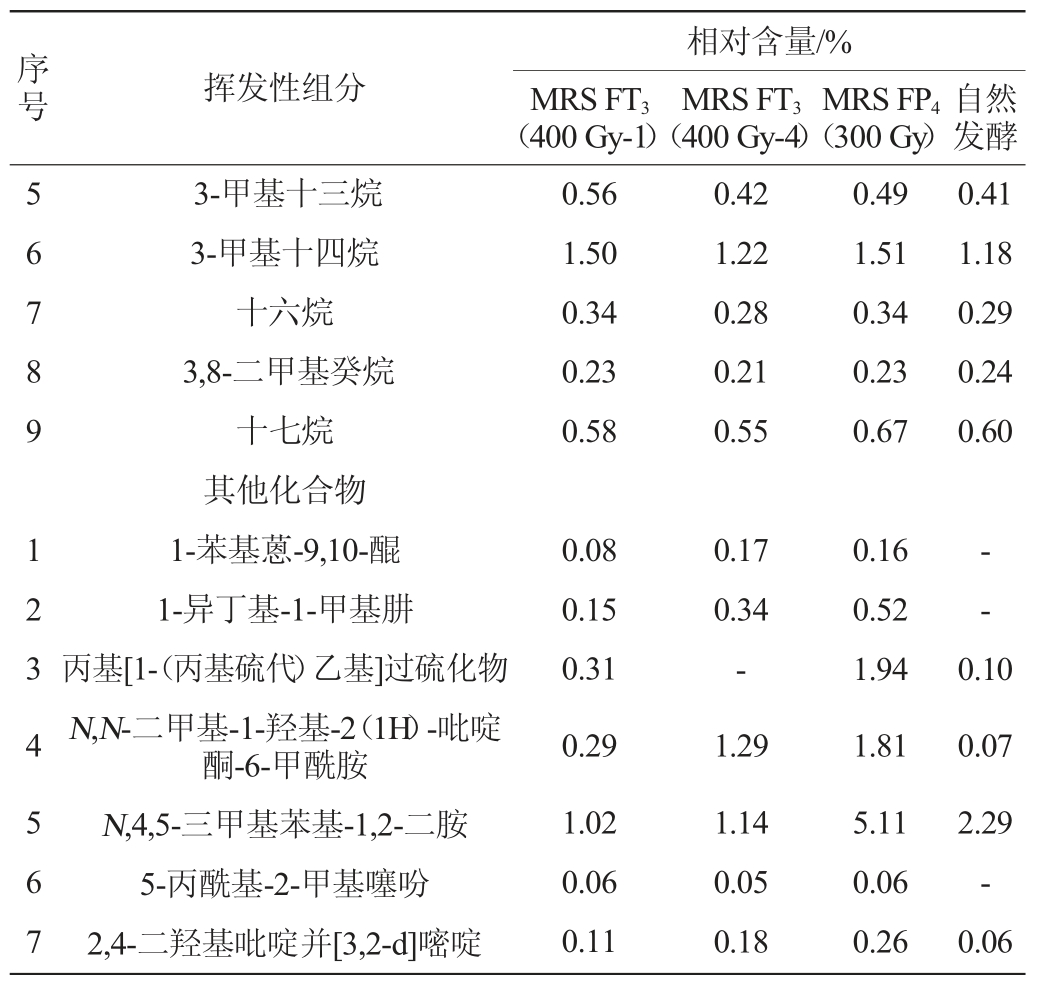
表4 不同乳酸菌发酵红辣椒酸汤的挥发性化合物种类及相对含量
Table 4 Types and relative contents of volatile flavor compounds in red pepper sour soup fermented by different lactic acid bacteria
续表
续表
由表3可知,自然发酵及菌株发酵的番茄酸汤中共检测到酸、醇、酯、酮、醛、烯、酚、烷烃及其他成分共计64种,其中相对含量>1%的化合物在4种番茄酸汤中共有16种。醇类和酯类化合物是含量较高的两类化合物且以乙醇及乙酸乙酯为代表,其中乙醇在4种菌株发酵的番茄酸汤中的相对含量分别为10.51%(MC FT1(700 Gy))、11.95%(MRS FT3(400 Gy-1))、8.92%(MRS FT3(400 Gy-4))和6.14%(自然发酵),乙酸乙酯则分别为56.87%、50.94%、49.50%和49.10%。在MC FT1(700 Gy)菌株发酵的番茄酸汤中,酸类化合物中的乙酸(1.16%)、L-乳酸(1.29%)和软脂酸(1.22%),酯类化合物中的棕榈酸乙酯(1.20%),酚类化合物中的2-甲氧基苯酚(1.07%)、丁香酚(1.34%)相对含量显著高于其他3种番茄酸汤;但酯类化合物中的2-苯基乙酸乙酯、酚类化合物中的4-乙基苯酚、2-甲氧基-4-乙烯基苯酚则在以MRS FT3(400 Gy-1)、MRS FT3(400 Gy-4)及自然发酵的番茄酸汤中含量更高。相较于菌株发酵,自然发酵番茄酸汤中2-苯乙醇、4-乙基愈创木酚和2,3-二氢苯并呋喃则具有更高相对含量,分别为5.30%、5.34%和3.32%。
表3 不同乳酸菌发酵番茄酸汤的挥发性风味化合物种类及相对含量
Table 3 Types and relative contents of volatile flavor compounds in tomato sour soup fermented by different lactic acid bacteria
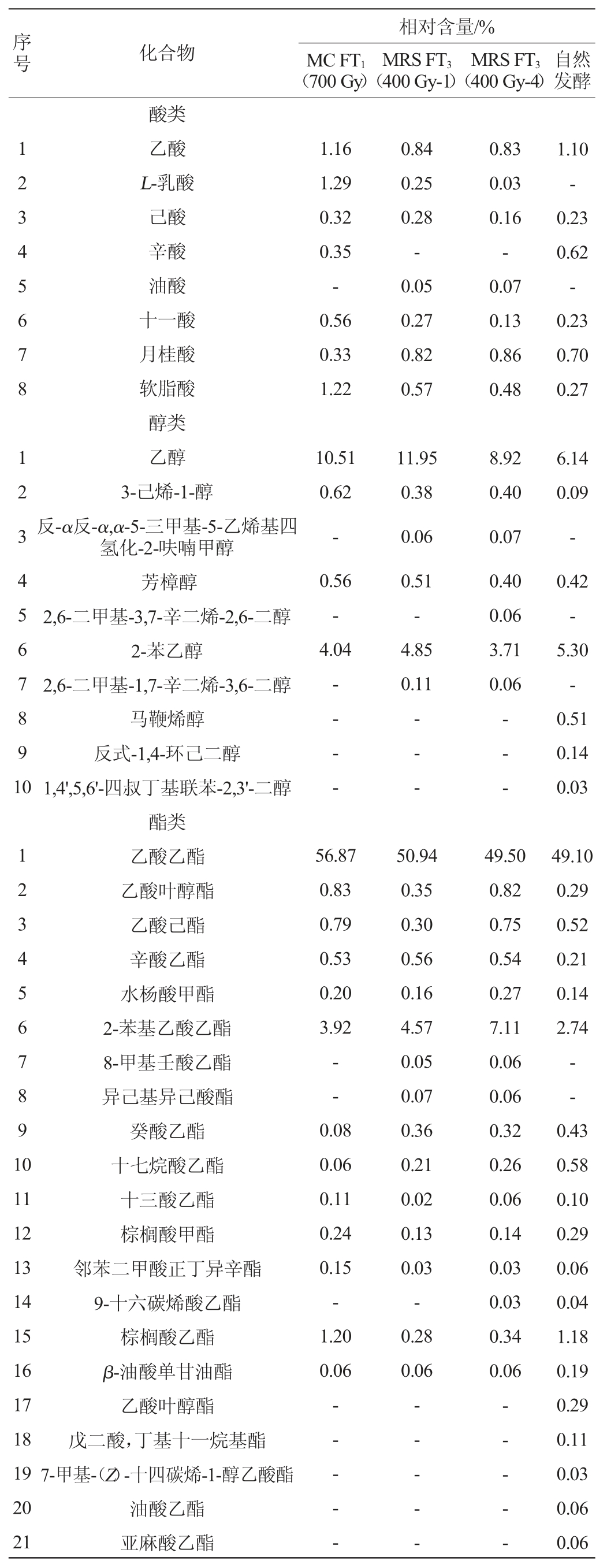
续表
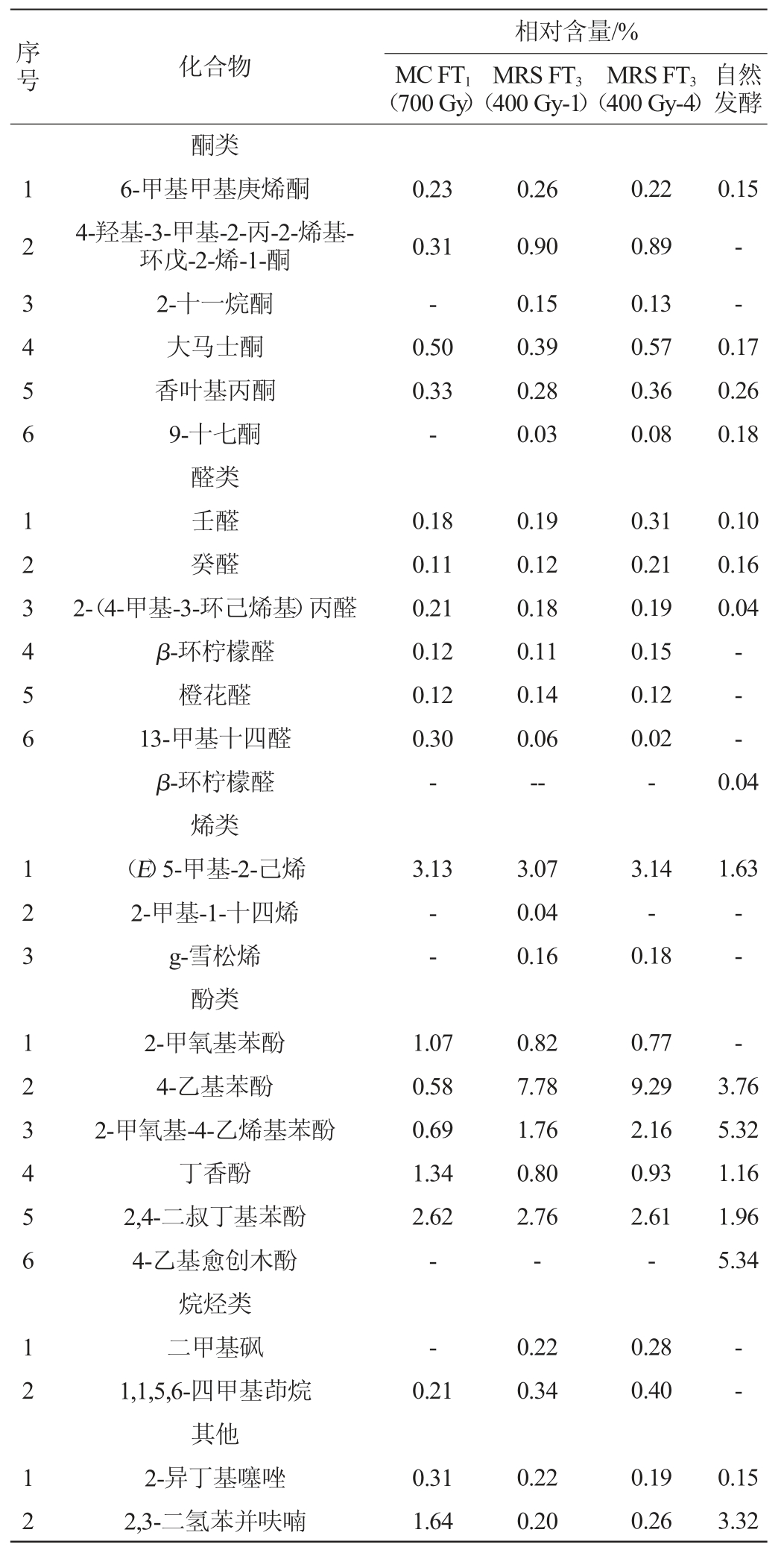
注:“-”表示未检出。下同。
由表4可知,在以MRSFT3(400Gy-1)、MRSFT3(400Gy-4)、MRS FP4(300 Gy)为发酵菌株制备的辣椒酸汤和自然发酵而得的辣椒酸汤中,共检测到酸、醇、酯等各类化合物53种,相对含量>1%的化合物有20种。与番茄酸汤类似,4种辣椒酸汤的挥发性组分相对含量较高的也是醇类和酯类化合物,分别达到了26.11%、22.39%、25.20%、8.99%和40.36%、46.81%、30.35%、64.64%。这与郑莎莎等[31-34]报道的番茄及辣椒发酵制品的风味物质组成不同,差异原因可能与乳酸菌种类和采样阶段有关。同时,与番茄酸汤不同,辣椒酸汤中的酸类(4种)、醛类(1种)、酚类(1种)、烯类(1种)化合物种类和含量更少,但烷烃类(9种)及其他类(7种)化合物种类更加丰富。含量>1%的化合物中,MRS FP4(300 Gy)发酵的辣椒酸汤中乙酸(未检出)、乙醇(2.38%)、乙酸乙酯(16.46%)及3-羟基-6-甲氧基月桂酮的相对含量较MRS FT3(400 Gy-1)、MRS FT3(400 Gy-4)菌株发酵的酸汤低,但芳樟醇、脱氢芳樟醇、水杨酸甲酯、4-乙基苯酚、白菖烯及N,4,5-三甲基苯基-1,2-二胺等组分则在MRS FP4(300 Gy)菌株发酵的酸汤中含量更高,分别达到了14.87%、1.81%、2.97%、5.92%、5.48%和5.11%。在自然发酵辣椒酸汤中,棕榈酸乙酯、亚油酸乙酯、1,2,4-三唑-3-酮及十三醛相对含量远高于菌株发酵的3种辣椒酸汤,但芳樟醇、4-乙基苯酚、白菖烯和3-乙基十一烷则以菌株发酵组为优势。
3 结论
本研究从番茄和辣椒酸汤中筛选出6株乳酸菌,其中菌株MRS FT5与MC FT1被鉴定为戊糖乳杆菌(Lactiplantbacillus pentosus),菌株MRS FP2、MRS FT3、MRS FT1被鉴定为植物乳杆菌(Lactiplantbacillus plantarum),菌株MRS FP4被鉴定为纳木雷氏乳杆菌(Lactobacillus namurensis)。经60CO-γ射线辐照分别于300 Gy、400 Gy和700 Gy获得HC值提升率>20%的突变菌株MC FT1(700 Gy)、MRS FT3(400 Gy-1)、MRS FT3(400 Gy-4)和MRS FP4(300 Gy)。选育菌株发酵的番茄和辣椒酸汤中分别共检出挥发性物质64种和53种,均以酯、醇类物质为主,表明选育菌株制备酸汤产品醇香和花香明显,与商业购买菌株发酵酸汤存在显著区别,可为酸汤工业化发展提供技术支持。
[1]中国食品工业协会.T/CNFIA 117—2020 酸汤调味料[S].北京:中国标准出版社,2020.
[2]曾荣妹,韩琳,黄平.贵州红酸汤火锅调料的研究进展及工业化进程[J].食品与发酵科技,2014,50(5):72-75.
[3]舒亚非,廖伟先,杨丽娟,等.贵州11种酸汤品质特性分析[J].中国酿造,2021,40(10):129-133.
[4]曲子晗,王楠兰,杨红梅,等.凯里红酸汤对大鼠肠道脂肪酸吸收和紧密连接蛋白的调控[J].中国酿造,2021,40(5):129-133.
[5]AZAM M,MOHSIN M,IJAZ H,et al.Lactic acid bacteria in traditional fermented Asian foods[J].Pak J Pharm Sci,2017,30(5):1803-1814.
[6]国立东,张文文,刘艳,等.传统发酵东北酸菜中植物乳杆菌HUCM115的分离及益生特性[J].食品科学,2020,41(18):140-145.
[7]TOURET T,OLIVEIRA M,SEMEDO-LEMSADDEK T.Putative probiotic lactic acid bacteria isolated from sauerkraut fermentations[J].PLoS One,2018,13(9):e0203501.
[8]PARK E J,CHUN J,CHA C J,et al.Bacterial community analysis during fermentation of ten representative kinds of kimchi with barcoded pyrosequencing[J].Food Microbiol,2012,30(1):197-204.
[9]周倩倩,袁钦,王楠兰,等.贵州苗族红酸汤对单纯性肥胖大鼠血清及肠道炎性的影响[J].中国酿造,2022,41(7):101-105.
[10]张璇.贵州“红酸汤”半成品中微生物区系的研究[D].重庆:西南大学,2011.
[11]王琪琪,田界先,潘宗东,等.基于Illumina MiSeq分析贵州凯里酸汤独特风味的优势菌群[J].食品与发酵工业,2020,46(14):40-47.
[12]何扬波,李国林,李咏富,等.红酸汤发酵过程中微生物区系及挥发性物质组成变化分析[J].食品工业科技,2022,43(19):171-184.
[13]李文涛,苏肖晶,陈萍.紫外线与亚硝基胍复合诱变选育高效降解亚硝酸盐乳酸菌[J].食品安全质量检测学报,2013,4(6):1721-1724.
[14]张兰威.乳酸菌优良菌株的选育及直投式酸奶发酵剂的研制[D].哈尔滨:东北农业大学,2002.
[15]崔国艳,陈五岭,周美红.激光诱变选育耐高温耐酸乳酸菌[J].中国酿造,2012,31(10):153-156.
[16]林杨,布丽根·加冷别克,孙建,等.乳酸菌的筛选及高产酸菌株的常压室温等离子体诱变选育[J].食品与发酵工业,2021,47(12):176-181.
[17]SUN N,LEE S,SONG K B.Characterization of a carotenoid-hyperproducing yeast mutant isolated by low-dose gamma irradiation[J].Int J Food Microbiol,2004,94(3):263-267.
[18]杨艳艳,刘晓艳,林剑.60Co-γ辐照对琥珀酸产生菌原生质体的诱变选育[J].中国酿造,2009,28(6):25-27.
[19]周德庆,徐德强.微生物学实验教程(第3版)[M].北京:高等教育出版社,2015:26-31.
[20]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB4789.35—2016 食品微生物学检验乳酸菌检验[S].北京:中国标准出版社,2016.
[21]国立东,张文文,刘艳,等.传统发酵东北酸菜中植物乳杆菌HUCM115的分离及益生特性[J].食品科学,2020,41(18):140-145.
[22]薛庆中.DNA和蛋白质序列数据分析工具(第3版)[M].北京:科学出版社,2012:18-25.
[23]王雨辰,王曙阳,董妙音,等.重离子束辐照选育高产植物乳酸菌[J].辐射研究与辐射工艺学报,2017,35(1):52-58.
[24]PERDANA J,FOX M B,CHEN S W,et al.Interactions between formulation and spray drying conditions related to survival of Lactobacillus plantarum WCFS1[J].Food Res Int,2014,56:9-17.
[25]国家卫生健康委员会,国家市场监督管理总局.GB 12456—2021 食品安全国家标准食品中总酸的测定[S].北京:中国标准出版社,2021.
[26]XIE C Z,ZENG H Y,WANG C X,et al.Volatile flavor components,microbiota and their correlations in different sufu,a Chinese fermented soybean food[J].J Appl Microbiol,2018,125(6):1761-1773.
[27]马莉,刘慧燕,方海田,等.产γ-氨基丁酸乳酸菌的分离鉴定及其发酵条件优化[J].中国酿造,2022,41(7):94-100.
[28]王婵.凯里红酸汤菌群、风味分析及其品质提升和应用研究[D].贵阳:贵州大学,2021.
[29]黄桂丹.60Co-射线辐射育种研究进展[J].林业与环境科学,2016,32(2):107-111.
[30]吴姝,李金玲,龙丽丽,等.自然与乳酸菌强化发酵过程中红酸汤品质变化[J].中国酿造,2020,39(10):75-78.
[31]郑莎莎.干酪乳杆菌H1发酵红酸汤的品质影响及特征代谢物研究[D].贵阳:贵州大学,2020.
[32]宋煜婷,王晓芸,丁筑红,等.外源菌种和辅助碳源发酵糟辣椒条件优化与品质分析评价[J].食品与发酵工业,2020,46(3):131-137.
[33]XU X X,WU B B,ZHAO W T,et al.Correlation between autochthonous microbial communities and key odorants during the fermentation of red pepper(Capsicum annuum L.)[J].Food Microbiol,2020,91:103510.
[34]欧阳晶,苏悟,陶湘林,等.辣椒发酵过程中挥发性成分变化研究[J].食品与机械,2012,28(6):55-58.