高级醇,又称为杂醇油,是指含有3个或者3个以上碳原子的一价醇类总称[1-2]。作为中国传统白酒的重要风味组分之一,高级醇含量对白酒的风味、口感和饮用舒适度有着极其重要影响。适量浓度的高级醇能够提升酒体风味口感,但含量过高又会使得酒体口感辛辣、难入喉,导致饮后舒适感较差[3-4]。因此,高级醇含量已经成为评判白酒品质的重要指标之一[5-6]。
白酒生产中常见的高级醇主要为异丁醇、异戊醇、正丙醇和正丁醇等[4,7]。正丙醇作为白酒中高级醇的组成成分之一,呈花香、青草香,味苦,当含量过高时会导致酒体辛辣苦涩,影响饮用体验[8]。小鼠毒理研究结果显示,实验酒样中正丙醇含量越高,实验组小鼠行为越是异常呆滞,可见正丙醇是引起白酒饮后不适的关键高级醇之一,浓度较高时会引起酒后易醉现象[9]。白酒固态发酵过程中微生物组成和变化对于白酒中风味组成有着极其重要的影响。有研究表明,酿酒酵母(Saccharomyces cerevisiae)、乳酸杆菌(Lactobacillus)、芽孢杆菌(Bacillus)是中国白酒发酵过程中产正丙醇的主要菌种,能够通过2-甲基苹果酸代谢、苏氨酸代谢和丙酸代谢途径产生正丙醇[10-12]。
筛选性状优良的功能微生物用于白酒发酵一直以来是白酒技术研发领域的重要方向之一[13-15]。目前,对于中国白酒低产杂醇油菌株的筛选应用大多主要集中于异丁醇和异戊醇方面,但对于正丙醇的相关研究却很少。在清香型白酒中,正丙醇含量仅次于异戊醇[8],因此筛选低产正丙醇的功能微生物,对清香型白酒品质提升具有重要意义。该研究以劲牌有限公司酒曲为材料进行低产正丙醇酵母菌株的筛选,通过高粱汁培养基复筛获得性状优良菌株,并进一步利用清香型白酒酿造工艺探究菌株的应用前景,以期降低清香型白酒生产中正丙醇含量,提升酒体风味口感。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
酒曲:取自劲牌有限公司制曲车间。麸皮:河南飞天农业开发股份有限公司;粳高粱:内蒙古赤峰;酿酒酵母(Saccharomyces cerevisiae)N1、N2和N3:劲牌有限公司;酒糟:劲牌有限公司酿造车间。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基[16]:酵母膏10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,
121 ℃灭菌30 min,备用。YPD固体培养基加琼脂20 g。
高粱汁发酵培养基[17]:取1 kg高粱破碎成粉末状,加入5L蒸馏水充分混匀,并加入5g淀粉酶于60℃水解淀粉1 h,然后放入高压灭菌锅中105 ℃处理30 min,冷却后加入5 g糖化酶和5 g淀粉酶于60 ℃水解24 h。离心获取上清液,将其糖度调节到8°Bx,装瓶,于121 ℃灭菌30 min,备用。
1.1.3 试剂
葡萄糖(分析纯)、蛋白胨、琼脂粉(均为生化试剂):国药集团化学试剂有限公司;酵母浸粉(生化试剂):北京奥博星生物技术有限公司;青霉素G钠(1 650 U/mg):上海阿拉丁生化科技股份有限公司;淀粉酶(5×104 U/g)、糖化酶(5×105 U/g):无锡雪梅酶制剂科技有限公司;TIANGEN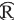 土壤基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技有限公司;Premix TaqTM预混酶液:日本TaKaRa公司;乙酸乙酯、正丙醇、异丁醇、异戊醇(均为色谱纯):美国SAFC Biosciences公司。
土壤基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技有限公司;Premix TaqTM预混酶液:日本TaKaRa公司;乙酸乙酯、正丙醇、异丁醇、异戊醇(均为色谱纯):美国SAFC Biosciences公司。
1.2 仪器与设备
AL204电子分析天平:梅特勒-托利多仪器(上海)有限公司;SPX-100B-Z生化培养箱:上海博讯实业有限公司;Nikon Eclipse E200显微镜:日本Nikon公司;BCM-1600A洁净工作台:苏州安泰空气技术有限公司;WFJ2000型可见分光光度计:尤尼柯仪器有限公司;Centrifuge 5424R高速台式冷冻离心机:德国艾本德(中国)有限公司;ABI 2720聚合酶链式反应(polymerase chain reaction,PCR)热循环仪:美国ABI公司;7890B气相色谱(gas chromatography,GC)仪、DB-FFAP毛细管色谱柱(60 m×0.25 mm,0.25 μm):美国安捷伦科技(中国)有限公司。
1.3 方法
1.3.1 酵母菌的分离纯化
取10 g酒曲加入90 mL无菌水中,置于30 ℃、160 r/min条件下振荡20 min,之后梯度稀释至10-4,分别吸取稀释度为10-3和10-4的菌悬液200 μL涂布于含有0.05 mg/mL青霉素G钠的YPD固体培养基平板上,置于30 ℃培养箱倒置培养,观察菌株生长情况。根据菌株的菌落形态、大小、颜色等特征,挑取不同酵母菌株于YPD固体培养基平板上划线纯化,30 ℃培养48 h获得纯化菌株,保藏备用。
1.3.2 低产正丙醇酵母菌菌株的筛选
(1)低产正丙醇酵母菌菌株的初筛
从平板上挑取单菌落接种到10 mL YPD液体培养基中,30 ℃、160 r/min条件下培养48 h后获得酵母种子液。按照2%(V/V)的接种量将种子液接种于50 mL YPD液体培养基中,30 ℃继续培养72 h,8 000 r/min离心5 min,获取上清液,采用GG法检测发酵上清液中的正丙醇含量。
(2)低产正丙醇酵母菌菌株的复筛
以生产所用的酿酒酵母N1、N2以及N3为对照菌株,将待检的酵母菌种子液按2%(V/V)的接种量接种于50 mL高粱汁发酵培养基中,瓶口用发酵栓密封,于30 ℃条件下静置培养7 d,8 000 r/min离心5 min,获取上清液,采用GC法测定发酵上清液中正丙醇等风味成分的含量。
1.3.3 风味物质的检测
样品前处理:取1 mL待测样品于2 mL进样瓶中,加入10 μL内标(2-乙基己醇:16 205.6 mg/L;2-甲基-2-丁醇:16 079.2 mg/L;乙酸正戊酯:16 484.0 mg/L)溶液,混合均匀后进行GC分析。
气相色谱条件[18]:检测器为氢火焰离子化检测器(flame ionization detector,FID),载气为高纯氮气(N2)(纯度为99.999%)。进样口温度为250 ℃,进样量为1 μL;分流比为20∶1;载气流速为1.0 mL/min;检测器温度为260 ℃。升温程序为初始温度35 ℃,保持1 min,以3.5 ℃/min升温至190 ℃,保持15min;尾吹气流速为25mL/min,氢气流速为30mL/min,空气流速为350 mL/min。
定性、定量方法:采用保留时间定性,内标法定量。
1.3.4 菌株的鉴定
(1)形态观察
将筛选酵母菌株划线接种于YPD固体培养基,30 ℃培养48 h,观察筛选酵母菌株的菌落形态;用灭菌牙签挑取适量菌体放于载玻片中,于显微镜(10×100)下观察菌体细胞形态。
(2)分子生物学鉴定
基因组DNA提取:收集菌体,采用TIANGEN 土壤基因组DNA提取试剂盒提取基因组DNA,具体方法参照试剂盒说明书。
土壤基因组DNA提取试剂盒提取基因组DNA,具体方法参照试剂盒说明书。
PCR扩增:以提取的基因组DNA为模板,利用真菌ITS区域通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')PCR扩增ITS基因片段[19]。PCR扩增体系:Premix TaqTM 15 μL,引物ITS1和ITS4各0.5μL,菌株DNA模板1μL和双蒸水(ddH2O)13μL。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,52 ℃退火50 s,72 ℃延伸30 s,共32个循环;72 ℃再延伸10 min,4 ℃保存。
ITS序列分析和系统发育树的构建:将PCR扩增成功的ITS区域基因片段送往武汉华大基因生物医学工程有限公司进行测序。将测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对,获取其同源性序列。基于同源性序列,利用MEGA-X软件采用邻接法(neighbor-joining,NJ)构建系统发育树,确定菌株的分类学地位。
1.3.5 耐受性分析[20]
温度耐受性:将筛选酵母菌的种子液按2%(V/V)的接种量接种于YPD液体培养基中,分别置于不同温度条件下(20 ℃、25 ℃、30 ℃、35 ℃、40 ℃、50 ℃)恒温静置培养48 h后,取酵母培养液于波长600 nm处测定吸光度值。
酸耐受性:将筛选酵母菌的种子液按2%(V/V)的接种量分别接种于pH为2、3、4、5、6、7、8的YPD液体培养基中,30 ℃恒温静置培养48 h后,取酵母培养液于波长600 nm处测定吸光度值。
糖耐受性:将筛选酵母菌的种子液按2%(V/V)的接种量分别接种于葡萄糖含量为0、2%、5%、10%、15%、20%、25%)的YPD液体培养基中,30 ℃恒温静置培养48 h后,取酵母培养液于波长600 nm处测定吸光度值。
乙醇耐受性:将筛选酵母菌的种子液按2%(V/V)的接种量分别接种于含乙醇体积分数为0、3%、6%、9%、12%、15%、18%的YPD液体培养基中,30 ℃恒温静置培养48 h后,取酵母培养液于波长600 nm处测定吸光度值。
1.3.6 低产正丙醇菌株在清香型白酒酿造中的应用
(1)实验用曲制备[21]
以5%(mL∶g)的比例将低产正丙醇酵母菌株的种子液接种到灭菌麸皮中,30 ℃培养3 d后烘干备用。实验组添加的是含有10%的低产正丙醇菌株Y19麸曲的生产土曲,而对照组使用的是含有10%酿酒酵母N1、N2和N3混合麸曲的生产土曲。
(2)高粱发酵试验
将所配制的实验曲5.25 g与蒸煮两次的粳高粱1.05 kg混合均匀,30 ℃条件下糖化24 h后,与1 kg酒糟混合拌匀放入发酵容器中,30 ℃恒温发酵7 d。待发酵完毕,将酒醅装入酒甑进行蒸汽馏酒,取200 mL酒样,测定出酒率[16]。并采用GC法对其中关键风味物质(乙酸乙酯、正丙醇、异丁醇、异戊醇)进行定量检测[16,22]。
1.3.7 数据处理
采用安捷伦MSD ChemStation软件处理气相色谱数据;菌株发酵和原酒风味色谱数据经IBM SPSS 19统计分析软件进行整理统计,由Origin 2018作图。
2 结果与分析
2.1 低产正丙醇酵母菌株的分离及初筛
从劲牌有限公司酒曲中共分离纯化获得45株酵母菌株,编号为Y1~Y45,其正丙醇产量见表1。
表1 45株酵母菌菌株的正丙醇产量
Table 1 Yield of propanol produced by 45 yeast strains
注:不同小写字母表示差异显著(P<0.05)。
由表1可知,45株酵母菌株在YPD培养基中均能代谢产正丙醇,正丙醇产量在1.47~19.81 mg/L之间。依据其正丙醇产量,酵母菌株大致分成三组:第一组包含3株酵母菌(Y1、Y4和Y7),其产正丙醇能力较强,正丙醇产量达到13.0~19.8 mg/L,是其余菌株产正丙醇量的2~10倍;第二组包含26株酵母菌(Y2、Y3、Y6、Y9、Y10、Y11、Y13、Y15、Y16、Y17、Y18、Y21、Y22、Y27、Y28、Y29、Y32、Y33、Y34、Y36、Y37、Y40、Y41、Y42、Y43和Y44),其产正丙醇能力相近,正丙醇产量为6.67~9.54 mg/L。第三组包含16株酵母菌(Y5、Y8、Y12、Y14、Y19、Y20、Y23、Y24、Y25、Y26、Y30、Y31、Y35、Y38、Y39和Y45),其正丙醇产量为1.47~5.99mg/L,其中菌株Y14和Y19的正丙醇产量较低,分别为3.16和1.47 mg/L,具有低产正丙醇发酵活性。因此,进一步对这两株酵母产正丙醇水平进行研究。
2.2 低产正丙醇酵母菌株的复筛
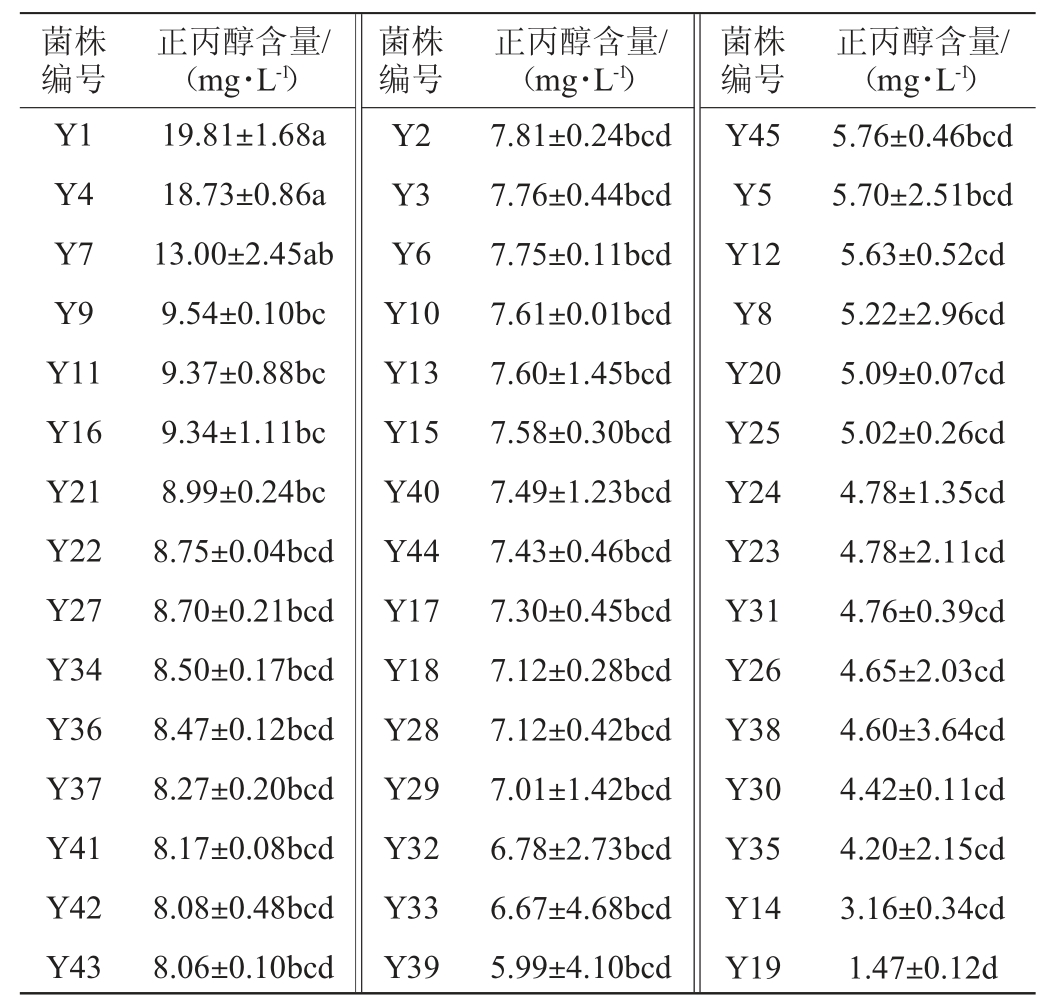
为进一步验证所筛选的菌株Y14和Y19低产正丙醇性能以及其在清香型白酒酿造过程中的发酵潜力,利用高粱汁发酵培养基模拟清香型白酒发酵环境,对这两株菌进行液体发酵试验,并以生产所用的N1、N2以及N3菌株作为对照,检测发酵液中正丙醇和其他主要风味物质代谢情况,结果见图1,其中乙酸乙酯、异丁醇和异戊醇为表征清香型白酒品质的重要风味物质[23-24]。
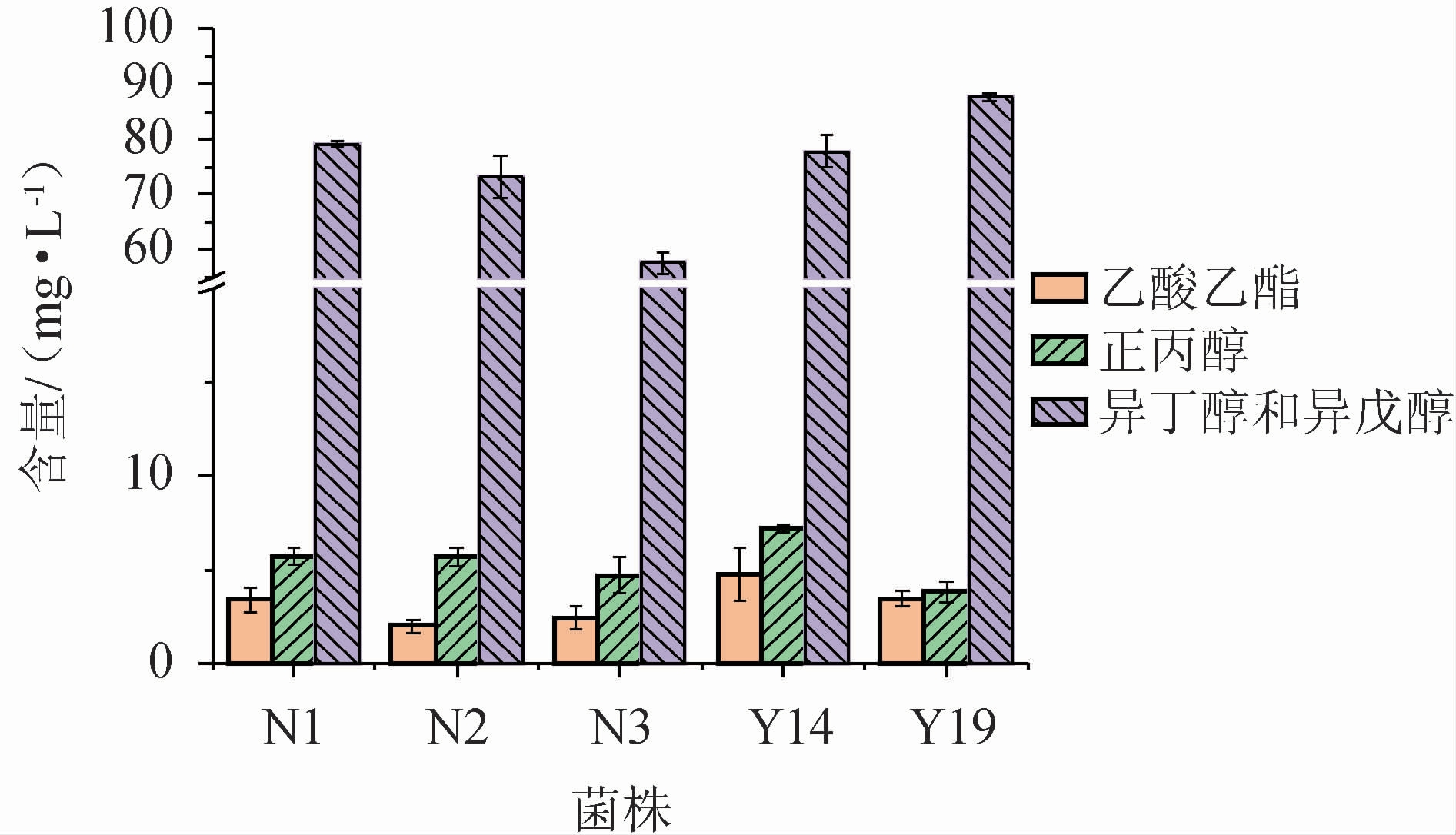
图1 筛选菌株Y14、Y19和生产用菌N1、N2和N3在高粱汁发酵培养基中代谢主要风味成分分析结果
Fig.1 Analysis results of the main flavor components of screened strains Y14,Y19 and production strains N1,N2 and N3 in sorghum juice fermentation medium
由图1可知,菌株Y14发酵液中正丙醇含量比对照组升高25.5%~51.0%,而菌株Y19与对照组相比降低18.8%~32.8%,效果较好。在乙酸乙酯方面,菌株Y14比对照组升高39.1%~140.9%,而菌株Y19提升了2.9%~73.7%;在异丁醇和异戊醇方面,菌株Y14比对照菌株N2和N3升高6.2%~34.9%,菌株Y19比对照菌株N1、N2、N3升高10.9%~52.2%。对比分析可以发现,菌株Y14在高粱汁发酵液中具有较好的提升酯类的效果,但与此同时也会引起发酵液中正丙醇和其他杂醇油的显著提升,这有可能是由于高粱汁发酵体系与YPD液体在营养组成上存在差异[25]。而菌株Y19在高粱汁发酵液中正丙醇含量仍较低,可见菌株Y19具有较好的低产正丙醇潜力,且相比生产用菌,在提高酯类方面也具有较大优势。因此,进一步探究菌株Y19在清香型白酒中应用潜力。
2.3 酵母菌Y19的鉴定
2.3.1 形态特征观察
为确定酵母菌Y19的种属关系及其分类学地位,对其菌落形态和显微形态进行观察,结果见图2。
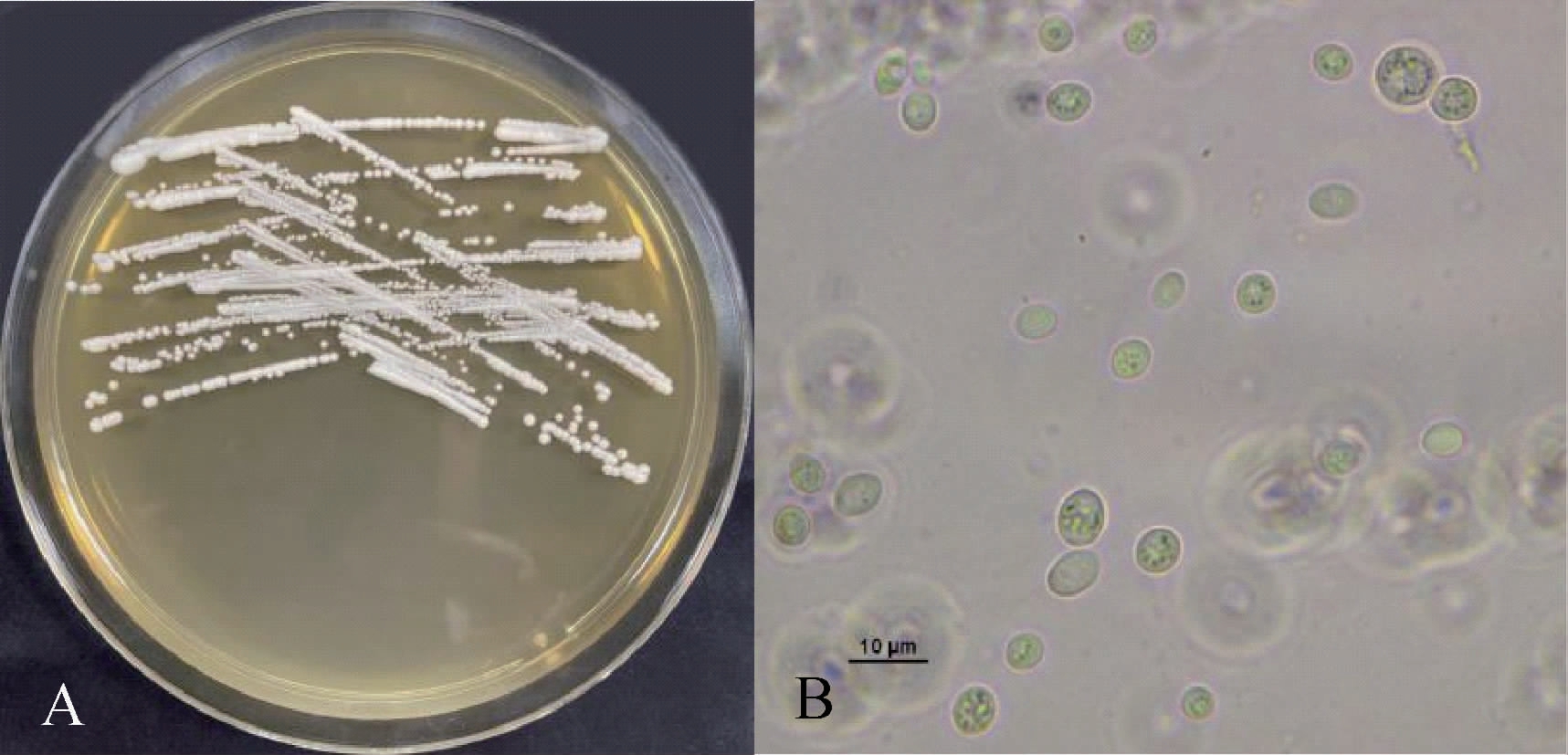
图2 菌株Y19的菌落(A)及细胞(B)形态
Fig.2 Colony (A) and cell (B) morphologies of strain Y19
由图2可知,菌株Y19在YPD固体培养基上呈乳白色、不透明,菌落呈表面光滑的奶油状或圆形,边缘整齐;在10×100倍光学显微镜下菌体细胞呈椭圆形,长度3~6 μm,宽度2~4 μm。对照《真菌鉴定手册》描述,菌株Y19与酿酒酵母(Saccharomyces cerevisiae)形态特征相似[26]。
2.3.2 分子生物学鉴定
为进一步明确菌株Y19的种属关系,对其内转录间隔区(internal transcribed spacer,ITS)序列进行分析,构建系统发育树,结果见图3。由图3可知,菌株Y19在与酿酒酵母(Saccharomyces cerevisiae)聚类在一起,亲缘关系最近,结合形态特征,将菌株Y19鉴定为酿酒酵母(Saccharomyces cerevisiae)。
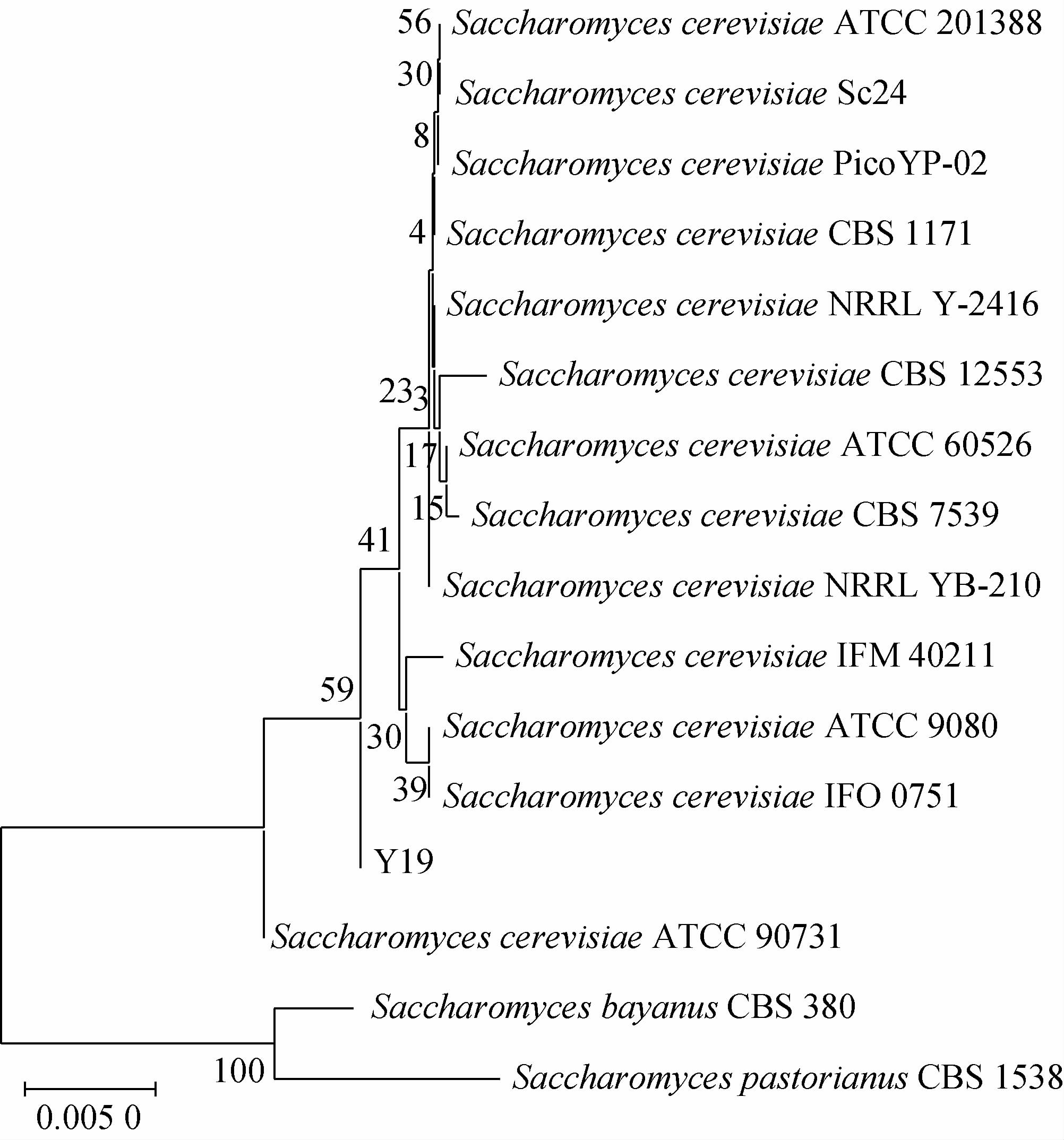
图3 基于ITS基因序列菌株Y19的系统发育树
Fig.3 Phylogenetic tree of strain Y19 based on ITS gene sequence
2.4 酿酒酵母Y19的环境耐受性实验
为探究酿酒酵母Y19对培养温度、酸、葡萄糖、乙醇的耐受性,对其在不同培养环境下的细胞生长活性进行检测,结果见图4。由图4可知,酿酒酵母Y19在不同培养温度、pH、葡萄糖含量和乙醇体积分数下呈现出不同的生长状况,在培养温度20~35 ℃、pH3~8、葡萄糖含量2%~25%以及乙醇体积分数0~12%条件下,酿酒酵母Y19的OD600nm值较高,可见酿酒酵母Y19可以适应不同葡萄糖含量环境,且在高乙醇体积分数以及偏酸性条件下具有较好细胞生长活性。清香型白酒发酵过程中,酒醅在发酵初期还原糖含量较高,且随着发酵进行会逐渐形成高乙醇含量、低pH的环境[24,27]。而酿酒酵母Y19的耐高糖、耐酸和耐乙醇特性有助于其在清香型白酒发酵过程中更好的繁殖,进而发挥降低正丙醇含量的能力,提升原酒品质。

图4 不同环境因子对酵母Y19生长的影响
Fig.4 Effects of different environmental factors on the growth of yeast Y19
2.5 酿酒酵母Y19在清香型白酒酿造中的应用
为进一步明确酿酒酵母Y19在清香型白酒酿造中的应用潜力,采用酿酒酵母Y19制备的麸皮种制曲,进行清香白酒酿造实验,采用GC法检测发酵结束后基酒中的主体风味成分(乙酸乙酯、正丙醇、异丁醇和异丙醇)含量,结果见图5。
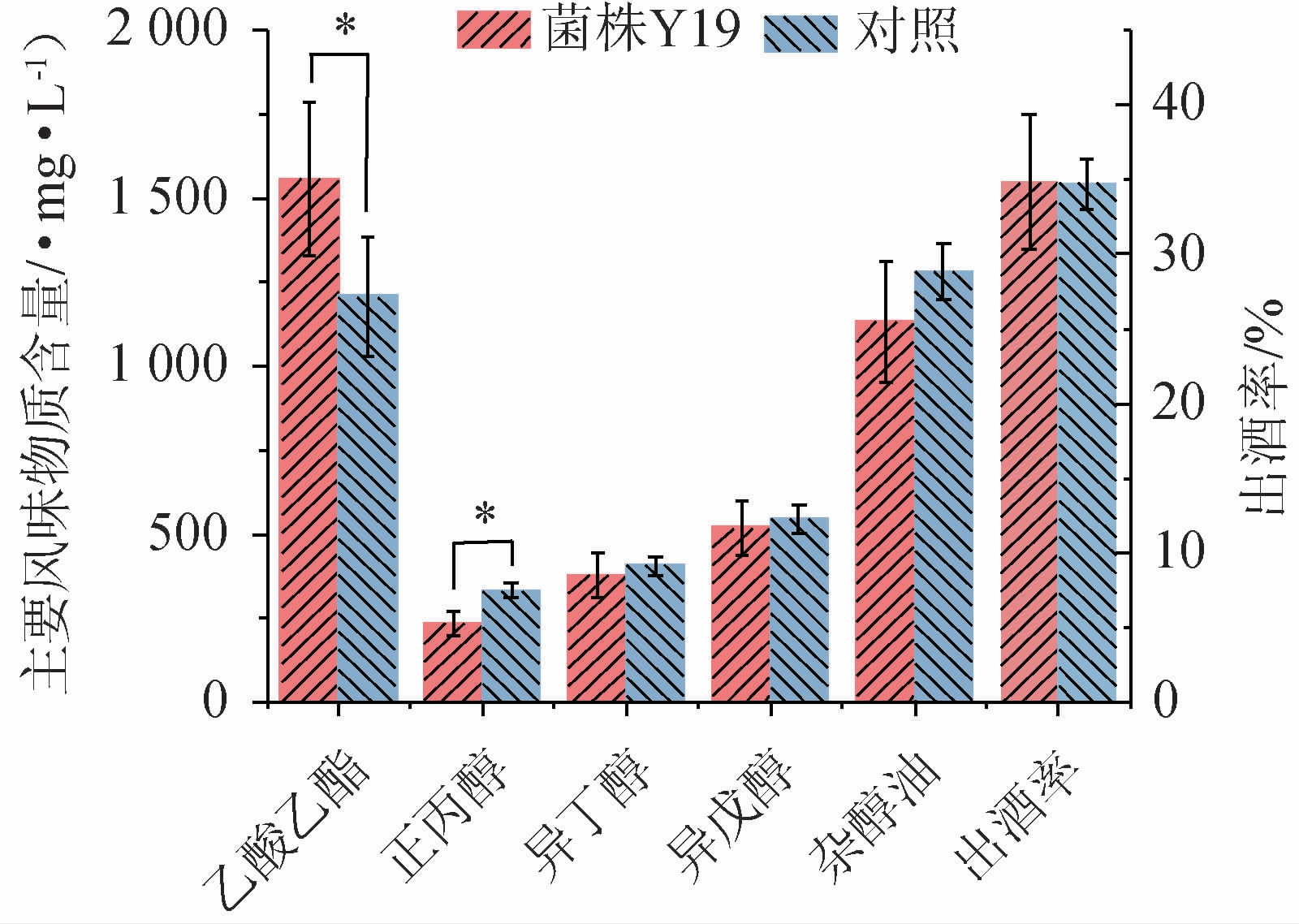
图5 酿酒酵母Y19对清香型白酒出酒率及主体风味物质的影响
Fig.5 Effects of strain Y19 on liquor yield and main flavor components in light-flavor Baijiu
“*”表示差异显著(P<0.05)。
由图5可知,与对照组相比,实验组酒样中正丙醇含量显著降低29.9%(P<0.05);乙酸乙酯含量显著升高28.8%(P<0.05),此外,出酒率(34.85%)升高,而异丁醇、异戊醇以及杂醇油总量(包括正丙醇、异丁醇和异戊醇)均降低,分别降低6.6%、4.4%和11.7%。结果表明,添加酿酒酵母Y19可以显著降低清香型原酒中的正丙醇含量,且具有明显提升乙酸乙酯效果,具有较好的生产应用潜力。
3 结论
本研究从清香型白酒酒曲中分离出一株具有低产正丙醇能力的酵母菌株Y19,经过菌落、细胞形态观察和ITS序列同源性比对鉴定为酿酒酵母(Saccharomyces cerevisiae)。通过高粱汁发酵实验发现,菌株Y19相比对照菌株正丙醇产量降低18.8%~32.8%,具有较好的低产正丙醇的能力。耐受性实验结果显示,菌株Y19在温度20~35 ℃、pH3~8、葡萄糖含量2%~25%以及乙醇体积分数0~12%条件下具有较好的生长活性,可以适应清香型白酒发酵过程微环境变化,发挥其低产正丙醇的潜力。进一步对该菌株在清香白酒发酵中代谢能力进行了验证,结果显示,与生产用曲相比,使用添加了酿酒酵母Y19强化曲的清香型白酒中正丙醇含量显著降低29.9%(P<0.05),乙酸乙酯含量显著升高28.8%(P<0.05),说明酿酒酵母Y19在降低清香型白酒中正丙醇和提升其乙酸乙酯含量方面具有较好的应用前景,为进一步开展大生产实验来提升清香型白酒中风味和口感提供了参考。
[1]GAO W J,FAN W L,XU Y.Characterization of the key odorants in light aroma type Chinese liquor by gas chromatography-olfactometry,quantitative measurements,aroma recombination,and omission studies[J].J Agr Food Chem,2014,62:5796-5804.
[2]HAZELWOOD L A,DARAN J M,MARIS A J A,et al.The Ehrlich pathway for fusel alcohol production: a century of research on Saccharomyces cerevisiae metabolism[J].Appl Environ Microb,2008,74(8):2259-2266.
[3]谢方安.谈白酒香气成分和作用[J].酿酒,2006,33(5):52-55.
[4]孙慧.浅析白酒杂醇油的含量[J].酿酒,2003,30(2):82-83.
[5]李园子,田伏锦,王凤寰,等.白酒酿造中适产高级醇酿酒酵母菌株选育研究进展[J].食品与发酵工业,2022,48(15):316-324.
[6]JIANG J,LIU Y C,LI H H,et al.Modeling and regulation of higher alcohol production through the combined effects of the C/N ratio and microbial interaction[J].J Agr Food Chem,2019,67(38):10694-10701.
[7]卢建军,杨帆,杨婧,等.白酒酿造中产正丙醇的微生物溯源研究[J].中国酿造,2019,38(7):151-155.
[8]王喆,张梦思,孙细珍,等.小曲清香型白酒中关键风味成分分析[J].食品科学,2022,43(14):264-271.
[9]格绒泽仁,皇甫洁,韩兴林,等.浓香型白酒饮后不适感关键高级醇类物质关联性判定新方法[J].食品与发酵工业,2019,45(14):191-195.
[10]柏永昊,张明春,缪礼鸿.芽孢杆菌对白酒发酵过程中正丙醇含量的影响[J].酿酒科技,2013(11):26-29.
[11]柏永昊,熊小毛,缪礼鸿,等.固态法发酵白酒中正丙醇产生的机理研究[J].中国酿造,2014,33(2):105-108.
[12]田源,孔小勇,方芳.浓香型白酒发酵过程微生物合成正丙醇途径解析[J].微生物学报,2020,60(7):1421-1432.
[13]杜相林,吴任之,桑其明,等.功能菌在浓香型白酒生产中的应用现状[J].酿酒,2022,49(4):17-21.
[14]王西,陈波,刘帮,等.功能菌在酱香型白酒生产过程中的研究[J].酿酒科技,2021(9):114-119.
[15]刘小改,马美荣,周林艳,等.高产乙酸乙酯酵母菌筛选及固态发酵应用研究[J].中国酿造,2020,39(10):79-83.
[16]许银,杨强,张龙,等.高产乙酸乙酯酵母菌的筛选及其在清香型小曲白酒生产中的应用[J].中国酿造,2021,40(8):76-80.
[17]徐岩.现代白酒酿造微生物学[M].北京:科学出版社,2019:427-428.
[18]孙细珍,杜佳炜,黄盼,等.现代工艺和传统工艺酿造小曲清香型白酒感官表征及风味成分分析[J].食品科学,2021,42(6):282-290.
[19]WHITE T J,BRUNS T,LEE S,et al.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics.In:PCR protocols:a guide to methods and applications[M].New York:Academic Press Inc,1990:315-322.
[20]李群,林斌,唐洁,等.清香型小曲白酒酿造中酵母资源解析及其耐受性能研究[J].食品与发酵工业,2022,48(9):41-47.
[21]江威,王路瑶,张宗杰,等.清香型小曲白酒酒醅中乳酸菌的筛选鉴定及其发酵特性研究[J].中国酿造,2022,41(8):57-63.
[22]杨强,唐洁,杨生智,等.清香型小曲白酒产酯酵母的筛选及应用[J].酿酒科技,2016(1):78-80.
[23]唐洁,陈申习,林斌,等.清香小曲白酒新工艺中微生物及环境因子对酒体风味变化的影响[J].食品与发酵工业,2019,45(17):40-47.
[24]LIN B,TANG J,YANG Q,et al.Microbial succession and its effect on key aroma components during light-aroma-type Xiaoqu Baijiu brewing process[J].World J Microb Biot,2022,38(10):166.
[25]董书甲.氮源对酿酒酵母代谢产物的影响[D].济南:齐鲁工业大学,2018.
[26]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:103-111.
[27]HU Y L,YANG Q,CHEN D,et al.Study on microbial communities and higher alcohol formations in the fermentation of Chinese Xiaoqu Baijiu produced by traditional and new mechanical technologies[J].Food Res Int,2021,140:109876.