白酒作为中国的国酒,具有悠久的历史和独特的民族文化内涵。中国白酒酿造采用独有的多边固态发酵模式,以酒曲将谷物原料同时糖化、发酵及生香,进而通过蒸馏、陈酿和勾调,最后形成了不同香型和风格的蒸馏酒[1]。其中,浓香型白酒因其“窖香浓郁、绵甜醇厚、香味谐调、尾味净爽”的特点,深受消费者的喜爱,常年占据白酒市场份额的一半以上。
在白酒酿造过程中,酒曲、酒醅、窖泥和黄水在窖池中组成了一个酿造环境。其中,酒醅既为酿造微生物的生长代谢提供了营养成分,又扮演着能量传递和物质交换的重要载体角色[2]。微生物在酒醅中生长、繁衍、代谢,形成了以乙醇为主体,酯、醇、酸、醛、酮、酚等多种组分共存的复杂体系。浓香型白酒含有上百种酯类,以四大酯(己酸乙酯、乳酸乙酯、乙酸乙酯和丁酸乙酯)最为重要,其中己酸乙酯是浓香型白酒的主体呈香组分,对浓香型白酒典型风格的塑造有重要作用[3-4]。值得注意的是,优质的浓香型白酒中己酸乙酯与乙酸乙酯的最佳比例应稳定在1∶(0.5~0.6)。然而在近几年,一些浓香型白酒企业在生产过程中出现了乙酸乙酯含量明显偏高的现象,从而造成酒体风味不协调,浓香不突出,勾调难度大等问题。
为了保持和稳定浓香白酒特有的风味和口感,一些研究者开始致力于“增己降乙”的相关理论研究[5]和生产工艺参数调整[6-8]。这些研究主要揭示了浓香型白酒“增己降乙”与酿酒工艺的相关性。另外,谢菲等[9]在浓香型大曲产乙酸能力与微生物群落结构及其代谢产物的相关性研究中发现与大曲产乙酸有显著正相关性的微生物有6个属,包括毛霉属、横梗霉属、魏斯氏菌属、芽孢杆菌属、假丝酵母属和Mitochondria。这说明在调整生产工艺参数实现“增己降乙”的过程中,酿造微生物的变化规律及其与乙酸及乙酸乙酯的形成也具有相关性。因此,为了探究浓香型白酒生产过程中乙酸乙酯含量偏高的原因,有必要进行酿造微生物的变化规律及其与乙酸及乙酸乙酯相关性的研究。
本研究采用顶空固相微萃取-气质联用法(headspace solid-phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)和高通量测序技术分别对酒醅中挥发性组分和微生物群落组成进行检测,旨在探寻不同来源的浓香酒醅中微生物群落与乙酸和乙酸乙酯的相关性,这为实现白酒酿造微生物功能的理性调控与实际应用奠定理论基础。
1 材料与方法
1.1 材料与试剂
Fast脱氧核糖核酸(deoxyribonucleic acid,DNA)SPIN提取试剂盒:美国MP Biomedicals公司;PicoGreen dsDNA分析试剂盒:美国Invitrogen公司;其他试剂均为国产色谱纯或分析纯。
1.2 仪器与设备
S1000TM Thermal Cycler 聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Bio-Rad公司;NanoDrop ND-1000紫外可见分光光度仪:美国Thermo Fisher Scientific公司;8890-5977B气相色谱-质谱联用仪:美国Agilent公司;DBwax色谱柱(30 m×0.25 mm×0.25 μm)、DVB/CAR/PDMS(50/30 μm)固相微萃取头:美国Supelco公司。
1.3 方法
1.3.1 样品处理
10个酒醅样品采集于不同产地的浓香型白酒企业,依次编号为TP、QL、SD、LZ、LZ-QY、YB、MY-ZW、MY-GW、MZ-1和MZ-2。本次取样均为下层酒醅(发酵60 d左右),参照HE G Q等[10]描述的方法在窖池内进行7点式取样。
1.3.2 酒醅样品挥发性组分测定
采用顶空固相微萃取-气相质谱联用技术对酒醅的挥发性组分进行测定。顶空固相微萃取条件:采用三相萃取头50/30 μm DVB/CAR/PDMS提取挥发性组分。称取1.0 g酒醅样品加入15 mL顶空瓶中,将顶空瓶置于恒温搅拌器中,在50 ℃预热平衡15 min,然后以250 r/min的搅拌速率下继续提取吸附30 min。萃取结束后,将SPME纤维插入GC-MS进样口解吸5 min,检测其挥发性组分。
GC-MS检测条件:色谱条件为进样口温度260 ℃,DBwax(30 m×0.25 mm×0.25 μm)色谱柱;升温程序为40 ℃保持5 min,以5 ℃/min升至220 ℃,然后以20 ℃/min升至250 ℃,保持2.5 min;其中载气为高纯氦气(He)(纯度99.999%),采用不分流模式,流速为1 mL/min。质谱条件为连接口温度260 ℃,四级杆温度150 ℃;电离方式为电子电离(electron ionization,EI)源,电子能量和离子源温度分别为70 eV和230 ℃;质谱扫描范围m/z为20~400 amu。检测质谱数据通过与美国国家标准与技术研究院(national institute of standards and technology,NIST)标准谱库2014对照进行组分鉴定,对匹配度>800的物质予以分析。
1.3.3 酒醅样品微生物群落测定
依据Fast DNA SPIN提取试剂盒的操作说明提取各酒醅样品的总微生物基因组DNA。将提取的基因组DNA进行1%琼脂糖凝胶电泳检测,取3 μL核酸用紫外分光光度计进行浓度测定。对于细菌,针对16S核糖核酸(ribosomal ribonucleic acid,rRNA)基因高变区V3-V4区域进行扩增,使用的正向引物为338F(5'-ACTCCTACGGGAGGCAGCA-3'),反向引物为806R(5'-GGACTACHVGGGTWTCTAAT-3');对于真菌,扩增区域为ITS区,引物为ITS5(5'-GGAAGTAAAAGTCGTAACAAGG-3')和ITS1(5'-GCTGCGTTCTTCATCGATGC-3')。PCR扩增体系为25 μL:5×reaction buffer和5×GC buffer各5 μL,0.25 μL DNA聚合酶(5 U/μL,Q5 High-Fidelity),2 μL脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTPs)(2.5 mmol/L),正反引物各1 μL(10μmol/L),2μLDNA模板,8.75μL双蒸水(ddH2O)。细菌的PCR扩增程序为98 ℃预热2 min;98 ℃变性15 s,55 ℃退火30 s,72 ℃延伸30 s,一共25个循环;最后72 ℃保持5min。真菌PCR热循环参数:95 ℃预热3 min;95 ℃变性30 s,61 ℃退火30 s,72 ℃延伸45 s,共32个循环。最后72 ℃保持10 min。纯化后的产物用分光光度计定量,然后将PCR产物等分子质量混合,对扩增的DNA文库添加特异的靶序列,最后在2×300 Illumina Miseq平台进行测序。
1.3.4 数据处理
测序数据处理及生物信息学分析,原始序列使用QIIME pipeline进行处理,依据CAPORASO J G等[11]描述的方法去除以下一些低质量序列:长度小于150 bp,序列平均质量小于20,单碱基重复数大于8 bp以及模糊的碱基。最后使用UCLUST把高质量的序列根据97%的序列相似度聚成不同的操作分类单元(operational classification unit,OTU)[12]。为了分析微生物和风味组分之间的相关性,计算其皮尔逊(Pearson)相关系数,等级相关系数以R表示,P<0.05表示关系的显著性。
2 结果与分析
2.1 不同酒醅中的风味化合物组成
发酵酒醅的风味组分对白酒风味的形成有着重要的贡献,本研究首先比较了不同来源的浓香酒醅中挥发性组分的差异,结果见表1。由表1可知,酒醅中共检测到71种挥发性组分,包括35种酯类、10种酸类、10种醇类、6种酮类、3种酚类以及7种其他化合物。这些物质的含量差异形成了白酒不同的风味。
表1 酒醅样品的挥发性组分相对含量测定结果
Table 1 Determination results of relative contents of volatile components in fermented grains samples

续表

注:ND表示未检测到。
在这些组分中,各类化合物的占比在不同酒醅中存在差异,结果见图1。由图1可知,占比最高的是酯类(50.93%~70.24%),其中,MY-ZW中酯类相对含量最高,达到70.24%,其次是酸类(22.48%~35.44%)和醇类(6.10%~11.93%),值得注意的是,在MY-GW中酸类和醇类含量均为最高,分别占35.44%和11.93%;另外,还有少量的酮类、酚类和其他化合物组分。酯类化合物是浓香型白酒的主要风味组分,大多呈现出果香、花香、甜香等悦人的香气,其含量和比例关系对浓香白酒典型风味的形成有显著的影响[13]。在检测到的酯类化合物中,除了主要的四大酯以外,占比较高的还有庚酸乙酯、辛酸乙酯、己酸丁酯和己酸己酯。这些组分均为短碳链脂肪酸酯类,主要呈水果香,对赋予白酒特定风味有重要的贡献[14]。己酸乙酯在各个酒醅样品中的占比为12.07%~38.95%,占酯类组分的21.66%~56.14%,符合浓香白酒发酵的典型风格。
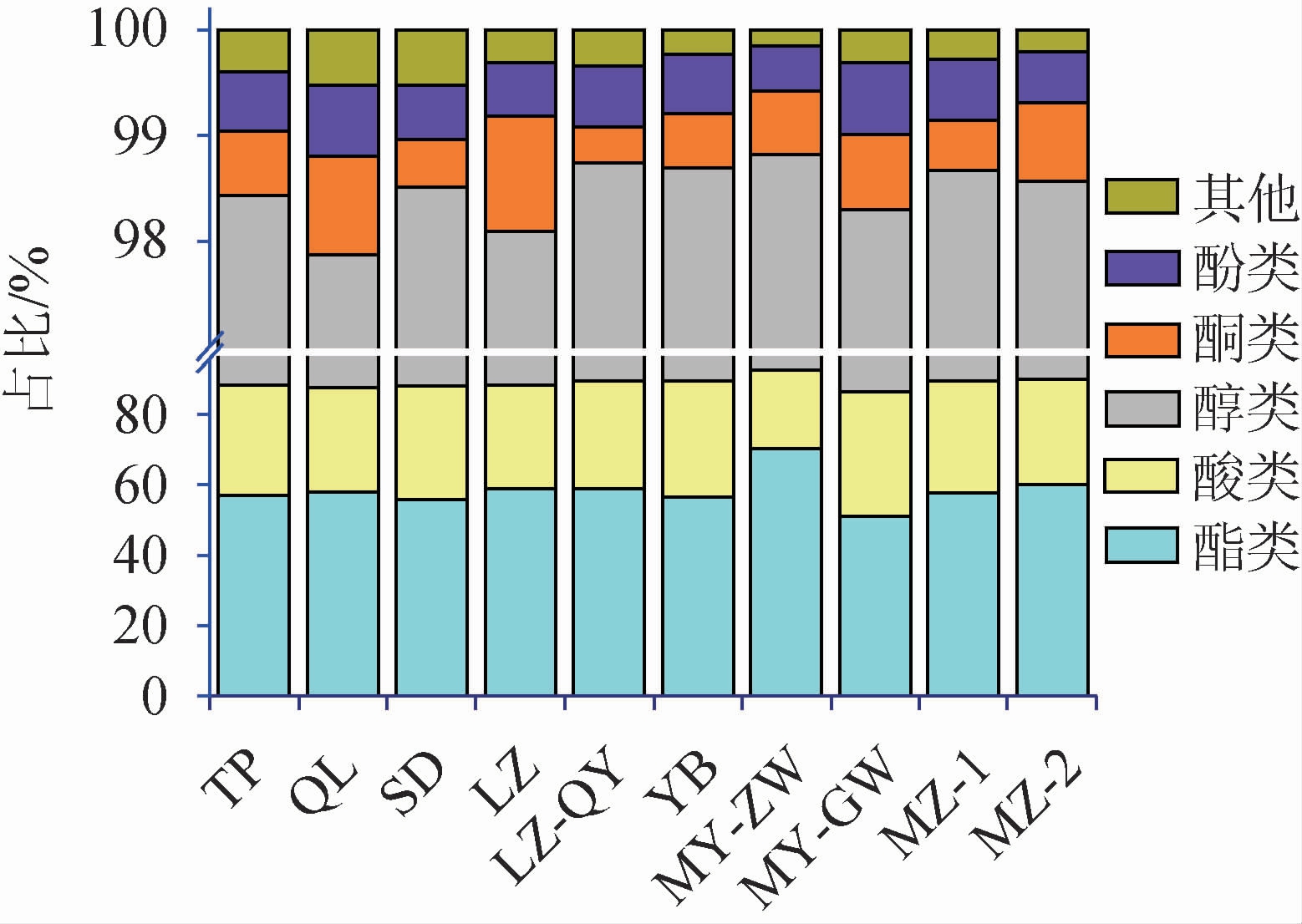
图1 酒醅样品中各类风味组分的比例
Fig.1 Proportion of different flavor compounds in fermented grains samples
酸类物质是白酒最重要的味感剂,其含量的多少和比例协调性对新酒老熟有显著的催化效应[15]。在本研究中,一共检测到了10种酸类组分,包括乙酸、丁酸、戊酸、己酸、庚酸和辛酸等8种有机酸和2种芳香族羧酸。己酸在样品中的含量占比为14.54%~23.15%,是酸类成分的主要有机酸,其含量占总酸的62.44%~67.88%。
在检测到的挥发性组分中,选取其中的32种主要风味物质进行聚类分析,结果见图2。由图2可知,酒醅样品种类及其风味组分均聚为两大类,其中MY-ZW、SD、TP和LZ-QY为一大类,这些样品中主要表现为酯类化合物含量较高;而QL、LZ、YB、MY-ZW、MZ-1、MZ-2则聚为另一大类,主要为酸类和醇类组分含量较高。与其他样品相比,SD、LZ、LZ-QY三个酒醅中的乙酸己酯、乳酸乙酯、乙酸乙酯和乙酸的含量相对较高,而己酸乙酯含量则相对较低。此外,在LZ酒醅样品中乙酸乙酯和乙酸的含量最高,分别占总挥发性组分的2.55%和4.94%。
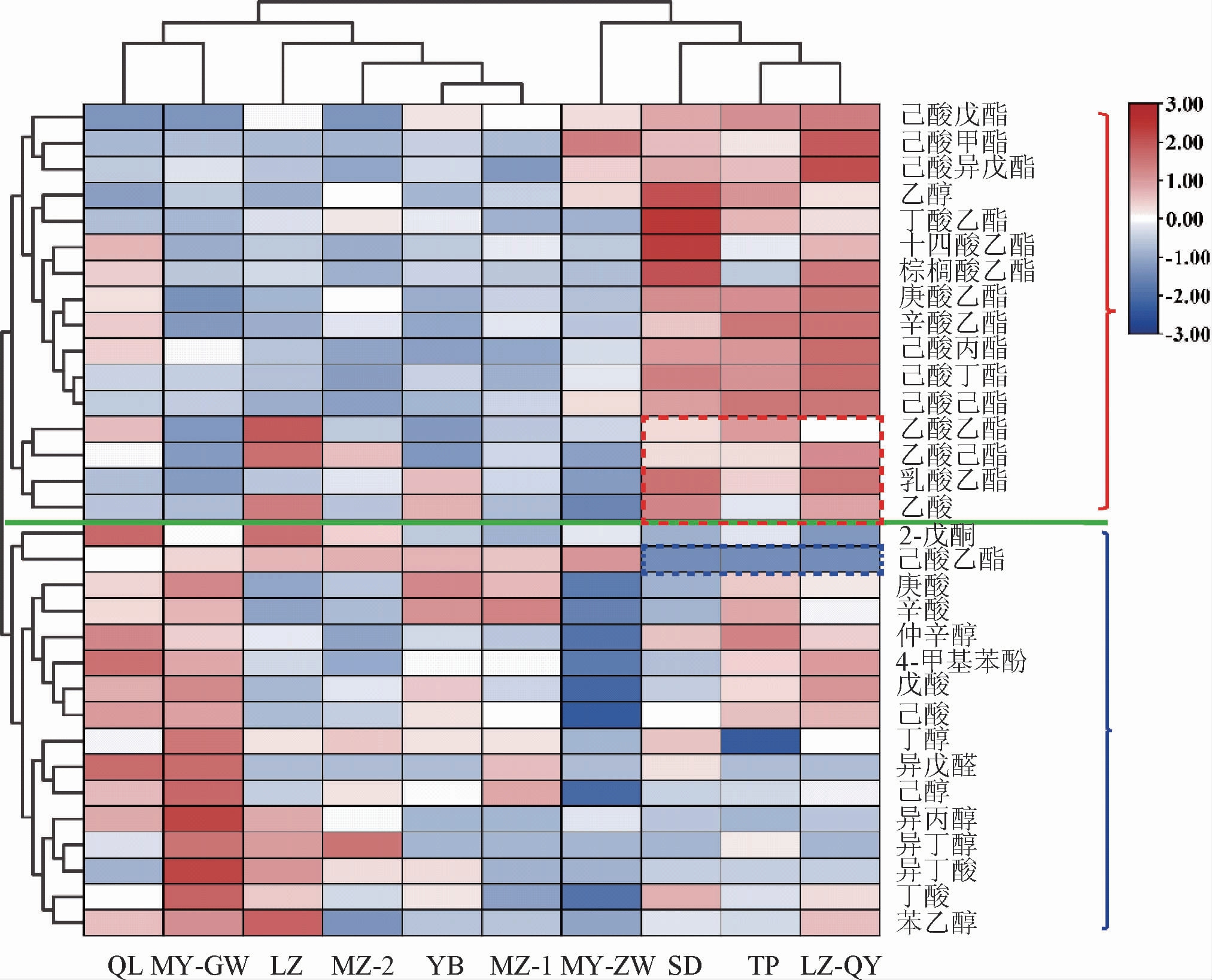
图2 不同酒醅样品主要挥发性风味物质含量热图
Fig.2 Heatmap of main volatile compounds in different fermented grains samples
2.2 酒醅中微生物群落组成
2.2.1 不同酒醅中乳酸菌组成
从属水平上分析酒醅的细菌微生物群落组成,结果见图3。由图3可知,除乳杆菌属(Lactobacillus)外,还在这10种样品中检测到了少量的黄杆菌属(Flavobacterium),盐单胞菌属(Halomonas),水小杆菌属(Aquabacterium),硝酸盐还原远洋杆菌(Pelagibacterium)等。其中,乳杆菌属占比94%~98%,为酒醅的绝对优势细菌。这与诸多的研究结果报道相一致,如SUN W等[16]研究了不同季节浓香型发酵酒醅的微生物群落特征,结果表明,夏季酒醅(76.3%)和冬季酒醅(43%)中乳杆菌属(Lactobacillus)均为优势菌属。另外,胡晓龙等[17]考察了浓香型酒醅微生物菌群演替规律及其空间异质性,结果表明乳杆菌属(Lactobacillus)成为发酵中后期酒醅(15~60 d)的绝对优势菌(98%),且几乎是唯一优势菌。这可能是乳酸菌在发酵过程中产生的乙醇、乙酸和乳酸等物质较快地改变了酿造微生态环境,使得很多微生物在厌氧、高酸和高乙醇环境下的生长受到抑制;而乳杆菌属(Lactobacillus)作为兼性厌氧菌,且能够耐受较低的pH,从而成为酒醅发酵结束后的绝对优势菌,这也是乳杆菌属(Lactobacillus)与其他很多菌属相互作用呈现负相关的一个重要原因[18]。通过这些相互作用抑制了一些不耐酸、不耐乙醇的微生物,这可能有助于降低白酒酿造过程杂菌污染的风险。
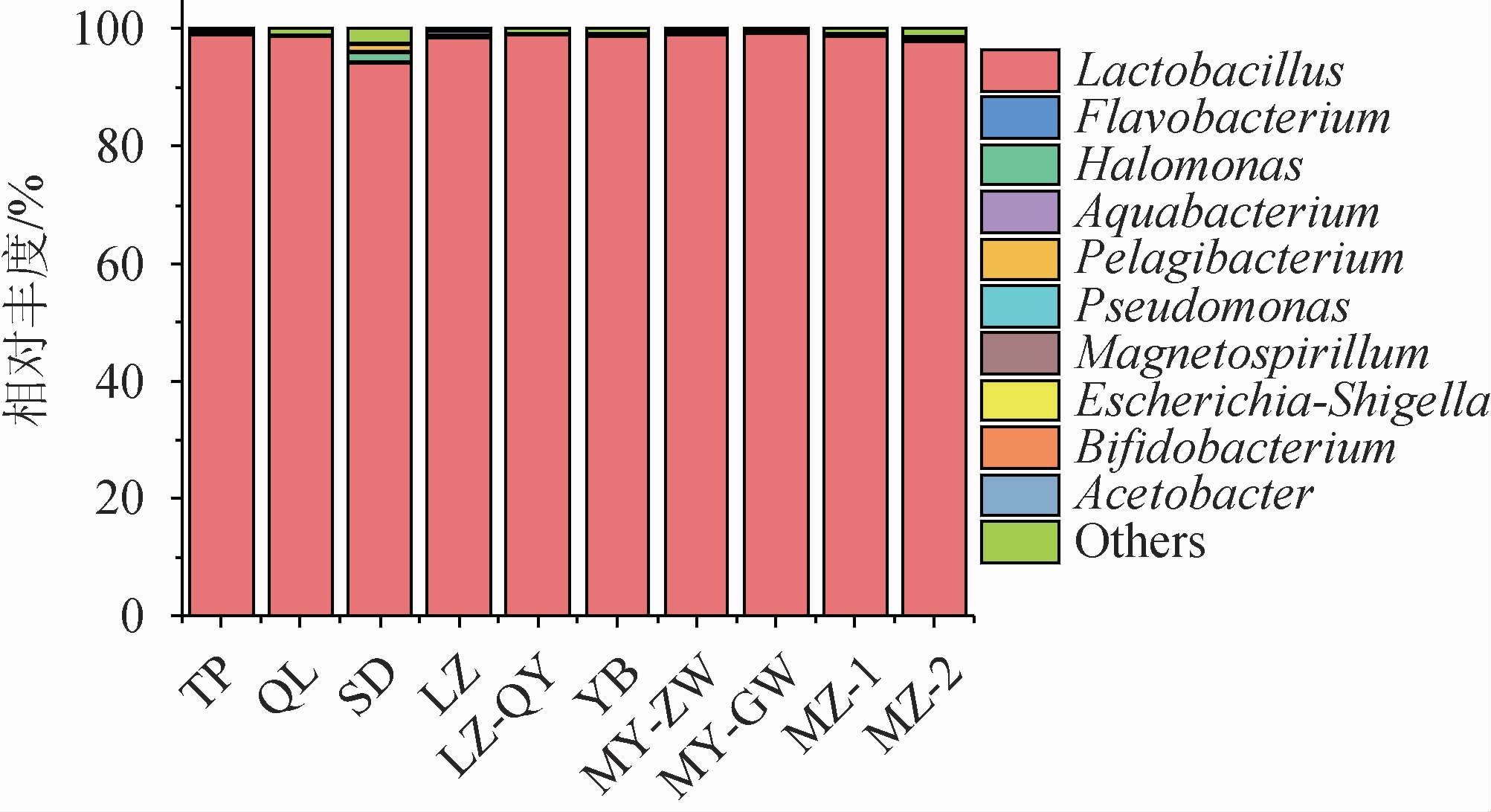
图3 不同酒醅样品中细菌属组成与相对丰度分布
Fig.3 Composition and relative abundance of bacterial genera in different fermented grains samples
分析了乳杆菌属(Lactobacillus)不同的物种组成,结果见图4。由图4可知,发酵结束后10种酒醅中一共检测到了10种乳酸菌,包括耐酸乳杆菌(Lactobacillus acetotolerans)、敏捷乳杆菌(Lactobacillus agilis)、短乳杆菌(Lactobacillus brevis)、布氏乳杆菌(Lactobacillus buchneri)、瑞士乳杆菌(Lactobacillus helveticus)、肠乳杆菌(Lactobacillus intestinalis)、面包乳杆菌(Lactobacillus panis)、罗伊氏乳杆菌(Lactobacillus reuteri)、沙克乳酸杆菌(Lactobacillus sakei)和Lactobacillus satsumensis。其中,耐酸乳杆菌(L.acetotol erans)的平均相对丰度最高,这与之前诸多报道相一致[19-20]。发酵结束后不同乳酸菌丰度水平不同,这可能与其受酒精、酸和厌氧等环境的长期驯化以及生长代谢有关;而L.acetotolerans由于其较强的耐酸和耐乙醇能力[21-22],使其在白酒发酵过程中能够成为优势物种。有研究报道,在米糠发酵过程中随着乳酸浓度的不断增加,在发酵6 d后其他乳酸菌逐渐停止生长,而L.acetotolerans仍然可以继续生长繁殖[23]。另外值得注意的是,在乙酸和乙酸乙酯含量较高的LZ酒醅样品中,还检测到了布氏乳杆菌(L.buchneri)、敏捷乳杆菌(L.agilis)和罗伊氏乳杆菌(L.reuteri)。
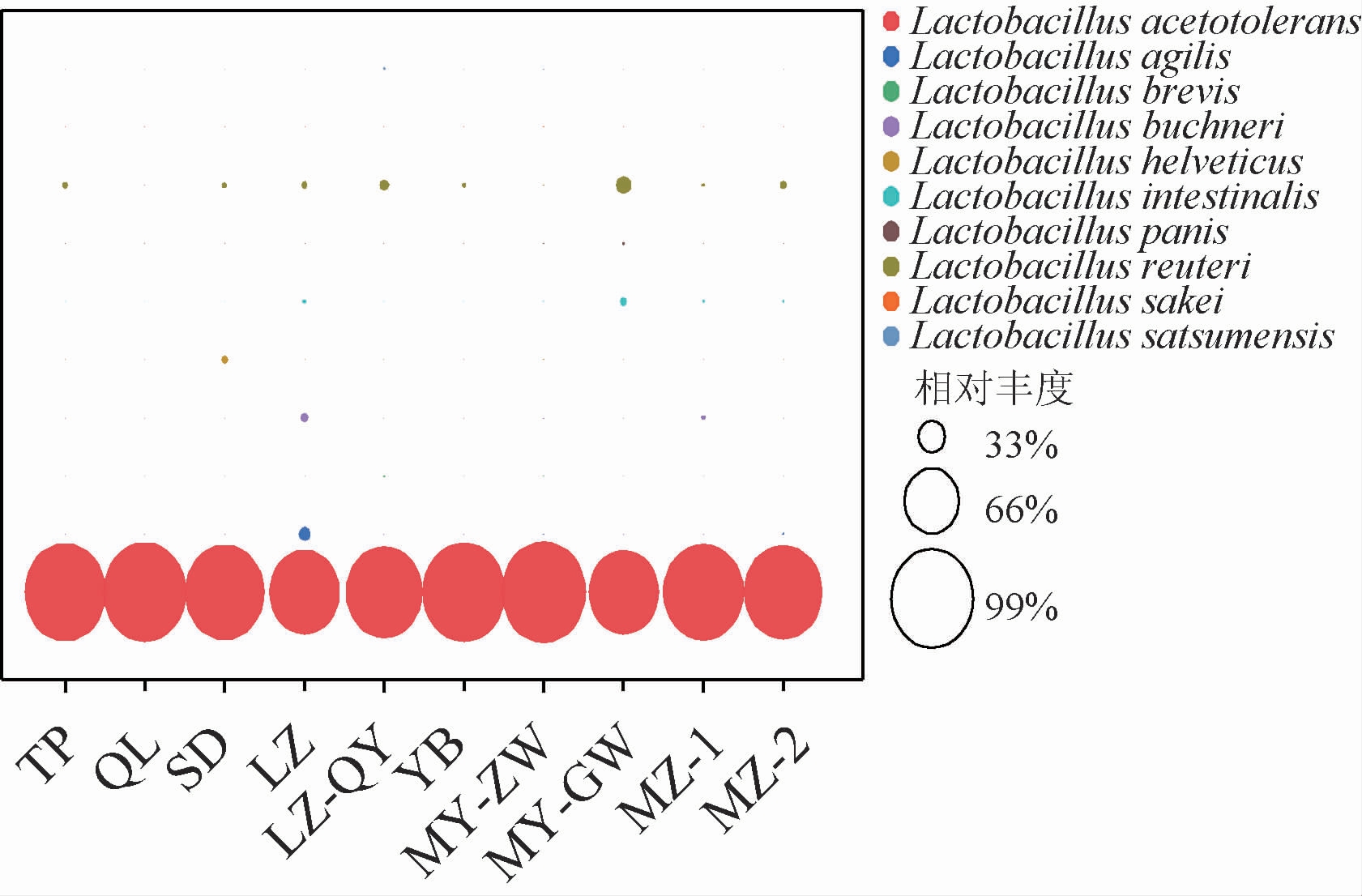
图4 不同酒醅样品中乳酸菌组成与相对丰度分布
Fig.4 Composition and relative abundance of lactic acid bacteria in different fermented grains samples
2.2.2 不同酒醅中酵母菌组成
在白酒酿造过程中,功能真菌群落主要由霉菌、酵母以及嗜热真菌组成。其中,酵母菌不仅可以影响出酒率,还会产生多种醇类和酯类等呈味组分,对白酒风味的形成至关重要[24]。特别地,有研究表明,酵母菌在葡萄酒发酵过程中,可以提高乙酸乙酯的含量,从而改善其风味品质[25]。进一步地,为了探究浓香型白酒酿造相关酵母菌与乙酸乙酯和乙酸的相关性,对不同酒醅样品中酵母菌的组成进行比较分析,结果见图5。
由图5可知,共检测出18种酵母菌,平均相对丰度>1%的优势酵母菌包括克柔假丝酵母(Candida xylopsoci)、扁平云假丝酵母(Candida humilis)、发酵毕赤酵母(Pichia fermentans)和克鲁维毕赤酵母(Pichia kluyveri)。其中,克柔假丝酵母(C.xylopsoci)的平均相对丰度最高,为55.3%~89.1%。其次,在检测到扁平云假丝酵母(C.humilis)的酒醅样品中,其相对丰度均>1.75%,且在LZ和LZ-QY酒醅中分别达到了36.2%和41.8%。另外,发酵毕赤酵母(Pichia fermentans)具有高密度发酵和生长速度快等优点,成为目前酿酒业中备受青睐的发酵菌种。克鲁维毕赤酵母(Pichia kluyveri)纯发酵会比酿酒酵母产生更多的乙醇和乳酸乙酯[26]。此外还检测到了许多白酒酿造过程中常见的酵母菌,如接合酵母(Zygoascus hellenicus)、膜璞毕赤酵母(Pichia membranifaciens)和蜂生假丝酵母(Candida apicola)等。
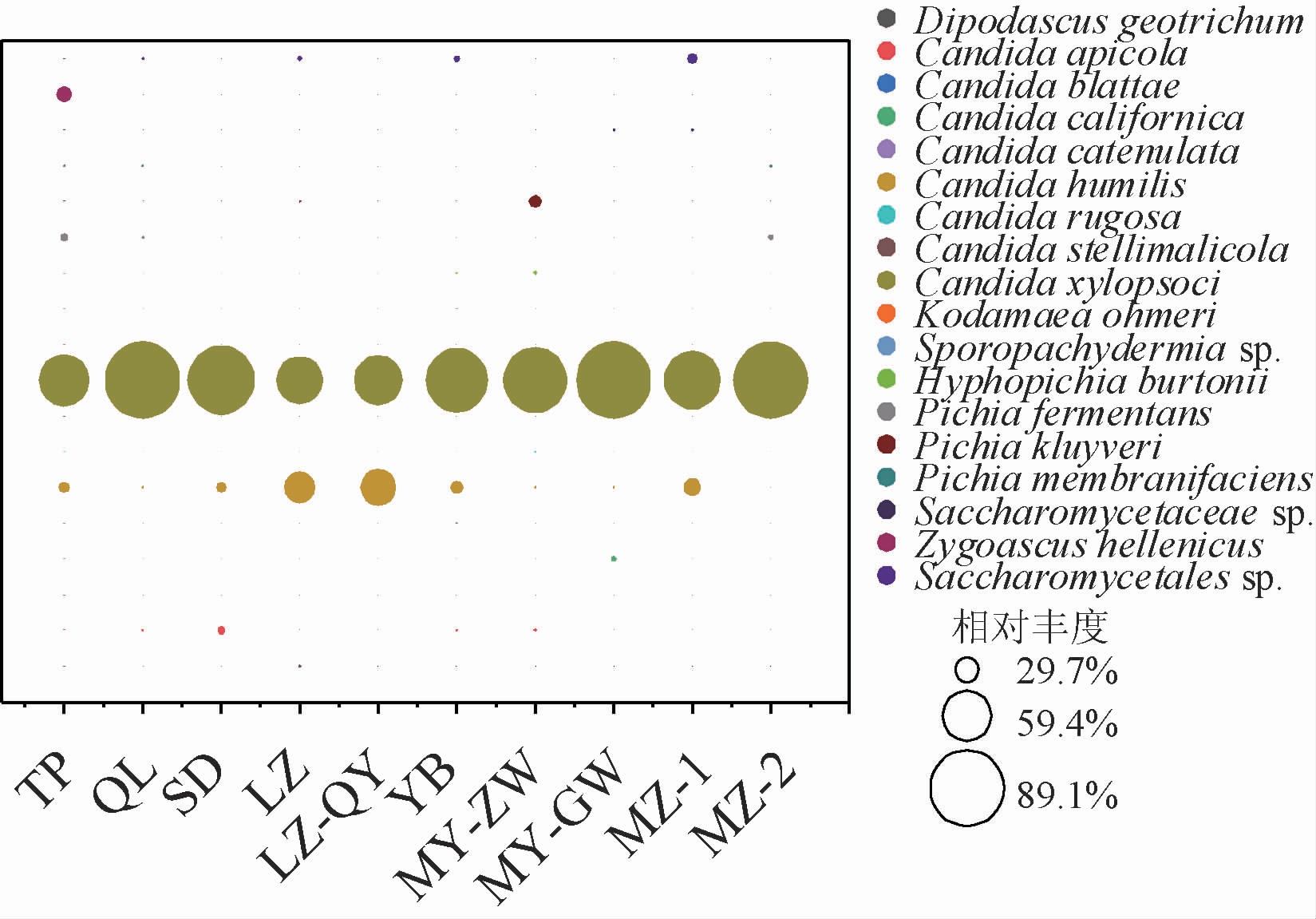
图5 不同酒醅中酵母菌组成与相对丰度分布
Fig.5 Composition and relative abundance of yeasts in different fermented grains samples
2.3 乳酸菌与酵母菌和乙酸及乙酸乙酯的相关性分析结果
通过Pearson相关性分析了主要乳酸菌种和主要酵母菌种与乙酸和乙酸乙酯的相关性,结果见表2。
表2 乳酸菌和酵母菌与乙酸及乙酸乙酯的Pearson相关性
Table 2 Pearson correlation of lactic acid bacteria and yeast with acetic acid and ethyl acetate
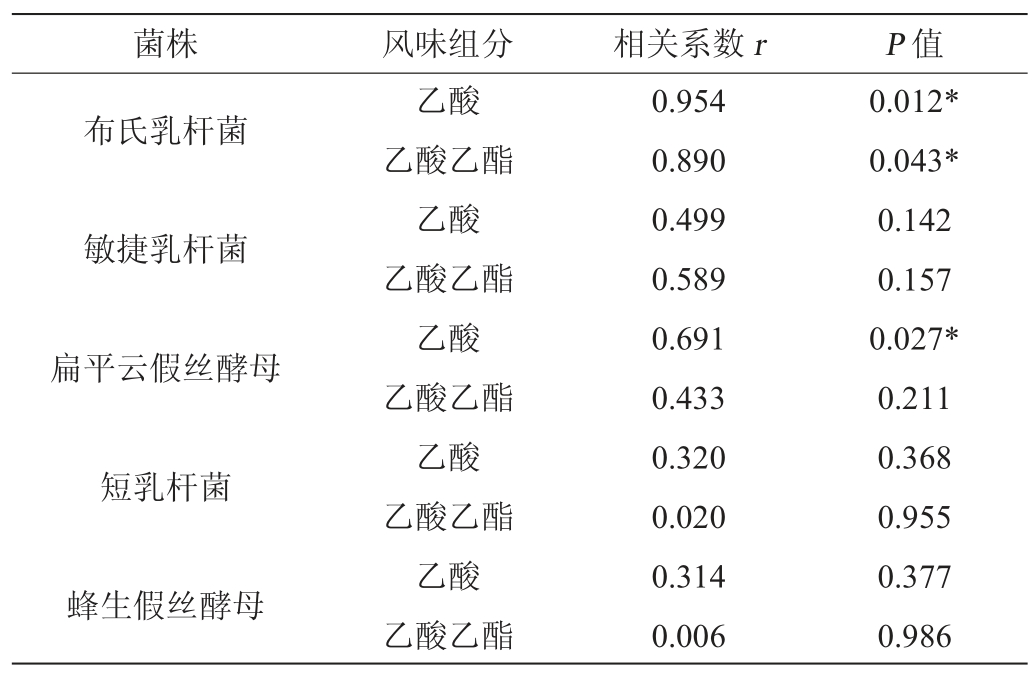
注:“*”表示差异显著(P<0.05)。
由表2可知,L.buchneri与乙酸(R=0.954,P=0.012)和乙酸乙酯(R=0.890,P=0.043)均呈现出显著的正相关性。这可能是因为L.buchneri属于异型发酵乳酸菌,其在厌氧、低pH条件下可以将一部分乳酸转变为乙酸[27]。而在考察同/异型乳酸菌对白酒糟发酵全混合日粮营养价值和发酵品质的影响中也发现,经L.buchneri发酵70 d后饲料中的乙酸含量显著增加到了1.45%[28]。这也说明了L.buchneri经过发酵增加了乙酸的含量。进一步分析酵母菌与乙酸及乙酸乙酯的相关性,结果表明,C.humilis与乙酸呈显著的正相关性(R=0.957,P=0.043),与乙酸乙酯也呈现出一定的正相关性(R=0.433,P=0.211)。有研究报道,将C.humilis YCT03CH菌株作为强化菌剂按9%比例加入酒醅中,经固态发酵28 d后,与对照组相比酒醅中乙酸乙酯含量显著增加了76.7%[29]。
3 结论
本研究采用顶空固相微萃取-气质联用法从酒醅中共检测出71种挥发性风味化合物,以酯类、酸类和醇类化合物为主,且不同来源酒醅中风味组分差异显著;通过高通量测序分析从酒醅中微生物群落检测到10种乳杆菌种和18种酵母菌种。通过分析乳酸菌和酵母菌与乙酸及乙酸乙酯的相关性发现,布氏乳杆菌和乙酸的相关性系数为0.954(P=0.012),和乙酸乙酯的相关系数R为0.890(P=0.043);扁平云假丝酵母和乙酸的相关系数R为0.957(P=0.043),和乙酸乙酯的相关系数R为0.433(P=0.211)。因此,布氏乳杆菌和扁平云假丝酵母与乙酸及乙酸乙酯含量存在显著的正相关性。这为揭示浓香型白酒中乙酸乙酯含量偏高的原因提供了微生物依据,也为开发白酒酿造功能微生物代谢调控技术奠定理论基础。
[1]ZHENG X W,HAN B Z.Baijiu(白酒),Chinese liquor:History,classification and manufacture[J].J Eth Foods,2016,3(1):19-25.
[2]LI H,HUANG J,LIU X,et al.Characterization of interphase microbial community in Luzhou-flavored liquor manufacturing pits of various ages by polyphasic detection methods[J].J Microbiol Biotechn,2017,27(1):130-140.
[3]FAN W L,QIAN M C.Characterization of aroma compounds of Chinese"Wuliangye"and"Jiannanchun"liquors by aroma extract dilution analysis[J].J Agr Food Chem,2006,54(7):2695-2704.
[4]FAN W L,QIAN M C.Identification of aroma compounds in Chinese'Yanghe Daqu'liquor by normal phase chromatography fractionation followed by gas chromatography-olfactometry[J].Flavour Frag J,2006,21(2):333-342.
[5]许育民.浓香型白酒增己降乙相关理论研究[J].酿酒科技,2021(4):48-54.
[6]宋瑞滨,邵泽良,宋军.浓香型白酒生产中乙酸乙酯偏高的原因及控制措施[J].酿酒,2019,46(3):55-60.
[7]谢玉球,时晓,周二干,等.浓香型原酒乙酸乙酯偏高的原因及解决措施[J].酿酒,2017,44(6):42-46.
[8]赖登燡,林东,王久明,等.浓香型白酒“增己降乙”与酿酒工艺的关联性研究[J].酿酒,2021,48(1):3-11.
[9]谢菲,刘雪娇,古丹,等.浓香型大曲产乙酸能力与微生物群落结构及其代谢产物的相关性研究[J].酿酒,2022,49(4):64-69.
[10]HE G Q,HUANG J,ZHOU R Q,et al.Effect of fortified Daqu on the microbial community and flavor in Chinese strong-flavor liquor brewing process[J].Front Microbiol,2019,10:56.
[11]CAPORASO J G,KUCZYNSKI J,STOMBAUGH J,et al.QIIME allowsanalysis of high-throughput community sequencing data[J].Nat Methods,2010,7(5):335-336.
[12]EDGAR R C.Search and clustering orders of magnitude faster than BLAST[J].Bioinformatics,2010,26(19):2460-2461.
[13]胡晓龙,田瑞杰,樊建辉,等.浓香型白酒挥发性化合物香气贡献及其地域特征研究进展[J].轻工学报,2022,37(2):1-14.
[14]LIU H,SUN B G.Effect of fermentation processing on the flavor of Baijiu[J].J Agr Food Chem,2018,66(22):5425-5432.
[15]张方,张宿义,苏占元,等.有机酸对浓香型白酒品质及其酿造过程影响的研究进展[J].酿酒科技,2016(1):94-102.
[16]SUN W,XIAO H,PENG Q,et al.Analysis of bacterial diversity of Chinese Luzhou-flavor liquor brewed in different seasons by Illumina Miseq sequencing[J].Ann Microbiol,2016,66(3):1293-1301.
[17]胡晓龙,王康丽,余苗,等.浓香型酒醅微生物菌群演替规律及其空间异质性[J].食品与发酵工业,2020,46(10):66-73.
[18]MOENS F,LEFEBER T,DE VUYST L.Oxidation of metabolites highlights the microbial interactions and role of Acetobacter pasteurianus during cocoa bean fermentation[J].Appl Environ Microb,2014,80(6):1848-1857.
[19]栗连会,肖辰,陆震鸣,等.泸型酒发酵酒醅中乳酸菌群落的来源、演替规律及功能预测[J].食品与生物技术学报,2018,37(12):1242-1247.
[20]LI X R,MA E B,YAN L Z,et al.Bacterial and fungal diversity in the traditional Chinese liquor fermentation process[J].Int J Food Microbiol,2011,146(1):31-37.
[21]TANAKA K,TAJIRI S,SAWADA R,et al.Acid-tolerant lactic acid bacterium isolated from rice vinegar[J].Int J Res Appl Nat Soc Sci,2015,10(3):29-36.
[22]YANG X,TENG K,ZHANG J,et al.Transcriptome responses of Lactobacillus acetotolerans F28 to a short and long term ethanol stress[J].Sci Rep,2017,7(1):2650.
[23]SAKAMOTO N,TANAKA S,SONOMOTO K,et al.16S rRNA pyrosequencing-based investigation of the bacterial community in nukadoko,a pickling bed of fermented rice bran[J].Int J Food Microbiol,2011,144(3):352-359.
[24]WANG D,CHEN L,YANG F,et al.Yeasts and their importance to the flavour of traditional Chinese liquor: a review[J].J I Brewing,2019,125(2):214-221.
[25]LUZZINI G,SLAGHENAUFI D,PASETTO F,et al.Influence of grape composition and origin,yeast strain and spontaneous fermentation on aroma profile of Corvina and Corvinone wines[J].LWT-Food Sci Technol,2021,143.
[26]AMAYA D E J,HERRERA L,ARELLANO P A G.Performance evaluation of Pichia kluyveri,Kluyveromyces marxianus and Saccharomyces cerevisiae in industrial tequila fermentation[J].World J Microb Biot,2013,29(5):875-881.
[27]OUDE ELFERINK S J,KROONEMAN J,GOTTSCHAL J C,et al.Anaerobic conversion of lactic acid to acetic acid and 1,2-propanediol by Lactobacillus buchneri[J].Appl Environ Microb,2001,67(1):125-132.
[28]莫丽芬,陈少梅,宣泽义,等.同/异型乳酸菌对白酒糟发酵全混合日粮营养价值和发酵品质的影响[J].中国牛业科学,2021,47(4):1-4.
[29]李良,胡申才,杜艾明,等.一种扁平云假丝酵母及其分离培养方法和应用:CN113528359A[P].2021-05-25.