白酒是具有中国特色的蒸馏酒,有着悠久的历史,在几千年的酒文化中占有重要地位[1]。饮酒健康的研究由来已久[2],随着经济社会的不断发展,人们也越来越注重饮酒健康。部分研究表明饮酒会造成行为失调[3],适度饮酒能减少疾病风险[4],如心血管疾病[5]、老年痴呆[6]等,而过度饮酒会造成酒精性肝病等严重后果[7-9]。然而酒精相关伤害是世界范围内最常见的可预见的疾病来源之一,每年有330万人是由此而死亡的,占全球死亡人数的6%[10]。
人饮酒后,乙醇主要由胃和小肠吸收,但代谢的主要器官在肝脏[11]。乙醇代谢的主要机制是:乙醇由乙醇脱氢酶(alcohol dehydrogenase,ADH)氧化为乙醛,乙醛由乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)氧化为乙酸,最后进入三羧酸循环(tricarboxylic acid cycle,TAC)[11-12]。酒精性肝病的发病原因有很多,但首要原因是一次性摄入过多的乙醇后,会造成乙醛及乙醇次要代谢产物的积累,产生多种活性氧,导致脂质过氧化、线粒体中谷胱甘肽(glutathione,GSH)和S-腺苷蛋氨酸(S-adenosyl methionine,SAM)的消耗[13]。白酒中除了乙醇和水外,还有一部分微量成分(约2%)[14],因为对白酒的风味起决定作用而被称为风味成分。白酒中的风味成分不仅决定了白酒的口味,也对乙醇代谢有一定的影响。酒精摄入时总是伴随着这些风味成分,所以在研究乙醇代谢时不能忽视这些成分对乙醇代谢的影响。目前的研究主要通过建立配制酒与白酒醉度模型来研究不同香型白酒或不同醇酸酯比例对乙醇代谢的影响,白酒中的风味成分较多,配制酒并不能完全反映白酒中各种微量成分的相互作用。谢佳等[15]利用小鼠模型对关键微量成分缺失的配制酒进行醉度评价,发现异丁醇和异戊醇可增加醉度,是通过抑制ADH和ALDH活性而引起醉度升高。HUANGFU J等[16]利用小鼠急性酒精戒断模型,探讨白酒中主要风味成分与宿醉症状的关系,发现与酱香型白酒组的中毒症状比清香型白酒和浓香型白酒轻,并推断酱香味白酒中的风味化合物乙酸、乙酸乙酯、乳酸乙酯和1-丙醇在宿醉引起的醉酒行为中起主要作用。彭斌等[17]研究了白酒醇酸酯比率对小鼠酒后乙醇代谢的影响,结果表明异戊醇会抑制乙醇在体内代谢,抑制了乙醇脱氢酶和乙醛脱氢酶的活性,乙酸能较好的促进乙醇代谢,减缓其他组分对乙醇脱氢酶和乙醛脱氢酶活性的抑制作用。刘嫒春等[18]对不同产地的浓香型白酒采用增量法构建小鼠灌胃模型,灌胃白酒、高醇白酒、高酯白酒及同浓度的酒精溶液,测定其增量变化对于小鼠乙醇代谢的影响,发现增加白酒中大多数醇类和酯类含量均能抑制ADH和ALDH活性,增加丁酸乙酯含量可以同时促进ADH和ALDH的活性。本研究选取产自山西、重庆、云南的清香型白酒(编号为SX、CQ、YN)为研究对象,分别灌胃小鼠相同浓度乙醇、白酒、高醇白酒、高酯白酒,测定小鼠的行为指标、血液中乙醇和乙醛含量以及肝脏中乙醇脱氢酶(ADH)和乙醛脱氢酶(ALDH)活性,探究3种清香型白酒及其主要风味成分对乙醇代谢及其关键酶的影响,旨在为开发与设计健康白酒提供参考,并为科学饮用白酒提供指导。
1 材料与方法
1.1 材料与试剂
1.1.1 实验动物
无特定病原体(specific pathogen free,SPF)级的雄性昆明小鼠(许可证号为SYXK(川)2018-185),125只,体质量(20±2)g,饲养温度(20±2)℃,相对湿度(60±2)%,光照/黑暗周期为12 h,可自由获取蒸馏水和小鼠维持饲料):四川大学实验动物中心。本实验获四川大学生命科学学院伦理委员会批准(SCU221101001)。
1.1.2 实验酒样
大曲清香型白酒(编号为SX,酒精度66%vol):山西某酒厂;小曲清香型白酒(编号为CQ,酒精度52%vol):重庆某酒厂;小曲清香型白酒(编号为YN,酒精度50%vol):云南某酒厂。
1.1.3 化学试剂
乙醇(色谱纯):上海麦克林生化试剂有限公司;异丁醇、正戊醇、异戊醇、乙酸乙酯、丁酸乙酯、戊酸乙酯(均为色谱纯):天津精细化工研究中心;乙腈、叔丁醇、小鼠96T乙醇脱氢酶酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒、小鼠48T乙醇脱氢酶ELISA试剂盒、小鼠96T乙醛脱氢酶ELISA试剂盒、小鼠48T乙醛脱氢酶ELISA试剂盒:成都蓉辰嘉华生物科技有限公司;1 mL肝素钠抗凝管:湖南比克曼生物科技有限公司。
1.2 仪器与设备
GC911-III型气相色谱仪、WondaCapWAX色谱柱(30m×0.25 mm×0.25 μm):四川知本分析科技有限公司;PRACTUM224-1CN电子分析天平:北京赛多利斯科学仪器有限公司;F6/10-10G型FLUKO超细匀浆器:上海弗鲁克流体机械制造有限公司;Biofuge stratos台式高速冷冻离心机:美国赛默飞世尔科技公司;DZKW-4电子恒温水浴锅:北京中兴伟业仪器有限公司;SpectraMAX Plus384酶标仪:上海美谷分子仪器有限公司。
1.3 方法
1.3.1 实验分组
实验组:3种清香型白酒样品分为SX组、CQ组、YN组;将异丁醇、正戊醇、异戊醇、乙酸乙酯、丁酸乙酯、戊酸乙酯以1%(V/V)的添加量[19]分别添加到3种酒样中,充分摇匀,分别得到SX+异丁醇、SX+正戊醇、SX+异戊醇、SX+乙酸乙酯、SX+丁酸乙酯、SX+戊酸乙酯、CQ+异丁醇、CQ+正戊醇、CQ+异戊醇、CQ+乙酸乙酯、CQ+丁酸乙酯、CQ+戊酸乙酯、YN+异丁醇、YN+正戊醇、YN+异戊醇、YN+乙酸乙酯、YN+丁酸乙酯、YN+戊酸乙酯,共21组。
乙醇溶液组:将乙醇溶液的酒精度分别调整为66%vol、52%vol、50%vol,共3组。
空白组:蒸馏水,共1组。
1.3.2 实验动物饲养及灌胃
小鼠适应性饲养3 d后,随机分为空白组、乙醇溶液组、实验组,共25组,每组各5只。每天上午10点开始灌胃,每天灌胃1次,持续灌胃7 d,初始灌胃剂量为3 mL/kg体质量,每次增加1 mL/kg体质量,最后一次的灌胃剂量为10 mL/kg体质量,灌胃前称体质量,以调整灌胃剂量。实验期间小鼠自由饮水及摄食。
1.3.3 小鼠行为学测定
(1)旷场实验
聚乙烯塑料露天场地(100 cm×100 cm×40 cm),观察并记录小鼠在灌胃10 min内的站立次数和行走次数[19]。不同的组别之间用体积分数为75%乙醇擦拭实验装置,避免上一只小鼠残留的气味或分泌物等因素影响小鼠行为[20]。
(2)平衡木实验
一根水平木杆(60 cm×1 cm)悬挂在装有垫料的盒子上方50 cm处。在实验前一天,训练每只小鼠通过平衡木3次,如果小鼠不能走到另一端,可以轻推臀部或稍微扭动尾巴来诱导其移动。灌胃10 min后,将每只小鼠置于平衡木的一端观察其行为,并记录行走评分[21]。评分标准如下:顺利通过平衡木得1分,前肢或后肢滑落得2分,悬挂或抱住平衡木得3分,直接跌落得4分。
1.3.4 小鼠血液中乙醇、乙醛浓度的测定
小鼠血液中乙醇、乙醛浓度的测定采用气相色谱法。
样品前处理:小鼠第7天灌胃2 h后,采用摘眼球法取血,将血样置于肝素钠抗凝管中,5 000 r/min离心15 min后,收集500 μL上清液,加入叔丁醇(1 mg/mL,20 μL)和乙腈(1 mg/mL,480 μL),混合后10 000 r/min离心10 min,通过0.22 μm有机滤膜过滤。
气相色谱条件:GC911-III型气相色谱仪上配有Wonda Cap WAX色谱柱(30 m×0.25 mm×0.25 μm),检测器温度250 ℃,进样口温度250 ℃,柱流量1.5 mL/min,分流比1∶20,进样量为1 μL。柱温为程序升温,升温条件:烘箱温度最初为48 ℃,以3 ℃/min的加热速率升温至55 ℃,维持6 min,再以30 ℃/min的速率升温至200 ℃,维持2 min。
定性定量方法:配制乙醇、乙醛混合标准工作液,分别以乙醇、乙醛标准工作液质量浓度(x)为横坐标,峰面积(y)为纵坐标,绘制乙醇和乙醛标准曲线,按照标准曲线回归方程计算小鼠血浆中乙醇、乙醛质量浓度。
1.3.5 小鼠肝脏中ADH和ALDH活性的测定
小鼠肝脏中ADH和ALDH活性的测定采用酶联免疫吸附法测定[18]。小鼠取血后采用颈椎脱臼法处死。立即取出肝脏,用4 ℃生理盐水清洗,滤纸吸干后储存于-80 ℃,随后根据试剂盒的原理与方法采用双抗体夹心法检测小鼠肝脏中ADH和ALDH水平。
1.3.6 白酒中醇类、酯类物质的测定
3种清香型白酒酒样中代表性醇类、酯类物质含量采用气相色谱测定,结果见表1。气相色谱条件如下:CP WAX 57CB色谱柱(50 m×0.25 mm×0.20 μm),检测器温度250 ℃,进样口温度240 ℃,柱流量为2 mL/min,分流比为20∶1。程序性升温:烘箱温度最初为35 ℃,维持5 min后,以5 ℃/min的加热速率升温至90 ℃,维持7 min,再以10 ℃/min的速率升温至200 ℃,维持20 min。
表1 3种清香型白酒样品代表性醇类和酯类含量测定结果
Table 1 Determination results of representative alcohols and esters contents in 3 kinds of light-flavor Baijiu samples
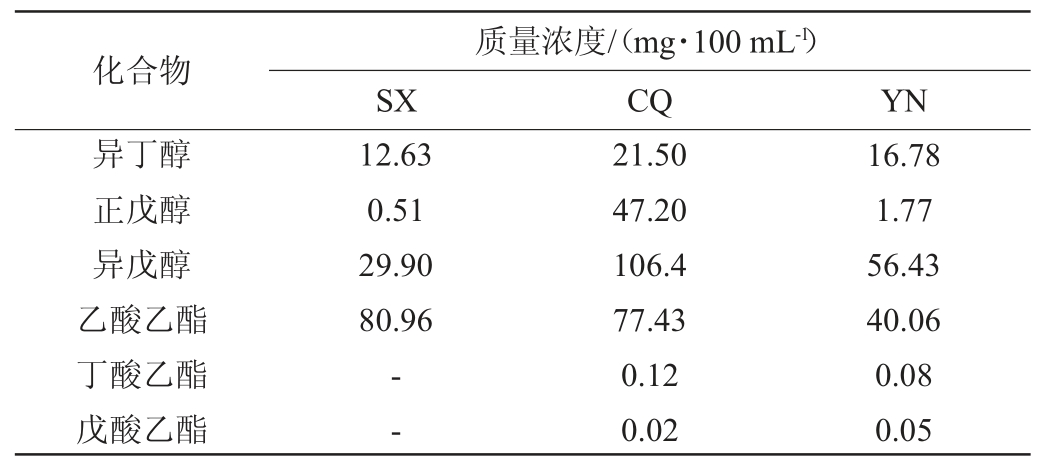
注:“-”表示未检出。
1.3.7 数据处理
所有实验结果均采用IBM SPSS Statistics 26.0软件分析,使用最小显著性差异(least significant difference,LSD)检验进行组间比较。P<0.05认为差异有统计学意义。使用Graphpad prism 8.0软件绘制数据图。
2 结果与分析
2.1 清香型白酒酒样中代表性醇类、酯类物质分析
由表1可知,白酒样品SX、CQ、YN分别检出4种、6种、6种代表性醇类和酯类,其中乙酸乙酯含量最高,含量分别为80.96 mg/100 mL、77.43 mg/100 mL和40.06 mg/100 mL,丁酸乙酯和戊酸乙酯在酒样SX中未检出。
2.2 小鼠行为学测定
旷场实验是用于检测小鼠在新异环境中的探索能力、运动能力及焦虑程度的行为学方法[22]。旷场实验的测定结果见图1。由图1可知,与空白组相比,3种清香型白酒和乙醇溶液组小鼠站立次数均增加。在3组酒样中,CQ组小鼠站立次数多且行走次数少,CQ+异丁醇、CQ+戊酸乙酯小鼠站立次数显著少于CQ组(P<0.05);CQ+异丁醇、CQ+乙酸乙酯、CQ+丁酸乙酯、CQ+戊酸乙酯组小鼠的行走次数显著多于CQ组(P<0.05)。
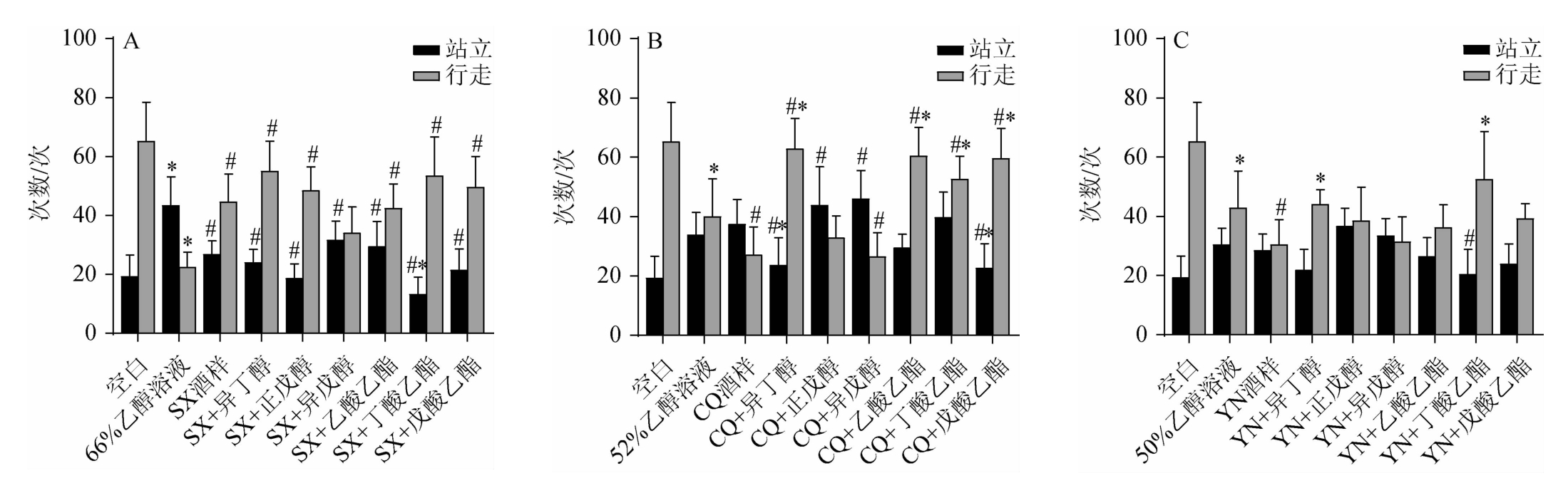
图1 小鼠旷场实验行为指标测定结果
Fig.1 Determination results of behavioral indicators of open field tests in mice
“#”表示与同浓度酒精溶液组相比有显著差异(P<0.05);“*”表示与同组原酒样相比有显著差异(P<0.05)。下同。
由表1可知,CQ酒样中异丁醇和异戊醇浓度明显高于另两种酒。结合相关研究[23],表明饮用异戊醇浓度高的白酒后,小鼠的自发行为受到影响,而饮用异丁醇浓度高的白酒后,小鼠过度兴奋,行走次数明显增加。SX组小鼠站立次数少于另两个酒样组和体积分数为66%乙醇溶液组,且体积分数为66%乙醇溶液组小鼠行走次数最低,表明乙醇对小鼠的活动和探索能力有一定的影响,而清香型白酒中的整体风味成分会减轻这种现象。
平衡木实验是评估小鼠肢体平衡以及肌肉运动协调能力的行为学方法,行走评分越高,共济失调现象越严重[24]。平衡木实验的测定结果见图2。由图2可知,与空白组相比,酒样组和乙醇溶液组均表现出轻微甚至明显的身体不协调。体积分数为66%乙醇溶液组小鼠行走评分最高,对小鼠的运动能力有明显的抑制作用,而SX组小鼠行走评分低于体积分数为66%乙醇溶液组和另两种酒样,表明高浓度的乙醇会引起共济失调,而SX酒样中的风味成分会减轻这种现象。SX酒样作为大曲清香型白酒,在口感、饮用舒适度方面都得到了酒行业的长期认可,酒中的微量成分已经是平衡的状态,所以向SX酒样中添加除丁酸乙酯外的风味成分均会使行走评分显著增加(P<0.05)。
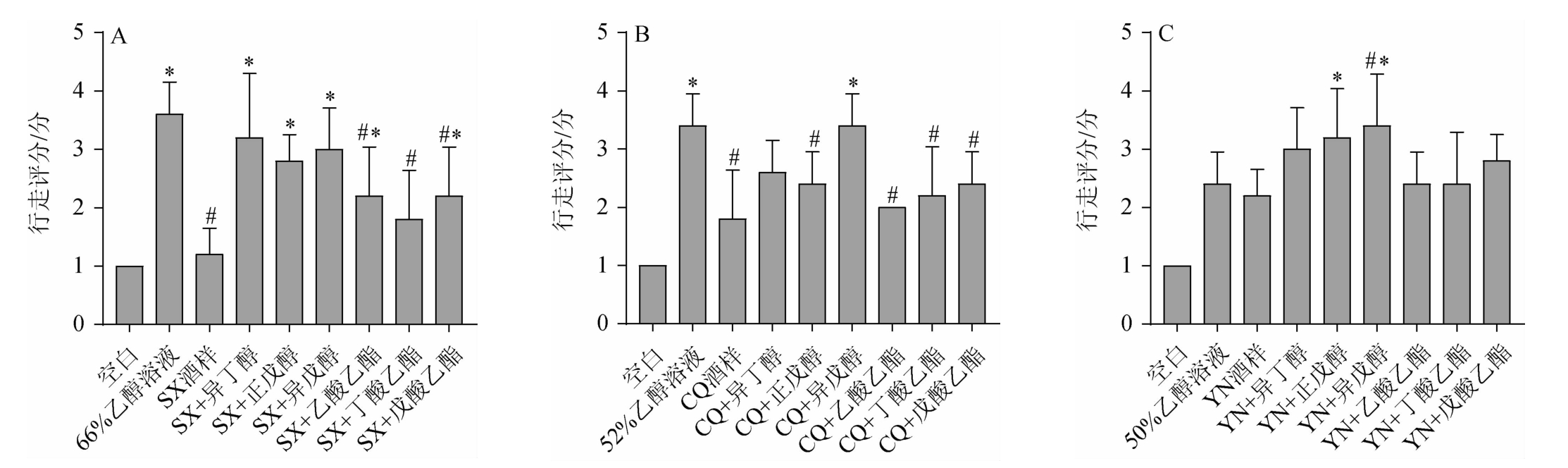
图2 小鼠平衡木实验行为指标测定结果
Fig.2 Determination results of behavioral indicators in balance beam tests in mice
CQ+异戊醇组造成的共济失调最严重,行走评分显著高于CQ组(P<0.05),这可能是因为向CQ酒样中加入1%(V/V)的异戊醇使得其浓度在酒样中过高。虽然YN酒样酒精度低,但酒体中的风味成分也对小鼠的平衡、运动能力的影响也是一个很重要的因素,所以YN组小鼠行走评分高于另两个组,且YN+正戊醇组、YN+异戊醇组小鼠行走评分显著高于YN酒样组(P<0.05)。三组实验组中,高醇酒样组小鼠行走评分均高于高酯酒样组,即增加酒样中酯类:异丁醇、正戊醇、异戊醇的浓度,能对小鼠造成更严重的共济失调。
2.3 小鼠血液中乙醇和乙醛含量的测定
小鼠血液中乙醇和乙醛含量测定结果见图3。由图3可知,饮酒2 h后,小鼠血液中的乙醇和乙醛浓度均高于空白组。乙醇质量浓度为5 257~10 656 mg/L,体积分数为66%乙醇溶液组小鼠血液乙醇浓度最高,SX组小鼠血液乙醇质量浓度显著低于66%乙醇溶液组(P<0.05),说明血液中乙醇浓度随酒精度的升高而增加,而清香型酒样中非乙醇的其他风味成分有利于乙醇代谢,减少血液中乙醇的积聚。SX组中,高醇酒样组小鼠血液乙醇浓度均高于SX组,其中增加SX酒样中异戊醇的浓度能明显增加血液乙醇浓度,而增加酯类物质,尤其是丁酸乙酯能明显降低血液乙醇浓度。CQ组中,高醇酒样组和高酯酒样组小鼠血液乙醇浓度均高于CQ酒样组,其中高醇酒样组作用更明显,尤其是CQ+异丁醇组、CQ+异戊醇组小鼠血液浓度显著高于CQ酒样组(P<0.05)。YN组中,增加YN酒样中正戊醇、异戊醇的浓度会使血液乙醇浓度高于YN酒样组,而增加异丁醇、乙酸乙酯、丁酸乙酯和戊酸乙酯的浓度会减少血液乙醇浓度。
由图3可知,血液中乙醛质量浓度为30~69 mg/L,在三种清香型白酒中,SX组小鼠血液乙醛浓度最高,增加SX酒样中异丁醇、丁酸乙酯、戊酸乙酯浓度能减少血液乙醛浓度。CQ组小鼠血液乙醛浓度最低,而体积分数为52%乙醇溶液组小鼠血液乙醛浓度高于另两个乙醇溶液组和CQ酒样组,说明体积分数为52%乙醇溶液抑制乙醛代谢,而同浓度的酒样能减弱这种抑制作用,增加CQ酒样中醇类和酯类物质的浓度,都会增加血液乙醛浓度,且酯类物质的影响更显著。YN组中,增加YN酒样中异丁醇、异戊醇、丁酸乙酯的浓度会减少血液乙醛浓度。

图3 小鼠血液中乙醇和乙醛质量浓度测定结果
Fig.3 Determination results of ethanol and acetaldehyde concentrations in mice blood
白酒会不同程度地增加血液中乙醇和乙醛的浓度,并且增加各风味成分浓度,对血液乙醇和乙醛的浓度也会产生不同的影响,其中对乙醇浓度的影响更大。尤其是SX+异戊醇组、CQ+异戊醇组、CQ+异丁醇组均会显著增加小鼠血液中乙醇浓度(P<0.05),表明在该酒样中增加这几种风味成分的浓度会抑制乙醇代谢的第一步,使得乙醇缓慢代谢为乙醛,从而导致血液中乙醇积累。SX+异戊醇组、CQ+乙酸乙酯组、CQ+丁酸乙酯组、CQ+戊酸乙酯组均会显著增加血液中乙醛浓度(P<0.05),表明在该酒样中增加这几种风味成分的浓度会抑制乙醛代谢反应,使得乙醛缓慢氧化为乙酸,造成乙醛积聚。
各酒样组中乙醇和乙醛的浓度均高于空白组,因此酒精的摄入,无论是常规酒还是高醇酒、高酯酒都引起了乙醇乙醛积聚。乙醛具有毒性[25],会让人产生恶心、头晕等反应[26];并且会阻止线粒体氧化,引发脂肪肝[27];还会与蛋白质[28]、脂质、脱氧核糖核酸(deoxyribonucleic acid,DNA)等[29]结合,造成各种损伤。相较于酒精溶液,三种清香型白酒都能缓解酒精毒性,相较于其余两种酒,向YN酒样中添加异丁醇、异戊醇、丁酸乙酯能促进这种缓解作用。
2.4 小鼠肝脏中ADH和ALDH活性的测定
小鼠肝脏中ADH和ALDH活性的测定结果见图4。由图4可知,与空白组小鼠相比,乙醇溶液组和实验组小鼠肝脏中的ADH浓度均高于空白组,可能是因为增加了底物乙醇的浓度,促进了反应的进行;而酒样组ADH活性均高于同浓度乙醇溶液组,说明乙醇能促进ADH活性,而酒中的风味成分能加强这种促进作用。
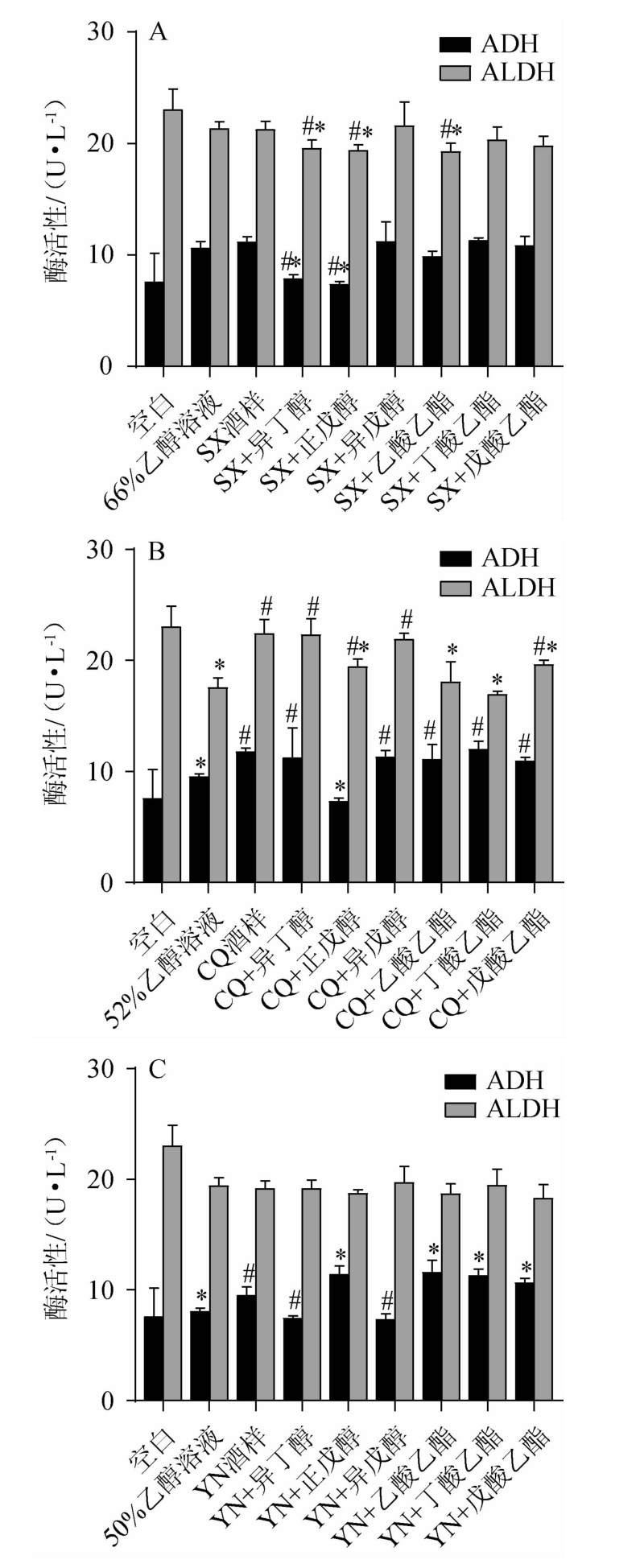
图4 小鼠肝脏中乙醇脱氢酶和乙醛脱氢酶活性测定结果
Fig.4 Determination results of alcohol dehydrogenase and aldehyde dehydrogenase activities in mice liver
由图4A可知,在SX组中,与体积分数为66%乙醇溶液相比,SX酒样促进肝脏中ADH的活性,SX+异戊醇组、SX+丁酸乙酯组小鼠肝脏中ADH活性稍高于SX酒样,而若SX酒样中存在高浓度的正戊醇和异丁醇时则会显著减少ADH的浓度(P<0.05)。由图4B可知,在CQ组中,与体积分数为52%乙醇溶液相比,CQ酒样显著促进小鼠ADH活性(P<0.05),增加CQ酒样中丁酸乙酯的浓度能促进ADH活性,而增加实验中另外五种风味成分的浓度后与原CQ酒样相比,均会抑制ADH活性,尤其是正戊醇,与酒样组相比酶活性受到显著抑制(P<0.05)。由图4C可知,在YN组中,与体积分数为50%乙醇溶液相比,YN组显著促进小鼠肝脏中的ADH活性(P<0.05),在YN酒样中加入正戊醇、乙酸乙酯、丁酸乙酯、戊酸乙酯均显著促进小鼠ADH活性(P<0.05),而增加异戊醇和异丁醇浓度会减弱原酒样对ADH的促进作用。
与空白组相比,乙醇溶液组和实验组小鼠肝脏中ALDH活性均受到抑制,只是抑制的程度有所差异。在SX组中,SX组小鼠与体积分数为66%乙醇溶液组小鼠ALDH活性相差不大,SX+异丁醇组、SX+正戊醇组、SX+乙酸乙酯组小鼠ALDH活性与SX酒样组相比均显著减弱(P<0.05),SX+异戊醇组小鼠肝脏中ALDH活性高于SX酒样组,但无明显差异(P>0.05)。在CQ组中,与体积分数为52%乙醇溶液相比,CQ组显著促进小鼠ALDH活性(P<0.05),在CQ酒样中增加实验中所用到的醇类和酯类均抑制ALDH活性,尤其是CQ酒样+正戊醇组,CQ酒样+乙酸乙酯组,CQ酒样+戊酸乙酯显著抑制(P<0.05)。在YN组中,与体积分数为50%乙醇溶液相比,YN酒样组轻微抑制小鼠肝脏中ALDH活性,在YN酒样中加入异丁醇、异戊醇和丁酸乙酯能增加ALDH浓度。
综上所述,与同浓度的乙醇溶液相比,三种清香型酒样会促进ADH活性,并且向酒样中加入少量醇类或酯类物质后,尤其是在体积分数为50%的YN酒样中加入正戊醇、乙酸乙酯和丁酸乙酯能加强其促进作用;而增加异丁醇浓度会减弱清香型白酒对ADH的促进作用。增加风味成分后的3种清香型白酒对ALDH的活性的影响并不明显,只在CQ酒样中增加正戊醇、乙酸乙酯、戊酸乙酯显著抑制ALDH活性(P<0.05)。由表1可知,CQ酒样的这三种化合物的成分高于其余两种酒,表明CQ酒样中高浓度的正戊醇、乙酸乙酯、戊酸乙酯能降低ALDH活性。
3 讨论
乙醇可以作为诱导剂诱导ADH活性的升高。有实验结果表明,长期摄入乙醇将导致肝细胞不同程度的病变,从而使肝细胞线粒体内的ADH和ALDH释放进入血液,用以氧化乙醇,造成肝脏和血液中的ADH活性增加[30]。但是当乙醇浓度持续增加时,ADH的活性反而下降,这是由于乙醇是一种化学试剂,对酶蛋白具有不可逆的抑制作用,而乙醇的氧化是一个可逆反应,所以ADH的活性同时也受到产物(烟酰胺腺嘌呤二核苷酸的还原态(nicotinamide adenine dinucleotide,NADH)及乙醛的抑制作用[31]。
虽然ADH氧化乙醇为乙醛,给ALDH提供了底物,但同时也导致NADH/烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)的比值增高,使得依赖NAD+的ALDH活性受到抑制[31-32]。在乙醇代谢时,由ADH和ALDH所决定的代谢速率是最关键的,因此在选择风味成分的时候,最好选择对两种酶同时具有促进作用的成分,使两种酶协调反应,或是选择对ALDH活性促进作用强的成分,避免乙醇代谢过程中有害产物乙醛的积聚。
在课题组前期研究中[18],采用同样的处理方法向小鼠灌胃相同剂量的浓香型白酒,高醇浓香型白酒和高酯浓香型白酒。灌胃浓香型白酒和清香型白酒对小鼠的自发活动行为以及探索行为的影响几乎一致,向这两种不同香型的白酒中添加异戊醇均会使小鼠站立次数增加,添加异丁醇均会导致小鼠过度兴奋,行走次数增加。与清香型白酒不同的是,浓香型白酒会导致小鼠共济失调,相同的是增加两种酒中醇类和酯类的浓度均会加重共济失调现象。
而通过检测小鼠灌胃2 h后血液中乙醇和乙醛的浓度,肝脏中ADH和ALDH活性发现,浓香型白酒中的风味成分会影响乙醇代谢,使得白酒组的血液乙醇浓度高于同浓度乙醇溶液组,清香型酒样中非乙醇的其他风味成分却有利于乙醇代谢,减少血液乙醇浓度。且与同浓度乙醇溶液相比,浓香型白酒会抑制ADH和ALDH活性,增加醇类和酯类物质后会加强抑制作用,而清香型白酒却会促进ADH活性,抑制ALDH活性,清香型白酒中高浓度的正戊醇、乙酸乙酯、戊酸乙酯能降低ALDH活性。
4 结论
本研究使用增量法来控制白酒风味成分的变化,从整体的层面来研究风味成分变化对乙醇代谢相关酶的影响。结果表明,增加三种清香型白酒中异戊醇浓度会使血液乙醇含量升高,向SX酒样和YN酒样中加入异丁醇、丁酸乙酯、戊酸乙酯会减少血液乙醛浓度。增加CQ酒样中醇类和酯类物质的浓度,都会增加血液乙醛浓度。因为底物浓度的增加,乙醇溶液组和酒样组都能促进ADH活性,且酒体中存在的风味成分能加强这种促进作用,向酒样中加入不同的醇类和酯类对酶活性有不同的影响。而乙醇溶液组和实验组小鼠肝脏中ALDH活性均受到抑制,CQ酒样中高浓度的正戊醇、乙酸乙酯、戊酸乙酯能降低ALDH活性。随着研究的不断深入,白酒中越来越多的微量成分被检测出,而微量成分的产生、代谢机制及其与人体健康的关系仍然是亟待解决的科学问题。
[1]刘丽莎.中国白酒国际竞争力提升策略研究[D].天津:天津商业大学,2021.
[2]李安军.文明饮酒健康生活[J].食品科学技术学报,2020,38(5):10-13,40.
[3]刘雅,皇甫洁,何松贵,等.影响广东米香白酒饮后代谢与舒适度的关键酒体风味成分研究[J].中国酿造,2022,41(9):105-110.
[4]TANASESCU M,HU F B.Alcohol consumption and risk of coronary heart disease among individuals with type 2 diabetes[J].Curr Diabet Rep,2001,1(2):187-191.
[5]KWON I,JUN D W,MOON J.Effects of moderate alcohol drinking in patients with nonalcoholic fatty liver disease[J].Gut Liver,2019,13(3):308-314.
[6]REAS E T,LAUGHLIN G A,KRITZ-SILVERSTEIN D,et al.Moderate,regular alcohol consumption is associated with higher cognitive function in older community-dwelling adults[J].J Prevent Alzheimer's Dis,2016,3(2):105-113.
[7]KLARICH D S,BRASSER S M,HONG M Y.Moderate alcohol consumption and colorectal cancer risk[J].Alcoholi Clin Exp Res,2015,39(8):1280-1291.
[8]BAJAJ J S.Alcohol,liver disease and the gut microbiota[J].Nat Rev Gastroenterol Hepatol,2019,16(4):235-246.
[9]黄宜辉,何建辉,蔡乐,等.过量饮酒行为的影响因素分析[J].昆明医科大学学报,2016,37(9):53-57.
[10]STRKEL P.Host factors in dysregulation of the gut barrier function during alcohol-associated liver disease[J].Int J Mol Sci,2021,22(23):12687.
[11]PLAWECKI M H,CRABB D W.Chapter 4-Metabolism[M]//SULLIVAN E V,PFEFFERBAUM A.Handbook of Clinical Neurology.Elsevier,2014:55-69.
[12]LAI C,LI Y,LIU C,et al.Inhibition of human alcohol and aldehyde dehydrogenases by cimetidine and assessment of its effects on ethanol metabolism[J].Chem Biol Int,2013,202(1-3):275-282.
[13]曾赏,李三强,李前辉.酒精性肝病的研究进展[J].世界华人消化杂志,2022,30(12):535-540.
[14]郭学武,范恩帝,马冰涛,等.中国白酒中微量成分研究进展[J].食品科学,2020,41(11):267-276.
[15]谢佳,彭斌,何松贵,等.白酒关键微量成分对醉度及小鼠乙醇代谢和急性酒精性肝损伤的影响[J].中国酿造,2018,37(6):155-160.
[16]HUANGFU J,LU J,LI C,et al.Evaluating and forecasting the associated main flavor components in Baijiu(Chinese distilled spirits)with alcohol metabolism and hangover symptoms through mice acute withdrawal model[J].Food Sci Nutr,2023,11(1):334-343.
[17]彭斌,张敬媛,何松贵,等.白酒醇酸酯比率对小鼠酒后乙醇代谢及行为能力的影响[J].中国酿造,2022,41(1):103-108.
[18]刘嫒春,曾礼兰,方帅,等.浓香型白酒风味成分对乙醇代谢及关键酶活性影响的体内实验研究[J].中国酿造,2022,41(6):122-128.
[19]HOLZER P,PAINSIPP E,WULTSCH T,et al.Gastritis,causes acid hypersensitivity and gender-related changes in circulating corticosterone and anxiety-related behavior of mice[J].Gastroenterology,2006,130(4):A443.
[20]ZHU M,CHEN P,HU X,et al.Rapid determination of pit mud moisture content using hyperspectral imaging[J].Food Sci Nutr,2020,8(1):179-189.
[21]CRABBE J C,METTEN P,YU C H,et al.Genotypic differences in ethanol sensitivity in two tests of motor incoordination[J].J Appl Physiol,2003,95(4):1338-1351.
[22]周正,宋美慧,褚光辉,等.GABA_B受体激动剂巴氯芬对小鼠空间识别记忆能力的影响[J].生命科学研究,2022,26(3):213-218.
[23]格绒泽仁,皇甫洁,韩兴林,等.浓香型白酒饮后不适感关键高级醇类物质关联性判定新方法[J].食品与发酵工业,2019,45(14):191-195.
[24]赵婉妤,胡力文,吕鑫,等.白酒饮用舒适度动物评价模型优化的研究[J].中国酿造,2021,40(1):55-58.
[25]AIDA J,YOKOYAMA A,HARA S,et al.Telomere shortening in the oral epithelium in relation to alcohol intake,alcohol dehydrogenase(ADH-1B),and acetaldehyde dehydrogenase (ALDH-2) genotypes and clinicopathologic features[J].J Oral Pathol Med,2020,49(1):82-90.
[26]蒋洋,张翠英,李于,等.酒类风味物质对人体乙醇代谢影响的研究进展[J].食品科学,2021,42(15):242-250.
[27]闫婷婷.基于线粒体损伤的乙醛神经细胞毒性机制研究[D].哈尔滨:哈尔滨工业大学,2020.
[28]GARAYCOECHEA J I,CROSSAN G P,LANGEVIN F,et al.Alcohol and endogenous aldehydes damage chromosomes and mutate stem cells[J].Nature,2018,553(7687):171.
[29]徐静宜.一种高表达乙醛脱氢酶植物乳杆菌的筛选、驯化及初步应用[D].合肥:安徽农业大学,2021.
[30]宋宇.生物体内乙醇脱氢酶(ADH)的活力测定、分布及其与乙醇代谢动力学的关系[D].成都:四川大学,2007.
[31]王国祥,程云友,李军,等.乙醇对胃乙醇脱氢酶活性变化的影响[J].临床消化病杂志,2001(4):158-160.
[32]LE DARE B,LAGENTE V,GICQUEL T.Ethanol and its metabolites:update on toxicity,benefits,and focus on immunomodulatory effects[J].Drug Metab Rev,2019,51(4):545-561.
[33]CENI E,MELLO T,GALLI A.Pathogenesis of alcoholic liver disease:Role of oxidative metabolism[J].World J Gastroenterol,2014,20(47):17756-17772.