牡蛎肉味道鲜美,富含蛋白质及牛磺酸、锌、硒,人体必需的8种氨基酸及多种功能性成分,是我国首批列为药食同源的保健疗效食品之一,具有良好的食用价值和保健作用。其高含量的牛磺酸被认为有益智健脑、降脂减肥、促进胆固醇分解,丰富的糖原物质、矿物质等具有醒酒、保肝、降压等作用[1-2],目前国内外已开发数千种关于牡蛎的保健产品。
将分子生物技术应用于牡蛎加工,获得的牡蛎肽较牡蛎蛋白具有更好的理化特性:分子质量小,可直接被小肠吸收;渗透压低,不容易引起腹泻;与蛋白相比更不容易引起致敏;完全保留了微生物、矿物质元素等营养物质。近几年关于牡蛎的研究大多数集中在其酶解产物,牡蛎肽被认为具有多重生物活性,如抗氧化剂、抗菌、抗高血压、抗炎、抗癌、抗疲劳、抗凝血等[3-9]。MIAO J Y等[9]用复合蛋白酶水解牡蛎肉并用6 kDa超滤膜过滤后得到牡蛎水解液(oyster hydrolysate,OH)-I(<6 kDa),通过考察小鼠游泳时间发现,OH-I活性最强,与对照组相比,OH-I显著延长了游泳时间(67.79%),提高了肌糖原(45.65%)和肝糖原(49.01%)含量,降低了血尿素氮(blood urea nitrogen,BUN)含量(18.44%)(P<0.05),同时表现出良好的化学抗氧化活性和细胞抗氧化活性。ASHA K K等[10]对牡蛎酶解并提取得到抗氧化肽。另外,牡蛎酶解产物对缓解勃起功能障碍也有显著作用[11]。虽然牡蛎蛋白水解物具有较高的生物活性和优异的性能,但由于风味呈现更多的海产腥味及不稳定性,其在食品中的应用仍然受到限制。
发酵食品可有效改善感官特性,从而增强食品的可食用性。酿酒酵母等微生物最常用于食品发酵,在以往的研究中报道,可将鱼腥味和土腥味转化为良好的风味[12-13]。转化途径主要是还原脱氢、脱甲酰化和酯化[13-14]。糖作为微生物的主要能量来源,直接影响微生物的发酵过程。关于不同的糖会导致微生物的生物活性产生差异,进而影响风味物质的形成的研究很少。因此,本实验选择在酵母菌发酵牡蛎酶解液(oyster enzymatic hydrolysate,OEH)处理过程中分别添加3种不同的糖,以期开发更好的风味产品,为后续开发以牡蛎为原料的发酵产品提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
太平洋牡蛎:山东省乳山市。
1.1.2 菌株
商业高温酿酒活性干酵母:安琪酵母股份有限公司。
1.1.3 主要试剂
果糖、D-无水葡萄糖(下文简称葡萄糖)、麦芽糖:美国Sigma公司;复合蛋白酶(10 U/mg):北京索莱宝科技有限公司;正构烷烃(C10~C25)、17种氨基酸混标(CDAA-M-270030-XZ-1mL):上海安谱实验科技股份有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
SEVEN EXCELLENCE pH计、ME2002E电子天平:梅托勒-托利多仪器上海有限公司;2020NX气相色谱-质谱联用(gas chromatography-mass spectrometer,GC-MS)仪、75 μm CAR/PDMS固相微萃取针:美国Superlco公司;LC-20AT高效液相色谱(high performance liquid chromatography,HPLC)仪:日本岛津公司;BJPX-200电热恒温培养箱:山东博科科学仪器有限公司;5804R台式高速离心机:德国Eppendorf公司;样品顶空瓶(20 mL):上海安捷伦科技有限公司。
1.3 试验方法
1.3.1 牡蛎酶解液及发酵液处理
OEH制备:取风干牡蛎粉碎后按照1∶10(g∶mL)的比例加水溶解,添加4 U/mL牡蛎液体的复合蛋白酶在50 ℃条件下酶解120 min,然后95 ℃灭酶处理15 min,离心、过滤(0.22 μm)得到牡蛎酶解液。
牡蛎酶解液发酵液(下文简称发酵液)制备:取一定量的牡蛎酶解液,分别按照0.1 g/mL添加量加入的果糖、葡萄糖、麦芽糖,再加入牡蛎酶解液体积分数6%的酵母活化液(活性干酵母添加10倍体积水,38 ℃活化30 min),用0.02 mol/L盐酸溶液调节pH值至5.4。放置于电热恒温培养箱中35 ℃条件下发酵6 d,置于4 ℃冰箱保藏备用。
1.3.2 测定方法
pH值测定:取5 mL样品,pH计在室温条件下测量pH值。总酸含量测定参照GB/T 12456—2021《食品中总酸的测定》中的pH计电位滴定法。有机酸含量测定参考HUANG T等[15]的方法并略有调整。高效液相色谱法具体如下:Waters AtlantisT3色谱柱(4.6 mm×250 mm,5 μm)。流动相为20 mmol/L NaH2PO4(pH 2.7),流速0.6 mL/min,柱温45 ℃,进样量10 μL,检测波长210 nm。游离氨基酸含量测定参考YANG Y等[16]的方法并略有调整。以10%三氯乙酸(trichloroacetic acid,TCA)稀释发酵液样本,TCA终体积分数为5%。过滤衍生化后以正己烷萃取,得到下层液体用Athena AAA专用柱(250 mm×4.6 mm,5 μm)对游离氨基酸含量进行分析。
1.3.3 牡蛎酶解液及发酵液挥发性成分测定及气味活度值
取发酵液1 mL,加入8 μL 2-辛醇(内标,0.082 2 μg/mL),5 g氯化钠待测;取牡蛎酶解液5 mL,加入8 μL 2-辛醇(0.082 2 μg/mL),5 g氯化钠待测。采用顶空固相微萃取法-气质联用技术(headspace solid-phase micro-extraction-GCMS,HS-SPME-GC-MS)测定。
GC条件:Hp-innovax(0.25 mm×0.25 μm,60 m)色谱柱;载气为高纯氦气(He)(99.999%),流量1 mL/min,不分流;氢气流速30 mL/min;空气流速450 mL/min;气化室温度250 ℃;检测器温度250 ℃;进样量为1 μL;电子电离(electron ionization,EI)源;离子源温度230 ℃;扫描范围20~450 eV,检测电压350 V,60 ℃条件下预热10 min,然后60 ℃条件下保持30 min。程序升温为40 ℃保持2 min;以5 ℃/min升至160 ℃,保持2 min;以10 ℃/min升至250 ℃,保持5 min。
MS条件:质谱接口温度为280 ℃,离子源温度为230 ℃,电子电离(EI)源,电子能量70 eV,扫描范围为30~350 m/z。
定性定量方法:检测出的未知化合物经计算机检索与美国国家标准技术研究所(national institute of standards and technology,NIST)library 2020匹配并选择匹配度>80%的物质作为有效成分,并结合保留指数(retention index,RI)进行筛选;以2-辛醇(0.082 2 μg/mL)为内标按照内标法计算相应物质浓度。
通过计算气味活性值(odor activity value,OAV)来评估每种化合物对发酵液整体香气的贡献。
1.3.4 数据处理
所有实验重复3次,结果以“平均值±标准差”表示。采用Origin 8.5软件对数据进行处理并绘制图形,主成分分析(principal components analysis,PCA)采用SIMCA-P软件(14.1,Umetrics,Umea)进行。
2 结果与分析
2.1 pH值和总酸含量变化
酸度和pH值的主要作用是使发酵液具有微生物稳定性,同时保存发酵液的颜色和感官特性[17]。添加不同种类糖的牡蛎酶解液发酵过程中pH及总酸含量的变化见图1。
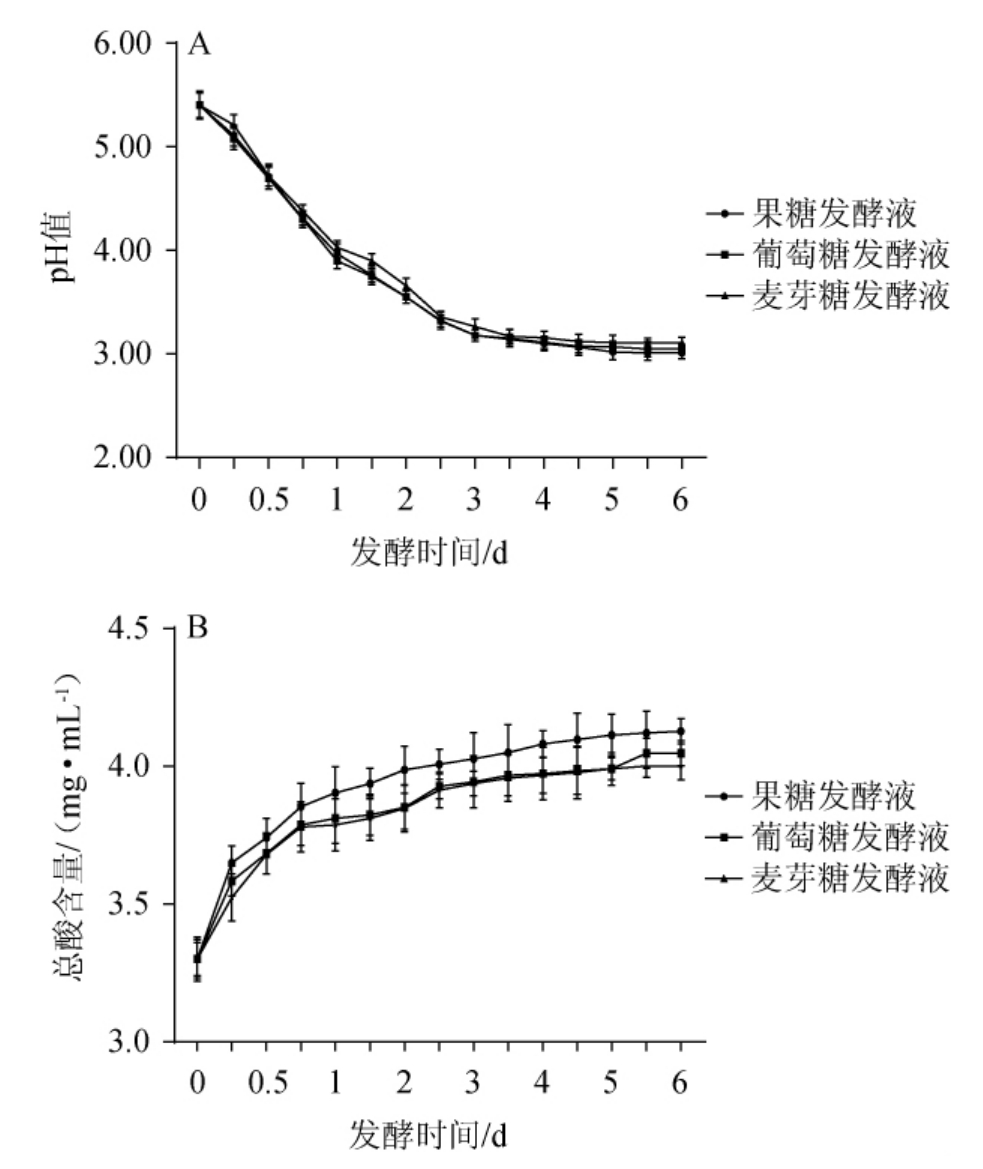
图1 添加不同种类糖的牡蛎酶解液发酵过程中pH(A)及总酸含量(B)变化
Fig.1 Changes of pH (A) and total acid content (B) of oyster enzymatic hydrolysate with different kinds of sugar during the fermentation process
由图1可知,添加不同种类糖的牡蛎酶解液发酵过程中pH及总酸含量变化规律基本一致,随着发酵时间的延长,pH不断降低,总酸含量不断上升,该趋势与SUN X Y等[18]的研究结果一致。添加麦芽糖发酵速率最快,添加果糖发酵速率次之,添加葡萄糖最慢;在发酵前24 h内,添加果糖的发酵液pH显著降低(P<0.05),由5.40±0.12降至3.97±0.10,总酸含量由(3.30±0.06)mg/mL增至(3.90±0.09)mg/mL。添加不同种类糖的牡蛎酶解液随发酵时间的延长,pH不断降低并逐渐稳定在3.01±0.06~3.11±0.06;总酸由(3.30±0.06)~(3.30±0.08)mgmL上升至(4.00±0.05)~(4.13±0.04)mg/mL。pH值越低,发酵液对微生物腐败的敏感性越低,酸度的影响因素包括底物品种、温度、湿度等因素。酵母菌属于兼性厌氧菌,在发酵过程中会产生乳酸、酒石酸等有机酸物质;同时牡蛎小肽及蛋白质被消耗的过程产生游离氨基酸,都对环境pH起到降低的作用。到了发酵后期,由于代谢产物及营养物质等的抑制作用,菌种发酵逐渐趋于稳定,pH值及总酸变化较小。
2.2 有机酸含量分析
牡蛎中风味成分的构成和含量的差异性导向了特征滋味的不同,一般来说,游离氨基酸及甜菜碱、琥珀酸等物质对贝类产品的风味起到主要作用。发酵液中的有机酸对风味、稳定性和品质有显著影响,并影响其pH值和可接受性。发酵液中苹果酸和乳酸含量较为丰富,可能与酿酒酵母(Saccharomyces cerevisiae)中 的γ-氨基丁酸(γaminobutyric acid,GABA)分流通路有关。在酵母中,GABA 可被GABA 转氨酶分解为琥珀酸半醛(succinic semialdehyede,SSA),然后将SSA转化为琥珀酸,进而进入三羧酸(tricarboxylic acid,TCA)循环。琥珀酸经一系列催化反应生成苹果酸。同时苹果酸可以提供一种令人愉悦的酸味。乳酸作为发酵的最主要的非挥发性酸之一,含量仅次于乙酸,并以柔和的酸感有效调和发酵液口感。
添加不同种类糖的发酵液中有机酸含量比较见图2。由图2可知,3种糖对于发酵液的有机酸含量有显著影响(P<0.05),发酵后4种有机酸较发酵前均有不同程度的下降。添加果糖的发酵液中酒石酸含量、苹果酸含量及乳酸含量显著高于其他两组(P<0.05),添加葡萄糖、麦芽糖的发酵液有机酸含量比较接近。添加麦芽糖、葡萄糖的发酵液以苹果酸为优势酸,添加果糖的发酵液以乳酸为优势酸,添加葡萄糖、麦芽糖处理的发酵液酒石酸均较低。在低酸性发酵液中,酒石酸作为常见的pH调节剂,酵母菌和酿酒细菌代谢相对困难,而其他有机酸则可以通过适当的调节及改性对酿酒产生较好的影响[19]。
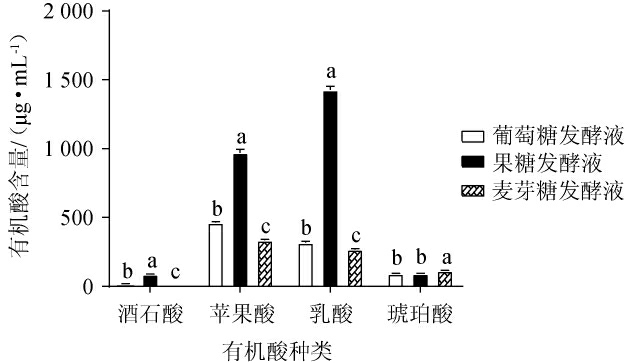
图2 添加不同种类糖的发酵液有机酸含量分析
Fig.2 Analysis of organic acids contents in fermentation broths with different kinds of sugar
不同小写字母表示差异显著(P<0.05)。
2.3 游离氨基酸含量分析
添加不同种类糖的发酵液和OEH中17种游离氨基酸含量分析见表1。由表1可知,除Tyr、Pro、His、Arg、Cys-Cys外,其余氨基酸几乎全部消耗;Asp、Glu、Ser、Gly、Tyr、Ala、Pro、Lys、Ile、His、Val、Arg在3种发酵液间存在显著差异(P<0.05)。葡萄糖处理的总氨基酸含量(totalaminoacidcontents,TAAC)最高,比OEH高4.05%,但添加另两种糖的游离氨基酸总量低于OEH。精氨酸是所有发酵液中的主导氨基酸,且高于OEH(P<0.05)。在OEH和添加麦芽糖的发酵液中苏氨酸(Thr)含量均低于检出限,而添加葡萄糖和果糖的发酵液中苏氨酸含量显著升高。
表1 添加不同种类糖的发酵液与牡蛎酶解液氨基酸含量分析
Table 1 Analysis of amino acid contents of fermentation broths with different kinds of sugar and oyster enzymatic hydrolysate
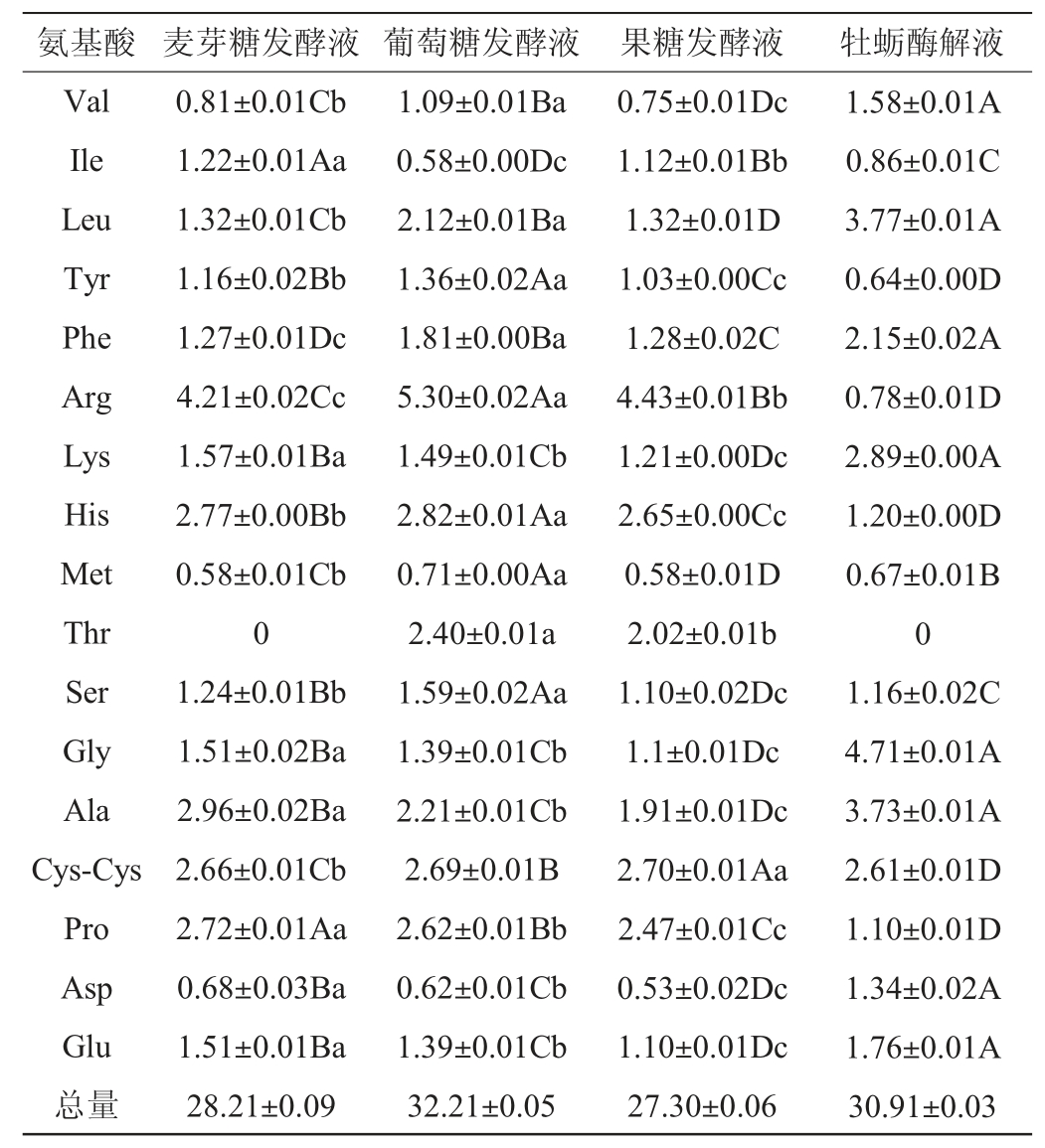
注:同列肩不同大写字母表示牡蛎发酵液与3种糖处理发酵液的差异显著(P<0.05),小写字母表示3种糖处理发酵液的差异显著(P<0.05)。
在相同的氮源和接种顺序背景下,三种糖类所反映的碳源差异可能是导致氨基酸含量差异的原因。此外,氨基酸也是酵母生长所需的氮源。一种普遍接受的观点认为,内源性蛋白酶启动蛋白质水解,而微生物酶可以影响香气化合物的形成[20]。
2.4 挥发性风味物质分析
2.4.1 GC-MS数据分析
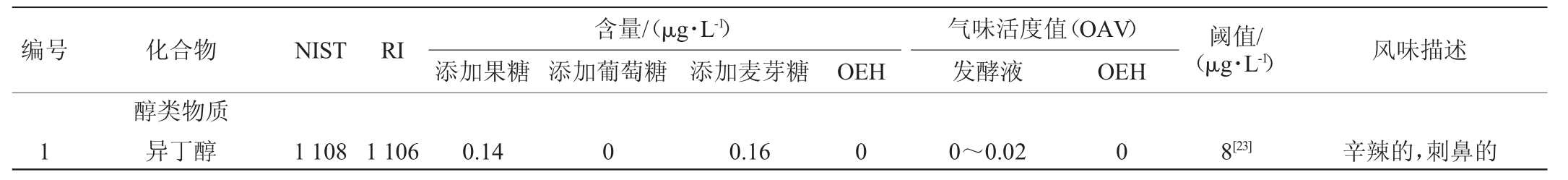
风味被认为是发酵饮料的主要特征之一,而挥发性物质的种类和含量对风味有很大的影响[21]。添加不同种类糖的发酵液及OEH的挥发性风味物质GC-MS分析结果见表2。由表2可知,分别添加3种糖的发酵液及OEH中共检测出41种挥发性化合物,包括15种醇类、5种酯类、7种醛类、10种酸类、1种酮类、3种其他类。为进一步比较发酵液中香气成分的影响,对风味物质的阈值进行分析。一般OAV>1的挥发风味成分比较容易被察觉到。而0.1<OAV<1的物质一般认为对风味具有一定的贡献。OEH中OAV>1的挥发性物质大部分是醛类,如(E,Z)-2,6-壬二烯醛(27 400)、2-壬烯醛(8 687.5)辛醛(521.67)及醇类物质,如1-辛烯-3-醇(155.71)、2-辛烯-1-醇(8.74),而经过糖处理的发酵液的OAV>1的挥发性物质主要体现为酯类物质,乙酸乙酯、辛酸乙酯、乙酸苯乙酯等,它们主要贡献了花香和果香;甜味剂果香的辛酸;麦芽糖味为主的异戊醇,醛类物质的OAV显著降低(P<0.05),说明经过发酵处理的酶解液风味有效改善了醛类物质呈现的土腥味、油脂味。3种糖处理发酵液的风味呈现差异明显,但都在不同程度降低了土腥味等不良风味。醇类物质由于含有较高的感知阈值,一般对风味的贡献较小,但其作为载体物质或者脂类物质的前体仍会影响风味[22]。
由表2亦可知,3种糖发酵后挥发性物质数量差异明显。牡蛎本身风味体现为鲜味及腥味、土腥味、油脂味,具体风味物质为醛类物质如戊醛、己醛、庚醛、(E)-2-庚烯醛、苯甲醛、癸醛、壬醛、辛醛、(Z)-2-癸烯醛等[22]。酶解液中大量存在的戊醛、庚醛及2-己烯醛、反-2-庚烯醛等的含量发酵后大幅度减少;同时,发酵液中出现高级芳香烃醛。发酵后产生了更多的醇(如苯甲醇、苯乙醇、月桂醇)。葡萄糖处理液中的醇类物质最丰富。此外,在酯类成分上,发酵液和酶解液也存在较大的差异,己酸乙酯、庚酸乙酯、辛酸乙酯、肉豆蔻酸异丙酯等多种酯类在发酵液中出现,棕榈酸乙酯在OEH中的含量为0.05 ng/mL,在添加葡萄糖、麦芽糖的发酵液中含量增加,在添加果糖的发酵液中,含量出现小幅度减少。添加麦芽糖的发酵液中己酸乙酯含量较高。OEH与添加果糖处理无显著差异(P>0.05),葡萄糖处理和麦芽糖处理显著增加了酸类风味物质(P<0.05),如庚酸、壬酸、癸酸、9-癸烯酸月桂酸等物质。这些差异表明,不同种类的糖对于风味物质的产生有一定的影响。
表2 添加不同种类糖的发酵液及牡蛎酶解液挥发性风味物质GC-MS分析结果
Table 2 Analysis results of GC-MS for volatile flavor compounds of fermentation broths with different kinds of sugar and oyster enzymatic hydrolysate
续表
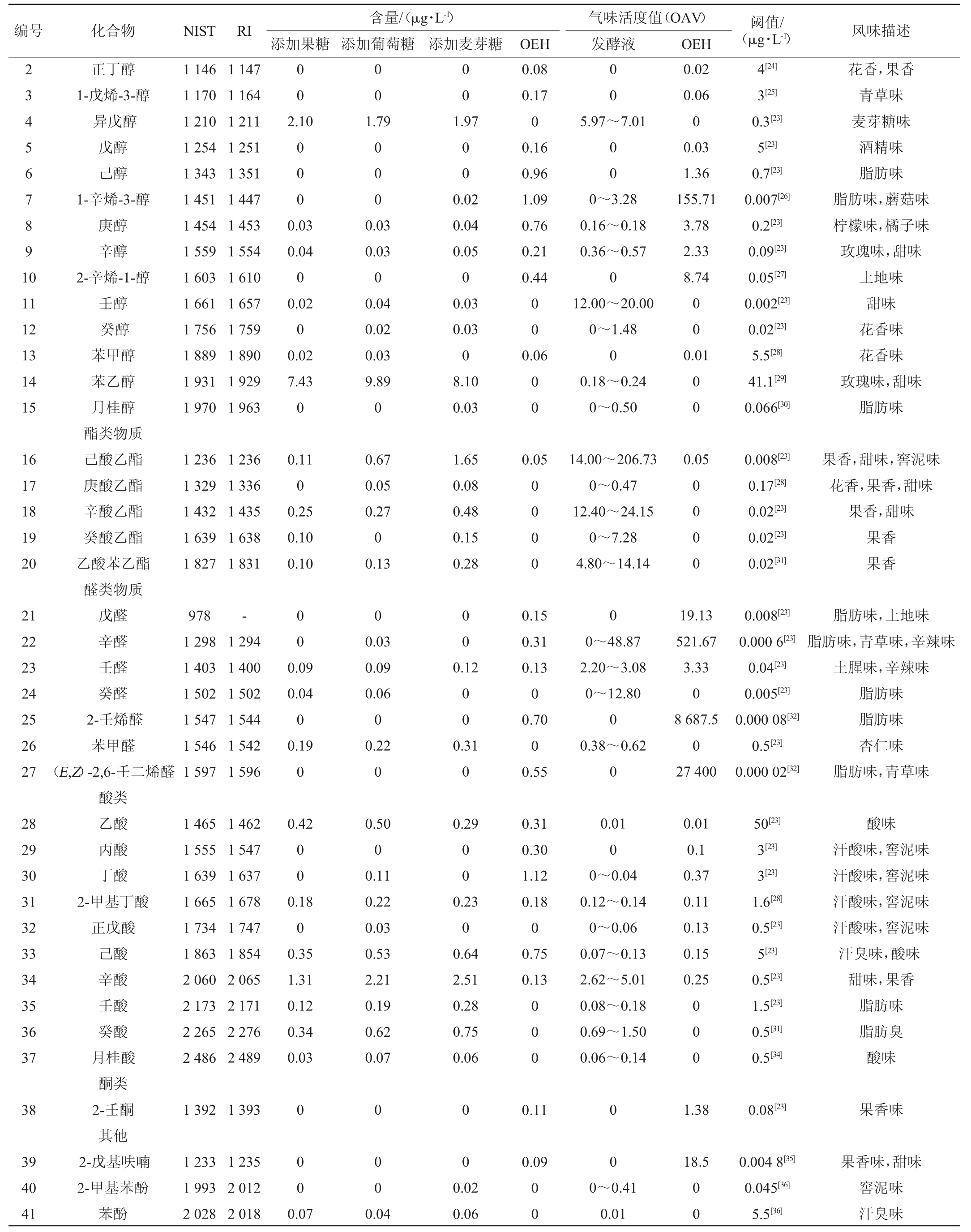
注:风味描述来自http://www.thegoodscentscompany.com/search2.html。
2.4.2 挥发性风味物质主成分分析
由图3可知,PC1和PC2的总贡献率为90.2%,说明通过PCA将数据降维后可得到PC1和PC2变量的得分矩阵,并且保留了图谱90.2%的信息。OEH位于PC1的左侧,与2-壬烷酮、2-戊基呋喃、(E)-2-壬烯醛、(E,Z)-2,6-壬二烯醛、辛烷、丙酸、丁酸以及1-丁醇、1-戊醇、1-己醇、1-辛烷-3-醇、1-庚醇、1-辛烷、2-辛烷-1-醇等8种醇呈较强的负相关关系。果糖和葡萄糖处理发酵液与癸醛和醋酸的反应呈强负相关,从3种糖处理的发酵液样品之间的距离判断,麦芽糖处理的发酵液在风味差异上可以和另外2种糖处理发酵液进行区分。
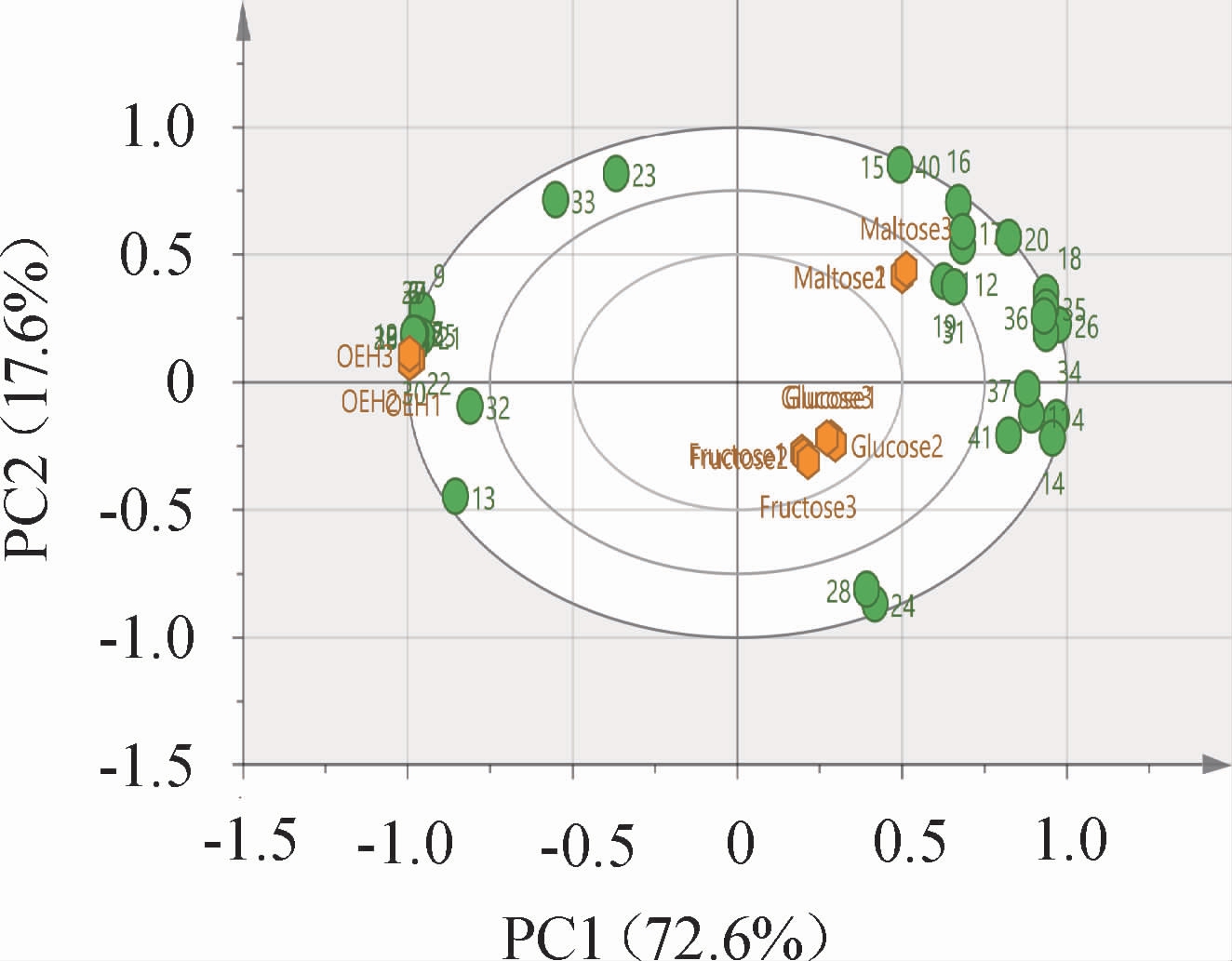
图3 添加不同种类糖的发酵液及牡蛎酶解液挥发性风味物质的主成分分析结果
Fig.3 Principal components analysis results of fermentation broths with different kinds of sugar and oyster enzymatic hydrolysate
2.5 讨论
通过对3种糖处理发酵液的理化性质和风味进行了研究,糖作为酒精发酵的底物,酵母将糖转化为乙醇和其他副产物。大多数酵母在高温条件下对葡萄糖表现出稍高的偏好,但一些酵母物种,如星状念珠菌(Candida stellate)和拜耳接合酵母(Zygosaccharomyces bailii)更喜欢果糖[37]。WANG Z等[38]揭示,葡萄糖、果糖和阿拉伯糖是推动中国白酒发酵过程和代谢多样性的关键糖,与微生物多样性呈正相关(P<0.05)。SU Y等[39]阐明不同时期非酿酒酵母对氮源的消耗速率不同。因此,不同的糖结构,微生物的偏好和代谢是不同的,不同的糖结构可以调节微生物的多样性,并导致不同的味道。
实验结果表明,发酵时间对发酵前后的理化指标有一定的规律性。3种不同糖处理对发酵液酸度和pH无显著影响,但游离氨基酸含量差异很大。支链芳香族氨基酸作为风味化合物的重要前体,芳香氨基酸(Tyr、Phe)的分解代谢可以产生花香的味道,中性粒细胞支链氨基酸Leu、Ile、Val可以转化为具有果香和甜味的化合物。
异味是限制水产品消费的关键因素。关于海产品异味的形成,有很多理论。此外,由于其成分复杂,不同的水产品、养殖环境、加工方式、运输过程等因素,异味会有明显的差异,限制了水产品的开发和应用。OEH的风味物质经过有效的发酵处理后呈现出以优质酯类和醇类为主的良好风味,大大满足了消费者对海鲜品质的要求,为海鲜的发展提供了良好的应用前景。但不同糖处理的发酵液风味成分存在较大差异。然而不同糖类处理的发酵液风味成分存在较大差异,关于糖类如何影响发酵液的有机酸形成及风味物质调控还有待进一步的研究,如何利用这种差异更好的为产品、工艺服务是未来研究的重难点。
3 结论
本实验采用SPME结合GC-MS法,基于OAV定量分析对不同糖处理的OEH发酵后液体的风味物质进行了分析,并考察了pH、总酸及有机酸、氨基酸的变化。结果表明,3种糖类处理的发酵液苹果酸和乳酸差异显著(P<0.05),不同糖处理液的氨基酸含量同样存在显著性差异(P<0.05),精氨酸含量最为丰富。经发酵处理,牡蛎风味得到改善,醛类物质含量减少,总体呈现以辛酸及辛酸乙酯、癸酸乙酯为主的花香、果香风味,但不同糖处理的发酵液在关键性风味物质(OAV>1)尤其是己酸乙酯含量上呈现显著性差异(P<0.05),通过发酵极大地改善了牡蛎的风味特征。
[1]UMAYAPARVATHI S,MEENAKSHI S,VIMALRAJ V,et al.Antioxidant activity and anticancer effect of bioactive peptide from enzymatic hydrolysate of oyster(Saccostrea cucullata)[J].Biomed Prev Nutr,2014,4(3):343-353.
[2]赵荣涛,王宁丽,魏鉴腾,等.牡蛎蛋白酶解多肽降糖及抗氧化活性评价[J].食品工业科技,2018,39(3):28-31.
[3]QIAN B J,ZHAO X,YANG Y,TIAN C.Antioxidant and anti-inflammatory peptide fraction from oyster soft tissue by enzymatic hydrolysis[J].Food Sci Nutr,2020,8(7):3947-3956.
[4]SEO J K,KIM D G,OH R,et al.Antimicrobial effect of the 60S ribosomal protein L29(cgRPL29),purified from the gill of pacific oyster,Crassostrea gigas[J].Fish Shellfish Immun,2017,67:675-683.
[5]GUO Z X,ZHAO F J Z,CHEN H,et al.Heat treatments of peptides from oyster (Crassostrea gigas) and the impact on their digestibility and angiotensin I converting enzyme inhibitory activity[J].Food Sci Biotechnol,2020,29:961-967.
[6]HWANG D,KANG M J,JO M J,et al.Antiinflammatory activity of β-thymosin peptide derived from pacific oyster(Crassostrea gigas)on no and PGE2 production by gown-regulating NF-κB in LPS-induced RAW264.7 macrophage cells[J].Mar Drugs,2019,17(2):129.
[7]UMAYAPARVATHI S,ARUMUGAM M,MEENAKSHI S,et al.Purification and characterization of antioxidant peptides from oyster(Saccostrea cucullata)hydrolysate and the anticancer activity of hydrolysate on human colon cancer cell lines[J].Int J Pept Res Ther,2014,20:231-243.
[8]BANG J S,JIN Y J,CHOUNG S Y.Low molecular polypeptide from oyster hydrolysate recovers photoaging in SKH-1 hairless mice[J].Toxicol Appl Pharmacol,2020,386:114844.
[9]MIAO J Y,LIAO W W,KANG M,et al.Anti-fatigue and anti-oxidant activities of oyster (Ostrea rivularis) hydrolysate prepared by compound protease[J].Food Funct,2018,9(12):6577-6585.
[10]ASHA K K,REMYA K K R,ASHOK K K,et al.Sequence determination of an antioxidant peptide obtained by enzymatic hydrolysis of oyster Crassostrea madrasensis(Preston)[J].Int J Pept Res Ther,2016,22:421-433.
[11]WANG H Y,YAN Z,LIU S,et al.Effects of enzymatic hydrolysate of oyster on erectile function in male hemicastrated rats[J].Int J Pept Res Ther,2020,26:2001-2007.
[12]BAO J,ZHANG X,ZHENG J H,et al.Mixed fermentation of Spirulina platensis with Lactobacillus plantarum,and Bacillus subtilis by randomcentroid optimization[J].Food Chem,2018,264:64-72.
[13]XU Y X,JIANG Z D,DU X P,et al.The identification of biotransformation pathways for removing fishymalodor from Bangia fusco-purpurea using fermentation with Saccharomyces cerevisiae[J].Food Chem,2022,380:132103.
[14]FOO J L,SUSANTO A V,KEASLING J D,et al.Whole-cell biocatalytic and de novo production of alkanes from free fatty acids in Saccharomyces cerevisiae[J].Biotechnol Bioeng,2017,114(1):232-237.
[15]HUANG T,LU Z M,PENG M Y,et al.Constructing a defined starter for multispecies vinegar fermentation via evaluating the vitality and dominance of functional microbes in autochethonous starter[J].Appl Environ Microbiol,2022,88(3):e02175-21.
[16]YANG Y,NIU C T,SHAN W X,et al.Physicochemical,flavor and microbial dynamic changes during low-salt doubanjiang(broad bean paste)fermentation[J].Food Chem,2021,351:128454.
[17]MENDES FERREIRA A,MENDES-FAIA A.The role of yeasts and lactic acid bacteria on the metabolism of organic acids during winemaking[J].Foods,2020,9(9):1231.
[18]SUN X Y,WANG J,LI C Y,et al.The use of γ-aminobutyric acid-producing Saccharomyces cerevisiae SC125 for functional fermented beverage production from apple juice[J].Foods,2022,11(9):1202.
[19]VOLSCHENK H,VAN VUUREN H J J,VILJOEN-BLOOM M.Malic acid in wine: Origin,function and metabolism during vinification[J].S Afr J Enol Vitic,2006,27(2):123-136.
[20]ZHANG B Q,LUAN Y,DUAN C Q,et al.Use of Torulaspora delbrueckii co-fermentation with two Saccharomyces cerevisiae strains with different aromatic characteristic to improve the diversity of red wine aroma profile[J].Front Microbiol,2018,9:606.
[21]COUSIN F J,LE GUELLEC R,SCHLUSSELHUBER M,et al.Microorganisms in fermented apple beverages:current knowledge and future directions[J].Microorganisms,2017,5(3):39.
[22]XIE W C,LU K,YU J,et al.Research progress on aroma of aquatic products[J].J Food Sci Tech,2022,40(1):11-21.
[23]ROTHE M,WÖLM G,TUNGER L,et al.Schwellenkonzentrationen von Aromastoffen und ihre Nutzung zur Auswertung von Aromaanalysen[J].Nahrung,1972,16(5):483-495.
[24]HALLENBERG B A.Beiträge zur Kenntnis der alkoholhaltigen Getranke[J].Skandinavisches Archiv Für Physiol,1914,31(1):75-80.
[25]STARK W,SMITH J F,FORSS D A.n-Pent-1-en-3-ol and n-pent-1-en-3-one in oxidized dairy products[J].J Dairy Res,1967,34(2):123-129.
[26]DARRIET P,PONS P M,HENRY R,et al.Impact odorants contributing to the fungus type aroma from grape berries contaminated by powdery midew(Uncinula necator);incidence of enzymatic activities of the yeast Saccharomyces cerevisiae[J].J Agr Food Chem,2002,50(11):3277-3282.
[27]LA GUERCHE S,DAUPHIN B,PONS M,et al.Charscterization of some mushroom and earthy off-odors microbially induced by the development of rot on grapes[J].J Agr Food Chem,2006,54(24):9193-9200.
[28]KEITH E S,POWERS J J.Determination of flavor threshold levels and sub-threshold,additive,and concentration effects[J].J Food Sci,1968,33(2):213-218.
[29]POWERS J J,QUINLAN M C.A research note.Flavor detection threshold values for ethyl caprylate and phenyl ethyl alcohol and estimates of the percent population having greater sensitivity[J].J Food Sci,1973,38(4):724-725.
[30]AHMED E M,DENNISON R A,DOUGHERTY R H,SHAW P E.Flavor and odor thresholds in water of selected orange juice components[J].J Agr Food Chem,1978,26(1):187-191.
[31]RYCHLIK M,SCHIEBERLE P,GROSCH W.Compliation of odor thresholds,odor qualities and retention indices of key food odorants[M].Germany:Deutsche Forschungsanstalt fur Lebensmittelchemie and Intitut fur Lebensmittelchemie der Technischen Universitat Munchen,1998,1-63.
[32]MAARSE H,VAN DER HEIJ D G.Trends in flavor research[M].London:Elsevier Science,1994:409-415.
[33]ANDERSSON T,FORSGREN G,NIELSEN T.The effects of selected aldehydes,ketones and carboxylic acids on off-flavors in water[J].Int J Food Sci Tech,2005,40(9):993-1004.
[34]CHARALAMBOUS G.The analysis and control of less desirable flavors in foods and beverages[M].New York:Academic Press,1980,241-265.
[35]BOATRIGHT W L,CRUM A D.Odor and flavor contribution of 2-pentyl pyridine to soy protein isolates[J].J Am Oil Chem Soc,1997,74(12):1575-1581.
[36]CHATONNET P,DUBOURDIEU D,BOIDRON J N.Incidence des conditions de fermentation et delevage des vins blancs secs en barriques sur leur composition en substances cedes par le bois de chene[J].Sci Alim,1992,12(4):665-685.
[37]BERTHELS N,OTERO R,BAUER F,et al.Discrepancy in glucose and fructose utilization during fermentation by Saccharomyces cerevisiae wine yeast strains[J].FEMS Yeast Res,2004,4(7):683-689.
[38]WANG Z,JI X A,WANG S L,et al.Sugar profile regulates the microbial metabolic diversity in Chinese Baijiu fermentation[J].Int J Food Microbiol,2021,359:109426.
[39]SU Y,SEGUINOT P,SANCHEZ I,et al.Nitrogen sources preferences of non-Saccharomyces yeasts to sustain growth and fermentation under winemaking conditions[J].Food Microbiol,2020,85:103287.