糖尿病已成为21世纪影响人类健康的重大代谢病。据统计,2021年糖尿病成年患者达5.37亿,预计2045年将达到7.83亿[1]。L-异亮氨酸羟化物—4-羟基异亮氨酸具有血糖水平依赖的促进胰岛素分泌的特性以及促进脂肪代谢等功能,对糖尿病具有良好的治疗效果,具有广阔的应用前景[2-3]。目前,4-羟基异亮氨酸的生产主要采用胡芦巴种子提取法,然而此方法生产效率低(约0.015%),致使生产规模小、产量低、成本高,严重限制了其应用[4]。此外,化学合成法因在生产过程中使用乙醛等有毒或易爆物,且存在提取收率低等不足仍停留在实验室研究阶段[5]。
KODERA T等[5]首次报道了在苏云金芽孢杆菌(Bacil-lus thuringiensis)中发现L-异亮氨酸羟化酶(L-isoleucine dioxygenase,IDO)(由ido基因编码),该酶能够以L-异亮氨酸和α-酮戊二酸为底物分别合成4-羟基异亮氨酸和琥珀酸。L-异亮氨酸羟化酶的发现为4-羟基异亮氨酸的生物合成奠定了基础。SHI F等[6]首次在L-异亮氨酸生产菌株谷氨酸棒杆菌乳糖发酵亚种(Corynebacterium glutamicum ssp.lactofermentum)中通过过表达ido基因和磷酸烯醇式丙酮酸羧化酶编码基因ppc,实现4-羟基异亮氨酸的生物合成。ZHANG C等[7]通过重构和动态调控C.glutamicum YI的三羧酸(tricarboxylic acid,TCA)循环实现其高效合成。然而,目前用于合成4-羟基异亮氨酸的谷氨酸棒杆菌底盘细胞均来源于诱变,故后续代谢工程改造难度大,且在反复诱变过程中因营养缺陷等因素菌株生长缓慢。
大肠杆菌(Escherichia coli)因遗传背景清晰、生长快等特性也被应用于生物合成4-羟基异亮氨酸研究。KIVERO A D等[8]通过阻断大肠杆菌TCA循环、乙醛酸循环、磷酸戊糖途径(pentose phosphate pathway,PPP)和恩特纳-杜多罗夫(Entner-Doudoroff,ED)途径并过表达ido基因,外源添加底物L-异亮氨酸合成4-羟基异亮氨酸,该方法操作复杂且成本高。近年来,大肠杆菌系统生物学和合成生物学研究的飞速发展使得构建4-羟基异亮氨酸从头合成菌株成为可能。在前期研究中,本课题组利用大肠杆菌构建出4-羟基异亮氨酸从头合成菌株Escherichia coli IEOH-9[9]。为进一步提升其4-羟基异亮氨酸合成性能,以Escherichia coli IEOH-9为出发菌株,首先通过强化L-异亮氨酸合成途径代谢流并增加烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate hydride,NADPH)供应进而强化L-异亮氨酸合成;然后弱化磷酸烯醇式丙酮酸向丙酮酸的代谢以增强草酰乙酸合成,并通过强化TCA循环增加α-酮戊二酸供应,最终获得一株高产4-羟基异亮氨酸菌株。本研究所用策略不仅可应用于4-羟基异亮氨酸合成菌株构建,还可为天冬氨酸族氨基酸及其衍生物的代谢工程育种提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 试剂
葡萄糖(分析纯):国药集团化学试剂有限公司;4-羟基异亮氨酸标准品(分析纯):德国默克公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶(2.5 U/μL):宝日医生物技术(北京)有限公司;一步法克隆试剂盒:南京诺唯赞生物科技有限公司;NADPH检测试剂盒:美国博世生物技术有限公司;DNA Marker(SM0331):赛默飞世尔科技(中国)有限公司。其他试剂均为国产分析纯。
1.1.2 菌株、质粒与引物
本研究所用菌株和质粒见表1,所用引物见表2。
表1 本研究所用菌株和质粒
Table 1 Strains and plasmids used in this study

表2 本研究所用引物
Table 2 Primers used in this study
续表

1.1.3 培养基
种子培养基[9]:葡萄糖30 g/L,酵母提取物8 g/L,胰蛋白胨4.5 g/L,KH2PO4 1.2 g/L,MgSO4·7H2O 0.25 g/L,FeSO4·7H2O 10 mg/L,MnSO4·H2O 10 mg/L,维生素B1(vitamin B1,VB1)1.3 mg/L,维生素H(vitamin H,VH)0.3 mg/L,苯酚红2.0%,使用1 mol/L的NaOH溶液将pH调至7.0~7.2。115 ℃高压蒸汽灭菌15 min。
发酵培养基[9]:葡萄糖30 g/L,酵母提取物2 g/L,胰蛋白胨4 g/L,KH2PO4 0.9 g/L,柠檬酸钠1 g/L,MgSO4·7H2O 0.9g/L,FeSO4·7H2O20mg/L,MnSO4·H2O8mg/L,VB12mg/L,VH 0.2 mg/L,苯酚红2.0%,适量泡敌,pH调至7.0~7.2,115 ℃高压蒸汽灭菌15 min。
1.2 仪器与设备
Mastercycler nexus聚合酶链式反应(polymerase chain reaction,PCR)仪:德国Eppendorf公司;Thermo UltiMate 3000高效液相色谱(high performance liquid chromatography,HPLC)仪:美国Thermo Fisher Scientific公司;UV2600紫外分光光度计:日本Shimadzu公司。
1.3 方法
1.3.1 基因编辑
利用成簇规律间隔的短回文重复序列相关蛋白(clus tered regularly interspaced short palindromic repeats/CRISPRassociated 9,CRISPR/Cas9)基因编辑系统(pRedCas9和pGRB)对Escherichia coli IEOH-9进行基因整合或敲除,操作方法见文献[10]。以将Ptrc驱动的lysCC1055T整合至tehB基因位点为例。利用sgRNA设计工具CRISPR RGEN Tools(http://www.rgenome.net/cas-designer/)设计20bp间隔序列,退火后利用一步法克隆试剂盒与线性pGRB连接,转化至Escherichia coli DH5α,通过筛选后获得质粒pGRB-tehB。以Escherichia coli W3110基因组DNA为模板,分别利用引物lysC-1/lysC-2及lysC-3/lysC-4PCR扩增lysC基因上下游片段以将突变位点引入序列,然后以获得的片段为模板利用引物lysC-1/lysC-4通过重叠PCR获得lysCC1055T。以Escherichia coli W3110基因组DNA为模板,分别利用引物lysC-5/lysC-6及lysC-9/lysC-10 PCR扩增获得用于同源重组的上游同源臂和下游同源臂;以lysCC1055T为模板,利用引物lysC-7/lysC-8 PCR扩增PtrclysCC1055T-Ttrc。然后通过重叠PCR利用引物lysC-5和lysC-10将上述片段重叠获得上游同源臂-Ptrc-lysCC1055T-Ttrc-下游同源臂的供体DNA。将pGRB-tehB(100 ng)和供体DNA(200 ng)电转化至含pREDCas9的Escherichia coli IEOH-9感受态细胞中。于LB液体培养基32 ℃、100 r/min复苏2 h后,涂布于含100 μg/mL的氨苄青霉素和奇霉素的LB固体培养基上,于32 ℃培养过夜。挑选单菌落,利用引物lysC-5/lysC-10进行菌落PCR鉴定,将鉴定正确的转化子于含10 mmol/L的阿拉伯糖的LB液体培养基中32 ℃、180 r/min振荡培养过夜以丢失pGRB-tehB。重组菌株于LB液体培养基42 ℃、180 r/min振荡培养过夜以丢失pREDCas9质粒。每次构建获得的菌株于LB液体培养基活化并连续传代10次,稀释后涂布于LB固体培养基,挑取3~5个单菌落进行摇瓶发酵实验,选取4-羟基异亮氨酸产量高且生物量无显著降低的菌株进行后续改造。
1.3.2 摇瓶发酵实验
菌株经LB斜面培养基活化后转接至30 mL种子培养基(根据需要添加100 mg/L氨苄青霉素),于32 ℃、220 r/min摇床振荡培养至OD600nm值为8~10。将种子培养物按10%(V/V)接种量接种至40 mL发酵培养基(根据需要添加100 mg/L氨苄青霉素),于32 ℃、220 r/min摇床振荡培养24 h。发酵过程中待苯酚红变红后添加10 μL质量浓度为600 g/L的葡萄糖溶液,用氨水维持pH在7.0~7.5。
1.3.3 检测与分析方法
利用分光光度计测定菌体生物量(以OD600nm值计);发酵液经8 000 r/min离心5 min后取上清液,适当稀释后,采用柱前衍生-高效液相色谱法测定氨基酸含量[11];采用NADPH检测试剂盒测定NADPH含量。
1.3.4 数据处理
摇瓶实验设置3个平行、每个实验重复3次;采用软件SPSS 17对数据进行统计学分析(P≤0.05);利用软件Origin 8.0和Microsoft Visio 2010绘图。
2 结果与分析
2.1 强化L-异亮氨酸对4-羟基异亮氨酸合成的影响
L-异亮氨酸是合成4-羟基异亮氨酸的前体物。前期研究中已通过过表达L-异亮氨酸途径关键酶编码基因ppc、thrABC、ilvA及ilvBN有效增加了L-异亮氨酸合成[9]。天冬氨酸激酶(aspartate kinase,AK)是L-异亮氨酸合成的关键酶,大肠杆菌含有3个天冬氨酸激酶(AK I、AK II和AK III);其中由thrA基因编码的AK I丰度最高,其次为lysC基因编码的AK III[12-14]。为进一步强化L-异亮氨酸合成,将强启动子Ptrc驱动的lysCC1055T(编码解除反馈抑制作用的AK III)整合至重组菌株Escherichia coli IEOH-9基因组,以考察其对4-羟基异亮氨酸合成的影响[15]。lysCC1055T基因的整合过程及鉴定结果见图1。分别利用引物lysC-5/lysC-6、lysC-9/lysC-10及lysC-7/lysC-8 PCR扩增获得用于同源重组的上游同源臂(538 bp,泳道1)、下游同源臂(499 bp,泳道2)及Ptrc-lysCC1055TTtrc(1 466 bp,泳道3),然后通过重叠PCR利用引物lysC-5和lysC-10将上述片段重叠(2 422 bp,泳道4)。按方法1.3.1将重叠片段同pGRB-tehb转化至含pRedCas9的Escherichia coli IEOH-9。由图1可知,以重组菌株Escherichia coli IEOH-9基因组DNA为模板,采用引物lysC-5和lysC-10 PCR扩增得到的产物碱基数约为1 500 bp(实际为1 443 bp,泳道6),以lysCC1055T整合菌株基因组DNA为模板,PCR扩增获得的产物碱基数约为2 500 bp(实际为2 422 bp,泳道5),表明lysCC1055T基因整合成功,将其命名为Escherichia coli IEOH-10。
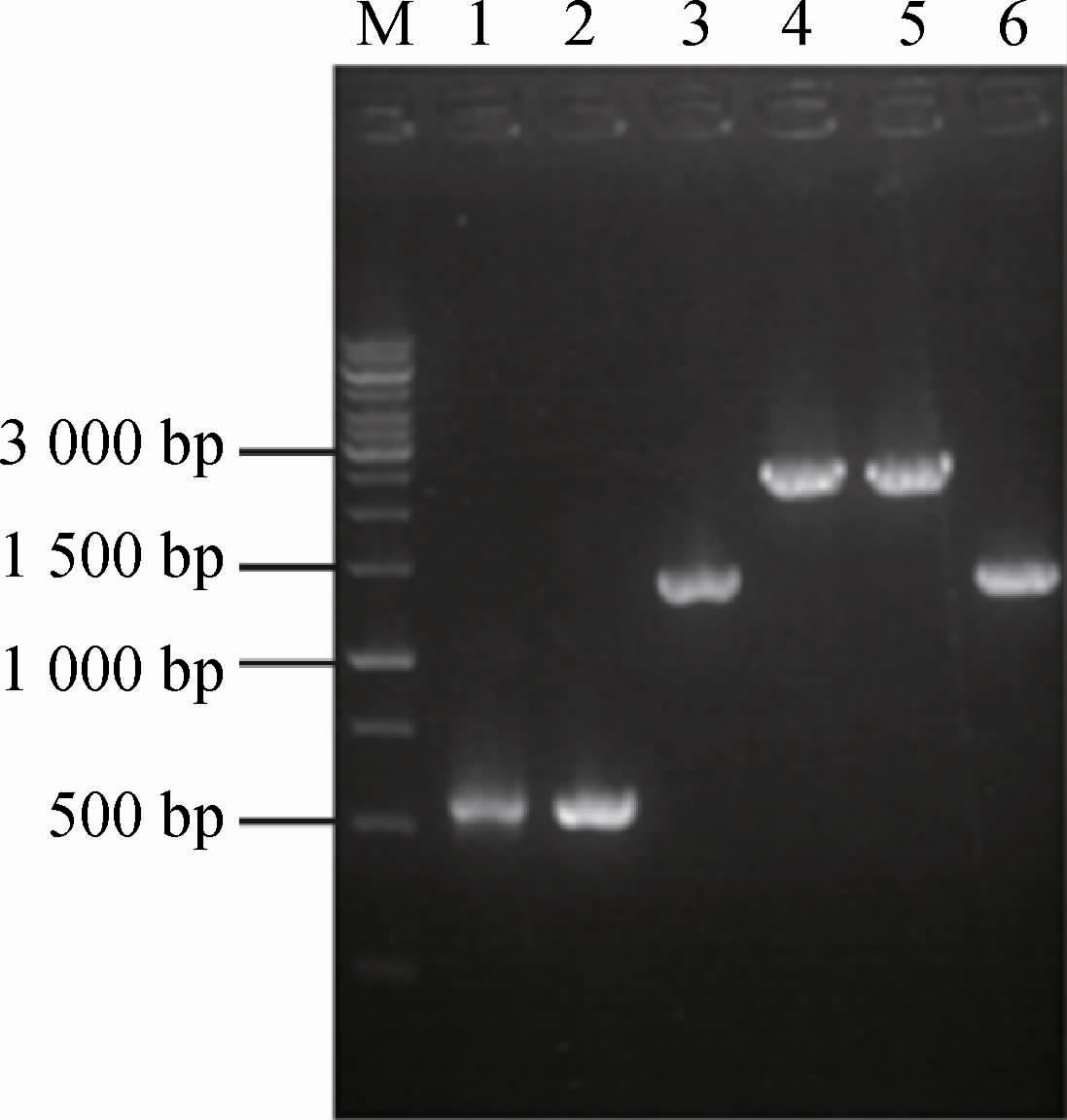
图1 Escherichia coli IEOH-10的鉴定结果
Fig.1 Identification results of Escherichia coli IEOH-10
M为DNA Marker。下同。
为考察lysCC1055T基因整合对4-羟基异亮氨酸合成的影响,以重组菌株Escherichia coli IEOH-9作为对照,对Escherichia coli IEOH-10进行摇瓶发酵。结果发现,重组菌株Escherichia coli IEOH-10(OD600nm值=51.5)与Escherichia coli IEOH-9(OD600nm值=52.7)生物量无明显差异(P>0.05),表明lysCC1055T基因整合对菌株生长无影响;重组菌株Escherichia coli IEOH-10经24 h发酵可合成17.3 g/L 4-羟基异亮氨酸,较重组菌株Escherichia coli IEOH-1(15.7 g/L)提高10.2%。
2.2 增强NADHP合成对4-羟基异亮氨酸合成的影响
大肠杆菌的L-异亮氨酸合成途径中6步反应直接或间接需要NADPH,故合成1 mol 4-羟基异亮氨酸需要6 mol NADPH[16]。来源于大肠杆菌的吡啶核苷酸转氢酶(由pntAB基因编码)可将还原型烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)转化为NADPH[17]。研究表明,过表达pntAB基因可有效提高胞内NADPH浓度并促进L-缬氨酸、L-高丝氨酸等产物合成[18-20]。将Ptrc驱动的pntAB基因整合至重组菌株Escherichia coli IEOH-10基因组中,以考察其对4-羟基异亮氨酸合成的影响。pntAB基因的整合过程及鉴定结果见图2。分别利用引物pntAB-1/pntAB-2、pntAB-5/pntAB-6及pntAB-3/pntAB-4 PCR扩增获得用于同源重组的上游同源臂(486 bp,泳道1)、下游同源臂(534 bp,泳道2)及Ptrc-pntAB-Ttrc(3 058 bp,泳道3),然后通过重叠PCR利用引物pntAB-1和pntAB-6将上述片段重叠(3 997 bp,泳道4)。由图2可知,由Escherichia coli IEOH-10基因组DNA扩增出碱基数约为1 500 bp的条带(实际为1 443 bp,泳道6),pntAB整合菌株基因组DNA扩增获得碱基数约为4 000 bp的条带(实际为3 997 bp,泳道5),表明pntAB基因整合成功,将其命名为Escherichia coli IEOH-11。
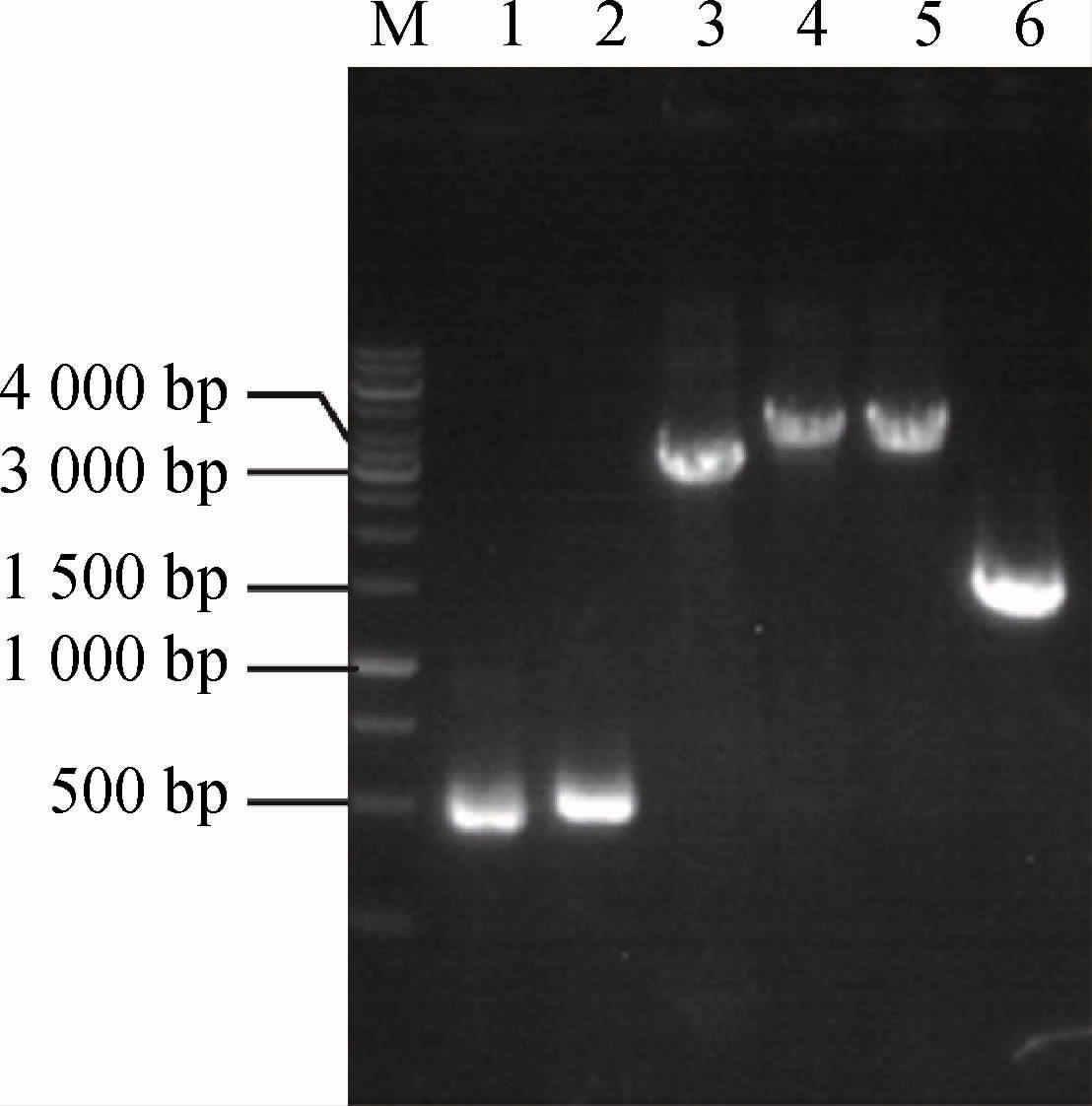
图2 Escherichia coli IEOH-11的鉴定结果
Fig.2 Identification results of Escherichia coli IEOH-11
为考察pntAB基因整合对4-羟基异亮氨酸合成的影响,以重组菌株Escherichia coli IEOH-10作为对照,对Escherichia coli IEOH-11进行摇瓶发酵。结果发现,重组菌株Escherichia coli IEOH-11(OD600nm值=51.4)与Escherichia coli IEOH-10(OD600nm值=51.5)生物量无明显差异(P>0.05),表明pntAB基因整合对菌株生长无影响;重组菌株Escherichia coli IEOH-11的4-羟基异亮氨酸产量达到19.4 g/L,较Escherichia coli IEOH-10提高12.1%。通过比较Escherichia coli IEOH-10和Escherichia coli IEOH-11胞内的NADPH浓度,发现Escherichia coli IEOH-11中的NADPH浓度较Escherichia coli IEOH-10高16.7%,分别为0.54 μmol/g干质量、0.63 μmol/g干质量。结果表明,过表达pntAB基因可有效提高胞内NADPH水平,从而促进4-羟基异亮氨酸的合成。
2.3 弱化丙酮酸激酶对4-羟基异亮氨酸合成的影响
丙酮酸激酶催化磷酸烯醇式丙酮酸生成丙酮酸[21]。大肠杆菌含有2个丙酮酸激酶同工酶(Pyk I和Pyk II),分别由pykF和pykA基因编码[22-23]。在大肠杆菌等兼性厌氧细菌中,葡萄糖的转运主要依靠磷酸转移酶系统,摄入1分子葡萄糖需消耗1分子磷酸烯醇式丙酮酸,生成葡萄糖-6-磷酸和丙酮酸[24]。由于在重组菌株Escherichia coli IEOH-9中已过表达磷酸烯醇式丙酮酸羧化酶编码基因ppc,故弱化丙酮酸激酶可适当减少磷酸烯醇式丙酮酸的消耗,从而增强草酰乙酸供应,用于合成L-异亮氨酸和α-酮戊二酸。分别敲除Escherichia coli IEOH-11的pykF和pykA基因,以考察其对4-羟基异亮氨酸的影响。pykF和pykA基因的敲除过程及鉴定结果见图3。分别利用引物pykF-1/pykF-2及pykF-3/pykF-4 PCR扩增获得用于敲除pykF基因的上游同源臂(483 bp,图A泳道1)和下游同源臂(489 bp,图A泳道2),然后通过重叠PCR利用引物pykF-1和pykF-2将上述片段重叠(972 bp,图A泳道3)。同理获得用于敲除pykA基因的上游同源臂(609 bp,图B泳道1)和下游同源臂(457 bp,图B泳道2)及其重叠片段(1 066 bp,图B泳道3)。由图3可知,以Escherichia coli IEOH-11基因组DNA为模板分别扩增出碱基数约为2 000 bp和2 500 bp的条带(实际为2 180 bp和2 381 bp,分别为图A和图B泳道5),以pykF和pykA基因敲除菌株基因组DNA为模板均扩增获得碱基数约为1 000 bp的条带(实际分别为972 bp和1 066 bp,分别为图A和图B泳道4),表明pykF和pykA基因成功敲除,分别命名为Escherichia coli IEOH-12和Escherichia coli IEOH-13。
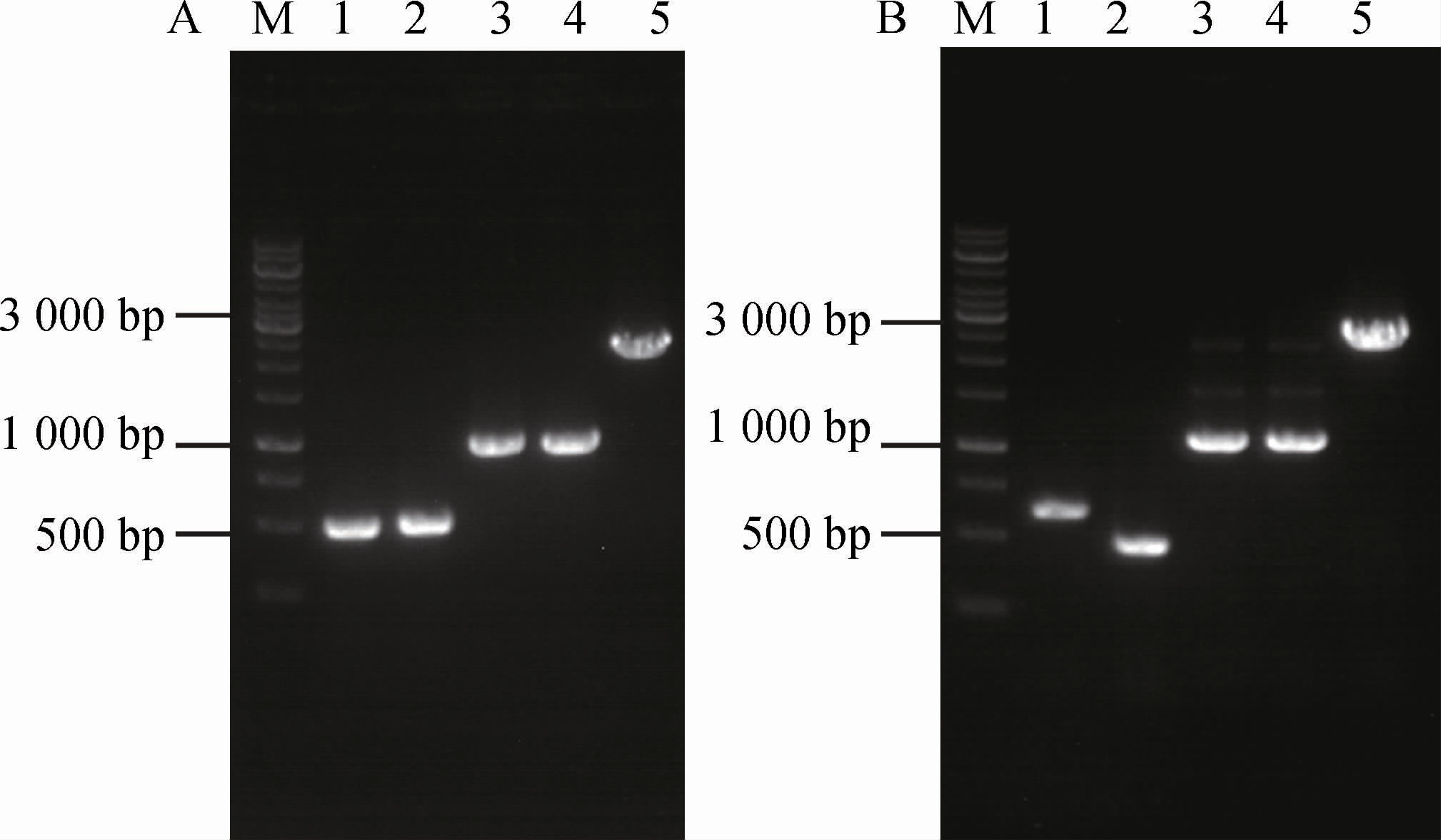
图3 Escherichia coli IEOH-12和Escherichia coli IEOH-13的鉴定结果
Fig.3 Identification results of Escherichia coli IEOH-12 and Escherichia coli IEOH-13
为考察pykF和pykA基因敲除对4-羟基异亮氨酸合成的影响,以重组菌株Escherichia coli IEOH-11作为对照,对Escherichia coli IEOH-12和Escherichia coli IEOH-13进行摇瓶发酵。结果发现,Escherichia coli IEOH-12的生物量(OD600nm值=48.7)略低于Escherichia coli IEOH-11和Escherichia coli IEOH-13(OD600nm值=50.8),其4-羟基异亮氨酸产量达到21.5 g/L,较Escherichia coli IEOH-11提高10.8%;而Escherichia coli IEOH-13的生物量和4-羟基异亮氨酸产量(19.6 g/L)均与Escherichia coli IEOH-11无明显差异(P>0.05)。研究发现,在大肠杆菌胞内Pyk I的活性高于Pyk II,故认为Pyk I为主要功能酶,因此,敲除pykA基因对4-羟基异亮氨酸合成无明显影响[24-26]。有研究表明,敲除pykF基因可增强磷酸烯醇式丙酮酸羧化酶活性[27],故推测敲除pykF基因使得Escherichia coli IEOH-12菌株胞内草酰乙酸浓度增强,为L-异亮氨酸和α-酮戊二酸的合成提供更多的前体物。
2.4 强化TCA循环提高α-酮戊二酸供应对4-羟基异亮氨酸合成的影响
从Escherichia coli IEOH-12菌株发酵液中检测到1.4 g/L L-异亮氨酸,暗示α-酮戊二酸供应不足,故拟过表达柠檬酸合酶编码基因gltA以期将草酰乙酸代谢流拉向TCA,增强α-酮戊二酸合成。gltA基因整合过程及鉴定结果见图4。分别利用引物gltA-1/gltA-2、gltA-5/gltA-6及gltA-3/gltA-4 PCR扩增获得用于同源重组的上游同源臂(568 bp,泳道1)、下游同源臂(569 bp,泳道2)及Ptrc-gltA-Ttrc(泳道3,1 407 bp),然后通过重叠PCR利用引物gltA-1和gltA-6将上述片段重叠(2463bp,泳道4)。由图4可知,以Escherichia coli IEOH-12基因组DNA为模板扩增出碱基数约为1 500 bp的条带(实际为1 396 bp,泳道5),以gltA基因整合菌株基因组DNA为模板扩增获得碱基数约为2 500 bp的条带(实际为2 463 bp,泳道6),表明gltA基因整合成功,命名为Escherichia coli IEOH-14。
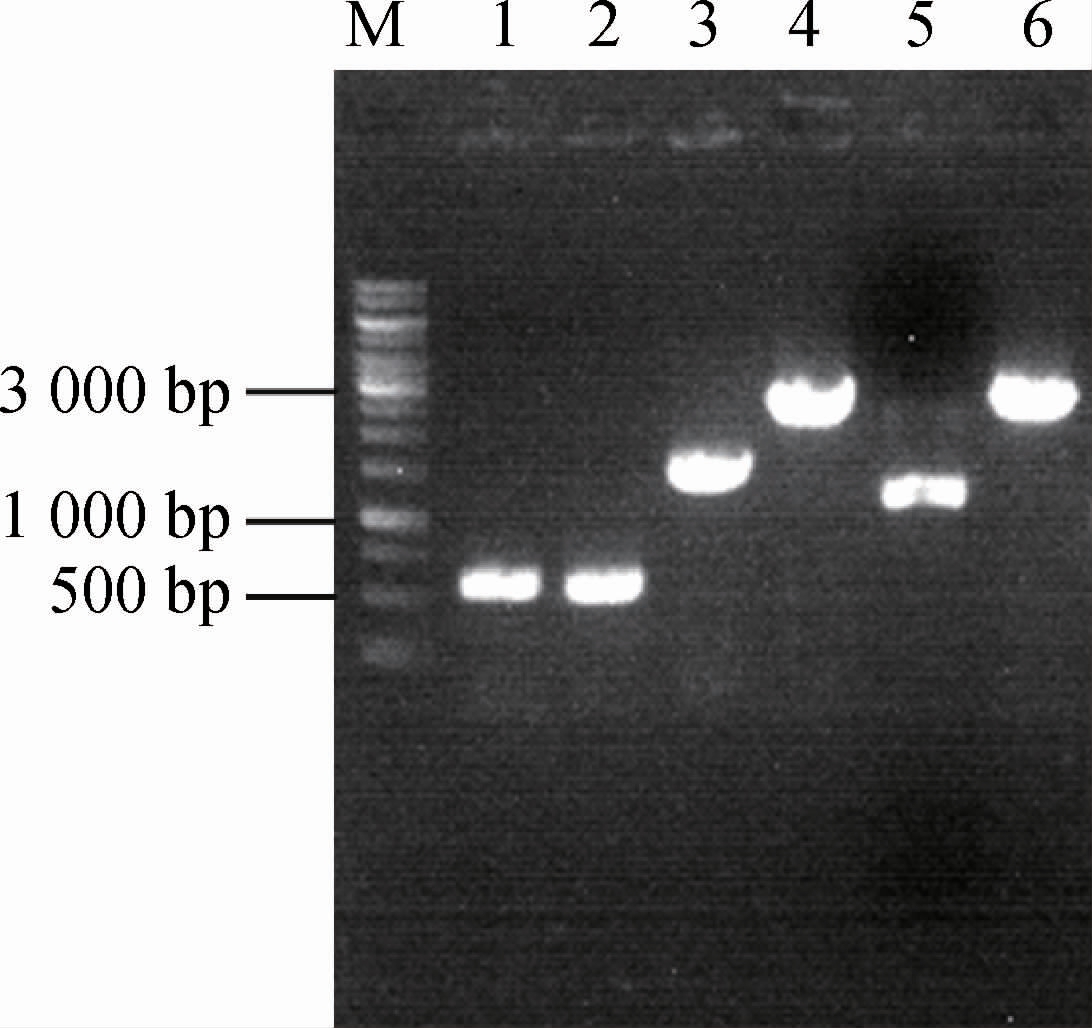
图4 Escherichia coli IEOH-14鉴定图谱
Fig.4 Map for identification of Escherichia coli IEOH-14
为考察gltA基因过表达对4-羟基异亮氨酸合成的影响,以重组菌株Escherichia coli IEOH-12作为对照,对Escherichia coli IEOH-14进行摇瓶发酵。结果发现,Escherichia coli IEOH-14的4-羟基异亮氨酸产量达到24.7 g/L,较Escherichia coli IEOH-12提高14.9%;其生物量(OD600nm值=50.3)较Escherichia coli IEOH-12(OD600nm值=48.7)略有提高;Escherichia coli IEOH-14的L-异亮氨酸积累量降低至0.1 g/L,表明通过过表达gltA强化了α-酮戊二酸供应,从而提高了L-异亮氨酸向4-羟基异亮氨酸的转化。
3 结论
以前期构建的4-羟基异亮氨酸合成菌株Escherichia coli IEOH-9为出发菌株,对其进行进一步代谢工程改造,以提高其合成性能。主要策略包括过表达lysCC1055T和pntAB基因强化L-异亮氨酸合成、敲除丙酮酸激酶编码基因pykF增强草酰乙酸生成以及过表达gltA提高α-酮戊二酸供应。获得的重组菌株Escherichia coli IEOH-14 4-羟基异亮氨酸产量达到24.7 g/L,较出发菌株Escherichia coli IEOH-9提高57.3%。在后续研究中可将ido基因整合至基因组以减少质粒带来的代谢负担并避免抗生素的使用;利用不同强度启动子过表达上述关键基因,以期获得最佳表达方式;引入外源回补途径(如来源于谷氨酸棒杆菌的丙酮酸羧化酶、来源于曼氏产琥珀酸菌(Mannheimia succiniciproducens)的磷酸烯醇式丙醇酸羧化酶)等对磷酸烯醇式丙酮酸-丙酮酸-草酰乙酸节点进行改造。
[1]INTERNATIONAL DIABETES FEDERATION.IDF Diabetes Atlas(10th ed)[M].Brussels:International Diabetes Federation,2021.
[2]WADHWA G,KRISHNA K V,TALIYAN R,et al.A novel UPLC-MS/MS method for simultaneous quantification of trigonelline,4-hydroxyisoleucine,and diosgenin from Trigonella foenum-graecum extract: Application to pharmacokinetic study in healthy and type 2 diabetic rats[J].Biomed Chromatogr,2022,36(2):e5275.
[3]SINGH P,ISHTEYAQUE S,PRAJAPATI R,et al.Assessment of antidiabetic effect of 4-HIL in type 2 diabetic and healthy Sprague Dawley rats[J].Hum Exp Toxicol,2022,41:1-11.
[4]LAI W,SHI F,TAN S,et al.Dynamic control of 4-hydroxyisoleucine biosynthesis by multi-biosensor in Corynebacterium glutamicum[J].Appl Biochem Microbiol,2022,106(13-16):5105-5121.
[5]KODERA T,SMIRNOV S V,SAMSONOVA N N,et al.A novel L-isoleucine hydroxylating enzyme,L-isoleucine dioxygenase from Bacillus thuringiensis,produces(2S,3R,4S)-4-hydroxyisoleucine[J].Biochem Biophys Res Commun,2019,390(3):506-510.
[6]SHI F,FANG H,NIU T,et al.Overexpression of ppc and lysC to improve the production of 4-hydroxyisoleucine and its precursor L-isoleucine in recombinant Corynebacterium glutamicum ssp.lactofermentum[J].Enzym Microb Technol,2016,87-88:79-85.
[7]ZHANG C,LI Y,MA J,et al.High production of 4-hydroxyisoleucine in Corynebacterium glutamicum by multistep metabolic engineering[J].Metab Eng,2018,49:287-298.
[8]KIVERO A D,NOVIKOVA A E,SMIRNOV S V.Modification of E.coli central metabolism to optimize the biotransformation of L-isoleucine into 4-hydroxyisoleucine by enzymatic hydroxylation[J].Appl Biochem Microbiol,2012,48(7):639-644.
[9]WEI M,LI G,XIE H,et al.Sustainable production of 4-hydroxyisoleucine with minimised carbon loss by simultaneously utilising glucose and xylose in engineered Escherichia coli[J].Bioersource Technol,2022,354:12719.
[10]LI Y,LIN Z,HUANG C,et al.Metabolic engineering of Escherichia coli using CRISPR-Cas9 meditated genome editing[J].Metab Eng,2015,31:13-21.
[11]张成林,刘远,薛宁,等.苏云金芽孢杆菌重组L-异亮氨酸羟化酶的酶学性质及其在4-羟基异亮氨酸合成中的应用[J].微生物学报,2014,54(8):889-896.
[12]LI Y,WEI H,WANG T,et al.Current status on metabolic engineering for the production of L-aspartate family amino acids and derivatives[J].Bioresour Technol,2017,245:1588-1602.
[13]PARK J H,LEE S Y.Fermentative production of branched chain amino acids: a focus on metabolic engineering[J].Appl Biochem Microbiol,2010,85(3):491-506.
[14]PARK J H,OH J E,LEE K H,et al.Rational design of Escherichia coli for L-isoleucine production[J].ACS Synth Biol,2012,1(11):532-540.
[15]LEE K H,PARK J H,KIM T Y,et al.Systems metabolic engineering of Escherichia coli for L-threonine production[J].Mol Sys Biol,2007,3(1):149.
[16]芦楠,李宇虹,陈宁,等.L-异亮氨酸及其衍生物代谢工程研究进展[J].食品与发酵工业,2021,47(9):307-313.
[17]UWE S,FABRIZIO C,SYLVIA H,et al.The soluble and membranebound transhydrogenases UdhA and PntAB have divergent functions in NADPH metabolism of Escherichia coli[J].J Biol Chem,2004,279(8):6613-6619.
[18]HAO Y,MA Q,LIU X,et al.High-yield production of L-valine in engineered Escherichia coli by a novel two-stage fermentation[J].Metab Eng,2020,62:198-206.
[19]ZHANG Y,WEI M,ZHAO G,et al.High-level production of L-homoserine using a non-induced,non-auxotrophic Escherichia coli chassis through metabolic engineering[J].Bioresource Technol,2021,327:124814.
[20]LIU B,XIANG S,ZHAO G,et al.Efficient production of 3-hydroxypropionate from fatty acids feedstock in Escherichia coli[J].Metab Eng,2019,51:121-130.
[21]MEZA E,BECKER J,BOLIVAR F,et al.Consequences of phosphoenolpyruvate: sugar phosphotranferase system and pyruvate kinaseisozymes inactivation in central carbon metabolism flux distribution in Escherichia coli[J].Microb Cell Fact,2012,11:127.
[22]RODRIGUEZ A,MARTÍNEZ J A,BÁEZ-VIVEROS J L,et al.Constitutive expression of selected genes from the pentose phosphate and aromatic pathways increases the shikimic acid yield in high-glucose batch cultures of an Escherichia coli strain lacking PTS and pykF[J].Microb Cell Fact,2013,12:86.
[23]SIDDIQUEE K A,ARAUZO-BRAVO M J,SHIMIZU K.Effect of a pyruvate kinase (pykF-gene) knockout mutation on the control of gene expression and metabolic fluxes in Escherichia coli[J].FEMS Microbiol Lett,2004,235(1):25-33.
[24]CARMONA S B,MORENO F,BOLIVAR F,et al.Inactivation of the PTS as a strategy to engineer the production of aromatic metabolites in Escherichia coli[J].J Mol Microbiol Biotechnol,2015,25(2-3): 195-208.
[25]XIE X,LIANG Y,LIU H,et al.Modification of glycolysis and its effect on the production of L-threonine in Escherichia coli[J].J Ind Microbiol Biotechnol,2014,41(6):1007-1015.
[26]MU Q,ZHANG S,MAO X,et al.Highly efficient production of L-homoserine in Escherichia coli by engineering a redox balance route[J].Metab Eng,2021,67:321-329.
[27]SIDDIQUE K AI Z,ARAUZO-BRAVO M,SHIMIZU K.Metabolic flux analysis of pykF gene knockout Escherichia coli based on 13C-labeling experiments together with measurements of enzyme activities and intracellular metabolite concentrations[J].Appl Biochem Microbiol,2003,63(4):407-417.