红曲是主要以大米为原料,通过接种红曲霉培养得到的红曲菌丝体及其代谢物与大米基质组成的一种混合物,是我们祖先的智慧结晶,已有1 000年以上应用历史,广泛用于酿酒、中药、食品着色等方面[1]。自然发酵的红曲是一个多菌种混合物,包含大量细菌和霉菌,以红曲霉为主[2]。红曲霉(Monascus spp.)是真菌门、子囊菌亚门、囊菌纲、散囊菌目、红曲科、红曲属,常见菌株主要为4种:安卡红曲霉(Monascus anka)、丛毛红曲霉(Monascus pilosus)、红色红曲霉(Monascus ruber)、紫色红曲霉(Monascus purpureus)[1]。红曲霉可产生糖化酶、酯化酶、蛋白酶等多种酶类物质,在这些酶的协同作用下使培养基质中产生单糖、多糖、氨基酸、肽、核苷酸等呈味物质和挥发性酯类、醇类等香气物质[3-4]。此外,红曲霉还代谢产生生理活性物质,包括莫纳可林K(Monacolin K)、γ-氨基丁酸、甾醇类以及多种色素类物质[5]。为了全面了解红曲霉对酿酒发酵过程的可能影响,本文主要总结红曲霉提高酶活、提升有益代谢物及降低桔霉素的调控方法以及在酿造黄酒、白酒中相关研究进展,以期为今后红曲霉在酿酒中的生产管理、理论研究与技术开发提供参考。
1 提高红曲霉产酶能力的方法
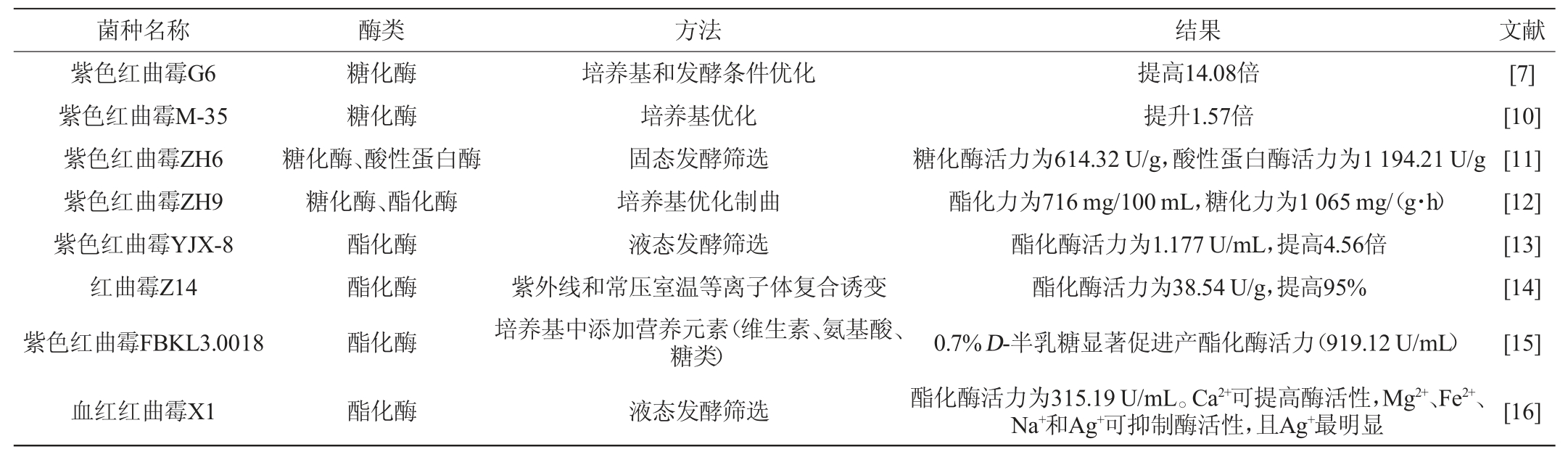
红曲霉发酵生产的糖化酶和淀粉酶可以作为糖化发酵剂酿制红曲酒,红曲酒在我国福建、浙江等省享誉盛名[6]。但即使作为有1 000多年酿造黄酒历史的古田红曲,其糖化酶活力低,很难适应现在的发酵时间快、成本低的市场要求[7]。不少学者致力于研究如何提高红曲霉的糖化酶活力,以培养基与发酵条件优化为主(见表1)。甚至研究加入非传统的培养基成分,如通过添加西洋参、红景天、芍药等中草药提高红曲中的糖化酶、蛋白酶和酯化酶活性以及红曲霉的数量,酶活提高后用于黄酒发酵能显著提高出酒率、总氨基酸含量和香气含量[8]。
酯化酶是一类催化合成低级脂肪酸酯的酶类的总称,主要是指脂肪酶、酯合成酶、磷酸酯酶的统称[12]。酯化酶在窖池内将酸与醇催化合成酯类,包括己酸乙酯、乙酸乙酯、乳酸乙酯等酯类物质,它们属白酒风味重要贡献物质,因此,酯化酶对白酒的风味至关重要[8]。红曲霉应用在白酒制曲生产时,红曲霉生长较为缓慢,在大曲菌系竞争优势较弱,不利于形成优势菌种;通过分离纯化等方式获得高酯化力或具特殊产物的纯种红曲霉菌株,再利用培养技术应用于强化制曲,可在白酒酿造生产中获得较好的应用效果[12]。因此,提高红曲霉的酯化酶活力是红曲霉研究的另一个热点,目前国内外相关研究见表1。
表1 提高红曲霉中糖化酶、蛋白酶和酯化酶活性的方法
Table 1 Methods for improving activities of amylase,protease and esterase in Monascus
2 提高红曲霉中有益次级代谢物和降低桔霉素的方法
红曲霉应用于酿酒行业除了因其有一定糖化发酵力和较强酯化力外[17],还因为红曲霉在代谢过程中能产生多种对人体有益的代谢产物,能增加酒的营养保健作用[18],以传统具有保健养生作用的黄酒为代表。红曲霉的有益次级代谢物有降脂效果与洛伐他汀相当的莫纳可林K[19-20]、具有降压作用的γ-氨基丁酸[21]等。
2.1 莫纳可林K
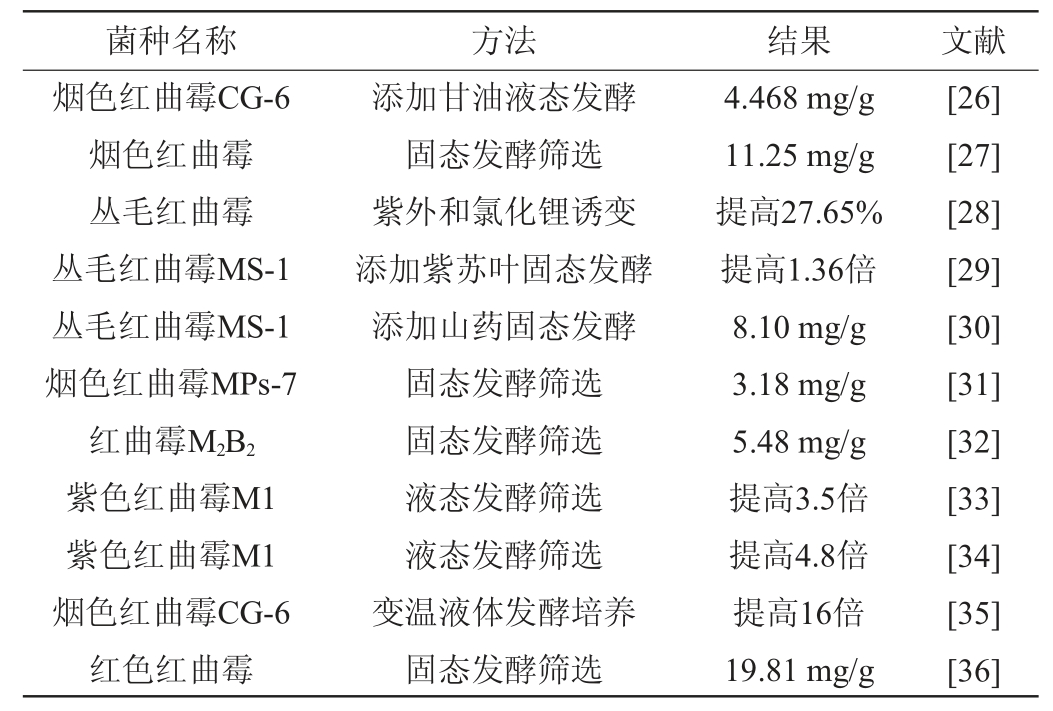
近年报道提高莫纳可林K产量的方法及相关文献见表2。
表2 筛选高产莫纳可林K红曲霉的方法
Table 2 Methods for screening Monascus with high-yield Monacolin K
莫纳可林K是1979年从红曲中分离出的一种能抑制胆固醇合成的活性物质,莫纳可林K通过与体内合成胆固醇的限速酶羟甲戊二酰辅酶(3-hydroxy-3-methyl glutaryl coenzyme A reductase,HMG-CoA)竞争,抑制胆固醇合成,从而降低血液总胆固醇水平[22]。另外,莫纳可林K还可以增加低密度脂蛋白胆固醇受体表达,从而降低体内低密度脂蛋白胆固醇含量[23]。红曲或莫纳可林K的调节血脂作用还可能与肠道菌群组成变化有关。给大鼠分别服用洛伐他丁、红曲米、红曲色素后,发现大鼠结肠中厚壁菌门和拟杆菌门比例显著降低(P≤0.01),毛螺菌科、瘤胃球菌科、普雷沃氏菌科和拟杆菌门S24-7菌群的丰度也发生了变化;结合转录组和代谢组联合分析显示,洛伐他丁、红曲米、红曲色素均能通过调节类固醇激素生物合成、甘油酯以及花生四烯酸的代谢途径改善大鼠脂质代谢[24]。近年研究发现,莫纳可林K还有抗癌作用,紫色红曲霉代谢产生的活性成分莫纳可林K能够清除癌细胞中黄嘌呤氧化酶体系引发的自由基,降低癌细胞线粒体中活性氧浓度,从而减少酸性神经酰胺酶生成,诱导癌细胞凋亡[25]。
2.2 红曲色素
红曲霉产生的红曲色素主要有6种,包括红色素(红斑胺素(rubropunctamine)和红曲红胺素(monascorubramine))、橙色素(红斑红曲素(rubropunctatin)和红曲红素(monascorubrin))、黄色素(红曲素(monascin)和安卡红曲黄素(ankaflavin))[37]。碳源和氮源与红曲色素的产量密切相关,通过影响红曲色素相关基因表达从而调控色素合成[38]。不同浓度亚油酸可作为一种信号分子,激活环磷酸腺苷(cyclic adenosine monophosphate,cAMP)-蛋白激酶A(protein kinase A,PKA)细胞信号通路,上调mokH和mokA基因转录水平,增加莫纳可林K和红曲红素产生[41]。除了培养基外,光和磁场等环境信号也影响红曲霉次生产物合成,研究发现,参与红曲色素和莫纳可林K生物合成的基因MpPhy受光和低频磁场影响,当暴露于白/蓝/绿/红光时,野生型紫色红曲霉色素产生会显著降低,但MpPhy基因缺失型紫色红曲霉暴露在白/红光时,色素产量与非光照环境没有显著差异。同时,用2.0 mT低频磁场处理MpPhy基因缺失型紫色红曲霉时,红曲色素产生会显著增加[40]。另一个研究也证实磁场能增加紫色红曲霉色素产量,在1.6 mT低频磁场处理后,红曲的黄色、红色和橙色色素产量分别增加72.9%、73.9%和40.1%,并且能使桔霉素产量减少45.0%,这与pskCT和ctnA转录下调以及pskPT、pigR、veA和laeA转录上调一致[41]。现有研究表明,红、橙、黄三种色素基本都是同步增加或下降;而通过氧化还原辅因子代谢工程策略调控,在800 mV/cm2电刺激下可以显著增加黄色红曲色素合成并抑制红色红曲色素产生,且无桔霉素合成[42]。
除了作为着色剂外,红曲色素还有潜在生理功能,包括抗炎、抗菌、抗病毒、减肥、调节胆固醇等[43-44]。动物实验发现,红曲素和红曲黄素可以增强抗氧化酶活性、降低脂质氧化程度、降低总胆固醇和甘油三酯水平[45]。红曲素对神经也有保护作用,在鱼藤酮诱导的帕金森疾病大鼠模型中,红曲素可以降低促炎因子水平,同时促进超氧化物歧化酶、谷胱甘肽过氧化物酶等抗氧化因子的表达,从而发挥神经元保护作用[46]。
2.3 桔霉素
桔霉素是红曲代谢产物,具有肝毒性和肾毒性,导致欧洲和美国停止使用红曲色素作为食品着色剂[47]。因此,如何减少桔霉素产生是红曲霉主要研究方向之一[48]。目前主要是通过菌种筛选、改造或制曲条件优化来获得高产莫纳可林K而不产/低产桔霉素的菌株见表3。研究指出,光、氧、氮源、酸碱度、温度、磁场等均会影响桔霉素生物合成,并同步影响莫纳可林K和红曲色素等有益活性成分生成[49]。最新研究已从基因水平阐明如何控制桔霉素产量[50-51]、如何避免红曲色素和莫纳可林K生成受影响。如外源添加抗坏血酸,通过抗氧化以及激活转录因子,增加富马酸和琥珀酸表达以减少桔霉素前体丙二酰辅酶(malonyl coenzyme A,malonyl CoA)生成,从而减少桔霉素合成,同时还促进了红曲色素合成并减少红曲色素降解[52]。有研究通过红曲霉基因测序,提出可根据桔霉素和莫纳可林K合成基因簇把红曲霉分为3类,包括能同时生成桔霉素和莫纳可林K的A类红曲霉、因缺少桔霉素基因簇不能生成桔霉素的B类红曲霉以及同时缺失桔霉素和莫纳可林K只生成红曲色素的C类红曲霉,可以根据不同生产需求通过基因测序筛选需要的菌株[53]。
表3 筛选高产莫纳可林K且不产/低产桔霉素红曲霉的方法
Table 3 Methods for screening Monascus with high-yield Monacolin K and non-yield and low-yield citrinin

然而,上述以提高红曲霉有益次级代谢物产量和降低桔霉素产生的方法研究中,较少关注红曲霉分泌酶的活力。糖化酶、酯化酶等分泌酶与次级代谢物在红曲霉的不同生长阶段产生,未来的研究需关注两阶段的产物指标,以便充分利用红曲霉分泌酶及代谢产物在酿酒中的应用价值。
3 红曲霉在黄酒酿造中的应用
黄酒是最早用红曲霉酿制的酒类[2]。红曲黄酒是以糯米为主要原料,添加红曲和白曲作为糖化发酵剂,经多种微生物酿造而成的一种低度酒,以色红、味醇、香浓著称[60]。
红曲黄酒独特挥发性风味组分形成与酒曲中微生物作用密切相关[61-62]。众多学者从生物学角度研究红曲黄酒酿酒机制[63-64]。用高通量测序技术分析福建红曲发现,红曲中优势微生物为芽孢杆菌属、魏斯氏菌属、片球菌属、黑曲霉、紫红曲霉和黄曲霉[65]。采用聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)技术和实时荧光定量聚合酶链式反应(real-time fluorescence quantitative polymerase chain reaction,RT-fqPCR)技术分析从福建地区采集的10种黄酒酿造用酒曲(5种古田红曲和5种乌衣红曲)的真菌菌群结构,结果表明乌衣红曲与古田红曲相比,具有更高的真菌菌群丰度、多样性及均匀性;乌衣红曲有更高的黄曲霉、米根霉、酵母菌菌量,然而两种酒曲中的红曲霉菌量无显著差异[66]。使用18S rRNA基因序列的聚合酶链式反应-限制性片段长度多态性(polymerase chain reaction-restriction fragment length polymorphism,PCR-RFLP)分型方法分析红曲黄酒传统酿造体系中真菌菌群的动态变化,显示真菌菌群结构处于不断变化中,酿造初期菌群种类多样,以紫色红曲霉、少根根霉、黑曲霉、米根霉等为主,酿造中后期这些优势菌有所减少,酿酒酵母逐渐成为优势菌,酒精度是影响红曲霉生长的关键因素[67]。
红曲霉在黄酒酿酒过程中能影响黄酒风味和增加黄酒中代谢产物[69]。对添加与不添加红曲的客家黄酒进行分析,结果显示,红曲对风味成分异戊醇、苯乙醇、乙酸异丁酯、异丁醇、棕榈酸乙酯和葵酸乙酯量影响较大,且仅添加红曲的客家黄酒中有160种多肽含量高于添加红曲的传统客家黄酒和不添加红曲的客家黄酒[68]。从中温大曲中筛选的3株红曲霉的研究结果显示,红曲霉糖化力较强、产生的红曲色素较多,并可生成较多的乳酸乙酯和乙酸乙酯[70]。有研究发现,红曲霉添加量与红曲黄酒中多酚成分及其抗氧化活性呈正比[71]。用红曲霉发酵糯米酒时,如果加入中草药会影响莫纳可林K的产量。陈皮、山楂和白芷这些中草药能够被红曲霉利用,通过影响莫纳可林K代谢基因转录因子和多个调节因子以及莫纳可林K的转运蛋白提高莫纳可林K产量,达到3.6 mg/g,比对照样提高41.18%。把中草药换为茯苓后,则会显著下调与莫纳可林K代谢相关的6个转录基因,导致莫纳可林K产量下降[72]。另有研究指出,红曲黄酒相比不添加红曲的黄酒,酒中酯类、醇类、醛类、酸类、酮类、酚类、含氮物质的种类以及酯类、酸类、酮类的含量均提高;同时,在发酵过程中添加锌/镁等金属离子能进一步提高酯类、酸类、酮类物质的种类和含量[73]。
4 红曲霉在白酒酿造中的应用
白酒是以粮谷为主要原料,以大曲、小曲、麸区、酶制剂及酵母等糖化发酵剂,经蒸煮、糖化、发酵、蒸馏、陈酿、勾调而成的蒸馏酒,可分为酱香、浓香、清香等十二大香型[74]。酯化酶对酒风格形成起到举足轻重作用[75]。传统白酒尤其是浓香型白酒由于受自然条件和制曲工艺技术的影响,普遍存在着酯化酶活力低的问题,因此,白酒香气产生过程缓慢且产量较低[76]。在酿造中引入新型酯化酶,不仅能够缩短发酵周期,而且产品品质也能够得到提升[77]。
本团队从青酒大曲中分离筛选到一株高产酯化酶的紫色红曲霉FBKL3.0018菌株,其用于生产高酯化大曲,使用该大曲可以加速窖内酒醅酯化;用红曲代替部分大曲酿酒时,酒样总酸、总酯均高于对照酒样,出酒率、优质品率比对照组有明显上升,分别提高1.7%和10.6%,己酸乙酯最高达5.04 g/L。减少曲用量时,酒样总酸、总酯均仍高于对照组酒样,优质品率提高10.8%,己酸乙酯含量高于对照组,且乳酸乙酯含量低于对照组[78]。另一研究从白酒酒曲中分离出一株紫色红曲霉YJX-8,并发现了一种新型酯化酶LIP05,通过基因组和转录组研究以及酶工程分析,显示该酯化酶属α/β水解酶家族,分子质量低且易于表达,在水相中不需辅助因子即可合成乙酸乙酯等酯类[79]。将酯化红曲、生香酵母、酿酒酵母制成的强化麸曲应用于大曲清香型白酒酿造,发酵过程升温速度、淀粉利用程度、酒醅糖化效果均优于对照组,且乙酸乙酯和乳酸乙酯含量高于对照组,酒质好于对照组[80]。
除了应用红曲霉酿造白酒外,还可用红曲霉处理白酒相关副产物。利用红曲霉发酵酿酒尾水生成酯化酶液,在最优反应条件下,乙酸乙酯含量高达222.7 mg/L,乳酸乙酯含量由92.9 mg/L下降至74.6 mg/L,乳酸乙酯与己酸乙酯的比值小于1,此酯化液可用于白酒勾兑,这不仅大幅提高了酒体中总酯含量,还减少了乳酸乙酯对主体香型的抑制和青涩杂味,使酒体香气更为突出协调[81]。白酒酿造主要副产物黄水富含多种有机物,也适用于红曲发酵制备酯化液。用一株高产酯化酶红曲霉菌株Monascus sanguineus X1对黄水进行发酵,在最佳培养条件下,发酵后的酯化液中乙酸乙酯体积分数可达0.12%[82]。
5 结论与展望
目前,红曲霉在酿酒行业中应用研究主要集中在黄酒,其在白酒酿造中应用研究较少,尤其在酱香型白酒酿造中应用鲜见报道,这与红曲霉在高温时培养难度较大、强化红曲霉的酶活力不稳定、应用效果不明显等问题有关,还需业界人士进行更多探索。另外,在白酒酿造中对于红曲霉的活性代谢产物难以通过蒸馏带入酒中的技术难题,可考虑采用固液萃取方法,使红曲中有益活性物质溶于酒基中。众多红曲代谢物机理研究主要关注莫纳可林K,对于其他红曲代谢产物的调控及机理研究较少。因此,未来研究一方面可利用代谢组、蛋白质组、基因组、微生物组等组学技术和细胞、动物模型,探究红曲菌对发酵底物代谢机理及调节机制以及代谢产物的生理功能,并可考虑运用人工智能和机器学习技术帮助处理、解释微生物组和代谢组的海量数据[83];另一方面,利用成熟的分子生物学技术对其关键基因进行基因敲除/过表达[84]、定向改造,获得高产糖化酶和酯化酶和有益次级代谢物、不产桔霉菌的红曲霉菌株,将其用于黄酒、白酒生产中,提高发酵原料淀粉转化率、促进酯类成分的合成,提高黄酒中有益成分种类与含量、改善白酒品质。
[1]蒋沅岐,董玉洁,周福军,等.红曲的化学成分药理作用及临床应用研究进展[J].中草药,2021,52(23):7379-7388.
[2]LIU Z B,WANG Z Y,LV X C,et al.Comparison study of the volatile profiles and microbial communities of Wuyi Qu and Gutian Qu,two major types of traditional fermentation starters of Hong Qu glutinous rice wine[J].Food Microbiol,2018,69(2):105-115.
[3]周康熙,陈颖,倪莉.红曲霉分离纯化,分类和鉴定研究进展[J].中国酿造,2021,40(1):7-13.
[4]单夏男.中国部分白酒大曲红曲霉遗传及生理学多样性的研究[D].金华:浙江师范大学,2022.
[5]LIN C H,LIN T H,PAN T M.Alleviation of metabolic syndrome by monascin and ankaflavin:the perspective of Monascus functional foods[J].Food Funct,2017,8(6):2102-2109.
[6]周容,王奕芳,李良,等.红曲在酿酒行业中的应用进展[J].酿酒,2018,45(5):23-28.
[7]陈景智,林娟,叶秀云,等.紫色红曲霉液态发酵产糖化酶的工艺研究[J].食品工业科技,2017,38(14):146-150.
[8]LUO F,LI L,WU Z Y,et al.Development of new red mold rice and determination of their properties[J].LWT-Food Sci Technol,2018,87:259-265.
[9]罗小叶,邱树毅,王晓丹.微生物发酵产酯化酶在浓香型白酒品质提升中研究进展[J].中国酿造,2019,38(8):6-8.
[10]许楚旋,江北,张琪,等.紫色红曲霉M-35菌株产淀粉酶发酵条件和培养基配方的优化[J].湖南农业科学,2017(4):5-10.
[11]李红胜,邢宏博,许赣荣,等.红曲菌固态发酵产消化酶生产工艺优化[J].广东农业科学,2021,48(11):133-142.
[12]程伟,张杰,潘天全,等.一株紫色红曲霉菌强化制曲的工艺优化[J].中国酿造,2020,39(10):71-74.
[13]许春艳,孙宝国,徐友强,等.合成己酸乙酯酯化酶产生菌的鉴定及产酶条件优化[J].中国食品学报,2020,20(5):138-147.
[14]赵志军,赵婷,刘延波,等.酯化型红曲菌复合诱变选育及其固态发酵条件优化[J].食品工业科技,2021,42(2):76-82.
[15]孟卓妮,王艳,吴鑫颖,等.不同营养元素对紫色红曲霉液态发酵产酯化酶的影响初探[J].中国酿造,2019,38(3):76-80.
[16]刘欢欢,杨帆,李贞景,等.高产酯化酶红曲菌的筛选、鉴定及酶学性质研究[J].中国酿造,2019,38(5):49-53.
[17]REN X Y,HE Z G,LIN X Z,et al.Screening and evaluation of Monascus purpureus FJMR24 for enhancing the raw material utilization rate in rice wine brewing[J].J Sci Food Agr,2021,101(1):185-193.
[18]周靖.红曲霉在白酒产业中的应用现状及展望[J].酿酒科技,2019(3):107-109.
[19]CICERO A F G,FOGACCI F,BANACH M.Red yeast rice for hypercholesterolemia[J].Method DeBakey Cardiov J,2019,15(3):192-199.
[20]NGUYEN T P T,GARRAHAN M A,NANCE SA,et al.Assimilation of cholesterol by Monascus purpureus[J].J Fungi,2020,6(4):352.
[21]苗君莅.γ-氨基丁酸的概述[J].食品工业,2021,42(4):363-366.
[22]ZHANG Y,CHEN Z T,WEN Q Y,et al.An overview on the biosynthesis and metabolic regulation of monacolin K/lovastatin[J].Food Funct,2020,11(7):5738-5748.
[23]XIONG Z X,CAO X H,WEN Q Y,et al.An overview of the bioactivity of monacolin K/lovastatin[J].Food Chem Toxicol,2019,131:110585.
[24]YANG H,PAN R H,WANG J,et al.Modulation of the gut microbiota and liver transcriptome by red yeast rice and Monascus pigment fermented by purple Monascus SHM1105 in rats fed with a high-fat diet[J].Front Pharmacol,2021,11:599760.
[25]KUROKAWA H,ITO H,MATSUI H. Monascus purpureus induced apoptosis on gastric cancer cell by scavenging mitochondrial reactive oxygen species[J].J Clin Biochem Nutr,2017,61(3):189-195.
[26]薛意斌,任志远,樊筱园,等.甘油对红曲霉CG-6莫纳可林K合成及相关基因表达的影响[J].食品科学技术学报,2018,36(6):33-38.
[27]张占军,王富花.基于红曲高产莫纳可林K的固态发酵工艺条件优化[J].食品研究与开发,2020,41(7):124-130.
[28]吴双双,刘文龙,邓雪菲,等.紫外-化学诱变筛选高产莫纳可林K或色素的红曲菌株[J].中国酿造,2018,37(11):116-121.
[29]卢绍闯,胡琳慧,冯艳丽.紫苏叶对红曲菌产色素和莫纳可林K及抗氧化物的影响[J].中国酿造,2017,36(11):101-104.
[30]覃学领,吴佩芝,余伊鑫,等.丛毛红曲菌固态发酵山药产莫纳可林K的影响因素研究[J].中国酿造,2021,40(12):98-102.
[31]史成,王笑,高嘉欣,等.两种辅料对固态发酵红曲米莫纳可林K与红曲色素产量的影响[J].食品科学技术学报,2020,38(4):119-126.
[32]陈慎,黄颖颖,陆东和,等.外加营养源对红曲霉固态发酵产莫纳可林K和洛伐他汀的影响[J].中国食品添加剂,2017(9):102-113.
[33]ZHANG C,LIANG J,YANG L,et al.Glutamic acid promotes monacolin K production and monacolin K biosynthetic gene cluster expression in Monascus[J].AMB Express,2017,7(1):22.
[34]ZHANG C,CHAI S,HAO S,et al.Effects of glutamic acid on the production of monacolin K in four high-yield monacolin K strains in Monascus[J].Appl Microbiol Biot,2019,103(13):5301-5310.
[35]LIN L,WANG C,LI Z,et al.Effect of temperature-shift and temperature-constant cultivation on the Monacolin K biosynthetic gene cluster expression in Monascus sp.[J].Food Technol Biotech,2017,55(1):40-47.
[36]ZHANG B B,XING H B,JIANG B J,et al.Using millet as substrate for efficient production of monacolin K by solid-state fermentation of Monascus ruber[J].J Biosci Bioeng,2018,125(3):333-338.
[37]LIU L J,ZHAO J X,HUANG Y L,et al.Diversifying of chemical structure of native Monascus pigments[J].Front Microbiol,2018,9:3143.
[38]TONG A J,LU J Q,HUANG Z R,et al.Comparative transcriptomics discloses the regulatory impact of carbon/nitrogen fermentation on the biosynthesis of Monascus kaoliang pigments[J].Food Chem,2022,13:100250.
[39]HUANG J,LIAO N Q,LI H M,et al.Linoleic acid enhance the production of moncolin K and red pigments in Monascus ruber by activating mokH and mokA,and by accelerating cAMP-PkA pathway[J].Int J Biol Macromol,2018,109:950-954.
[40]XIONG X Q,LIU Y B,ZHANG J L,et al.Mutational analysis of MpPhy reveals magnetoreception and photosensitivity involvement in secondary metabolites biosynthesis in Monascus purpureus[J].J Photoch Photobio B,2021,217:112164.
[41]XIONG X Q,ZHEN Z X,LIU Y B,et al.Low-frequency magnetic field of appropriate strengths changed secondary metabolite production and Na+concentration of intracellular and extracellular Monascus purpureus[J].Bioelectromagnetics,2020,41(4):289-297.
[42]LIU J,WU J Y,CAI X R,et al.Regulation of secondary metabolite biosynthesis in Monascus purpureus via cofactor metabolic engineering strategies[J].Food Microbiol,2021,95:103689.
[43]KIM D,KU S.Beneficial effects of Monascus sp.KCCM 10093 pigments and derivatives:a mini review[J].Molecules,2018,23(1):98.
[44]SHI Y X,CHEN W S.Monascin ameliorate inflammation in the lipopolysaccharide-induced BV-2 microglial cells via suppressing the NF-κB/p65 pathway[J].Iran J Basic Med Sci,2020,23(4):461-468.
[45]LEE C L.Monascin and ankaflavin of Monascus purpureus prevent alcoholic liver disease through regulating AMPK-mediated lipid metabolism and enhancing both anti-inflammatory and anti-oxidative systems[J].Molecules,2021,26(20):6301.
[46]LIN Q Y,HOU S,DAI Y Y,et al.Monascin exhibits neuroprotective effects in rotenone model of Parkinson's disease via antioxidation and antineuroinflammation[J].Neuro Rep,2020,31(9):637-643.
[47]DUJOVNE C A.Red yeast rice preparations:are they suitable substitutions for statins?[J].Am J Med,2017,130(10):1148-1150.
[48]陈慎,黄颖颖,杨成龙.酿造红曲研究现状与展望[J].中国酿造,2022,41(5):8-12.
[49]JIA S,QIN X L,ZHAO X X,et al.Strategies to enhance the production efficiency of Monascus pigments and control citrinin contamination[J].Process Biochem,2022,117:19-29.
[50]ZHANG J,GAO J,LI M,et al.MrGcn5 is required for the mycotoxin production,sexual and asexual development in Monascus ruber[J].Food Biosci,2021,43:101304.
[51]ZHENG Y F,HUANG Y Y,MAO Z J,et al.Histone deacetylase MrRpd3 plays a major regulational role in the mycotoxin production of Monascus ruber[J].Food Control,2022,132:108457.
[52]SHENG W,HE Y F,YANG J,et al.Effects of exogenous ascorbic acid on yields of citrinin and pigments,antioxidant capacities,and fatty acid composition of Monascus ruber[J].LWT-Food Sci Technol,2022,154:112800.
[53]LIU A,CHEN A J,LIU B Y,et al.Investigation of citrinin and monacolin K gene clusters variation among pigment producer Monascus species[J].Fungal Genet Biol,2022,160:103687.
[54]吴玉峰,刘双平,韩笑,等.酿酒用高产洛伐他汀红曲菌的筛选[J].食品科学技术学报,2021,39(6):77-86.
[55]庄月娥,陈华观.高产莫纳可林K,低产桔霉素的红曲霉菌株筛选及其发酵条件优化[J].福建农业科技,2020(1):6-10.
[56]GHOSH S,DAM B.Genome shuffling improves pigment and other bioactive compound production in Monascus purpureus[J].Appl Microbiol Biotechnol,2020,104(24):10451-10463.
[57]ZHEN Z X,XIONG X Q,LIU Y B,et al.NaCl inhibits citrinin and stimulates Monascus pigments and monacolin K production[J].Toxins,2019,11(2):118.
[58]LI Z,LIU Y,LI Y,et al.Screening and identification of Monascus strains with high-yield monacolin K and undetectable citrinin by integration of HPLC analysis and pksCT and ctnA genes amplification[J].J Appl Microbiol,2020,129(5):1410-1418.
[59]MARI A,SKOCAJ M,LIKAR M,et al.Comparison of lovastatin,citrinin and pigment production of different Monascus purpureus strains grown on rice and millet[J].J Food Sci Technol,2019,56(7):3364-3373.
[60]吕旭聪,蒋雅君,胡荣康,等.红曲黄酒传统酿造用曲的特征挥发性风味成分分析[J].中国食品学报,2019,19(5):222-233.
[61]TIAN S F,ZENG W Z,FANG F,et al.The microbiome of chinese rice wine(Huangjiu)[J].Curr Res Food Sci,2022,5:325-335.
[62]董洋,刘亚琼,刘姗姗.杂粮红曲酒高级醇及其挥发性风味物质研究[J].酿酒科技,2017(3):55-59.
[63]HUANG Y Y,LIANG Z C,LIN X Z,et al.Fungal community diversity and fermentation characteristics in regional varieties of traditional fermentation starters for Hong Qu glutinous rice wine[J].Food Res Int,2021,141:110146.
[64]HUANG Z R,GUO W L,ZHOU W B,et al.Microbial communities and volatile metabolites in different traditional fermentation starters used forHong Qu glutinous rice wine[J].Food Res Int,2019,121:593-603.
[65]李路,吕燕霖,郭伟灵,等.红曲黄酒传统酿造用曲中的微生物菌群及挥发性风味组分分析[J].食品科学,2019,40(2):79-84.
[66]王智耀,卞丹,何理琴,等.红曲黄酒酿造用曲真菌菌群分析[J].中国食品学报,2019,19(1):200-206.
[67]吕旭聪,刘志彬,张雯,等.红曲黄酒传统酿造体系中真菌菌群多样性分析方法的构建及其应用[J].中国食品学报,2018,18(8):214-223.
[68]ZHAO W H,QIAN M,D H,et al.Effect of Hong Qu on the flavor and quality of Hakka yellow rice wine(Huangjiu)produced in southern China[J].LWT-Food Sci Technol,2022,160:113264.
[69]SAKANDAR H A,HUSSAIN R,KHAN Q F,et al.Functional microbiota in Chinese traditional Baijiu and Mijiu Qu(starters):A review[J].Food Res Int,2020,138:109830.
[70]夏培禹,袁宁,管桂坤,等.红曲霉的初筛及在黄酒酿造中的应用[J].酿酒科技,2020(2):121-124.
[71]陆方菊,彭斌,何松贵,等.红曲米添加量对红曲酒多酚成分及其抗氧化活性的影响[J].中国酿造,2019,38(5):113-118.
[72]PENG L,AI-LATI A,LIU S P,et al.Effects of Chinese medicines on monacolin K production and related genes transcription of Monascus ruber in red mold rice fermentation[J].Food Sci Nutr,2020,8:2134-2142.
[73]钟明叶,刘学彬,王久明,等.红曲对黄酒挥发性风味物质的影响[J].酿酒科技,2020(3):105-111.
[74]国家市场监督管理总局,国家标准化管理委员会.GB/T 15109—2021白酒工业术语[S].北京:中国标准出版社,2021.
[75]王艳,吴鑫颖,胡娜,等.紫色红曲霉FBKL3.0018液态发酵产酯化酶的工艺优化[J].食品工业科技,2018,39(15):147-153.
[76]杨磊,穆敏敏,文成兵,等.浓香型白酒提质增香技术研究进展[J].酿酒,2022,49(1):17-21.
[77]张瑞瑞,徐子一,孙厚权,等.新型酯化酶在传统白酒酿造行业中的应用[J].酿酒,2018,45(6):13-16.
[78]罗小叶,胥思霞,邱树毅,等.高酯化大曲催化增香技术在浓香型白酒生产上的应用[J].中国酿造,2018,37(10):141-144.
[79]XU Y Q,WANG X C,LIU X,et al.Discovery and development of a novel short-chain fatty acid ester synthetic biocatalyst under aqueous phase from Monascus purpureus isolated from Baijiu[J].Food Chem,2021,338:128025.
[80]管健,廖蓓,常煦,等.功能菌在大曲清香型白酒生产中的应用[J].酿酒科技,2018(10):103-107.
[81]方春玉,周健,李智.红曲霉发酵液酯化酿酒尾水制备酯化液的研究[J].食品工业科技,2018,39(13):46-50.
[82]刘丹,杨帆,薛意斌,等.红曲霉Monascus sanguineus X1处理黄水的培养基优化及酯化液制备[J].食品科学技术学报,2020,38(1):36-42.
[83]CHEN G M,HUANG Z R,WU L,et al.Microbial diversity and flavor of Chinese rice wine(Huangjiu):an overview of current research and future prospects[J].Curr Opin Food Sci,2021,42:37-50.
[84]唐光甫,桂艳玲,满海乔,等.利用CRISPR/Cas9编辑红曲霉pyrG基因对其次生代谢的影响[J].生物技术通报,2022,38(9):109-115.