杨梅(Myrica rubra(Lour.)S.et Zucc.),是一种在我国长江南部地区广泛种植的双子叶纲杨梅科杨梅属常绿乔木植物[1-2]。杨梅果实富含维生素、有机酸和膳食纤维等多种具有生物功能活性的有效成分,被认为是对人体健康有益的功能水果[3-4]。杨梅果实无外皮包裹,其柔软多汁,易受机械损伤,并且杨梅表面凹凸不平,利于微生物繁殖,采后果实品质劣变迅速,不耐贮运[5-6]。为避免杨梅资源浪费,杨梅深加工技术的研究势在必行。目前市场上杨梅深加工产品主要有:杨梅干[7]、杨梅果浆、杨梅速溶干粉[8]和杨梅渣饮料[9]等,关于杨梅酿造型果酒的产品较少。
酵母菌在果酒发酵中起着重要的作用,可将大分子物质分解为易于人体吸收的小分子物质,并利用无机元素形成特殊风味[10]。杨梅具有独特的香气和酸甜味,添加酵母菌进行发酵后可保留其特殊香气,并且保留杨梅特殊色泽[11]。CHEN H等[1]使用气相色谱-质谱联用(gas chromatographymass spectrometer,GC-MS)仪[12-13]研究杨梅发现,薄荷醇、石竹烯、芳樟醇和乙酸等化合物是构成杨梅独特香气的重要成分。但酵母菌发酵后杨梅酒的香气物质是否会发生变化,迄今为止研究较少。
本研究采用安琪酵母RV171酿造杨梅果酒,考察酵母菌添加量、发酵温度和发酵时间等影响因素对杨梅酒酒精度的影响,并采用单因素及响应面试验优化其发酵工艺[14],并对杨梅酒挥发性风味成分进行分析,为杨梅汁的制备提供理论依据和技术参考。
1 材料与方法
1.1 材料与试剂
杨梅:南京福晶农业科技有限公司;RV171酵母菌:安琪酵母股份有限公司。
果胶酶(≥40 U/mg)、纤维素酶(100 U/mg),偏重亚硫酸钾(分析纯):上海蓝季生物公司;高纯氦气(He):南京化学股份有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
LRH-70生化培养箱:上海一恒科学仪器有限公司;KDM型控温电热套:山东科诚科学仪器有限公司;DB-Wax毛细管色谱柱(30 m×0.25 mm,0.25 μm):美国Agilent公司;手动固相微萃取(solid-phase microextraction,SPME)进样器、二乙烯苯/碳分子筛/聚二甲基硅氧烷共聚物萃取头:美国Supeclo公司;SCIONSQ-456气相色谱-质谱联用仪:美国Bruker公司。
1.3 方法
1.3.1 杨梅酒发酵工艺流程

操作要点:
(1)杨梅要保证新鲜,无异味,无腐烂特征;
(2)添加0.4%复合酶(果胶酶∶纤维素酶=3∶1)在45 ℃水浴环境中酶解60 min[14];
(3)取10~20倍于酵母质量的杨梅汁稀释液溶解RV171酵母菌,在37 ℃水浴环境活化10~20 min;
(4)使用白砂糖调节糖度为24°Bx;
(5)添加食品级偏重亚硫酸钾,调节SO2质量浓度为60 mg/L;
(6)使用0.22 μm滤膜过滤杨梅酒。
1.3.2 酒精度的测定方法
根据侍崇娟等[15]的方法测定杨梅酒酒精度。
1.3.3 杨梅酒发酵条件优化单因素试验
(1)酵母添加量对杨梅酒酒精度的影响
设置杨梅汁中酵母添加量为0.1%、0.2%、0.3%、0.4%、0.5%、0.6%,在28 ℃的恒温培养箱中发酵10 d,发酵结束后测定杨梅酒酒精度。
(2)发酵温度对杨梅酒酒精度的影响
杨梅汁中添加0.3%酵母菌,在发酵温度分别为20 ℃、22 ℃、24 ℃、26 ℃、28 ℃、30 ℃,于恒温培养箱发酵10 d,发酵结束后测定杨梅酒酒精度。
(3)发酵时间对杨梅酒酒精度的影响
杨梅汁中添加0.3%酵母菌,在26 ℃恒温培养箱中分别发酵0、2 d、4 d、6 d、8 d、10 d、12 d,发酵结束后测定酒精度。
1.3.4 杨梅酒发酵条件优化响应面试验设计
在单因素试验的基础上,根据Box-Behnken 试验设计原理[14],以酵母菌添加量(X1)、发酵温度(X2)和发酵时间(X3)为考察因素,通过响应面分析,优化杨梅酒发酵工艺最优参数。具体因素及水平见表1。
表1 杨梅酒发酵条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for bayberry wine fermentation conditions optimization

1.3.5 杨梅酒挥发性风味成分分析
杨梅汁挥发性成分采用顶空固相微萃取方法萃取,参考CHEN H等[16]方法并修改,取5 mL杨梅汁于15 mL样品瓶,添加1.6 g NaCl,在50 ℃水浴环境中,350 r/min平衡20 min后插入萃取头萃取20 min,手动进样后,250 ℃解吸3 min。
(1)色谱条件[16]
DB-Wax毛细管色谱柱(30 m×0.25 mm,0.25 μm);载气为高纯氦气(He),流速1.0 mL/min;不分流;升温程序为起始柱温50 ℃,以5 ℃/min的速率升温至90 ℃,再以10 ℃/min的速率升温至230 ℃,保留15 min。
(2)质谱条件
进样口与接口温度均为250 ℃;离子源温度200 ℃;电子电离(electronic ionization,EI)源;电子能量70 eV;灯丝发射流量80 μA;质量扫描范围30~450 m/z。
(3)定性定量
运用计算机谱图美国国家标准技术研究所(national institute of standards and technology,NIST)和Wiley进行初步检索及资料分析,再结合文献进行人工谱图解析,进而确定各挥发性化合物;按总离子流色谱图峰面积归一化法进行相对定量,并以归一化面积的相对含量表示。
1.3.6 数据处理及分析
所有试验均重复3次,试验结果取平均值,数据采用Origin 2019与Design Expert 8.0.6 进行数据分析和图表绘制。用SPSS 17.0进行单因素方差分析,并检验数据的差异显著性(P<0.05表示差异显著)。
2 结果与分析
2.1 杨梅酒发酵工艺优化单因素试验结果
2.1.1 酵母菌添加量对杨梅酒酒精度的影响
酵母菌添加量对杨梅酒酒精度的影响见图1。由图1可知,杨梅汁在28 ℃的恒温培养箱中发酵10 d时,随着酵母菌添加量的增加,杨梅酒酒精度呈先上升后下降趋势。酵母菌添加量在0.1%~0.3%时,杨梅酒酒精度显著升高(P<0.05),是由于发酵初期酵母菌含量少,会消耗原料中的能量用于生长繁殖酵母菌[17];酵母菌添加量为0.3%时,杨梅酒酒精度达到最大值,为12.03%vol,杨梅汁发酵完全;酵母添加量继续增加,由于初始酵母菌含量过高,消耗过多糖分,发酵后期缺少能量,导致酒精含量降低。因此,酵母添加量为0.3%为最适添加量。
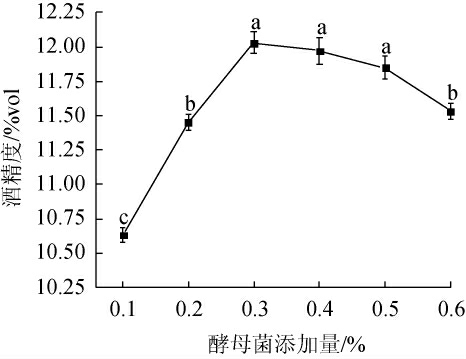
图1 酵母菌添加量对杨梅酒酒精度的影响
Fig.1 Effect of yeast addition on alcohol content of bayberry wine
不同小写字母表示差异显著(P<0.05)。下同。
2.1.2 发酵温度对杨梅酒酒精度的影响
发酵温度对杨梅酒酒精度的影响如图2所示。由图2可知,杨梅汁添加0.3%酵母菌发酵10 d时,随着发酵温度的升高,杨梅酒酒精度呈先上升后下降趋势。发酵温度在20~26 ℃时,随着发酵温度升高,杨梅酒酒精度显著升高(P<0.05),是由于温度较低时,酵母菌活力较低,发酵速度缓慢,温度升高时,发酵菌种活力升高,致使酒精度上升[15];发酵温度在26 ℃时,杨梅酒酒精度达到最大值为12.15%vol;发酵温度继续升高,会使酵母菌生长提前进入衰亡期,导致酒精度降低。根据实际生产需求,杨梅酒发酵最适温度为26 ℃。
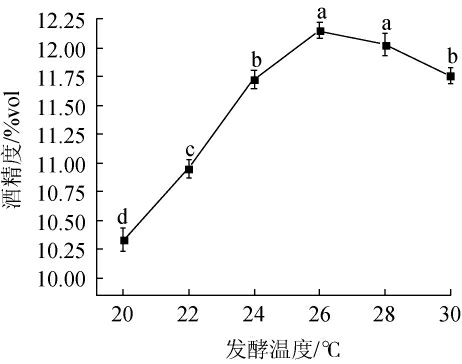
图2 发酵温度对杨梅酒酒精度的影响
Fig.2 Effect of fermentation temperature on alcohol content of bayberry wine
2.1.3 发酵时间对杨梅酒酒精度的影响
发酵时间对酒精度的影响如图3所示。由图3可知,杨梅汁添加0.3%酵母菌在26 ℃进行发酵,随着发酵时间的延长,杨梅酒酒精度先升高后趋于稳定。发酵时间为0~8 d时,杨梅酒酒精度显著上升(P<0.05);发酵第8天时,杨梅酒酒精度达到最大值为12.12%vol;发酵时间延长,杨梅酒酒精度无显著变化(P>0.05)。因此,杨梅酒最适发酵时间为8 d。
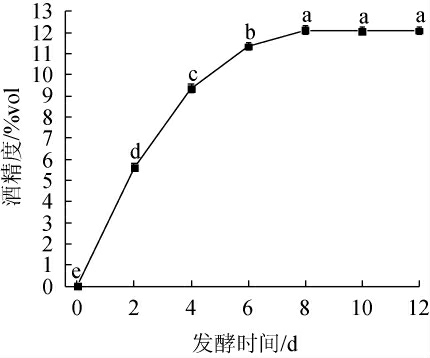
图3 发酵时间对杨梅酒酒精度的影响
Fig.3 Effect of fermentation time on alcohol content of bayberry wine
2.2 杨梅酒发酵工艺优化响应面试验
2.2.1 响应面试验设计方案及结果
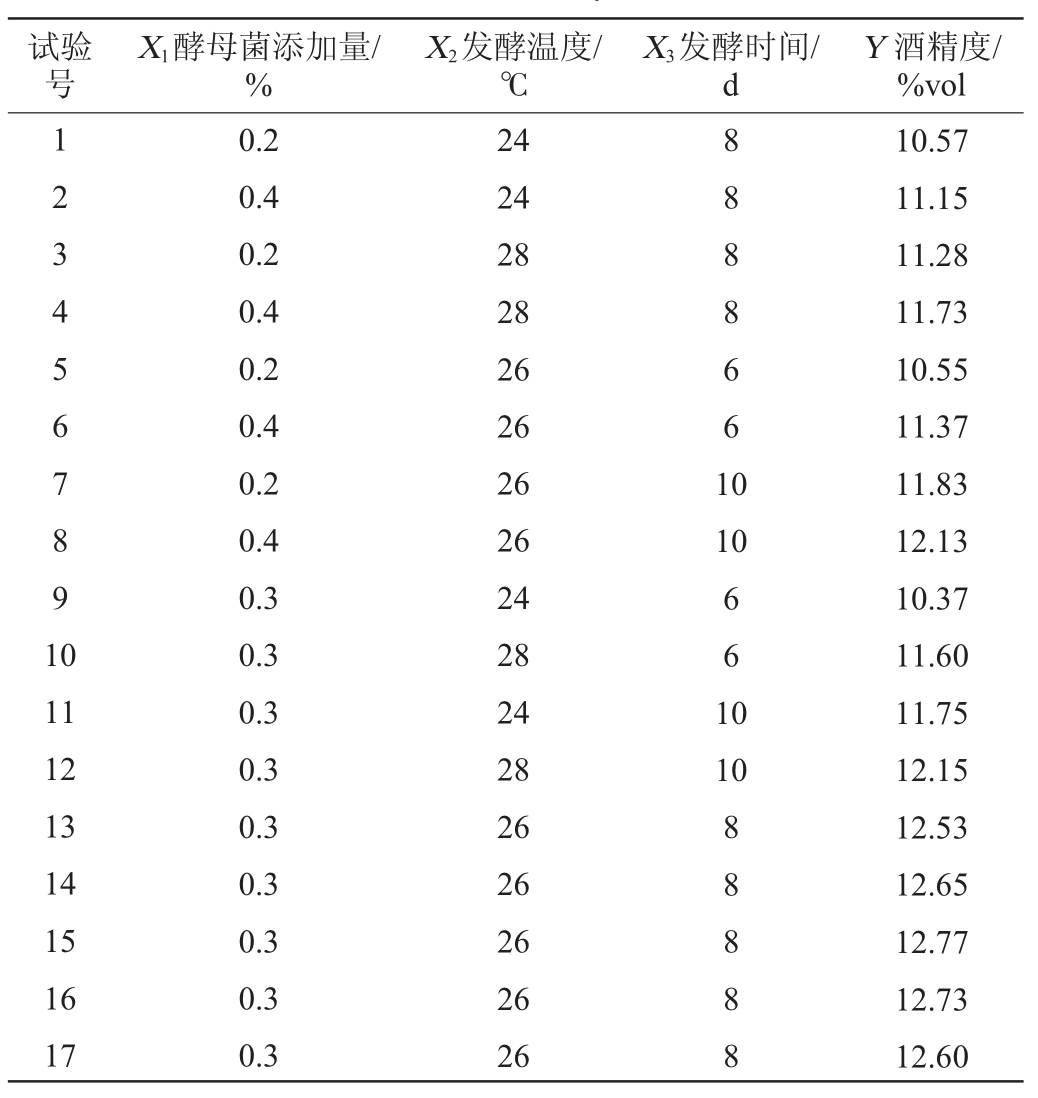
在单因素试验的基础之上,选取酵母菌添加量(X1)、发酵温度(X2)、发酵时间(X3)为自变量,杨梅酒酒精度(Y)为响应值,进行3因素3水平的响应面优化试验,试验设计及结果见表2。
表2 杨梅酒发酵条件优化响应面试验设计及结果
Table 2 Design and results for response surface tests for bayberry wine fermentation conditions optimization
2.2.2 响应面数学模型建立与方差分析
使用Design-Expert 8.0.6统计分析软件对表2中的试验结果进行线性二次多项式回归拟合,并建立二次多元回归方程:Y=12.66+0.27X1+0.37X2+0.50X3-0.033X1X2-0.13X1X3-0.21X2X3-0.74X12-0.74X22-0.45X32。模型的方差分析结果见表3。
表3 回归模型的方差分析结果
Table 3 Results of variance analysis of regression model
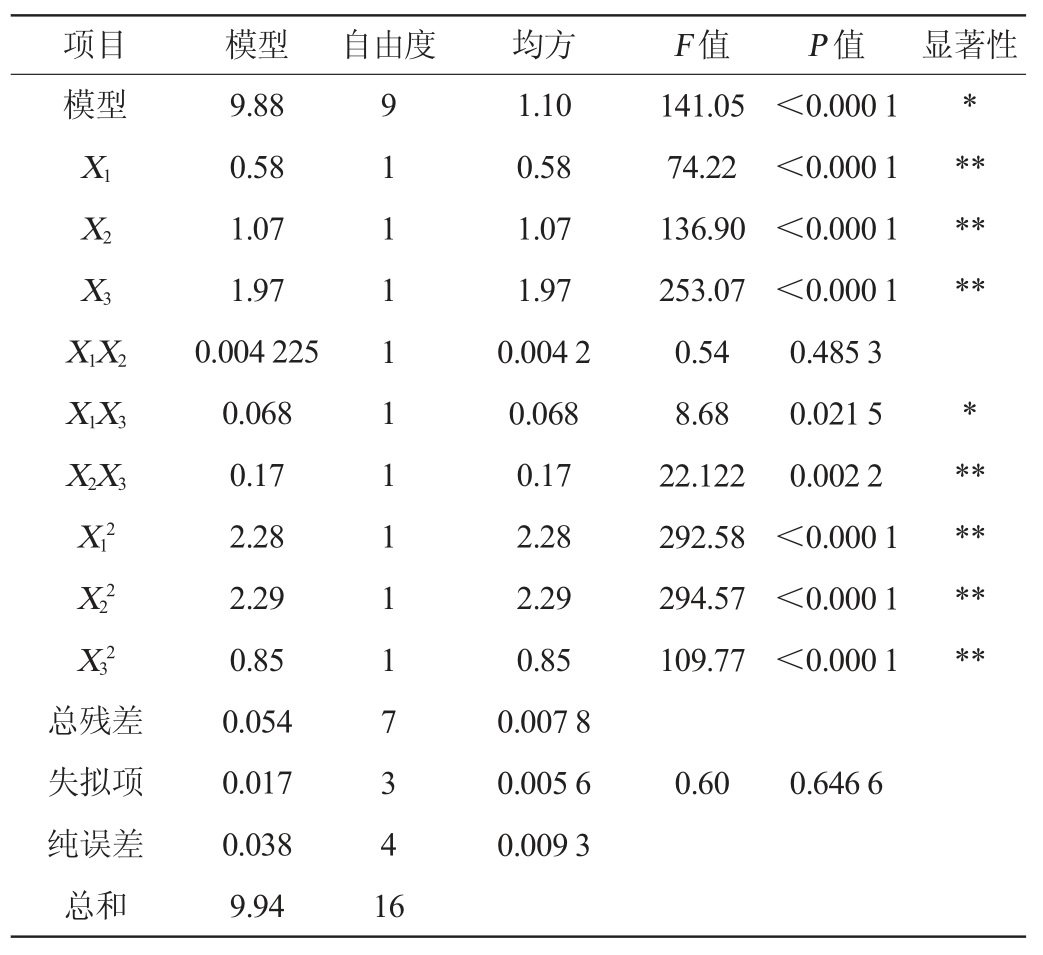
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
由表3可知,该模型极显著(P<0.000 1),失拟项P=0.646 6>0.05,不显著;决定系数R2=0.994 5,调整决定系数R2Adj=0.987 5,说明该数学模型与试验结果拟合较好[18],试验值与预测值有着高度的相关性,各因素与响应值间线性关系显著,可用于杨梅出汁率理论预测。由F检验判断得到,各因素对杨梅酒酒精度的影响大小顺序为发酵时间(X3)>发酵温度(X2)>酵母菌添加量(X1)。由表3亦可知,一次项X1、X2、X3、交互项X2X3及二次项X12、X22、X32对杨梅酒酒精度的影响极显著(P<0.01),交互项X1X3对杨梅酒酒精度的影响显著(P<0.05),其他项对结果影响不显著(P>0.05)。
2.2.3 响应面分析
酵母菌添加量及发酵温度与发酵时间间交互作用对杨梅酒酒精度影响的响应面及等高线见图4。由图4可知,响应面呈凸状,等高线呈椭圆形,说明交互作用明显,这与方差分析结果一致。
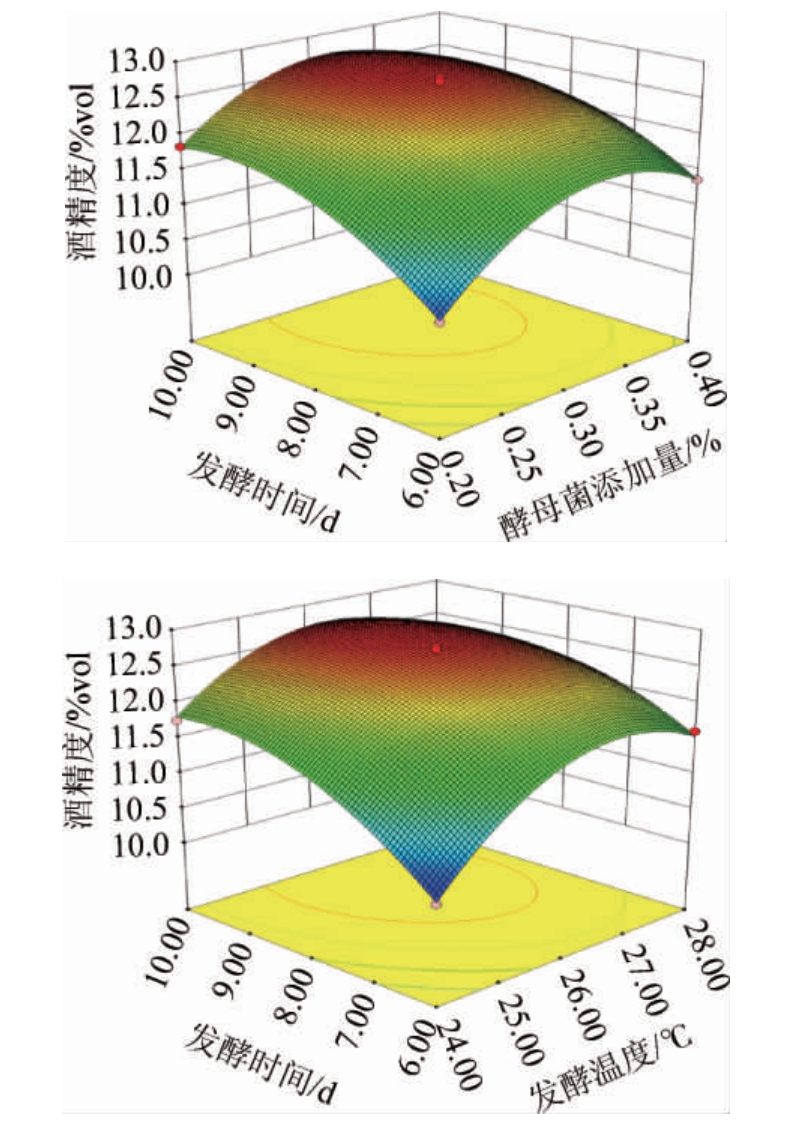
图4 各因素间交互作用对杨梅酒酒精度影响的响应曲面及等高线
Fig.4 Response surface plots and contour lines of effect of interaction between various factors on alcohol content of bayberry wine
通过响应面分析法获得杨梅酒最优发酵工艺条件为:酵母菌添加量0.31%、发酵温度26.35 ℃、发酵时间8.98 d,此条件下杨梅酒酒精度理论值为12.83%。为操作方便,将上述条件修正为:酵母菌添加量0.3%、发酵温度26 ℃、发酵时间9 d,此条件下进行3次平行试验,测得杨梅酒酒精度实际值为(12.63±0.12)vol%,与理论值非常接近,说明该模型可用于生产中杨梅酒酒精度的分析预测。
2.3 发酵对杨梅汁和杨梅酒挥发性风味成分的影响
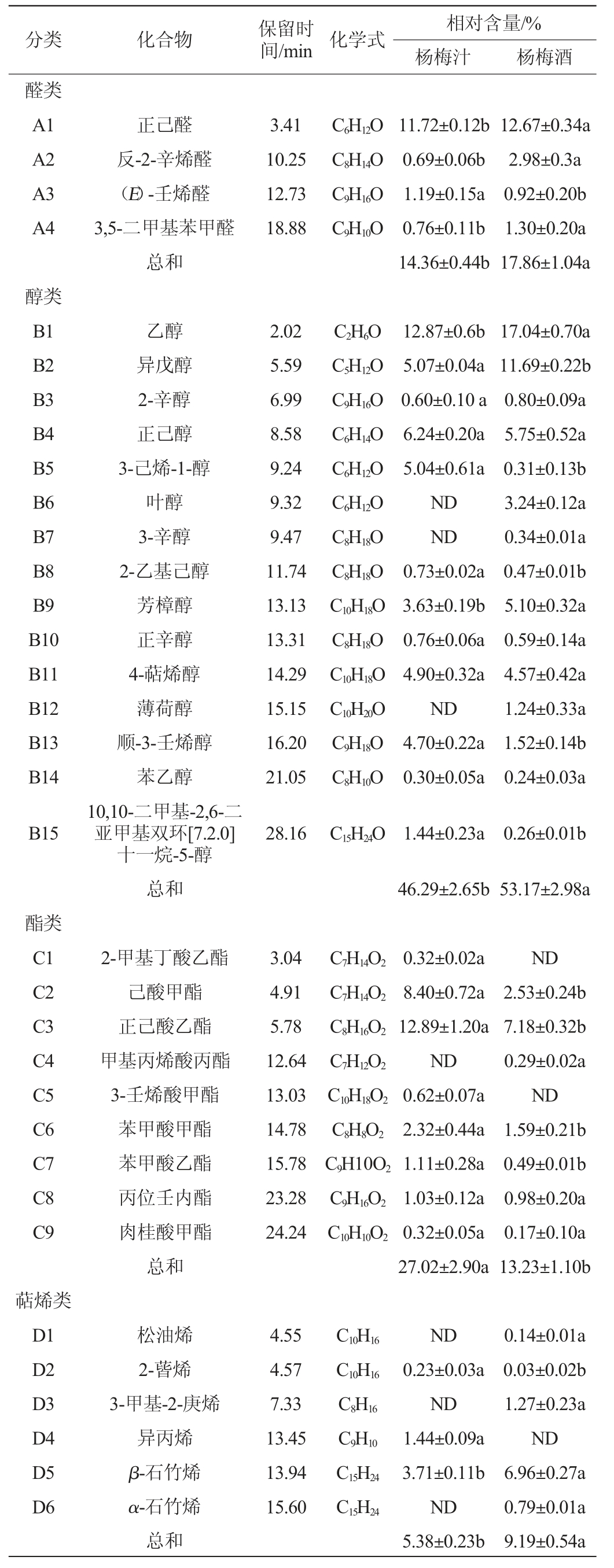
杨梅汁、杨梅酒挥发性成分相对含量测定结果见表4。由表4可知,杨梅汁与杨梅酒均鉴定出醛类、醇类、酯类、萜烯类及其他(芳香烃类及萜烯类氧化物)类共5大类挥发性化合物,共检出挥发性风味成分38种,其中杨梅汁中31种,杨梅酒中35种。其中28种化合物在杨梅汁与杨梅酒均存在,这与CHEN H等[11]的研究结果相一致,包括杨梅特征香气化合物β-石竹烯[19]。由表4可知,4-萜烯醇、2-甲基丁酸乙酯、3-壬烯酸甲酯、异丙烯、邻异丙基甲苯、2-辛酮、甲基庚烯酮等挥发性化合物只在杨梅汁检出,与CHEN H等[16]研究结果类似;杨梅酒中检出新挥发性化合物11种,其中包括叶醇、3-辛醇、薄荷醇、甲基丙烯酸丙酯、松油烯、3-甲基-2-庚烯、α-石竹烯、乙烯乙基甲酮、2-戊基呋喃,其中叶醇呈果实、植物香味;薄荷醇呈薄荷香味;松油烯呈松树香味;α-石竹烯是β-石竹烯的异构体,呈水果香、松香味,并且具有抗氧化、抗癌的生物能力,由此可知,酵母菌发酵之后可增加产品挥发性化合物种类,提升杨梅产品香气质量。
表4 杨梅汁和杨梅酒的挥发性风味成分GC-MS分析结果
Table 4 Results of volatile flavor components of bayberry juice and bayberry wine analysis by GC-MS
续表
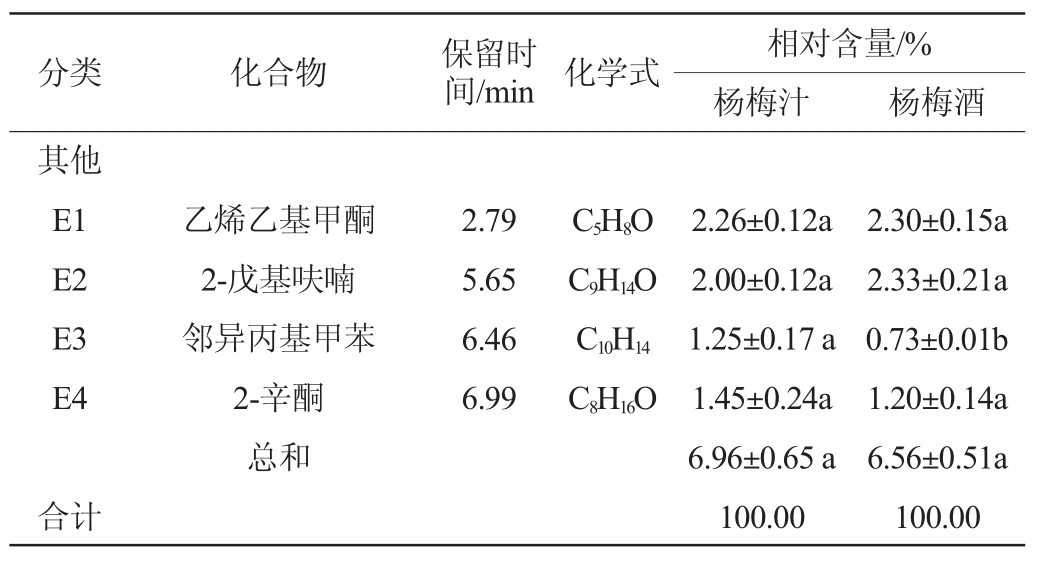
注:不同字母表示同一指标间差异显著(P<0.05);ND表示未检出该化合物。
2.3.1 醛类化合物
醛类化合物通常是由多酚氧化或醇类氧化得到[20],是水果果香和青叶香的重要来源[16]。由表4可知,杨梅汁与杨梅酒醛类化合物种类都为4种,且酵母菌发酵过程中,可利用葡萄糖和其他营养物质合成醛类挥发性化合物;酯类化合物会分解成醇类化合物,并发生醇类氧化现象,导致醛类化合物含量显著增加24.37%(P<0.05),其中正己醛显著增加8.10%(P<0.05),其呈现的草香、新鲜味,发酵后香味更加突出,对杨梅酒香气质量提升有积极作用。
2.3.2 醇类化合物
由表4可知,醇类挥发性化合物在杨梅汁与杨梅酒中相对含量较高,分别为46.29%、53.17%,与YU H Y等[21]结果相近,但是两者之间存在显著性差异(P<0.05),由表4可知,发酵处理后醇类化合物相对含量增加14.86%,且种类增加3种,为叶醇(3.24%)、3-辛醇(0.34%)、薄荷醇(1.24%),是由氨基酸在发酵过程中通过脱羧反应或脱氨反应所生成[23];异戊醇、3-己烯-1-醇、2-乙基己醇、顺-3-壬烯醇和10,10-二甲基-2,6-二亚甲基双环[7.2.0]十一烷-5-醇等相对含量均显著下降(P<0.05),但这些化合物无特征香味表达,对杨梅酒香气质量影响较小。
2.3.3 酯类化合物
酯类化合物中的己酸甲酯具有水果甜味;正己酸乙酯具有苹果香味,两者都是典型的芳香活性化合物,有助于产品产生强烈的果味[11,16,22]。由表4可知,杨梅酒酯类化合物含量和种类较杨梅汁显著减少(P<0.05)。发酵处理后2-甲基丁酸乙酯、己酸甲酯、正己酸乙酯、3-壬烯酸甲酯、苯甲酸甲酯和苯甲酸乙酯等酯类化合物含量均显著减少,此变化趋势与杨梅存储期间挥发性成分变化类似[13],其中苯甲酸乙酯呈过熟、发霉香味,对杨梅香气有负面影响,其含量减少是杨梅汁及杨梅酒香气质量上升的重要依据[23]。
2.3.4 萜烯类化合物
β-石竹烯有治疗结肠炎的药理作用,也是成熟杨梅果实中的重要香气成分[19,24]。由表4可知,杨梅酒萜烯类化合物含量显著增加70.82%(P<0.05),化合物种类增加3种,为松油烯(0.14%),呈柑橘香味;3-甲基-2-庚烯(1.27%);α-石竹烯(0.79%),呈水果香。推测是酵母菌作用下,促使杨梅胞内物质分解,与酯类化合物的次级代谢共同作用形成[25-26]。表明酵母菌发酵过程中可转化生成多种特征挥发性物质,是增加杨梅酒品质的重要手段。
2.3.5 其他类化合物
由表4可知,杨梅汁与杨梅酒的其他类挥发性化合物的种类、含量无显著性差异(P>0.05)。其中邻异丙基甲苯含量显著降低41.60%(P<0.05);乙烯乙基甲酮、2-戊基呋喃和2-辛酮含量均无显著性变化(P>0.05)。
3 结论
本研究以新鲜荸荠杨梅为原料,使用RV171酵母菌发酵制备杨梅酒。在单因素试验的基础上,通过响应面法优化杨梅酒发酵工艺,并使用SPME-GC-MS分析杨梅汁与杨梅酒的挥发性化合物含量差异。结果表明,杨梅酒最佳发酵工艺条件为酵母菌添加量0.3%、发酵温度26 ℃、发酵时间9 d,在此条件下杨梅酒酒精度为12.63%;SPME-GC-MS分析结果表明,酿酒酵母发酵制备所得杨梅酒,可以将杨梅汁中的葡萄糖、有机酸和氨基酸等营养物质转化成杨梅酒中的香气成分,共检出挥发性香气成分35种,主要分为五大类,为醛类、醇类、酯类、萜烯和其他类,与杨梅汁相比较,发酵后醛类、醇类和萜烯类成分相对含量显著提高24.37%、14.86%、70.82%(P<0.05),酯类显著降低51.04%(P<0.05),使杨梅酒特殊香气成分增加,提升杨梅酒香气品质。并且杨梅酒是杨梅加工产业的重要产品,可解决杨梅资源浪费,提升产品质量,在实际生产中有重要的生产指导意义。
[1]CHEN H,CHEN J L,CHEN S G,et al.Characterization of aroma-active volatiles in three Chinese bayberry(Myrica rubra)cultivars using GC-MSolfactometry and an electronic nose combined with principal component analysis[J].Food Res Int,2015,72:8-15.
[2]林怡.超高压加工技术对杨梅汁品质的影响[D].杭州:浙江大学,2013.
[3]谢焕雄,王海鸥,胡志超,等.我国杨梅生产与贮藏加工现状[J].食品研究与开发,2007,(6):162-164.
[4]FANG Z X,MIN Z,WANG L X.HPLC-DAD-ESIMS analysis of phenolic compounds in bayberries (Myrica rubra Sieb.et Zucc.)[J].Food Chem,2007,100(2):845-852.
[5]焦云,柴春燕,马炜炜,等.不同质地杨梅果实肉柱细微构造与细胞壁组分及相关酶活性分析[J].江西农业学报,2018,30(5):12-17.
[6]黎欢,张群,付复华,等.不同品种杨梅果渣营养成分及抗氧化特性研究[J].轻工科技,2018,34(5):25-28.
[7]朱文佩,刘丽华,刘常贵.初制杨梅干的加工技术[J].浙江农业科学,2010(1):107-108.
[8]解红霞.杨梅全粉干燥工艺及贮藏性质的研究[D].济南:齐鲁工业大学,2015.
[9]ZHU Y Y,JIANG J,YUE Y,et al.Influence of mixed probiotics on the bioactive composition,antioxidant activity and appearance of fermented red bayberry pomace[J].LWT-Food Sci Technol,2020,133:110076.
[10]RIBEIRO-FILHO N,LINFORTH R,POWELL C D,et al.Influence of essential inorganic elements on flavour formation during yeast fermentation[J].Food Chem,2021,361:130025.
[11] CHEN H,CHEN J L,CHEN S G,et al.Sensory evaluation,physicochemical properties and aroma-active profiles in a diverse collection of Chinese bayberry (Myrica rubra) cultivars[J].Food Chem,2016,212:374-385.
[12]PINO J A.Odour-active compounds in papaya fruit cv.Red Maradol[J].Food Chem,2014,146:120-126.
[13] SELLI S,KELEBEK H,AYSELI M T,et al.Characterization of the most aroma-active compounds in cherry tomato by application of the aroma extract dilution analysis[J].Food Chem,2014,165:540-546.
[14]马剑,路高勇,陈智玲,等.复合酶法制备杨梅汁工艺优化及品质分析[J].食品研究与开发,2022,43(7):82-88.
[15]侍崇娟,吕钰凤,杜晶,等.杨梅酒发酵工艺及其风味变化[J].食品工业科技,2015,36(6):166-170.
[16]CHEN H,CHEN J L,LI X,et al.Differentiation of the volatile profiles of Chinese bayberry cultivars during storage by HS-SPME-GC/MS combined with principal component analysis[J].Postharvest Biol Tec,2015,100:59-72.
[17] LI H,TAO Y S,WANG H,et al.Impact odorants of Chardonnay dry white wine from Changli County (China)[J].Eur Food Res Technol,2008,227:287-292.
[18]LIU Z Z,LI H L,CUI G Q,et al.Efficient extraction of essential oil from Cinnamomum burmannii leaves using enzymolysis pretreatment and followed by microwave-assisted method[J].LWT-Food Sci Technol,2021,147:111497.
[19] FANG H T,CHEN J L,TIAN Y Q,et al.Chemometrics characterization of volatile changes in processed bayberry juice versus intact fruit during storage by headspace solid-phase micro-extraction combined with GC-MS[J].J Food Process Pres,2020,44(6):e14444.
[20]XU Y X,ZHANG M,FANG Z X,et al.How to improve bayberry(Myrica rubra Sieb.et Zucc.)juice flavour quality:Effect of juice processing and storage on volatile compounds[J].Food Chem,2014,151:40-46.
[21]YU H Y,XIE T,HE L L,et al.Characterization of aroma compounds in bayberry juice by sensory evaluation and gas chromatography-mass spectrometry[J].Food Measure,2020,14:505-513.
[22]杨埔,蔚慧欣,张鑫,等.环境胁迫对清香型白酒发酵核心微生物生长的影响[J].酿酒科技,2021(12):22-26.
[23]BAHORUN T,LUXIMON-RAMMA A,CROZIER A,et al.Total phenol,flavonoid,proanthocyanidin and vitamin C levels and antioxidant activities of Mauritian vegetables[J].J Sci Food Agr,2004,84(12):1553-1561.
[24]LEI F,XU Y Y,XIAO Y D,et al.Effects of pre-drying treatments combined with explosion puffing drying on the physicochemical properties,antioxidant activities and flavor characteristics of apples[J].Food Chem,2021,338:128015.
[25]WANG S Y,LI Y Q,REN J,et al.Comparison on evolution of volatile compounds and aroma attributes in different pH-adjusted fermented bog bilberry syrup wines during bottle-aging period[J].Food Biosci,2018,22:121-128.
[26]GAO X L,FENG T,LIU E M,et al.Ougan juice debittering using ultrasound-aided enzymatic hydrolysis:Impacts on aroma and taste[J].Food Chem,2021,345:128767.