D-塔格糖(D-tagatose)是近年来新发现的功能性稀有糖,具有抗氧化、降血糖、改善肠道菌群、防龋齿、预防结肠癌等多种功能,广泛应用于食品、饮料、糖果、化妆品、医药等领域中[1-4]。D-塔格糖的生产主要是利用L-阿拉伯糖异构酶(L-arabinose isomerase,L-AI)将D-半乳糖异构化为D-塔格糖,该酶被认为是生物转化D-塔格糖最优良的生物催化剂,且广泛存在于各种嗜温、嗜热、超级嗜热微生物中[5-8]。由于高温有利于L-AI催化D-半乳糖转化为D-塔格糖,工业生产D-塔格糖所用的微生物主要是嗜热菌或其所产生的L-AI,但其安全性一直饱受质疑。因此人们转向从食品级微生物如乳酸菌中寻找能够产生L-AI的菌株。
目前利用乳酸菌生物转化D-塔格糖的研究主要集中在三方面,一是筛选挖掘野生菌株中的L-AI基因并进行高效异源表达,为D-半乳糖异构化为D-塔格糖提供酶学基础[9-10];二是开展L-AI酶学性质、酶分子改造、酶固定化等方面研究[11-13],使其适应工业需求,提高D-塔格糖的产率;三是以产L-AI菌株为全细胞催化剂,通过系统优化全细胞催化条件强化D-半乳糖的异构化[14-15]。乳酸菌是一类公认安全的菌株,目前已发现部分能够产L-AI的乳酸菌,如短乳杆菌(Lactobacillus brevis)、清酒乳杆菌(Lactobacillus sakei)、发酵乳杆菌(Lactobacillus fermentum)等,对D-塔格糖的安全生产具有重要价值与意义。应碧等[16]从腌菜和泡菜中分离筛选出了一株高产D-塔格糖的乳酸菌,经鉴定为植物乳杆菌(Lactobacillus plantarum)WU14,其发酵粗酶液中L-AI酶活达到13.95 U/mL。王晓茹等[17]以菌体量和产酶量为依据,对产L-AI的短乳杆菌(L.brevis)发酵培养条件进行优化,结果表明,在初始pH 6.0、发酵温度37 ℃、发酵时间24 h条件下,菌株全细胞催化反应48 h,对9%D-半乳糖的转化率达到43%~44%。XU Z等[18]将来源于发酵乳杆菌(L.fermentum)CGMCC2921的L-AI进行克隆并异源表达于大肠杆菌(Escherichia coli)BL21(DE3)中,对重组酶进行纯化,研究结果表明,纯化的酶催化效率较高,D-半乳糖的转化数(kcat)/米氏常数(Km)为9.02 mmol/min,在1 mmol Mn2+存在情况下,65 ℃反应12 h,底物转化率高达55%。尽管目前已经发现多种能够产生L-AI的乳酸菌,但乳酸菌属于嗜温菌,其野生菌株的D-塔格糖产率普遍不高,所产的L-AI存在着稳定性较差,最适反应温度较低等问题,不能直接运用于工业生产中,因而需要对菌株生产D-塔格糖的各种条件进行优化,对其所产L-AI的性质进行探究,以期提高D-塔格糖产率,运用于D-塔格糖的工业生产中。
本研究以前期筛选到的L-AI产生菌发酵乳杆菌(Lactobacillus fermentum)C6为研究对象,采用单因素试验及正交试验对菌株C6的培养基及培养条件进行优化,并将菌株C6作为全细胞催化剂,对其生物转化D-塔格糖的全细胞催化反应条件及细胞透性化学处理方式进行研究,旨在开发一种安全高效的全细胞催化剂,获得其生产D-塔格糖的最优条件,提高D-塔格糖的产率,为后续利用全细胞催化法生产制备D-塔格糖提供理论与应用基础。
1 材料与方法
1.1 材料与试剂
发酵乳杆菌(Lactobacillus fermentum)C6:保藏于江西农业大学生物科学与工程学院。
D-塔格糖标准品(纯度>99%)、D-半乳糖、L-阿拉伯糖(均为分析纯):上海麦克林生化科技有限公司;盐酸、葡萄糖、磷酸氢二钾(均为分析纯):西陇科学股份有限公司;间苯二酚(分析纯):上海阿拉丁生化科技股份有限公司;酵母浸粉、牛肉膏、蛋白胨(均为生化试剂):北京奥博星生物技术有限责任公司;吐温-80(生化试剂):上海申宇医药化工有限公司;硫胺素焦磷酸(thiamine pyrophosphate,TPP)(分析纯):西格玛奥德里奇(上海)贸易有限公司。
MRS培养基:葡萄糖20 g、酵母浸粉5 g、牛肉膏10 g、蛋白胨10 g、乙酸钠5 g、柠檬酸氢二铵2 g、磷酸氢二钾2 g、吐温80 1 mL、无水硫酸镁0.58 g、硫酸锰0.25 g、蒸馏水1 000 mL、pH 6.5。115 ℃湿热灭菌30 min。
初始发酵培养基:葡萄糖5 g、酵母浸粉10 g、蛋白胨10 g、无水乙酸钠10 g、MgSO4·7H2O 0.4 g、MnSO4·2H2O 0.05 g、K2HPO4 0.4 g、L-阿拉伯糖(诱导剂)1 g、蒸馏水1 000 mL、pH 6.5。115 ℃湿热灭菌30 min。
1.2 仪器与设备
LDZX-50KBS立式高压蒸汽灭菌器:上海申安医疗器械厂;DK-8D三温三控水槽:上海博迅实业有限公司医疗设备厂;LXJ-IIB大容量低速离心机:上海安亭科学仪器厂;JW-3022HR医用离心机:安徽嘉文仪器装备有限公司;JY92-IIDN超声波细胞粉碎机:宁波新芝生物科技股份有限公司;HH-S21-4-S电热恒温水浴锅:上海新苗医疗器械制造有限公司;LRH-250A生化培养箱:广东泰宏君科学仪器股份有限公司;SpectraMax 190全波长酶标仪:美谷分子仪器(上海)有限公司。
1.3 实验方法
1.3.1 发酵乳杆菌C6的活化及发酵培养
将甘油管保藏的发酵乳杆菌C6按1%(V/V)接种量接入MRS培养基中,37 ℃培养12 h,再按2%(V/V)接种量转移到发酵培养基中,37 ℃发酵培养24 h,获得菌株C6的发酵液。
1.3.2 菌株C6全细胞催化剂制备
将50 mL发酵液常温下5 000 r/min离心10 min,用10 mL磷酸盐缓冲液(50 mmol/L,pH 7.0)洗涤菌体沉淀2次,离心除去上清液,所得菌体沉淀即为菌株C6全细胞反应催化剂。
1.3.3 全细胞催化反应体系
菌株C6的全细胞催化反应在50 mL离心管中进行,向其中加入2mL0.5mol/LD-半乳糖液(蒸馏水配制,含10mmol/L氯化锰),然后置于37 ℃水浴反应36 h。
1.3.4 发酵乳杆菌C6的发酵条件优化
(1)单因素试验
以最初始培养基成分及培养条件为基础,以D-塔格糖产率为评价指标,研究各发酵培养基成分(碳源、氮源、诱导剂、金属离子、生长因子)及各培养条件(反应温度、反应pH、装液量、接种量)对D-塔格糖产率的影响。发酵条件优化单因素试验设计见表1。
表1 发酵乳杆菌C6发酵条件优化单因素试验设计
Table 1 Design of single factor tests for Lactobacillus fermentum C6 fermentation conditions optimization
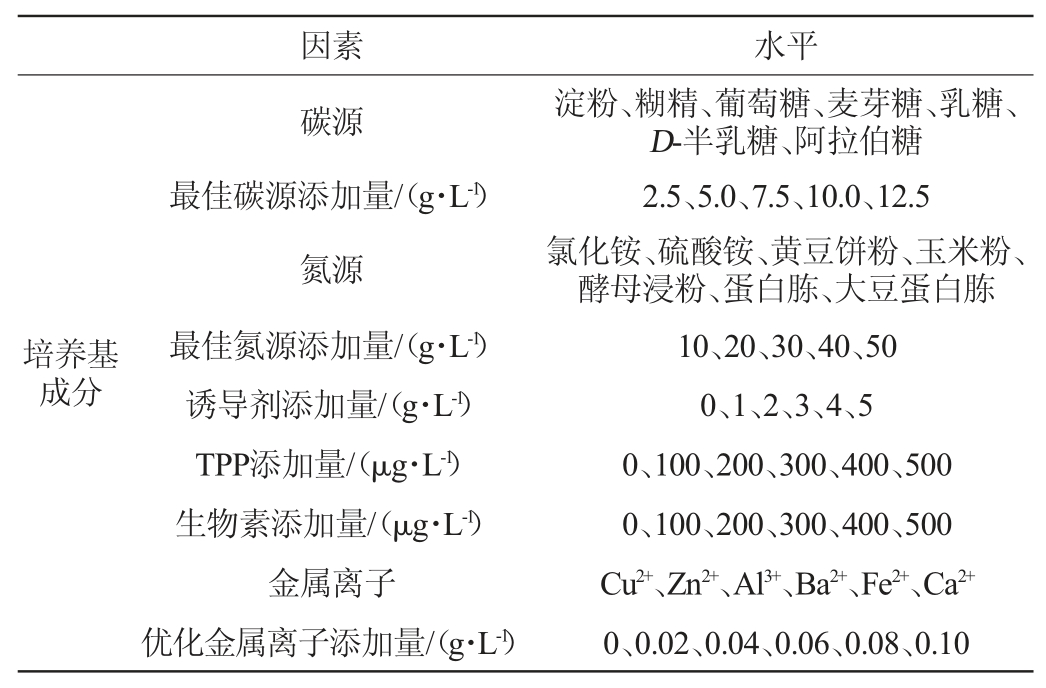
续表

(2)正交试验
在单因素试验的基础上,以D-塔格糖产率为评价指标,选取接种量(A)、诱导剂添加量(B)、初始pH值(C)、葡萄糖添加量(D)4个因素进行4因素3水平L9(34)的正交试验,正交试验因素及水平见表2。
表2 发酵乳杆菌C6发酵条件优化正交试验因素与水平
Table 2 Factors and levels of orthogonal experiments for Lactobacillus fermentum C6 fermentation conditions optimization
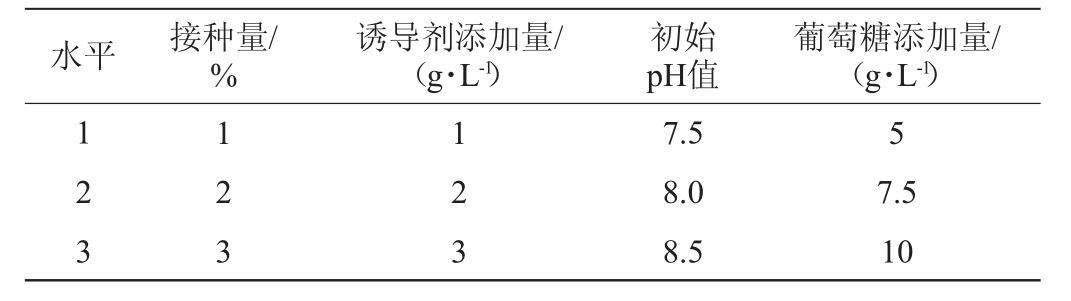
1.3.5 全细胞催化反应条件优化
以单因素试验及正交试验结果为基础,对菌株进行发酵培养,并制备全细胞催化剂,通过改变全细胞催化反应体系中反应温度(35 ℃、40 ℃、45 ℃、50 ℃、55 ℃、60 ℃、65 ℃、70 ℃、75 ℃)、反应pH(4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5)、金属离子种类(Cu2+、Mg2+、Mn2+、Ca2+、Fe2+)及浓度(0、5 mmol/L、10 mmol/L、15 mmol/L、20 mmol/L)、底物浓度(0.25 mol/L、0.50 mol/L、0.75 mol/L、1.00 mol/L、1.25 mol/L)及反应时间(12 h、24 h、36 h、48 h、60 h)、底物加入体积(2 mL、5 mL、10 mL、15 mL、20 mL、25 mL、30 mL),研究各因素对全细胞催化过程中D-塔格糖产率的影响,从而确定最优全细胞催化反应条件。试验所需缓冲液有醋酸盐缓冲液(pH 4.5~5.5)、磷酸盐缓冲液(pH 6.0~7.0)、Tris-HCl缓冲液(pH 7.5~8.5),缓冲液浓度均为50 mmol/L,调节反应液pH时,菌体沉淀洗涤及底物D-半乳糖配制应用同样pH值的缓冲液。
全细胞催化合成D-塔格糖:以最优发酵培养基及培养条件培养菌株,在最优全细胞催化反应条件下转化D-半乳糖,每隔8 h取样,测定菌体L-阿拉伯糖异构酶酶活及D-塔格糖产率,与初始全细胞催化反应条件对比,研究不同催化条件对菌体L-阿拉伯糖异构酶酶活及底物转化率的影响。
1.3.6 细胞透性化学处理方式优化
将50 mL菌体发酵液常温5 000 r/min离心10 min,离心除去上清液,向菌体沉淀中加入10 mL已知浓度的透性剂:2%甲苯、20%乙醇、20%丙酮、0.2%曲拉通、0.2%吐温80、0.2%二甲基亚砜(dimethyl sulfoxide,DMSO)(所有试剂均用Tris-HCl缓冲液配制),重悬混匀,置于20 ℃静置处理20 min、40 min、60 min,对照加入等量缓冲液处理同等时间,处理完毕后常温离心去除上清液,使用Tris-HCl缓冲液洗涤菌体2次,获得透性化细胞,将其投入最优全细胞催化反应体系,转化时间24 h,反应结束后离心取上清测定D-塔格糖浓度,计算D-塔格糖产率。
1.3.7 D-塔格糖浓度及产率的测定
D-塔格糖浓度的测定采用间苯二酚法[19]:使用12%的稀盐酸配制1 mg/mL的间苯二酚溶液,取反应上清液25 μL,加蒸馏水稀释200倍至5 mL,加入等体积间苯二酚液,沸水浴30 min,冷却5 min,利用酶标仪测定反应液在波长400 nm处的吸光度值,用稀释200倍的底物为空白对照,以D-塔格糖质量浓度(X)为横坐标,吸光度值(Y)为纵坐标,绘制D-塔格糖标准曲线,获得标准曲线回归方程Y=0.004 9X+0.002 98,相关系数R2=0.999 7,确定D-塔格糖产率,其计算公式如下:
1.3.8 L-阿拉伯糖异构酶酶活的测定
收集菌体发酵液50 mL,于8 000 r/min冷冻离心5 min,去除发酵液上清,剩下的菌体沉淀使用Tris-HCl缓冲液(50 mmol/L,pH 7.5)洗涤2遍,最后用5 mL缓冲液重悬菌体。超声破碎(超声功率240 W,工作2 s,间歇2 s,破碎时间20 min)后10 000 r/min冷冻离心10 min,取上清液作为粗酶液测定酶活。酶活反应体系:0.5 mL粗酶液+0.5 mL D-半乳糖液,60℃反应1h,反应结束后100 ℃沸水浴5 min,10 000 r/min离心2 min,取上清液测定D-塔格糖的含量(μg/mL)。L-阿拉伯糖异构酶酶活定义为:每毫升酶液每分钟生成1 μg D-塔格糖定义为一个酶活力单位(U/mL)。
1.3.9 数据处理
所有试验均重复3次,试验结果以“平均值±标准差”表示,采用Excel 2019软件对试验数据进行分析处理,采用Origin 9.0软件对数据进行分析作图,采用DPS 7.05软件对正交试验结果进行方差分析。
2 结果与分析
2.1 发酵培养基成分对菌株C6D-塔格糖产率的影响
为制备获得性能优良的全细胞催化剂,对发酵乳杆菌C6的发酵培养基中碳源、氮源、诱导剂、生物素、金属离子的种类和浓度进行优化,结果见图1。
由图1a可知,固定碳源添加量为5 g/L,当碳源为葡萄糖时,D-塔格糖产率最高,为(13.71±0.20)%,说明葡萄糖最有利于菌株生产L-AI,转化D-半乳糖为D-塔格糖。因此,确定碳源为葡萄糖。

图1 发酵培养基成分对D-塔格糖产率的影响
Fig.1 Effect of fermentation medium composition on D-tagatose yield
不同字母表示组间差异显著(P<0.05)。下同。
由图1b可知,葡萄糖添加量为2.5~7.5 g/L时,D-塔格糖产率逐渐增加;当葡萄糖添加量为7.5 g/L时,D-塔格糖产率达到最大值,为(12.69±0.13)%,葡萄糖添加量>7.5 g/L时,D-塔格糖产率逐渐下降,这可能与L-阿拉伯糖操纵子有关。L-阿拉伯糖操纵子中araB、araA和araD基因(合称PBAD基因)分别编码阿拉伯糖代谢所需的和酮糖激酶、阿拉伯糖异构酶、核酮糖-5磷酸差向异构酶,它们的表达由操纵子中另一个基因araC产生的转录因子AraC蛋白调控,当葡萄糖浓度过高或者L-阿拉伯糖浓度过低时,菌体内环磷酸腺苷(cyclic adenosine monophosphate,cAMP)浓度低,转录因子AraC处于Pr形式(起阻遏作用),阻遏PBAD基因的转录,尽管菌体生长迅速但无法有效合成L-AI,反而致使塔格糖产率降低[20-21]。因此,确定碳源添加量为7.5 g/L。
由图1c可知,当氮源为酵母浸粉时,其D-塔格糖产率最高,为(13.17±0.12%),其次为蛋白胨,其D-塔格糖产率为(5.92±0.01%)。相对于无机氮源,有机氮源营养更加丰富,常常含有丰富蛋白质、肽类、游离氨基酸、脂肪等物质[22]。因此,确定氮源为酵母浸粉与蛋白胨(1∶1)。
由图1d可知,当酵母浸粉与蛋白胨(1∶1)添加量为10~40 g/L时,D-塔格糖产率逐渐增加;酵母浸粉与蛋白胨(1∶1)添加量为40 g/L时,D-塔格糖产率达到最大值,为(17.91±0.23%);酵母浸粉与蛋白胨(1∶1)添加量>40 g/L时,D-塔格糖产率逐渐下降。因此,确定酵母浸粉与蛋白胨(1∶1)添加量为40 g/L。
由图1e可知,当诱导剂L-阿拉伯糖添加量为0~2 g/L时,D-塔格糖产率逐渐增加;L-阿拉伯糖添加量为2 g/L时,D-塔格糖产率达最大值,为(16.93±0.39)%;L-阿拉伯糖添加量>2 g/L时,D-塔格糖产率逐渐下降。少量添加诱导剂便能大大提升塔格糖产率,这可能是由于阿拉伯糖能够与AraC蛋白结合,使其变为Pi形式(激活状态),能够促进PBAD基因的转录[23]。因此,确定诱导剂添加量为2 g/L。
由图1f可知,当生物素添加量为0~100 μg/L时,D-塔格糖产率逐渐增加;生物素添加量为100 μg/L时,D-塔格糖产率达最大值,为(15.86±0.01)%;生物素添加量>100 μg/L时,D-塔格糖产率下降至呈平稳趋势。因此,确定生物素添加量为100 μg/L。
由图1g可知,当硫胺素焦磷酸添加量为0~400 μg/L时,D-塔格糖产率逐渐增加;生物素添加量为400 μg/L时,D-塔格糖产率达最大值,为(15.04±0.03)%;生物素添加量>400 μg/L时,D-塔格糖产率下降。研究表明,微量添加部分生长因子如生物素、硫胺素焦磷酸能够促进菌体细胞生长,进而提升塔格糖产率[24]。因此,确定硫胺素焦磷酸添加量为400 μg/L。
由图1h可知,锌离子提升D-塔格糖产率效果明显,其D-塔格糖产率为(17.68±0.14%)。其原因可能是,金属离子通常能影响酶活性进而影响底物转化率[25],而其他二价金属离子均有不同程度的抑制作用。因此,确定金属离子为锌离子。
由图1i可知,当硫酸锌添加量为0~0.04 g/L时,D-塔格糖产率逐渐增加;硫酸锌添加量为0.04 g/L时,D-塔格糖产率最高,为(14.95±0.08)%;硫酸锌添加量>0.04 g/L时,D-塔格糖产率下降。因此,确定硫酸锌添加量为0.04 g/L。
2.2 发酵条件对菌株D-塔格糖产率的影响
对发酵乳杆菌C6的发酵条件(培养温度、培养基初始pH值、装液量和接种量)进行优化,结果见图2。
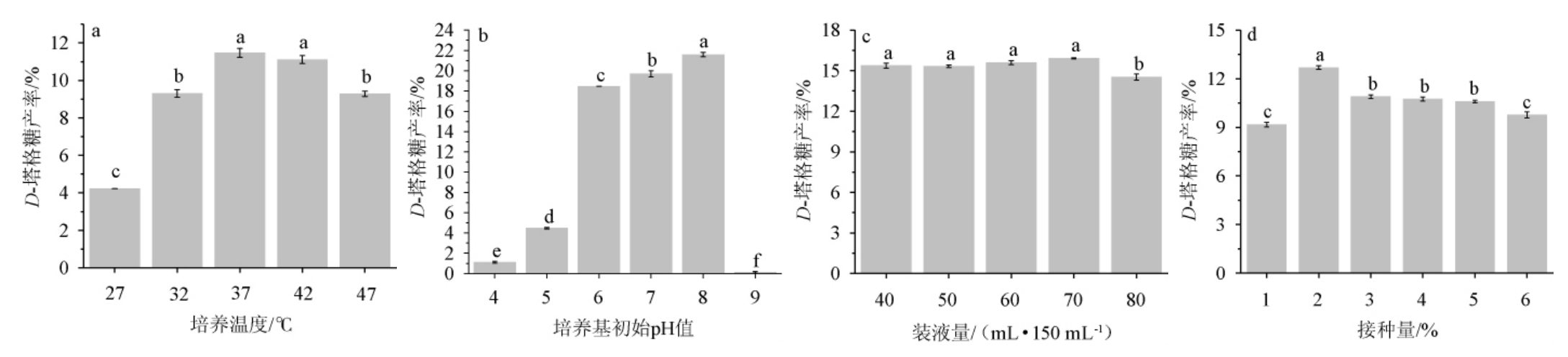
图2 发酵条件对D-塔格糖产率的影响
Fig.2 Effect of fermentation conditions on D-tagatose yield
由图2a可知,在27~47 ℃范围内,随着培养温度在27~37 ℃范围内增加,D-塔格糖产率逐渐增加;培养温度为37 ℃时,D-塔格糖产率为(11.47±0.24)%;培养温度>37 ℃时,D-塔格糖产率逐渐下降。因此,最适培养温度为37 ℃。由图2b可知,随着培养基初始pH值在4~8范围内的增加,D-塔格糖产率逐渐增加,说明其适应性较强,在酸性、中性及弱碱性环境都能正常生长。当pH值为8时,菌株D-塔格糖产率达到最大值,为(21.60±0.21)%。因此,最适发酵培养基的初始pH值为8。由图2c可知,装液量对D-塔格糖生成影响不大,其原因可能是,菌株C6是乳酸菌,属于兼性厌氧型细菌,对氧气需求量并不严格。因此,最适装液量为70 mL/150 mL。由图2d可知,随着接种量在1%~6%范围内的增加,D-塔格糖产率呈先升高后下降的趋势。当接种量为2%时,D-塔格糖产率为最高值,为(12.69±0.11)%。因此,最适接种量为2%。
2.3 发酵乳杆菌C6的发酵条件优化正交试验结果
在单因素试验的基础上,以D-塔格糖产率为评价指标,选择对D-塔格糖产率影响较大的因素葡萄糖质量浓度、诱导剂质量浓度、初始pH值、接种量,进行4因素3水平的正交试验设计,正交试验结果与分析见表3。
表3 发酵条件优化正交试验结果与分析
Table 3 Results and analysis of orthogonal experiments for fermentation conditions optimization
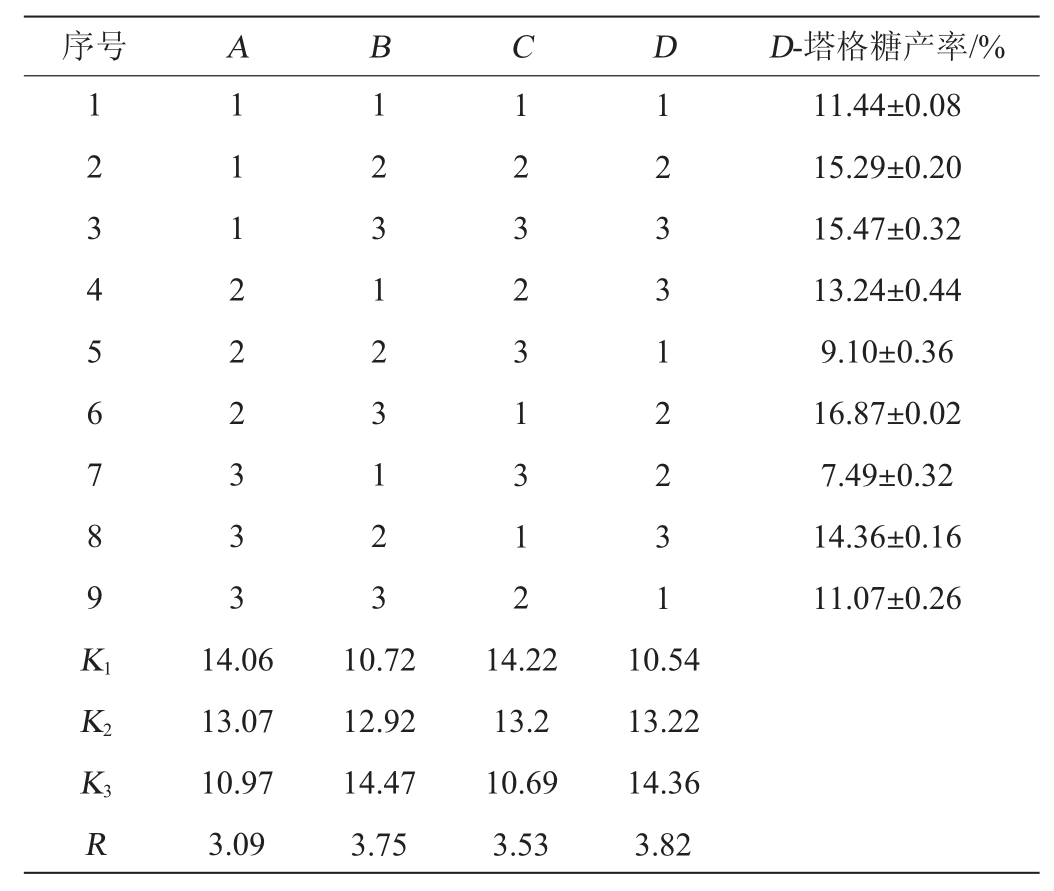
由表3可知,由R值可知,4个试验因素对D-塔格糖产率影响的大小顺序为:D(葡萄糖质量浓度)>B(诱导剂质量浓度)>C(初始pH值)>A(接种量)。可见碳源质量浓度对底物转化率影响最大,是菌株发酵培养过程的关键因素;其次是诱导剂。正交试验结果表明,4因素最优理论组合为A1B3C1D3,即接种量1%、诱导剂质量浓度3 g/L、初始pH值7.5、葡萄糖质量浓度10 g/L。结合单因素试验结果,最终确定发酵乳杆菌C6的最优发酵培养基组成为:葡萄糖10 g/L,酵母浸粉20 g/L,蛋白胨20 g/L,无水乙酸钠10 g/L,MgSO4·7H2O 0.4 g/L,MnSO4·2H2O 0.05 g/L,K2HPO40.4 g/L,L-阿拉伯糖3 g/L,ZnSO4·7H2O 0.04 g/L,生物素100 μg/L,焦磷酸硫胺素400 μg/L;最优发酵条件为:培养温度37 ℃、初始pH值7.5、装液量70 mL/150 mL、接种量1%。
L-阿拉伯糖酶的生物合成属于生长偶联型[17,26]。当菌株发酵时间为24 h,此时菌体量及酶活水平都较高,OD600nm值达到1.25±0.01,酶活达到(107.81±3.22)U/mL,较初始条件(OD600nm值为0.65±0.01,酶活为(49.81±0.66)U/mL),分别提高了92.31%、116.44%,D-塔格糖产率达到(17.79±0.12)%,较初始条件(9.42±0.20)%提高89.05%。培养条件优化过后的各项指标均优于优化前。
2.4 发酵乳杆菌C6全细胞催化反应条件对D-塔格糖产率的影响
大部分生物催化反应中,因游离酶存在稳定性较差、制备困难、纯化工艺较复杂等缺陷,多数反应使用的是全细胞催化法,该法能维持细胞内部酶的稳定性与适应性,且无需进行复杂的酶纯化步骤,具有极大的开发价值[27-28]。以发酵乳杆菌C6为全细胞催化剂,对其全细胞催化反应过程中的反应温度、反应pH值、金属离子浓度、反应时间、底物体积进行研究,结果见图3。
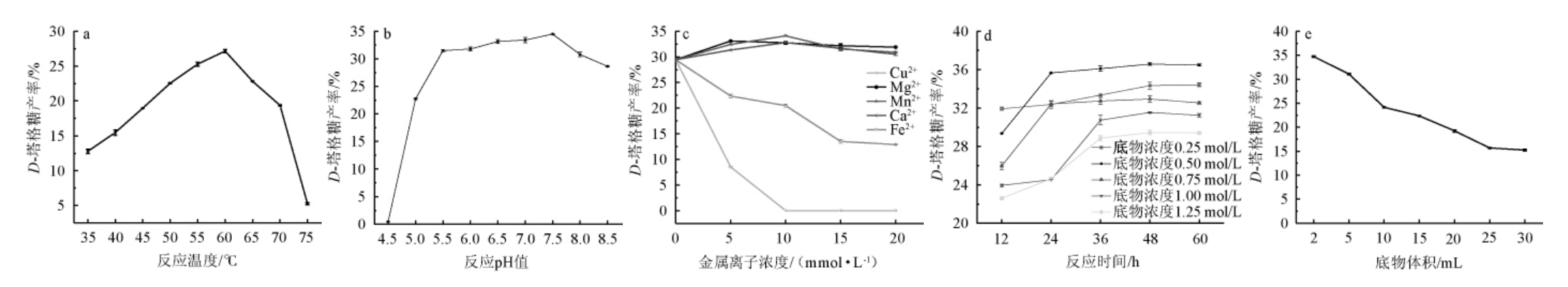
图3 发酵乳杆菌C6全细胞催化反应条件优化
Fig.3 Optimization of Lactobacillus fermentum C6 whole-cell catalytic reaction conditions
由图3a可知,随着反应温度在35~60 ℃范围内的增加,D-塔格糖产率逐渐增大;当反应温度为60 ℃时,D-塔格糖产率达到最大值,为(27.16±0.23)%;当反应温度>60 ℃时,D-塔格糖产率逐渐下降。因此,最适温度为60 ℃。这是因为L-AI催化反应过程是动态平衡反应,高温有利于平衡向D-塔格糖生成方向进行。工业酶一般要求热稳定要强,最适温度最好在60 ℃以上[29],可见菌株C6所产的L-AI较符合工业要求,应用潜力较大。
由图3b可知,随着反应pH值在4.5~7.5范围内的增加,D-塔格糖产率逐渐增加;当反应pH值为7.5时,D-塔格糖产率达到最大值,为(34.50±0.08)%;当反应pH>7.5时,D-塔格糖产率逐渐下降。因此,最适反应pH值为7.5。菌株C6最适反应pH值虽为7.5,但其耐酸性较强,在pH 5.5~7.0范围内底物转化率都比较高,符合工业要求。目前,D-塔格糖工业生产通常以乳糖为原料,其酶解为半乳糖的pH大概为5.0~6.0,为减少调节pH的过程以及副反应的产生,工业要求所用L-AI最适pH值为5.0~6.0[30]。
由图3c可知,随着Cu2+与Fe2+金属离子浓度的增加,D-塔格糖产率逐渐下降,随着Mg2+、Ca2+、Mn2+浓度在0~10mmol/L范围内的增加,D-塔格糖产率有所增加,当Mn2+浓度为10 mmol/L,D-塔格糖产率达到最大值,为(34.11±0.09)%;Mg2+、Ca2+、Mn2+浓度>10 mmol/L,D-塔格糖产率逐渐下降。因此,最适金属离子为Mn2+(10 mmol/L)。金属离子的添加浓度必须适量,添加高浓度的金属离子不仅会增加工业生产成本,更不利于D-塔格糖后期纯化处理[31]。
对于单一酶反应来说,底物浓度影响着酶促反应速率且遵循米氏方程规律,当底物浓度远小于Km(米氏常数)时,增加底物浓度,反应速度增加,当底物浓度>Km时,反应速度便不会增加[32]。由图3d可知,随着反应时间在12~36 h范围内的增加,D-塔格糖产率呈升高的趋势;当反应时间>36 h,D-塔格糖产率逐渐平稳,当反应时间为36 h时,0.5 mmol/L的底物浓度条件下,D-塔格糖产率为(36.10±0.27)%。因此,最适底物浓度为0.5 mol/L。
由图3e可知,当底物浓度一定时,随着底物体积在2~30 mL范围内的增加,底物转化率随之减小,底物加入体积为2 mL时,D-塔格糖产率达到最大值,为(34.74±0.15)%,说明菌体胞内酶对底物的转化能力有限。
2.5 发酵乳杆菌C6全细胞催化生产D-塔格糖的动态变化
分别在初始和优化后的发酵乳杆菌C6全细胞催化反应条件下,测定并对比了催化反应过程中D-塔格糖及L-AI时序性动态变化,结果见图4。
由图4可知,初始反应条件下,反应时间在0~24 h范围内,D-塔格糖产率增长较快,在2~32 h范围内,D-塔格糖产率变化不大,32~40 h范围内,D-塔格糖产率略有上升,40~48 h范围内,D-塔格糖产率略微下降趋于稳定,该条件下,菌体D-塔格糖产率最大值为(20.63±0.16)%。最优反应条件下,反应时间在0~24 h范围内,D-塔格糖产率增长较快,反应时间>24 h时,D-塔格糖产率趋于稳定,24~48 h范围内,D-塔格糖产率稍微下降,反应时间>24 h时,D-塔格糖产率达到最大值,为(43.41±0.48)%。结果表明,菌株C6所产L-AI催化D-半乳糖转化为D-塔格糖的反应属于可逆反应,这与有关L-AI催化生产D-塔格糖的研究报道相符[33],且优化后的反应条件相较初始条件更利于菌株转化D-半乳糖为产物,D-塔格糖产率达到最大值,达到(43.41±0.48)%,相较初始反应条件提高了110.42%。在两种条件下,菌体酶活均随时间延长不断下降,但优化反应条件下的酶活显著高于初始条件,且酶活下降速率更慢,这说明优化反应条件在一定程度上增强了酶的稳定性,减缓了酶活下降速度。
2.6 发酵乳杆菌C6细胞透性化学处理方式优化
由于细胞屏障的阻碍作用,全细胞催化速率不如游离酶。为提高催化效率,研究者利用细胞透性化技术打破细胞屏障,提高细胞壁与细胞膜渗透性,促进底物与酶接触反应,以达到提高全细胞催化效率的目的。微生物所产的L-阿拉伯糖异构酶多为胞内酶[34],因此透性细胞对于D-塔格糖产率的提高可能具有促进作用。化学渗透剂对菌株产D-塔格糖的影响见图5。
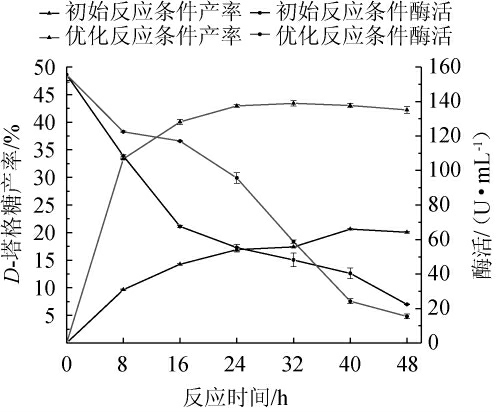
图5 发酵乳杆菌C6全细胞催化反应过程
Fig.5 Process of Lactobacillus fermentum C6 whole-cell catalytic reaction
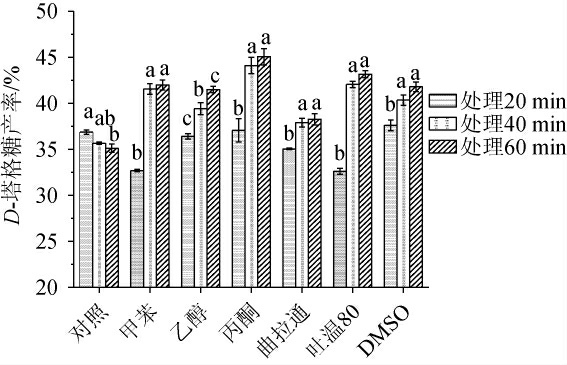
图5 化学渗透剂对D-塔格糖产率的影响
Fig.5 Effect of chemical penetrant on D-tagatose yield
由图5可知,随着处理时间的延长,D-塔格糖产率均逐渐增加,当处理时间为60 min时,在影响D-塔格糖产率的6种化学渗透剂中,20%丙酮透性细胞效果最好,D-塔格糖产率可达(45.07±0.89)%。此现象表明随着丙酮等渗透剂处理时间的延长,各种化学透性剂充分与细胞接触,穿过细胞壁与细胞膜脂质反应,破坏细胞膜结构与流动性,致使细胞透性增强,有利于底物与胞内酶的接触,提高渗透细胞的底物转化能力[35]。张华等[36]利用2%~5%的甲苯制备透性化植物乳酸杆菌细胞转化D-半乳糖,反应96 h后,底物转化率达到42%,透性细胞表观酶活力最大值达到9.3 U。
3 结论
利用前期筛选得到的一株能够产生L-阿拉伯糖异构酶的发酵乳杆菌C6为全细胞催化剂,以菌株生物量(OD600nm值)及D-塔格糖产率为评价指标,采用单因素试验及正交试验得到菌株C6的最优培养基为:葡萄糖10 g/L、酵母浸粉20 g/L、蛋白胨20 g/L、无水乙酸钠10 g/L、MgSO4·7H2O 0.4 g/L、MnSO4·2H2O 0.05 g/L、K2HPO4 0.4 g/L、L-阿拉伯糖3 g/L、ZnSO4·7H2O 0.04 g/L、生物素100 μg/L、焦磷酸硫胺素400 μg/L;最优培养条件为:培养温度37 ℃、初始pH值7.5、装液量70 mL、接种量1%、培养时间24 h,在此最优条件下,OD600nm值为1.25和L-阿拉伯糖异构酶酶活为107.81 U/mL,较优化前分别提高了92.31%和116.44%,为制备性能优良的全细胞催化剂提供了基础。发酵乳杆菌C6全细胞最优催化反应条件为:反应温度60 ℃、反应pH值7.5、Mn2+10 mmol/L、底物浓度0.5 mol/L、底物加入体积2 mL,反应时间24 h;最优细胞透性处理方式为20%丙酮处理60 min,在此条件下,D-塔格糖产率达到(45.07±0.89)%。发酵乳杆菌C6胞内酶L-阿拉伯糖异构酶在全细胞催化反应所体现的各项性质,如最适温度、pH、底物等,为该酶的后续开发利用及全细胞规模化制备D-半乳糖提供了一定的理论依据。
[1] ZHAN Y J,XU Z,LI S,et al.Coexpression of β-D-galactosidase and L-arabinose isomerase in the production of D-tagatose:a functional sweetener[J].J Agr Food Chem,2014,62(11):2412-2417.
[2]梁敏,翟娅菲,邹洋,等.新型甜味剂塔格糖的应用及生产[J].食品与药品,2011,13(3):125-128.
[3] LU Y,LEVIN G V,DONNER T W.Tagatose,a new antidiabetic and obesity control drug[J].Diabetes Obes Metab,2010,10(2):109-134.
[4]沐万孟,张涛,江波,等.D-塔格糖与L-阿拉伯糖异构酶的研究进展[J].食品与发酵工业,2007,33(6):84-90.
[5]陈洲,李子杰,李爱民,等.生物法合成稀有己酮糖的研究进展[J].生物产业技术,2018,6:40-48.
[6] YOON S H,KIM P,OH D K.Properties of L-arabinose isomerase from Escherichia coli as biocatalyst for tagatose production[J].World J Microb Biot,2003,19(1):47-51.
[7]PRABHU P,TIWARI M K,JEYA M,et al.Cloning and characterization of a novel L-arabinose isomerase from Bacillus licheniformis[J].Appl Microbiol Biot,2008,81(2):283-290.
[8]KIM H J,OH D K.Purification and characterization of an L-arabinose isomerase from an isolated strain of Geobacillus thermodenitrificans producing D-tagatose[J].J Biotechnol,2005,120(2):162-173.
[9] DU M G,ZHAO D Y,CHENG S S,et al.Towards efficient enzymatic conversion of D-galactose to D-tagatose:purification and characterization of L-arabinose isomerase from Lactobacillus brevis[J].Bioproc Biosyst Eng,2019,42(1):107-116.
[10]XU Z,QING Y J,LI S,et al.A novel l-arabinose isomerase from Lactobacillus fermentum CGMCC2921 for D-tagatose production: Gene cloning,purification and characterization[J].J Mol Catal B: Enzym,2011,70(1-2):1-7.
[11]ZHANG G Y,AN Y F,PARVEZ A,et al.Exploring a highly D-galactose specific L-arabinose isomerase from Bifidobacterium adolescentis for D-tagatose production[J].Front Bioeng Biotech,2020,8:377.
[12] JAYARAMAN A B,KANDASAMY T,VENKATARAMAN D,et al.Rational design of Shewanella sp.l-arabinose isomerase for d-galactose isomerase activity under mesophilic conditions[J].Enzyme Microb Tech,2021(147):109796.
[13] SHIN K C,SIM D H,SEO M J,et al.Increased production of foodgrade D-tagatose from D-galactose by permeabilized and immobilized cells of Corynebacterium glutamicum,a GRAS host,expressing D-galactose isomerase from Geobacillus thermodenitrificans[J].J Agr Food Chem,2016,64(43):8146-8153.
[14]高文旭.D-塔格糖生产菌发酵工艺条件的研究[D].大连:大连工业大学,2018.
[15]孙志军,陈文薪,凌锦,等.高产D-塔格糖植物乳杆菌WU14的L-阿拉伯糖异构酶发酵培养基优化[J].食品科技,2019,44(5):24-32.
[16]应碧,张艳丽,周通,等.高产D-塔格糖植物乳杆菌WU14的筛选与鉴定[J].中国饲料,2015,4:17-20.
[17]王晓茹,杜梦鸽,胡木子,等.Lactobacillus brevis D-tag1产L-阿拉伯糖异构酶的条件优化[J].大连工业大学学报,2021,40(3):171-174.
[18] XU Z,LI S,LIANG J F,et al.Protein purification,crystallization and preliminary X-ray diffraction analysis of L-arabinose isomerase from Lactobacillus fermentum CGMCC2921[J].Acta Crystallogr F,2015,71(1):28-33.
[19]徐磊,赵东莹,王一倩,等.间苯二酚法测定D-塔格糖含量[J].大连工业大学学报,2017,36(3):168-170.
[20]徐煜,蒋德意,韩迪.植物乳杆菌Lp-G18谷氨酰胺合成酶活力发酵工艺优化[J].乳业科学与技术,2022,42(2):13-17.
[21]程丽芳,沐万孟,张涛,等.微生物来源的L-阿拉伯糖异构酶的研究进展及应用前景[J].微生物学通报,2008,35(10):1626-1632.
[22]杜丽红,郝亚男,陈宁,等.有机氮源及其在微生物发酵中的应用[J].发酵科技通讯,2019,48(1):1-4.
[23] GREENBLATT J,SCHLEIF R.Arabinose C protein: regulation of the arabinose operon in vitro[J].Nature New Biol,1971,233(40):166-170.
[24]雷剑芬,陆可,冯今亮,等.生长因子用量对缬氨酸发酵的影响[J].发酵科技通讯,2002,31(1):18-19.
[25]李彦君.L-阿拉伯糖异构酶的克隆表达及酶学性质研究[D].天津:天津科技大学,2011.
[26]孙志军.植物乳杆菌WU14的L-AI发酵工艺研究及其分子改良[D].南昌:江西农业大学,2019.
[27]周祺,吕雪芹,柴雪莹,等.枯草芽孢杆菌全细胞催化高效合成α-熊果苷[J].食品与发酵工业,2021,47(22):1-7.
[28]肖源,张同,杨之帆,等.重组地衣芽胞杆菌全细胞催化合成淫羊藿次苷D2[J].武汉科技大学学报,2021,44(6):438-444.
[29]程丽芳.解纤维热酸菌L-阿拉伯糖异构酶的克隆表达,性质研究及分子改造[D].无锡:江南大学,2010.
[30]徐铮,李贵祥,李莎,等.生物法生产D-塔格糖的研究进展[J].生物加工过程,2013,11(4):64-71.
[31]梅文鼎.Bacillus coagulans NL01 L-阿拉伯糖异构酶的理性设计及D-塔格糖制备[D].南京:南京林业大学,2016.
[32]邹刚华,赵凤亮,单颖,等.亚热带稻田土壤反硝化动力学参数估算[J].土壤,2019,51(3):517-523.
[33]秦丽红.利用乳酸菌L-阿拉伯糖异构酶生产D-塔格糖的研究[D].济南:山东大学,2021.
[34]翁玮慧,张华,江波.L-阿拉伯糖异构酶粗酶性质及其生物合成塔格糖的研究[J].食品工业科技,2006,27(1):158-162.
[35]王珊.产脂肪酶微生物细胞的透性化及固定化研究[D].大连:大连工业大学,2010.
[36]张华,江波,潘蓓蕾,等.透性化植物乳酸杆菌细胞L-阿拉伯糖异构酶表观活力的研究[J].食品与发酵工业,2006,32(10):17-19.