中草药包括中药饮片、中药汤剂和中成药[1-2],近年来随着中草药的普及和制药业的不断发展,中国每年都会产生大量的中药残留(药渣)[3],传统的中药药渣处理方法包括焚烧、堆放和填埋,这些方法不仅导致严重的生态环境污染,而且造成中药药渣的巨大浪费[4]。近年来,人们对药渣的有效利用进行了探索[5]。以药渣为原料,通过热解制备成生物燃料和生物能源[6],还可以通过酶解或发酵生产乙醇和沼气[7-8]。从药渣中提取多糖和黄酮类化合物等有效活性成分[9-10]。药渣也可以用于生态环境修复[11-13],通过热解制备成生物炭,用来吸附环境中的重金属和其他污染物,改善土壤肥力和促进植物生长。
在现代可持续农业的发展中,线虫的生物防治技术因其对土壤中有益微生物无毒害、对地下水无污染及对农产品无残留影响等特点,正成为防治植物寄生线虫最具前景和最有效的措施之一[14]。土壤中的一些原生真菌其产生的有毒代谢产物可以使线虫的种群数目处于较低水平[15]。淡紫拟青霉(Paecilomyces lilacinus)是其中一种重要的植物病原线虫卵寄生真菌,对根结线虫和胞囊线虫的卵有较强寄生能力,是导致根结线虫和胞囊线虫自然下降的主要因素之一[16],并且其能促进作物生长和引起土壤微生物种群和组成的变化[17]。为了充分发挥淡紫拟青霉对线虫的杀虫潜力,近年来对其杀虫机理进行了研究,证明其能释放几丁质酶和丝氨酸蛋白酶等裂解酶,协助菌丝体侵入虫卵,其中几丁质酶在降解线虫卵中间层(几丁质层)中具有重要作用[18-19]。
固态发酵具有生产成本相对较低、代谢物得到充分保留、储存和运输方便等优点,固体发酵更适应于生产的要求[20]。本研究以黄芩药渣废弃物为基质,对其培养基组成及发酵条件进行优化,并考察不同几丁质添加量对菌株产几丁质酶活性的影响,以期全面促进淡紫拟青霉农业综合防治效果,为淡紫拟青霉的产业化提供指导。
1 材料与方法
1.1 材料与试剂
淡紫拟青霉(Paecilomyces lilacinus):由河南省微生物工程重点实验室分离保藏。
黄芩药渣:河南福森药业有限公司;几丁质、几丁质酶活性检测试剂盒:北京索莱宝生物科技有限公司;本试验所用试剂均为分析纯或生化试剂。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g/L,葡萄糖20 g/L,琼脂15~20 g/L,121 ℃灭菌25 min。
种子培养基:氯化钠10 g/L,磷酸二氢钾0.5 g/L,葡萄糖2 g/L,磷酸氢二钾1.5 g/L,硝酸铵1 g/L,七水硫酸镁0.1 g/L,自然pH,115 ℃灭菌20 min。
基础发酵培养基:黄芩药渣20 g,玉米粉0.4 g,(NH4)2SO4 0.04 g,含水量为70%,自然pH,121 ℃灭菌30 min。
1.2 仪器与设备
PL203电子天平:梅特勒-托利多仪器(上海)有限公司;SX-500高压蒸汽灭菌锅:日本Kagoshima Seisakusyo公司;HYG-A全温摇瓶柜:太仓市豪诚实验器制造有限公司;DRP-9052型电热恒温培养箱:上海森信实验仪器有限公司;Varisokan Flash多功能酶标仪:美国赛默飞世尔科技公司;HH恒温水浴锅:江苏金坛市中大仪器厂;MIKRO22R离心机:德国Hettich 公司。
1.3 方法
1.3.1 种子液的制备
在无菌条件下,用0.5 cm打孔器在长满淡紫拟青霉的PDA平板上取5块菌饼加入100 mL种子培养基中,30 ℃、180 r/min摇床培养48 h,即获得淡紫拟青霉种子液。
1.3.2 分生孢子数的测定
培养一定时间后将发酵结束的淡紫拟青霉固体培养物中加入60 mL无菌水,180 r/min充分振荡1 h,得到孢子悬浮液,用移液枪吸取适量菌液,显微镜下血球计数法测定分生孢子数。每个处理重复3次。
1.3.3 固态发酵培养基组成优化单因素试验
以基础发酵培养基为基础,固定碳源添加量为0.4 g,氮源添加量为0.04 g,淡紫拟青霉种子液接种量为10%,发酵温度30 ℃,发酵时间7 d。分别考察碳源(玉米粉、可溶性淀粉、麸皮、蔗糖)及碳源添加量(0.4 g、0.6 g、0.8 g、1.0 g、1.2 g),氮源(尿素、酵母、蛋白胨、KNO3、(NH4)2SO4)及氮源添加量(0.02 g、0.04 g、0.06 g、0.08 g、0.10 g),基质总质量的含水量(70%、80%、90%、100%、110%)对分生孢子数的影响。
1.3.4 固态发酵培养基组成优化正交试验
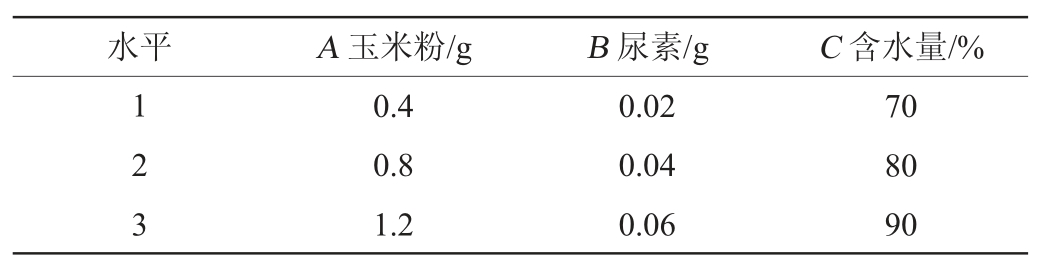
在单因素试验的基础上,设计3因素3水平L9(33)正交试验优化固态发酵培养基组成,正交试验因素与水平见表1,每个处理3个重复。
表1 固态发酵培养基组成优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiment for medium composition optimization of solid-state fermentation
1.3.5 固态发酵培养条件的优化
固定发酵温度为30 ℃,发酵时间为7 d,分别考察淡紫拟青霉种子液接种量(6%、8%、10%、12%)、发酵温度(20 ℃、24 ℃、28 ℃、32 ℃、36 ℃)、发酵时间(3 d、5 d、7 d、9 d)对菌株分生孢子数的影响。
1.3.6 不同几丁质添加量对菌株产几丁质酶活性的影响
在上述最佳发酵培养基和培养条件的基础上加入不同含量的几丁质,几丁质添加量分别为0.3%、0.6%、0.9%、1.2%、1.5%,在最佳发酵条件下培养7d后测定几丁质酶活性。
1.3.7 几丁质酶活性的测定
采用几丁质酶活性检测试剂盒测定几丁质酶活性[21]。几丁质酶活活定义为:37 ℃条件下每1 mL培养液每小时分解几丁质产生1 μmol N-乙酰氨基葡萄糖的酶量为一个酶活性单位(U/mL)。
1.3.8 数据分析
采用Excel 2007进行数据分析,采用SPSS 26.0软件进行单因素方差分析(analysis of variance,ANOVA),并采用Duncan法检验数据的差异显著性,P<0.05表示差异显著。
2 结果与分析
2.1 固态发酵培养基组成优化单因素试验
2.1.1 碳源对菌株产孢的影响
由图1A可知,淡紫拟青霉在以玉米粉为碳源的固态发酵培养基中所获得的分生孢子数显著高于其他碳源培养基(P<0.05),分生孢子数为3.78×108 CFU/g。由图1B可知,随玉米粉添加量的增加,固态发酵培养基中所获得的分生孢子数呈先升高后降低的趋势,玉米粉添加量为0.8 g时,分生孢子数最高,为4.62×109 CFU/g。所以淡紫拟青霉固态发酵培养基的最佳碳源为0.8 g玉米粉。
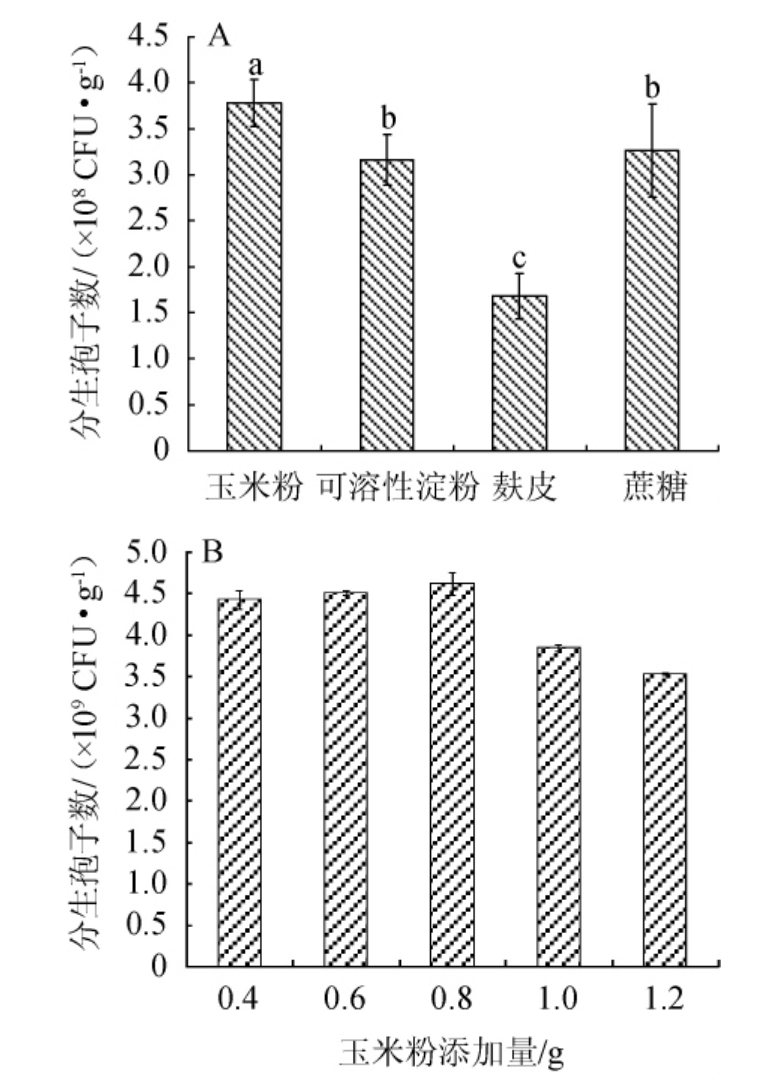
图1 碳源种类(A)及玉米粉添加量(B)对菌株分生孢子数的影响
Fig.1 Effects of carbon source types (A) and corn flour addition (B)on conidia number of strain
不同小写字母表示差异显著(P<0.05)。下同。
2.1.2 氮源对菌株产孢的影响
由图2可知,不同的氮源对淡紫拟青霉的分生孢子数具有影响,与其他氮源相比,其中尿素的添加能显著性提高淡紫拟青霉的分生孢子数(P<0.05),分生孢子数为3.6×109 CFU/g。由图2B可知,随尿素添加量的增加,固态发酵培养基中所获得的分生孢子数呈先升高后降低的趋势,尿素添加量为0.04 g时,分生孢子数最高,为4.85×109 CFU/g。所以淡紫拟青霉固态发酵培养基的最佳氮源为0.04 g尿素。

图2 氮源种类(A)及尿素添加量(B)对菌株分生孢子数的影响
Fig.2 Effects of nitrogen source types (A) and urea addition (B) on conidia number of strain
2.1.3 含水量对菌株产孢的影响
由图3可知,当含水量为70%~80%时,分生孢子数逐渐增加;含水量为80%时,分生孢子数达到最高,分生孢子数为4.91×109 CFU/g,显著高于其他水平(P<0.05)。所以,淡紫拟青霉固体发酵培养基的最佳含水量为80%。
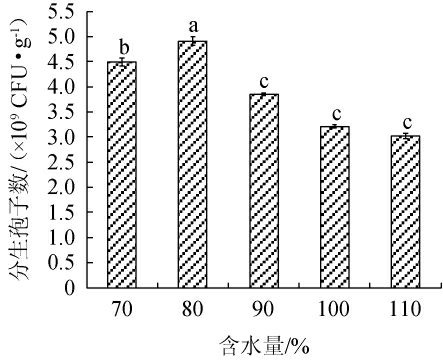
图3 含水量对菌株分生孢子数的影响
Fig.3 Effect of water content on conidia number of strain
2.2 固态发酵培养基组成优化的正交试验结果
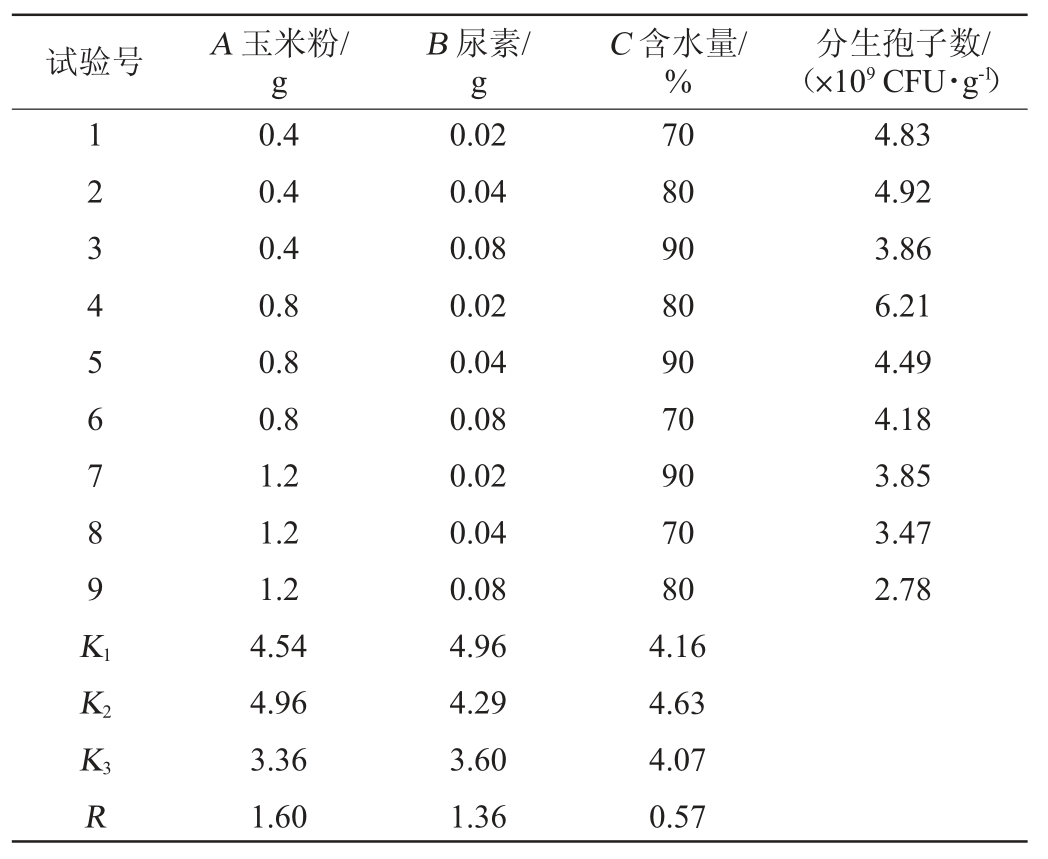
由表2可知,对菌株淡紫拟青霉产分生孢子数影响顺序为玉米粉(A)>尿素(B)>含水量(C),对应的最佳培养基组合为A2B1C2,即玉米粉含量为0.8 g,尿素含量为0.02 g,含水量为80%,在此优化条件下,分生孢子数可达6.21×109 CFU/g。
表2 固态发酵培养基组成优化正交试验结果与分析
Table 2 Results and analysis of orthogonal experiments for medium composition optimization of solid-state fermentation
2.3 固态发酵培养条件对菌株产孢的影响
2.3.1 不同接种量对菌株产孢的影响
由图4可知,淡紫拟青霉的分生孢子数随接种量的增加呈先增加后变化平稳的趋势,接种量太小不利于菌株的生长和孢子萌发,接种量为10%时,淡紫拟青霉的分生孢子数最高,为6.48×109 CFU/g,而当接种量超过10%时,分生孢子数略有所下降,但差异不显著(P>0.05)。所以淡紫拟青霉固态培养基的最佳接种量为10%。
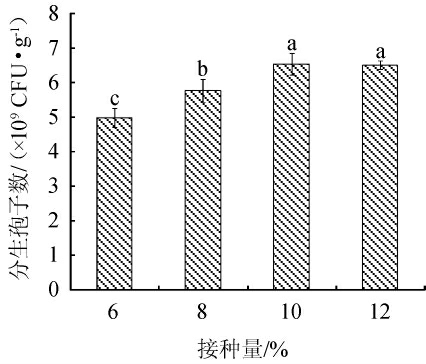
图4 接种量对菌株分生孢子数的影响
Fig.4 Effect of inoculum on conidia number of strain
2.3.2 不同培养温度对菌株产孢的影响
由图5可知,淡紫拟青霉的分生孢子数随培养温度的升高呈先缓慢增加后减少的趋势,在培养温度28 ℃时分生孢子数最高,8.98×109 CFU/g。而随着培养温度的继续升高,菌株的分生孢子数反而显著降低(P<0.05)。可能是由于淡紫拟青霉对温度的变化特别敏感,36 ℃超出菌株耐受温度,菌株的生长及产孢受到抑制。因此,淡紫拟青霉的最佳培养温度为28 ℃。
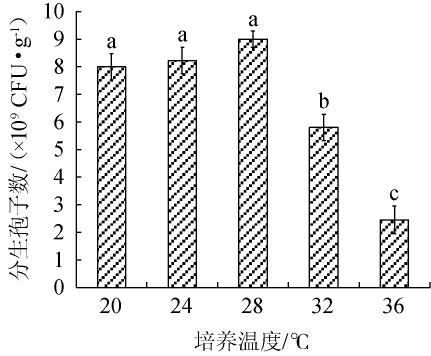
图5 培养温度对分生孢子数的影响
Fig.5 Effect of culture temperature on conidia number of strain
2.3.3 不同发酵时间对菌株产孢的影响
由图6可知,随着发酵时间的增加,淡紫拟青霉的分生孢子数也随着升高。在发酵培养第3天时,菌株已经产生分生孢子,到第7天时分生孢子数显著性增加,发酵培养到第9天,菌株分生孢子数有所下降。淡紫拟青霉在前期主要以菌丝体生长为主,后期产生分生孢子。因此,7 d为该菌株的最佳产孢时间。
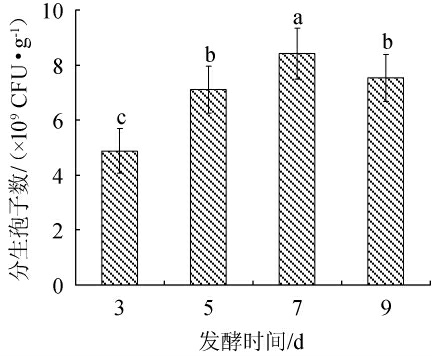
图6 发酵时间对分生孢子数的影响
Fig.6 Effect of culture time on conidia number of strain
2.4 不同几丁质添加量对菌株产几丁质酶活性的影响
几丁质添加量对菌株产几丁质酶活性的影响见图7。由图7可知,当几丁质添加量为0~0.9%时,菌株产几丁质酶活性逐渐增加;当几丁质添加量为0.9%时,几丁质酶活性为1.5 U/mL,几丁质酶活性比对照提升了30%,且具有显著差异(P<0.05);当几丁质添加量>0.9%时,几丁质酶活性变化趋于平稳。几丁质酶是一类诱导酶,添加一定含量的几丁质可以作为诱导物诱导菌株产几丁质酶。综合考虑,确定几丁质添加量为0.9%。
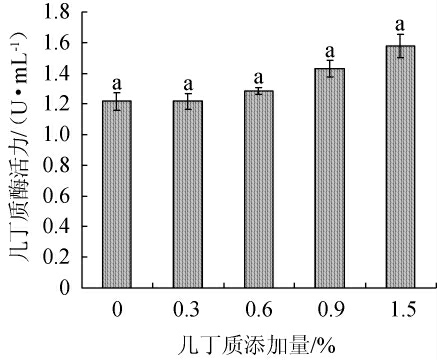
图7 几丁质添加量对菌株产几丁质酶活性的影响
Fig.7 Effect of chitin addition on chitinase-producing activity of strain
3 讨论
发酵培养基可以利用低成本的农业、工业副产品或其它废弃物作为发酵基质,不仅容易获取,生产成本低,且能够为淡紫拟青霉的生长和产孢提供充足的营养[22-23]。本研究采用中药渣最为淡紫拟青霉固体发酵基质,中药渣中含有丰富有机质、多糖和氮、磷、钾等营养物质,且不含致病菌[24],可以用作微生物菌剂发酵,制作有机微生物肥料,变废为宝。结果表明,在黄芩药渣中加入适量的碳源玉米粉和氮源尿素可以提高其产孢子能力,前期研究发现玉米粉是一种适合淡紫拟青霉的营养物质[25],发酵基质含水量是影响淡紫拟青霉固体发酵产孢的重要因素,含水量过低或者过高都不利于淡紫拟青霉的产孢。含水量过高时,物料含水量大影响发酵物料的透气性,不利于淡紫拟青霉的生长及分生孢子的分化;而含水量较低时,培养基干燥,菌株生长缓慢[26]。本研究进一步研究了发酵条件对菌株产孢能力的影响。接种量的多少对固体发酵影响比较显著,接种量太小,不能满足菌株萌发的需要,淡紫拟青霉生长缓慢,产孢量少,而且接种量太小不利于菌株对养分的有效利用,淡紫拟青霉孢子产量也会降低。温度也是影响菌株产孢的一个重要因素,温度升高有利于淡紫拟青霉产孢,但固体发酵是一个放热的过程,当温度过高时,超过菌株耐受温度,不利于菌株的生长及产孢[25],温度过低时菌株生长缓慢,延长生长周期。CAO J等[27]研究表明,添加几丁质粉提升几丁质酶的活性,但其活性仅为0.11 U/mL。添加0.9%几丁质时,可显著增加菌株产几丁质酶酶活性(P<0.05)。
4 结论
淡紫拟青霉固态发酵黄芩药渣的最佳培养基组成为:黄芩药渣20 g,玉米粉0.8 g,尿素0.02 g,含水量80%,固态发酵最佳培养条件为培养温度28 ℃,接种量10%,培养时间7 d,在此优化条件下,分生孢子数可达8.98×109 CFU/g。添加0.9%几丁质时,可显著增加菌株产几丁质酶酶活性(P<0.05)。本研究提升了淡紫拟青霉发酵黄芩药渣的产孢能力和几丁质酶活性,利用黄芩药渣生产生防菌肥既可以解决药渣对环境的危害,变废为宝,又可以提高经济效益,具有广阔的应用前景。
[1]FENG W W,AO H,PENG C,et al.Gut microbiota,a new frontier to understand traditional Chinese medicines[J].Pharmacol Res,2019,142:176-191.
[2] YANG W Z,ZHANG Y B,WU W Y,et al.Approaches to establish Q-markers for the quality standards of traditional Chinese medicines[J].Acta Pharmacol Sin,2017,7(4):439-446.
[3]朱伟群,王丽君,梁攀,等.中药资源可持续发展的现状与未来[J].世界中医药,2018,13(7):1752-1755.
[4]DE AZEVEDO A R G,ALEXANDRE J,PESSANHA L S P,et al.Characterizing the paper industry sludge for environmentally-safe disposal[J].Waste Manag,2019,95:43-52.
[5] LU Q,LI C L.Comprehensive utilization of Chinese medicine residues for industry and environment protection:Turning waste into treasure[J].J Clean Prod,2021,279:123856.
[6]ZENG X,SHAO R Y,WANG F,et al.Industrial demonstration plant for the gasification of herb residue by fluidized bed two-stage process[J].Bioresource Technol,2016,206:93-98.
[7]张英,张颖颖,吴献跃,等.中药药渣生产乙醇预处理方法的探讨[J].广州中医药大学学报,2013,30(2):223-227.
[8]GUAN H B,FAN X X,ZHAO B F,et al.An experimental investigation on biogases production from Chinese herb residues based on dual circulating fluidized bed[J].Int J Hydrog Energy,2018,43(28):12618-12626.
[9]郑宇翔,肖凤霞,林励,等.青蒿渣中总多糖提取工艺及其抗氧化活性[J].中国实验方剂学杂志,2015,21(14):8-11.
[10]闫精杨,江曙,刘培,等.银杏叶药渣中聚戊烯醇和总黄酮的综合提取工艺研究[J].南京中医药大学学报,2017,33(1):104-108.
[11]XIAO L L,DING Y.Study on remediation of Cu and Cd in contaminated soil with the combination of biochar and maifanite[J].Environ Sci Technol,2019,42(2):145-150.
[12]SUN Q Z,SARATALE R G,SARATALE G D,et al.Pristine and modified radix Angelicae dahuricae(Baizhi)residue for the adsorption of methylene blue from aqueous solution:a comparative study[J].J Mol Liq,2018,265:36-45.
[13]YU Z W,GAO Q,ZHANG Y,et al.Production of activated carbon from sludge and herb residue of traditional Chinese medicine industry and its application for methylene blue removal[J].Bio Resources,2019,14(1):1333-1346.
[14]DEEP S,MUSLIM M,TYAGI N.On field management of root-knot infestation in tomato and brinjal through bioformulations of Paecilomyces lilacinus and Pochonia chlamydosporia[J].J Biopest,2020,13(2):187-194.
[15]KERRY B R.Rhizosphere interactions and the exploitation of microbial agents for the biological control of plant-parasitic nematodes[J].Annu Rev Phytopathol,2000,38(1):423-441.
[16]祝明亮,夏振远,张克勤,等.淡紫拟青霉在烤烟根际定殖能力分析[J].中国烟草科学,2004,10(1):25-28.
[17] YU Z,ZHANG Y C,LUO W S,et al.Root colonization and effect of biocontrol fungus Paecilomyces lilacinus on composition of ammoniaoxidizing bacteria,ammonia-oxidizing archaea and fungal populations of tomato rhizosphere[J].Biol Fert Soils,2015,51(3):343-351.
[18]KIEWNICK S,SIKORA R A.Biological control of the root-knot nematode Meloidogyne incognita by Paecilomyces lilacinus strain 251[J].Biol Control,2006,38(2):179-187.
[19]BINH C T,VAN TUAN T,TRAM T B,et al.Determination of protease and chitinase activities from Paecilomyces variotii NV01 isolated from Dak Lak pepper soil[J].Vietnam J Sci,Technol Eng,2020,61(4):58-63.
[20]高立红,江志阳,尹微.淡紫拟青霉固体发酵工艺研究[J].微生物学杂志,2020,40(6):36-43.
[21]鞠婷.高产几丁质酶菌株EBI-001 全基因组分析及发酵工艺优化[D].哈尔滨:哈尔滨工业大学,2020.
[22]DAI J Y,YANG Y,DONG Y S,et al.Solid-state co-cultivation of Bacillus subtilis,Bacillus mucilaginosus,and Paecilomyces lilacinus using tobacco waste residue[J].Appl Biochem Biotechnol,2020,190:1092-1105.
[23]景芳,张树武,刘佳,等.长枝木霉T6生防菌剂发酵条件优化及其对辣椒立枯病的防治效果[J].中国生物防治学报,2020,36(1):113-124.
[24] MA J F,CHEN Y P,ZHAO Y,et al.Effects of traditional Chinese medicine residue on plant growth and soil properties:a case study with maize(Zea mays L.)[J].Environ Sci Pollut Res,2019,26:32880-32890.
[25]周莲,谢小林,吴天福,等.淡紫拟青霉M-1固体发酵工艺优化及基于自动化种曲机的中试生产[J].中国生物防治学报,2019,35(5):793-804.
[26]曾庆才,肖荣凤,刘波,等.生防菌哈茨木霉FJAT-9040固体发酵条件的响应面优化[J].福建农业学报,2015,30(3):192-197.
[27]CAO J,ZHANG W J,LI K L,et al.Solid-state fermentation technology of Paecilomyces lilacinus and development of agricultural biocontrol agent based on agricultural waste resources[C]//.Proceedings of 2018 International Conference on Modeling,Simulation and Optimization(MSO 2018),2018:601-610.