毛葡萄(Vitis quinquangularis Rehd)是适合卡斯特山区种植的果种[1],在毛葡萄原产地之乡-广西罗城县种植面积已高达5 334 hm2[2]。毛葡萄味酸,不适合鲜食,多用于酿酒[3-4]。随着产量的与年俱增,毛葡萄丰产后集中上市、不耐贮运与酿酒产能不足的矛盾日益凸显[5]。拓宽毛葡萄的加工形式,实现毛葡萄饮料、毛葡萄醋饮料等产品的多样性开发,已成为罗城毛葡萄产业健康发展的当务之急[5]。毛葡萄汁在加工过程中会产生大量含多种活性物质[6-8]的毛葡萄皮渣,其富含的花色苷类物质既能做食品的天然色素[9-11],又对人体有抗癌[12]、抗氧化[13]等功效,极具开发价值。此外,生产低酸度醋饮料[14]以及果汁饮料[15]时,会遇到因稀释比大导致色素不足而仅呈浅红或桔红色的问题,需外加着色剂才能获得悦人的红色。因此,在毛葡萄加工企业建立花色苷的工业化提取技术,实现饮料生产色素的自给是毛葡萄企业深加工能力提升的重要一环。
葡萄皮渣是季节性加工副产品,易腐烂,可采用传统干燥[16]、冷冻干燥[17]或冷冻贮存的方式延长其加工期。目前,利用溶剂提取[18]、超声波辅助提取[19]、微波提取[20]、脉冲电场提取[21]、加压提取[22]、酶法提取[23]等方法对葡萄酿酒酒渣花色苷进行试验室规模的提取研究报道较多,但其工业化提取因受商业保护而报道较少。事实上,溶剂萃取是工业化提取的常见方式,而其他方法因耗能大、工业化设备不完善、投资运行成本高等原因而鲜见应用。新兴的真空辅助提取技术是在真空条件下进行的溶剂提取,可加快提取液对流,增加胞内和胞间的液体传质,因降低提取液的沸点而更有利于热敏性物质的提取[24-25]。随着工业化真空辅助设备日趋完善,其在规模化应用中渐露头角[26]。
目前,仅见利用溶剂提取[18]、微波-超声波协同提取[19]对毛葡萄酿酒皮渣花色苷的实验室研究报道,未见对毛葡萄汁皮渣花色苷提取的报道。鉴于此,本研究利用60 L真空提取浓缩装置对毛葡萄皮渣的花色苷进行提取、浓缩,以花色苷含量为评价指标,采用单因素试验及响应面试验对其提取工艺进行优化,并对浓缩效果进行比对,以期为毛葡萄花色苷的工业化提取提供数据支持。
1 材料与方法
1.1 材料与试剂
毛葡萄皮渣:广西大益生态食品有限公司制汁压榨后直接冷冻的皮渣;柠檬酸、柠檬酸钠、磷酸(均为分析纯):天津市化学试剂研究所有限公司;体积分数为85%乙醇(分析纯):广西大益生态食品有限公司。
1.2 仪器与设备
ZY-NS-TS-60真空动态提取浓缩系统:上海紫裕生物科技有限公司;25 L 316不锈钢桶蒸馏器:烟台帝伯仕酿酒设备有限公司;UV-1800紫外可见分光光度计:济南欧威滕生物科技有限公司;H1850台式高速离心机:北京宏达恒业科技有限公司;ME204E电子天平:陆冠森生物科技(上海)有限公司:CQB900果立方破壁机:佛山市润物电器有限公司;ST2100酸度计:广州市怡华新电子仪器有限公司;PAL-34S酒精计:广州市爱宕科学仪器有限公司。
1.3 方法
1.3.1 毛葡萄皮渣花色苷的提取
将冷冻榨汁后的湿毛葡萄皮渣解冻,利用破壁机破碎打浆,过40目筛。将过筛后的葡萄皮渣浆(毛葡萄皮的密度以0.54 kg/L计)与一定体积分数乙醇按试验设计的料液比混合成25 L待提取液,然后用体积分数85%的磷酸调至设定的pH值。加入真空提取罐中,开启油浴加热器和真空泵,在真空度0.08 MPa和油浴温度65 ℃条件下进行提取。提取过程中,溶液在真空条件下呈低沸点沸腾状态,所产生的酒精蒸汽经冷却装置冷凝后经回收罐和回流管路重回至提取罐,实现真空动态回流提取。期间,每隔20 min通过离心泵进行提取罐液体打回流1 min,以提高物料提取的一致性。
1.3.2 毛葡萄皮渣花色苷的浓缩
提取结束时,泄掉提取罐的真空后开启离心泵,切换管路,将醪液由提取罐经在线金属过滤网过滤转醪至浓缩罐。待物料全部转至浓缩罐后开启真空泵和浓缩罐油浴加热器,维持浓缩罐的真空度在0.085~0.09 MPa之间,保持油浴温度65 ℃,使液体呈沸腾状态。蒸发液经冷却装置汇流于回收罐,随着浓缩的进行,回收罐溶液中冷凝液体积增加、酒精度逐渐下降。当酒精度接近60%vol时,从回收罐中进行第一次酒精溶液排收,此后每隔40 min排收一次。伴随着回收罐中酒精溶液体积的增加,浓缩罐内的液体逐渐减少,待浓缩至1.5 L左右时终止浓缩。关闭加热阀,泄掉浓缩罐真空,回收浓缩液,冷藏备用。所回收的低度酒精需使用桶式蒸馏装置浓缩,以便作为提取溶剂反复使用。
1.3.3 毛葡萄皮渣花色苷提取工艺优化单因素试验设计
在料液比1∶6(V/V),提取液酒精度60%vol,提取液pH 3.0的条件下,先考察提取时间(30 min、60 min、90 min、120 min、150 min、180 min)对花色苷含量的影响。然后在此基础上,依次考察料液比(1∶4、1∶5、1∶6、1∶7、1∶8(V/V))、乙醇体积分数(40%vol、50%vol、60%vol、70%vol、80%vol)、及pH(1.0、2.0、3.0、4.0、5.0)对花色苷含量的影响。
1.3.4 毛葡萄皮渣花色苷提取工艺优化正交试验设计
根据单因素试验的结果,选取料液比(A)、乙醇体积分数(B)、提取时间(C)为考察因素,以花色苷含量为评价指标,采用正交设计助手V3.1软件设计3因素3水平的L9(34)正交试验,试验设计因素与水平见表1。
表1 毛葡萄皮渣花色苷真空辅助提取优化正交试验因素与水平
Table 1 Factors and levels of orthogonal test for vacuum-assisted extraction process optimization of Vitis quinquangularis Rehd anthocyanin

1.3.5 花色苷含量的检测
采用pH示差法检测花色苷含量[22,27]。将提取液或浓缩液8 000 r/min离心15 min,将上清液用纯净水稀释10倍后,取5 mL上清液分别与pH 1.0的0.2 mol/L盐酸-氯化钾缓冲液、pH 4.5的0.2 mol/L柠檬酸-柠檬酸钠缓冲液按体积比1∶1混和,20 ℃平衡30 min,分别在波长520 nm及700 nm处测定各自的吸光度值,计算花色苷含量,其计算公式如下:
式中:H为花色苷含量,mg/L;ΔA=(A520nm-A700nm)pH1.0-(A520nm-A700nm)pH4.5;MW为锦葵色素-3-O-葡萄糖分子质量493.2;DF为稀释倍数;P为光程1 cm;ε以锦葵色素-3-O-葡萄糖摩尔的消光系数20 200 L/(mol·cm)计[22,27]。
1.3.6 花色苷得率的计算
花色苷得率的计算公式如下:
式中:H是毛葡萄皮渣提取液中花色苷的质量浓度,mg/L;V是提取液的体积,L;m是湿毛葡萄皮的质量,mg;w是湿毛葡萄皮渣的水分含量,%。
1.3.7 浓缩损失率的计算
花色苷浓缩损失率的计算如下:
式中:H1是提取液中花色苷的质量浓度,mg/L;V1是提取液的体积,L;H2是浓缩液中花色苷的质量浓度,mg/L;V2是浓缩液的体积,L。
1.3.8 数据处理
所有试验重复3次,采用正交试验V3.1软件进行显著性差异分析,采用Origin2018软件绘制图形。
2 结果与分析
2.1 毛葡萄皮渣花色苷真空辅助提取工艺优化单因素试验结果
2.1.1 提取时间对花色苷提取效果的影响
提取时间对花色苷提取效果的影响见图1。由图1可知,在提取时间30~180 min内,随着提取时间的增加,提取液中花色苷的含量呈先增高后下降的趋势。当提取时间为120 min时,达到最高,为(287.03±2.44)mg/L。120 min之前花色苷含量低可能是因为溶出不完全造成的,而120 min之后的降低可能是由于花色苷溶出已完全但因热降解损失而造成的[9,12,22]。基于此,选取最优提取时间为120 min。
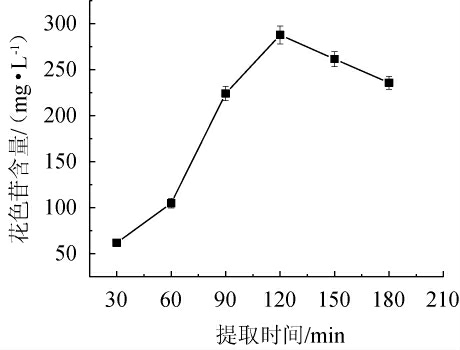
图1 提取时间对毛葡萄皮渣花色苷含量的影响
Fig.1 Effect of extraction time on Vitis quinquangularis Rehd anthocyanin content
2.1.2 料液比对花色苷提取效果的影响
料液比对花色苷提取效果的影响见图2。由图2可知,随着料液比1∶4(V/V)变化为1∶6(V/V)时,提取液花色苷含量逐渐增加,分析原因可能是料液比的降低能提高花色苷分子扩散速率,使溶解在提取液中的花色苷增多[18]。当料液比为1∶6(V/V)时,花色苷含量最高,为(305.59±2.97)mg/L。当料液比1∶6(V/V)变化为1∶8(V/V)时,提取液中的花色苷含量呈降低趋势,可能与此时溶出已比较完全而过多的提取溶剂会引发稀释有关。基于此,选取料液比1∶6(V/V)为最优料液比。
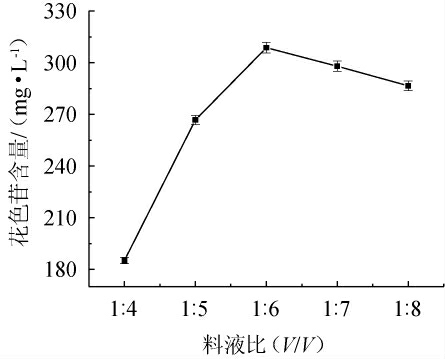
图2 料液比对毛葡萄皮渣花色苷含量的影响
Fig.2 Effect of solid-liquid ratio on Vitis quinquangularis Rehd anthocyanin content
2.1.3 乙醇体积分数对花色苷提取效果的影响
乙醇体积分数对花色苷提取效果的影响见图3。由图3可知,随着提取液乙醇体积分数的增大,提取液花色苷的含量呈先升后降的趋势。当乙醇体积分数为60%时,花色苷的含量最高,为(306.95±3.17)mg/L。葡萄皮中富含多种花青素单体的衍生物和聚合体组分,每个组分具有不同的极性[27],而体积分数60%乙醇的极性居中,故对毛葡萄皮渣不同极性花色苷组分均有较好的溶解作用[25]。基于此,选取最优乙醇体积分数为60%。
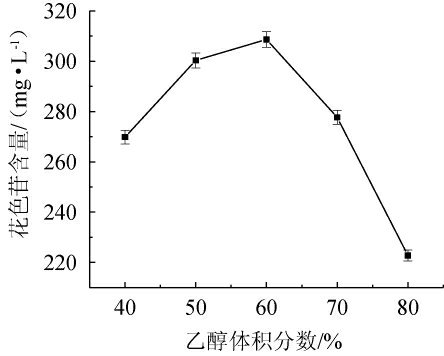
图3 乙醇体积分数对毛葡萄皮渣花色苷含量的影响
Fig.3 Effect of ethanol volume fraction on Vitis quinquangularis Rehd anthocyanin content
2.1.4 pH对花色苷提取效果的影响
pH对花色苷提取效果的影响见图4。由图4可知,pH为1时提取效果最好,花色苷含量最高,为(353.64±2.41)mg/L。随着pH的增大,提取效果逐渐降低,分析原因可能是低pH有利于细胞壁的水解,花色苷在pH 1~3稳定,从而有利于花色苷的提取[22]。使用食品级磷酸的调配pH<1.0的提取液比较困难,故未进行进一步的实验。基于此,固定提取液pH为1.0。
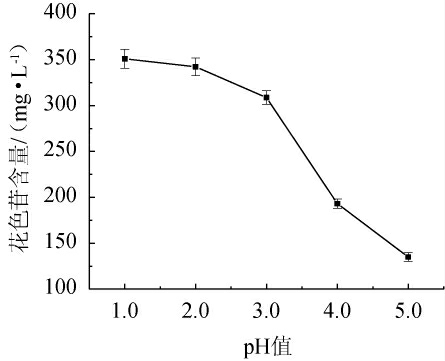
图4 pH对毛葡萄皮渣花色苷含量的影响
Fig.4 Effect of pH on Vitis quinquangularis Rehd anthocyanin content
2.2 毛葡萄皮渣花色苷真空辅助提取工艺优化正交试验结果
正交试验的结果及方差分析分别见表2、表3。由表2及表3可知,不同因素对毛葡萄皮渣中花色苷提取的影响主次顺序为料液比>酒精度>提取时间,其中料液比和酒精度对花色苷的提取效果有显著影响(P<0.05),通过极差分析确定最佳提取条件为A2B3C2,即料液比1∶6(V/V)、乙醇体积分数65%、提取时间120 min。在此条件下进行验证试验,所得提取液的花色苷含量为423.12 mg/L,花色苷的提取得率、浓缩得率分别为(1.59±0.02)%、(1.42±0.02)%,浓缩损失率为(10.92±0.24)%,效果较理想,但提取液从21.72 L浓缩至1.70 L所需时间为(5.12±0.05)h,耗时较长,后续有待缩短。浓缩试验结果表明浓缩过程中花色苷的损失较高,分析原因,可能来自两个方面:一是,加热条件下的花色苷降解以及在浓缩罐上的挂壁损失;二是,由于研究所用的浓缩罐底部无油浴加热带、只有罐身有加热带,会导致浓缩后期浓缩液无法直接加热而导致挥发效果差,进而增加浓缩时间,从而引发过多的花色苷热降解。
表2 毛葡萄皮渣花色苷真空辅助提取工艺优化正交试验结果与分析
Table 2 Results and analysis of orthogonal experiment for vacuum-assisted extraction process optimization of Vitis quinquangularis Rehd anthocyanin
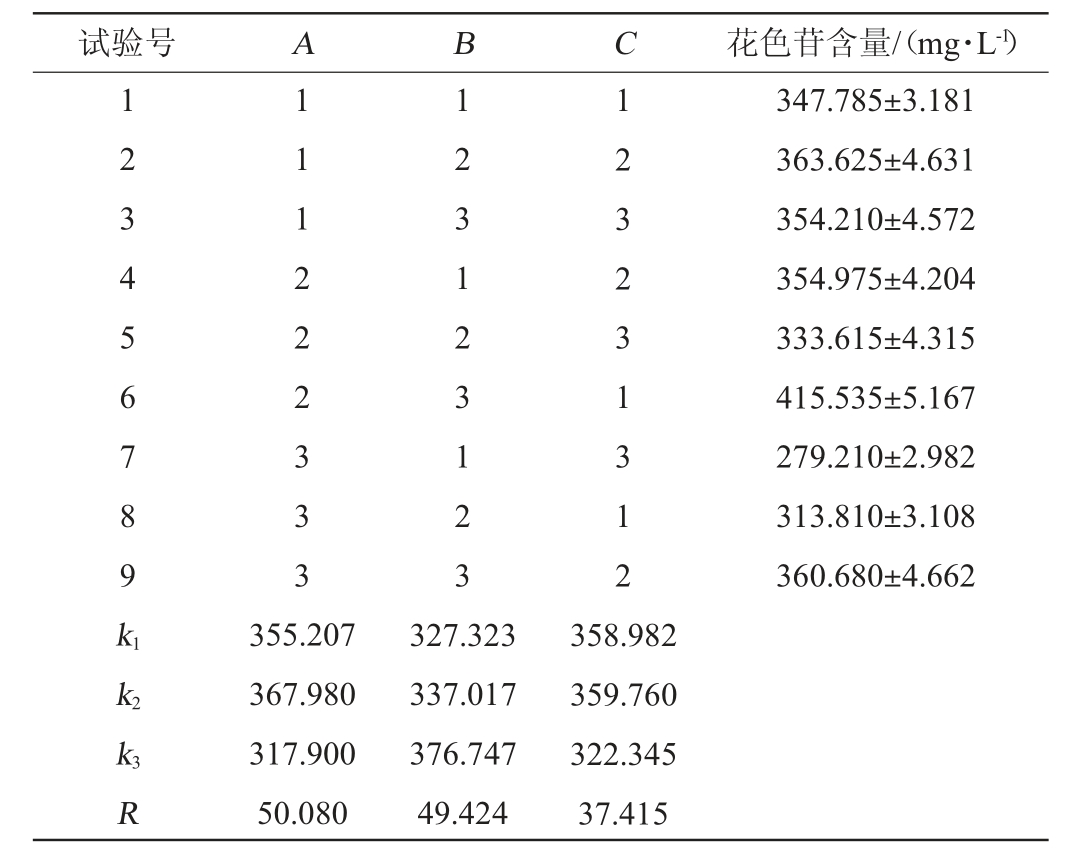
表3 正交试验结果方差分析
Table 3 Variance analysis of orthogonal tests results
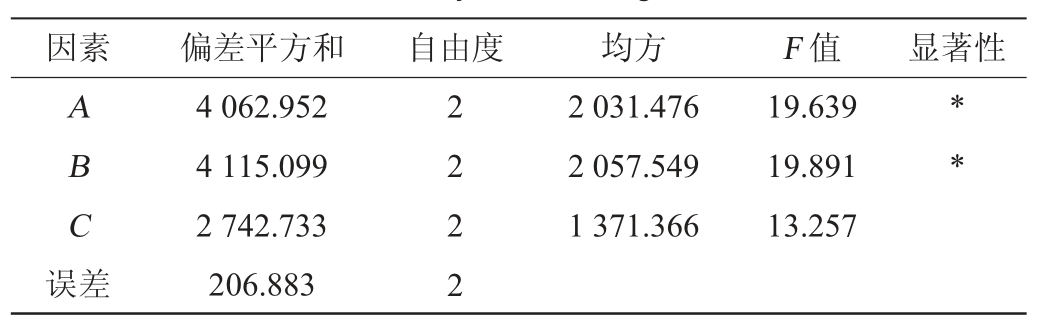
注:“*”表示对结果影响显著(P<0.05)。
本研究花色苷提取得率与文献[12,18,23]报道在一个数量级上,而花色苷的实际提取得率与葡萄品种、农事条件、提取方法等直接相关[9,13,28]。试验未对浓缩液进行花色苷的进一步提纯,因为毛葡萄皮中的单宁等成分是花色苷良好的辅色剂和稳定剂,以混合物保存可使浓缩液花色苷的稳定性更高[24],且可降低生产成本。
3 结论
在单因素的基础上,采用正交试验优化确定毛葡萄皮花色苷真空辅助提取工艺的最佳条件为:料液比1∶6(V/V),酒精度65%vol,pH 1,真空度0.08 MPa,油浴温度65 ℃,提取时间120 min。在此优化条件下,花色苷的提取得率、浓缩得率分别为(1.59±0.02)%、(1.42±0.02)%,浓缩损失率为(10.92±0.24)%,浓缩时间为(5.12±0.05)h。本研究的试验结果为毛葡萄花色苷的大生产提取和浓缩提供了一定的数据支持。为提高浓缩效率,在后续的大生产选型时,需要选取底部有加热带装置的浓缩罐,以提高浓缩效率、减少花色苷的热损失,缩短浓缩时间。不提纯的浓缩液可能对花色苷稳定性有利,但是否适合应用到汁饮料和醋饮料的生产中,尚需要后续进行口味接受度验证试验,确保饮料保持鲜红色泽的同时不会因单宁含量过多而出现突兀的涩味。
[1]何海旺,赵明,龙芳,等.广西桂北喀斯特地区野生毛葡萄种质资源初步评价[J].中国农学通报,2015,31(31):119-124
[2]孙尚军.广西罗城县野生毛葡萄产业扶贫的研究[D].南宁:广西大学,2017.
[3]吴代东,李乃流,姚宁,等.毛葡萄酿酒工艺优化初探[J].中外葡萄与葡萄酒,2016(2):32-34.
[4]管敬喜,黄羽,韦荣福,等.三种酿造工艺对野酿2号毛葡萄酒香气成分的影响[J].食品工业科技,2020,41(2):220-226.
[5]何彦平,韦宇萍.广西罗城毛葡萄产业发展现状及“十四五”期间发展措施[J].南方农业,2021,15(17):154-155.
[6]罗强.仫佬族野生毛葡萄饮料研制及抗疲劳功能研究[J].食品研究与开发,2017,38(1):174-178.
[7]黄小云,杨莹,成果,等.葡萄酿酒皮渣中齐墩果酸的分离提取及利用[J].中国酿造,2017,36(12):110-114.
[8]车金鑫,师俊玲,罗光武.广西罗城毛葡萄多酚、黄酮和白藜芦醇的组成特性及其抗氧化活性研究[J].西北农林科技大学学报(自然科学版),2017,45(7):107-114.
[9] ALAPPAT B,ALAPPA J.Anthocyanin pigments: Beyond aesthetics[J].Molecules,2020,25(23):5500.
[10] GARCIA-LOMILLO J,GONZALEZ-SANJOSE M L.Applications of wine pomace in the food industry:Approaches and functions[J].Compr Rev Food Sci F,2017,16(1):3-22.
[11]SPARROW A M,DAMBERGS R G,CLOSE D C,et al.Grape skins as supplements for color development in Pinot noir wine[J].Food Res Int,2020,133:108707.
[12]TAN J Q,LI Q,XUE H K,et al.Ultrasound-assisted enzymatic extraction of anthocyanins from grape skins: optimization,identification,and antitumor activity[J].J Food Sci,2020,85(11):3731-3744.
[13]OLIVEIRA J,SILVA M A,TEIXEIRA N,et al.Screening of anthocyanins and anthocyanin-derived pigments in red wine grape pomace using LC/DAD-MS and MALDI-TOF techniques[J].J Agr Food Chem,2015,63(35):7636-7644.
[14]操庆国,曹正,许伟祥,等.发酵型巨峰葡萄果醋饮料生产工艺研究[J].食品科技,2019,39(11):84-90.
[15]魏玉梅,张帅中,冯玉兰,等.响应面法优化人参果枸杞葡萄复合饮料工艺[J].加工与保鲜,2022,22(3):43-49.
[16]PEDROZA M A,AMENDOLA D,MAGGI L,et al.Microwave-assisted extraction of phenolic compounds from dried waste grape skins[J].Int J Food Eng,2015,11(3):359-370.
[17] TORRES C,SCHUMACHER R,ALANON M E,et al.Freeze-dried grape skins by-products to enhance the quality of white wines from neutral grape varieties[J].Food Res Int,2015,69:97-105.
[18]管敬喜,杨莹,张劲,等.野生毛葡萄皮渣花色苷提取工艺研究[J].酿酒科技,2016(8):40-43.
[19]薛敏敏,邓学良,李忠海,等.微波-超声波协同提取野生毛葡萄皮色素的工艺研究[J].食品与机械,2010(6):141-143.
[20]KWIATKOWSKI M,KRAVCHUK O,SKOUROUMOUNIS G K,et al.Microwave-assisted and conventional phenolic and colour extraction from grape skins of commercial white and red cultivars at veraison and harvest[J].J Clean Prod,2020,275:122671.
[21]ICAS S I,BANDICI L,TEUSDEA A C,et al.The bioactive compounds,antioxidant capacity,and color intensity in must and wines derived from grapes processed by pulsed electric field[J].CYTA-J Food,2017,15(4):553-562.
[22] PEREIRA D T V,TARONE A D,CAZARIN C B B,et al.Pressurized liquid extraction of bioactive compounds from grape marc[J].J Food Eng,2019,240:105-113.
[23] TATICCHIA A,ESMONTIBELLER M J,MONTEIRO P L,et al.Improvement of enzymatic assisted extraction conditions on anthocyanin recovery from different varieties of V.vinifera and V.labrusca grape pomaces[J].Food Anal Method,2019,12:2056-2068.
[24]WANG Y Q,WU Z F,KE G,et al.Effective vacuum assisted extraction method for the optimization of labdane diterpenoids from Andrographis paniculata by response surface methodology[J].Molecules,2015,20:430-445.
[25] TATICCHIA A,EPOSTO S,VENEZIANIA G,et al.High vacuum-assisted extraction affects virgin olive oil quality:Impact on phenolic and volatile compounds[J].Food Chem,2021,342:128369.
[26]郭炳其,魏朝丹,周树勇.真空低温工艺技术在黑胡萝卜花青素提取中的应用[J].生物加工过程,2016,14(1):19-23.
[27]LI S C,SUN L,FAN X C,et al.Polymorphism of anthocyanin concentration and composition in Chinese wild grapes[J].Aus J Grape Wine R,2021,27(1):34-41.
[28]GORDILLO B,SIGURDSON G T,SIGURDSON G T,et al.Assessment of the color modulation and stability of naturally copigmented anthocyanin-grape colorants with different levels of purification[J].Food Res Int,2018,106:791-799.