红曲霉是我国传统的药食两用丝状真菌,利用红曲霉酿制药酒在我国及东南亚有近两千年的历史[1]。红曲霉代谢产物不仅可以用于食品着色、增香,而且具有降低胆固醇、活血化瘀以及抗炎症等药物功效[2-3]。红曲霉代谢产物包括红曲色素、莫纳可林K(monacolin K)、γ-氨基丁酸、酯化酶以及辅酶Q10等[4-6]。天然发酵的红曲中含有一种具有高效降脂作用的他汀—开环型莫纳可林K(monacolin K),其能够竞争性抑制胆固醇合成中关键限速酶(羟甲戊二酰辅酶A还原酶),直接发挥降脂作用,相比洛伐他汀,不再需要人体肝脏内的羟基脂酶参与水解,减轻了肝脏负担,因此,monacolin K的降脂作用和副作用相比化学合成的洛伐他汀优势明显,是目前各国公认比较理想的降胆固醇药剂[7-8]。
1955年,BLANC G等[9]研究发现,部分红曲霉可产生桔霉素,对脊椎动物具有肝肾毒性,红曲菌发酵产品的安全性引起了人们的担忧,成为我国红曲产品出口及新产品开发的限制性因素,筛选低产或不产桔霉素的红曲霉菌株成为红曲产业研究的热点[10-12]。目前,国内外关于高产开环型monacolinK、低产或不产桔霉素红曲霉菌株鲜有报道[13-14]。部分报道也仅仅集中在少数功能性红曲企业,整体monacolin K开环率处于较低水平,行业技术还有待进一步革新和完善。
本研究采用不同红曲霉固态发酵制备功能红曲米,采用高效液相色谱法(high performance liquid chromatography,HPLC)对红曲米中monacolin K、桔霉素等物质的含量进行分析,筛选安全高产开环型monacolin K菌株,并进行红曲酒酿造相关应用研究,为制备富含天然他汀类物质的高品质红曲酒提供一定的研究基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
籼米、糯米、麸皮、大豆:均为市售农产品;黄酒高活性干酵母、根霉小曲:安琪酵母股份有限公司;32株红曲霉菌株(ABQ1、ABQ2、ABQ3、ABQ4、ABQ5、ABQ6等):分离自福建古田、浙江杭州、广西武宣以及甘肃兰州等地的传统红曲样品,保存于本实验室;安卡红曲霉(Monascus anka)(BJ-1)、红色红曲霉(Monascus ruber)(BJ-2、WH-1)、紫色红曲霉(Monascus purpureus)(BJ-3、GD-1、WH-2):国内菌种保藏机构。
1.1.2 培养基
分离培养基[15]:6%葡萄糖、2%蛋白胨、0.2%硝酸钠、0.1%磷酸二氢钾、0.05%硫酸镁、2%琼脂粉,121 ℃高压蒸汽灭菌30 min。
大米培养基[15]:52%籼米、4%大豆粉、2%麸皮、2%大豆油、1%半乳糖,121 ℃高压蒸汽灭菌30 min,在超净工作台中捣散培养基后冷却备用。
1.1.3 试剂
洛伐他汀(纯度≥98%):美国Sigma公司;桔霉素(纯度≥98%):上海阿拉丁生化科技股份有限公司;琼脂糖、Ezup柱式真菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒、聚合酶链式反应(polymerase chain reaction,PCR)引物:生工生物工程(上海)股份有限公司;酵母粉、蛋白胨(均为生化试剂):安琪酵母股份有限公司;甲醇、乙腈(均为色谱纯):百灵威科技有限公司;半乳糖(生化试剂):上海源叶生物科技有限公司;磷酸二氢钾、硫酸镁(均为分析纯):国药集团化学试剂有限公司;硝酸钠(分析纯):西陇科学股份有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
GHP-9160型恒温培养箱:上海一恒科学仪器有限公司;789013型气相色谱(gas chromatography,GC)仪、MSD-5977B型气质联用(gas chromatography-mass spectrometry,GC-MS)仪:美国安捷伦科技有限公司;57330-U型固相微萃取手柄、50 μm CAR/DVB/PDMS型纤维萃取头:美国Supelco公司;LC-10A高效液相色谱(high performance liquid chromatography,HPLC)仪:日本岛津公司;17126-104630 C18高效液相色谱柱:美国赛默飞公司;EC250-90型电泳仪、S1000型PCR仪:美国Bio-Rad公司。
1.3 方法
1.3.1 高产monacolin K和低产桔霉素红曲霉菌株的筛选
采用无菌水从茄子瓶中刮洗培养7~9 d的红曲霉孢子,制备孢子悬液(孢子浓度105~106 CFU/g),然后以6%的接种量分别接种到大米培养基中进行固态发酵,先采用高温35 ℃、相对湿度85%条件培养5 d,然后转入低温23 ℃、相对湿度55%条件下培养18~20 d,直至大米全部变为鲜红色,发酵结束后55~60 ℃烘干,得到功能红曲米[15],最后粉碎至60目以上,采用HPLC法测定各个样品中monacolin K和桔霉素含量。
1.3.2 红曲霉菌株的鉴定
形态观察:将红曲霉菌株接种到分离培养基平板中,30 ℃条件下培养8 d,采用显微镜观察红曲霉菌株的菌落形态及菌丝有无横隔、孢子囊柄、孢子囊、囊轴、囊托以及孢子形态等。
分子生物学鉴定:收集红曲霉菌丝体,采用无菌蒸馏水清洗,加入液氮研磨成粉末,采用Ezup柱式真菌基因组DNA提取试剂盒提取DNA。以其为模板,采用引物CMD5(5'CCGAGTACAAGGARGCCTTC-3')和CMD6(5'-CCGATRGAGGTCATRACGTGG-3')对菌株的钙调蛋白(calmodulin)基因进行PCR扩增[16]。PCR扩增体系:10×PCR反应缓冲液5 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTPs)(2.5 mmol/L)1 μL,上下游引物(10 μmol/L)各1 μL,Taq聚合酶2 U,DNA模板2 μL,加无菌蒸馏水至50 μL。PCR扩增程序:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸60 s,33个循环;72 ℃终末延伸10 min。采用琼脂糖凝胶电泳验证扩增产物,然后将产物委托华大基因公司进行测序。将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对,选取同源性较高的模式菌株的calmodulin基因序列作为参比对象,利用Clustal X软件按照最大同源性原则进行多序列比对,采用MEGA软件中的邻接(neighbor-joining,NJ)法构建系统发育树[17]。
1.3.3 红曲酒及小曲酒酿造工艺流程及操作要点
(1)红曲酒[18]
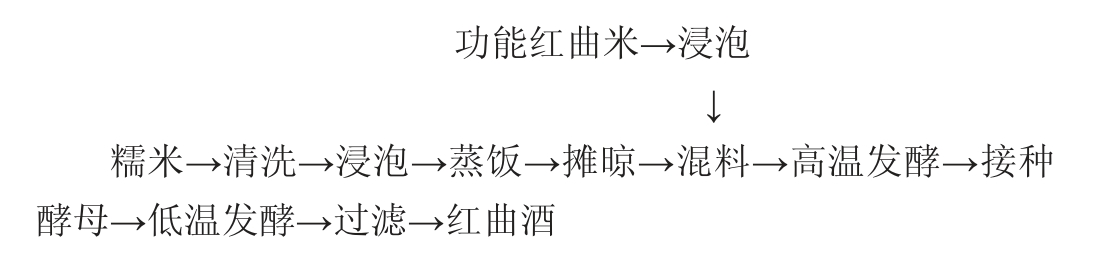
操作要点:将糯米清洗、浸泡12 h以上,隔水蒸饭,冒蒸汽后维持20 min,将米饭取出捣散、摊凉,加入1.5倍提前浸泡10 h以上的功能红曲米液(料水比1∶10),前7 d于30~36 ℃高温条件下发酵,每天搅拌一次,第8天加入0.01%黄酒高活性干酵母,23~25℃低温发酵约40d,过滤,得到红曲酒。
(2)小曲酒[19]
操作要点:糯米清洗、浸泡、蒸饭及摊晾工艺同红曲酒,摊凉后,加入糯米质量0.5倍水溶解根霉小曲后接种到米饭中,前3天30~36 ℃高温发酵,每天搅拌一次,第4天加入0.01%黄酒高活性干酵母,23~25 ℃低温发酵约40 d,过滤,得到小曲酒。
1.3.4 分析检测
monacolin K含量:参考QB/T 2847—2007《功能性红曲米(粉)》中的HPLC法测定,并计算monacolin K开环率,其计算公式如下:

桔霉素含量:参考GB 5009.222—2016《食品安全国家标准食品中桔青霉素的测定》中的免疫亲和柱净化-HPLC法测定。
还原糖(以葡萄糖计)含量:采用3,5-二硝基水杨酸法测定[20]。
酸度(以乙酸计):参考GB/T 12456—2008《食品中总酸的测定》中的酸碱滴定法测定。
酒精度:参考GB 5009.225—2016《食品安全国家标准酒中乙醇浓度的测定》中的酒精计法测定。
1.3.5 主要挥发性风味物质的检测
采用顶空固相微萃取-气质联用(headspace solid phase microextraction-gas chromatography-mass spectrometry,HSSPME-GC-MS)测定挥发性风味物质,样品前处理方法和检测方法参考文献[21-22],略有改动。
样品前处理:红曲酒(小曲酒)样品8 000 r/min离心16 min,保留上清液。取2.0 mL上清液样品,加入4.0 mL蒸馏水、2.5 g氯化钠及10 μL内标溶液(2-辛醇,128.2 mg/L),50 ℃条件下使用50/30 μm DVB/CAR/PDMS固相微萃取头平衡吸附50 min,270 ℃解吸5 min,用于GC-MS测定。
气相色谱条件:TG-WAXMS毛细管色谱柱(30 m×0.25 mm,0.25 μm),进样量1 μL、色谱柱温度230 ℃,载气为高纯氦气(He),载流模式分流比为1∶20,流速为1.0 mL/min。色谱柱初始温度为40 ℃,维持5 min,先以5 ℃/min的速度升温到95 ℃,然后以8 ℃/min的速度升温到230 ℃,维持10 min。
质谱条件:电子电离(electron ionization,EI)源,发射电流50 μA,电子能量70 eV,离子源温度230 ℃,传输线温度250 ℃,扫描范围33~400 amu。
定性、定量:综合标准样品和美国国家标准与技术研究院(national institute of standards and technology,NIST)质谱数据库进行定性分析,采用内标法进行半定量。
1.3.6 数据处理与分析
每组实验分别做3个平行,采用SPSS 22.0软件对数据进行分析,结果采用“平均值±标准偏差”表示;采用Origin 2021软件处理图表。
2 结果与分析
2.1 不同红曲霉制备功能红曲米中monacolin K和桔霉素含量的分析
采用38株红曲霉菌株制备功能红曲米,采用HPLC测定功能红曲米中的monacolin K及桔霉素含量,结果发现,只有12株红曲霉菌株制备的功能红曲米的高效液相色谱图中具有monacolin K特征峰,对其进行定性定量分析,结果见表1。由表1可知,不同红曲霉菌株产monacolin K和桔霉素含量差异较大,12株红曲霉菌株中有10株菌株制备的功能红曲米中能检测到monacolin K,且3株红曲霉菌株产monacolin K性能较好,含量达到10 mg/g以上。本实验室分离的红曲霉菌株制备的功能红曲米样品中monacolin K含量高低依次为:ABQ2>ABQ4>ABQ3>ABQ5>ABQ1>ABQ6,综合不同菌株产monacolin K含量、桔霉素水平以及结合菌落形态特征,初步筛选得到菌株ABQ1、ABQ2、ABQ3、ABQ4。
表1 不同红曲霉菌株制备功能红曲米中monacolin K和桔霉素含量的测定结果
Table 1 Determination results of monacolin K and citrinin contents in functional Monascus rice prepared by different Monascus spp.strains
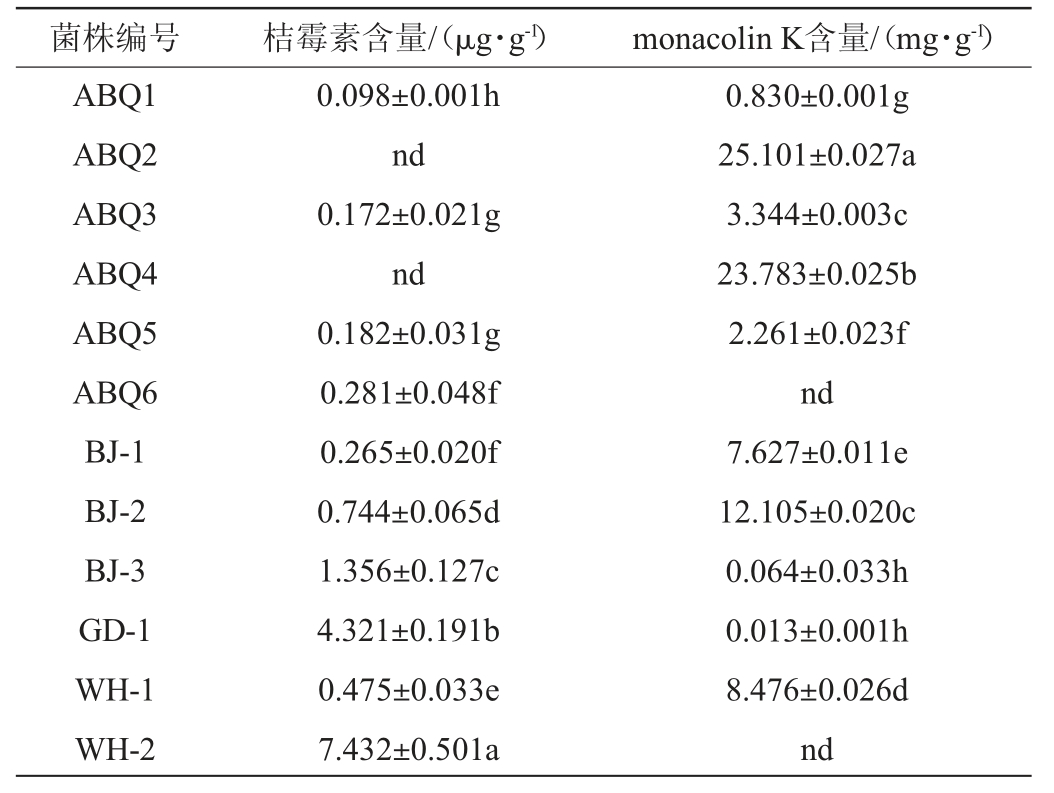
注:不同字母代表差异显著(P<0.05);“nd”表示未检测到。
2.2 不同红曲霉菌株产monacolin K分析
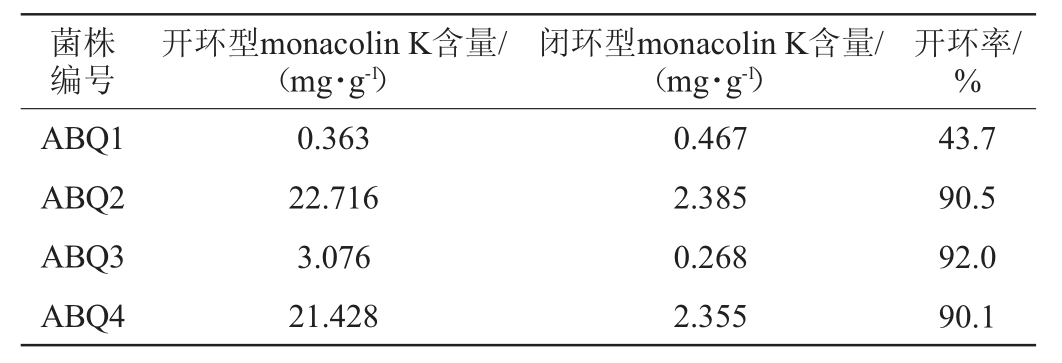
采用HPLC法分别对4株红曲霉制备的功能红曲米中开环monacolin K的含量进检测分析,结果见图1和表2。由图1可知,4株红曲霉制备的功能红曲米中均能检测到明显的monacolin K特征峰,其中开环型monacolin K出峰时间(约21 min)早于闭环型monacolin K出峰时间(约23 min)。由表2可知,4株红曲霉菌株制备的功能红曲米样品中,开环型monacolin K均处于较高水平,与相关文献[23-24]报道的红曲霉经过固态发酵制备的功能红曲米中主要为开环型monacolin K基本一致。但不同红曲霉菌株制备的功能红曲米中monacolin K开环率存在一定差异,红曲霉菌株ABQ2、ABQ3、ABQ4制备的功能红曲米中monacolin K开环率均达到90%以上,其中红曲霉菌株ABQ3制备的功能红曲米中monacolin K开环率最高,为92.0%,红曲霉菌株ABQ1制备的功能红曲米中monacolin K开环率相对较低,为43.7%。对功能红曲米中开环型monacolin K含量进行比较发现,红曲霉菌株ABQ2制备的功能红曲米中开环型monacolin K含量最高为22.716 mg/g,且开环率为90.5%,因此,优选红曲霉菌株ABQ2作为高产开环型monacolin K菌株。
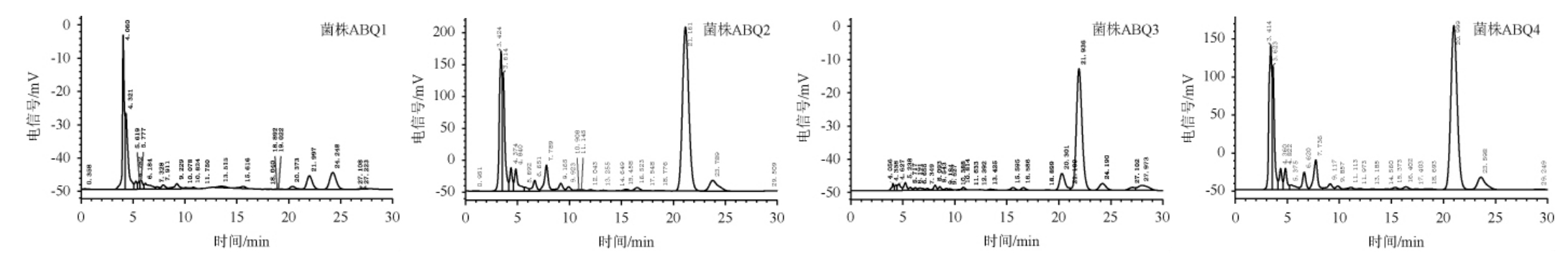
图1 4株红曲霉菌株制备功能红曲米中monacolin K的高效液相色谱分析结果
Fig.1 HPLC analysis results of monacolin K in functional Monascus rice prepared by 4 Monascus spp.strains
表2 4株红曲霉菌株制备功能红曲米中monacolin K含量测定结果
Table 2 Determination results of monacolin K content in functional Monascus rice prepared by 4 Monascus spp.strains
2.3 红曲霉菌株ABQ2的鉴定
2.3.1 形态观察
菌株ABQ2的菌落及细胞形态见图2。由图2可知,菌株ABQ2在分离培养基上生长状态良好,培养7~9 d菌落初为白色,老熟后变为淡粉色,菌落表面有放射状皱纹,丝绒状。显微镜下菌丝呈现不规律的分枝,有横隔,透明无色,分生孢子单生或成链,倒梨形至球形,孢子呈现宽椭圆形,基于此初步判定该菌株为红曲霉属(Monascus sp.)。
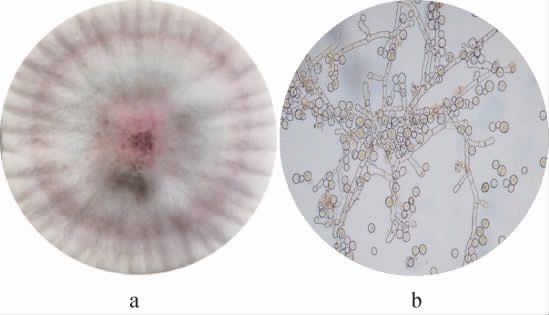
图2 菌株ABQ2的菌落(a)及细胞(b)形态
Fig.2 Morphology of colony (a) and cell (b) of strain ABQ2
2.3.2 分子生物学鉴定
基于钙调蛋白基因菌株ABQ2的系统发育树见图3。由图3可知,菌株ABQ2与丛毛红曲霉(Monascus pilosus)CBS:286.34T(KY849968)聚于一支,亲缘关系最近,相似性达99.62%,结合形态观察结果,鉴定该菌株为丛毛红曲霉(Monascus pilosus)。

图3 基于钙调蛋白基因菌株ABQ2的系统发育树
Fig.3 Phylogenetic tree of strain ABQ2 based on calmodulin gene
2.4 红曲酒品质的分析
2.4.1 理化指标的分析
以根霉小曲酒作为对照,采用丛毛红曲霉ABQ2制备的功能红曲米酿造红曲酒,并对其理化指标进行分析,结果见表3。由表3可知,红曲酒的酒精度为12.3%vol,monacolin K含量为0.48 mg/mL,开环率为88.74%,桔霉素未检出,其他主要理化指标与小曲酒差异不大,表明在红曲酒酿造过程中丛毛红曲霉ABQ2不仅具有较强糖化糯米淀粉能力,而且同时能够利用糯米中的营养物质代谢积累monacolin K,酿造的红曲酒中monacolin K含量和酒精度均达到较高水平,其理化指标基本达到轻工行业标准QB/T 5334—2018《红曲酒》要求。
表3 红曲酒及小曲酒的理化指标
Table 3 Physicochemical indexes of Hongqujiu and Xiaoqujiu

注:同列肩不同小写字母表示差异显著(P<0.05);“nd”表示未检出。
2.4.2 主要挥发性风味成分分析
以根霉小曲酒作为对照,采用顶空固相微萃取-气质联用仪测定红曲酒中的主要挥发性风味成分,结果见表4。红曲酒酿造过程中风味物质的形成是由多种微生物相互作用的结果,主要由红曲霉、酵母菌以及厌氧菌协同发酵产生多种生物酶、有机酸以及醇类等,然后经过一系列催化反应形成最终红曲酒的风味[25]。红曲酒中主要风味物质为酯类和高级醇类,酯类物质作为红曲酒主要风味物质,构成了酒体独特风格,红曲酒中主要酯类物质包括:乳酸乙酯、乙酸乙酯、己酸乙酯、丁酸乙酯、乙酸正丁酯等[26]。
表4 红曲酒及小曲酒主要挥发性化合物GC-MS分析结果
Table 4 GC-MS analysis results of main volatile flavor substances in Hongqujiu and Xiaoqujiu

注:“*”表示差异显著(P<0.05);“**”表示差异极显著(P<0.01);“nd”表示未检出。
由表4可知,红曲酒中总酯含量(433.65 mg/L)明显高于小曲酒(332.37 mg/L),特别是乳酸乙酯(170.63 mg/L)、乙酸乙酯(96.75 mg/L),其含量均达到较高水平,形成了红曲酒主体特征风味,红曲酒中较高酯类可能和红曲霉自身能够分泌或者促进其他微生物代谢丰富有机酸和酯化酶有关[27-28]。高级醇类物质同样是酒类关键香味和风味物质,适宜的高级醇能增加酒体丰满度和协调感,过量则会给酒体带来异味、不愉悦以及醇臭等感官体验[29-30]。红曲酒中高级醇含量(145.52 mg/L)相对小曲酒(151.2 mg/L)整体显著减少,主要高级醇为正丙醇、异丁醇、正戊醇、β-苯乙醇等。醛类物质是酒中香与味的纽带,醛类化合物的熔点普遍比其他组分的熔点低,易挥发,在蒸发全过程中就会“拖带”其他组分蒸发,因而有助香的作用,同时适当醛类物质对酒体骨架风味形成十分关键[31]。红曲酒中主要醛类物质含量(7.21 mg/L)相对小曲酒(13.80 mg/L)整体偏低,主要为乙醛和5-甲基呋喃醛。吡嗪类物质一般具有类似于杏仁、焙烤、肉香等怡人香味,可使酒体更为丰满[32],红曲酒中相关物质含量较少。
3 结论
为获得高产开环型monacolin K、同时低产桔霉素的优势红曲霉菌株,本研究以monacolin K和桔霉素含量为主要评价指标,通过对不同产地红曲样品分离和菌种保藏机构购买的红曲霉菌株进行固态发酵功能红曲米筛选,获得10株产红曲霉菌株,通过monacolin K含量及开环率比对分析,确定1株高产开环型monacolin K菌株ABQ2,经形态观察及分子生物学鉴定为丛毛红曲霉(Monascus pilosus),该菌株发酵的功能红曲米monacolin K含量达到25.101 mg/g,开环率为90.5%,且桔霉素未检出,初步判断是一株性能优良、且相对安全的红曲霉菌株。进一步将菌株ABQ2应用于红曲酒酿造研究,以根霉小曲酒为对照,测定红曲酒的理化指标及主要挥发性风味成分。结果发现,红曲酒的酒精度为12.3%vol,酸度为1.91 g/100 mL,相比小曲酒酒精度和酸度指标基本相当,此外还富含红曲monacolin K,其含量达到0.48 mg/mL,其他各项理化指标均符合国家轻工行业标准QB/T 2847—2007《功能性红曲米(粉)》要求。红曲酒主要风味物质为酯类和高级醇类,红曲酒中总酯含量(433.65 mg/L)相比小曲酒极显著增加(P<0.01),其中乳酸乙酯(170.63 mg/L)和乙酸乙酯含量(96.75 mg/L)最高,高级醇类物质含量(145.52 mg/L)相比小曲酒略低,主要为正丙醇、异丁醇、正戊醇、β-苯乙醇等。本研究主要对菌株ABQ2产monacolin K、桔霉素以及发酵红曲酒应用进行了相关研究,关于Monascus pilosus系统安全性评价还需要进一步深入分析,以期实现其在功能红曲酒或黄酒行业中规模化的应用。
[1]刘姣,周有祥,徐琪,等.不同红曲菌中红曲色素与橘霉素的比较分析[J].食品科学,2018,39(18):94-99.
[2]CHENG M J,WU M D,CHAN H Y,et al.A new azaphilone metabolite from the fungus Monascus ruber[J].Chem Nat Compd,2016,52:231-233.
[3]JO D,CHOE D,NAM K,et al.Biological evaluation of novel derivatives of the orange pigments from Monascus sp.as inhibitors of melanogenesis[J].Biotechnol Lett,2014,36:1605-1613.
[4]ZHOU X,REN F Y,WEI H,et al.Combination of berberine and evodiamine inhibits intestinal cholesterol absorption in high fat diet induced hyperlipidemic rats[J].Lipids Health Dis,2017,16:239.
[5]LIU M T,WANG A L,SUN Z,et al.Cytotoxic monacolin analogs from Monascus purpureus-fermented rice[J].J Asian Nat Prod Res,2013,15(6):600-609.
[6]赵娜,张红星,谢远红,等.一株高产Monacolin K紫红曲霉菌株筛选,鉴定及发酵条件优化[J].天然产物研究与开发,2019,31(8):1326-1331.
[7]孙伟,刘爱英,梁宗琦.红曲中莫纳可林K(Monacolin K)的研究进展[J].西南农业学报,2003,16(3):112-116.
[8]HUANG Q,ZHANG H,XUE D.Enhancement of antioxidant activity of Radix Puerariae and red yeast rice by mixed fermentation with Monascus purpureus[J].Food Chem,2017,226:89-94.
[9] CHEN G,YANG S Z,WANG C T,et al.Investigation of the mycelial morphology of Monascus and the expression of pigment biosynthetic genes in high-salt-stress fermentation[J].Appl Microbiol Biotechnol,2020,104:2469-2479.
[10]李志强,刘颖,林风,等.两种红曲菌固态发酵产莫纳可林K和桔霉素的比较[J].食品与发酵工业,2020,46(17):94-98.
[11] YANY Y,LIU B,DU X J,et al.Complete genome sequence and transcriptomics analyses reveal pigment biosynthesis and regulatory mechanisms in an industrial strain,Monascus purpureus YY-1[J].Sci Rep,2015,5:8331.
[12]LIU Z B,WANG Z Y,LV X C,et al.Comparison study of the volatile profiles and microbial communities of Wuyi Qu and Gutian Qu,two major types of traditional fermentation starters of Hong Qu glutinous rice wine[J].Food Microbiol,2018,69:105-115.
[13]刘颖,林风,郑军荣,等.低桔霉素且产Monacolin K红曲菌株的筛选与鉴定[J].福建农林大学学报:自然科学版,2015,44(5):456-461.
[14]PIONO J A,TOLLE S,GÖK R,et al.Characterisation of odour-active compounds in aged rum[J].Food Chem,2012,132(3):1436-1441.
[15]王伟平,王莉平,彭其安,等.红曲霉菌种选育及固态发酵法生产Monacolin K 研究[J].中国酿造,2006,25(8):21-23.
[16]SCHOCH C L,SEIFERT K A,HUHNDORF S,et al.Nuclear ribosomal internal transcribed spacer(ITS)region as a universal DNA barcode marker for Fungi[J].Proce Natl Acad Sci,2012,109(16):6241-6246.
[17]LI H D,GAO D H,YAN X H.Identification and expression analysis of a calmodulin gene in Phycocalida chauhanii(Rhodophyceae,Bangiales)[J].J Appl Phycol,2021,33:1915-1923.
[18]王龙,朱正军,饶铖乐,等.功能性红曲酒酿造工艺研究[J].酿酒科技,2013(7):41-45.
[19]吕义俊,孙齐,郭唐芳,等.清香型小曲酒糖化发酵过程微生物及色谱指标变化规律研究[J].酿酒科技,2022(3):31-34.
[20]郑平,吴幼茹,杨继伟,等.甘蔗醋发酵产物在体外及模拟人体肠胃环境中的抗氧化活性[J].食品科学,2016,37(11):242-247.
[21] CAO Y,XIE G F,WU C,et al.A study on characteristic flavor compounds in traditional Chinese rice wine-Guyue Longshan rice wine[J].J Inst Brew,2010,116(2):182-189.
[22]吴玉峰,刘双平,韩笑,等.酿酒用高产洛伐他汀红曲菌的筛选[J].食品科学技术学报,2021,39(6):77-86.
[23]许赣荣,陈晔,陈蕴,等.无桔霉素高比例开环式莫纳可林K红曲产品的生产[J].食品与发酵工业,2004,30(10):59-63.
[24]WU L,ZHOU K X,CHEN F,et al.Comparative study on the antioxidant activity of Monascus yellow pigments from two different types of Hongqufunctional Qu and coloring Qu[J].Front Microbiol,2021,12:715295.
[25] SHIN H M,LIM J W,SHIN C G,et al.Comparative characteristics of rice wine fermentations using Monascus koji and rice nuruk[J].Food Sci Biotechnol,2017,26:1349-1355.
[26]LV X C,JIA R B,CHEN J H,et al.Development of reverse transcription quantitative real-time PCR(RT-qPCR)assays for monitoring Saccharomycopsis fibuligera, Rhizopus oryzae,and Monascus purpureus during the traditional brewing of Hong Qu glutinous rice wine[J].Food Anal Methods,2017,10:161-171.
[27]赵志军,赵婷,刘延波,等.酯化型红曲菌复合诱变选育及其固态发酵条件优化[J].食品工业科技,2021,42(2):76-82.
[28]陈帅,郑佳,刘琨毅,等.红曲酯化酶促反应及其代谢产物特征[J].食品与发酵工业,2012,38(2):47-51.
[29] CORDENTE A G,ESPINASE NANDORFY D,SOLOMON M,et al.Aromatic higher alcohols in wine: Implication on aroma and palate attributes during chardonnay aging[J].Molecules,2021,26(16):4979.
[30]蒋洋,张翠英,李于,等.酒类风味物质对人体乙醇代谢影响的研究进展[J].食品科学,2021,42(15):242-250.
[31]YONCHEVA T,SPASOV H,KOSTOV G.Study of the yeast strain influence and the alcoholic fermentation conditions on the higher alcohols and aldehydes content in Gamza wines[J].Bull Trans U Brasov.II:Foresto Wood Ind Agr Food Eng,2021,14(2):173-186.
[32]薛新新,孙守营,张娇娇,等.馥郁香型白酒感官风格及特征风味构成的剖析[J].中国酿造,2022,41(2):76-79.