百香果,学名西番莲(Passiflora coerulea L.),富含氨基酸、多糖、多酚、黄酮、维生素C、维生素E等多种生物活性物质及硒、铁等人体必需的多种微量元素[1-2],具有提神醒脑抗疲劳[3]、生津止渴助消化、提高人体免疫力[4]、延缓衰老和降压降血脂[5]等功效。香梨,富含钾、铁、维生素A、维生素C等[6-7],具有止咳润喉、调节新陈代谢、促进血液循环、减轻疲劳、增强心肌活力、降低血压等功效[8]。库尔勒香梨含糖量和出汁率高,而百香果富含多种香味物质,且二者成熟期相近。因此,将香梨和百香果混合进行复合果酒的酿造有利于实现优势互补从而酿造出优质果酒。
目前,香梨和百香果果酒多采用单一的酿酒酵母(Saccharomyces cerevisiae)进行发酵,其产生的酯类等香气成分含量低,导致果酒风味单调[9]。近年来,有研究发现非酿酒酵母(non-Saccharomyces)能适当改善果酒香味复杂性和口感饱满度,赋予果酒独特的风格和口味的多样[10];而且,非酿酒酵母还可产生β-葡萄糖苷酶等胞外酶[11],以促进挥发性香气成分的生成,改善果酒的风味。库德里阿兹威毕赤酵母(Pichia kudriavzevii)是一种常用的非酿酒酵母[12],可有效提升果酒香气特征中的花香和果香特征物质如乙酸乙酯等酯类[13],但由于其产乙醇能力弱,因此,毕赤酵母常被用于与酿酒酵母混合发酵低度果酒。贾言言等[14]在果酒发酵中加入梅奇酵母(Metschnikowia agaves)与酿酒酵母进行混菌发酵,并与单菌发酵的果酒对比后发现,混菌发酵的果酒能有效改善果酒风味与品质,同时保留果汁的典型香气特征。植物乳杆菌(Lactobacillus plantarum)可在发酵过程中促进苹果酸-乳酸发酵(malolactic fermentation,MLF)的发生,从而改善发酵果酒质量。植物乳杆菌中含有编码β-葡萄糖苷酶等多种酶的基因,能丰富果酒的挥发性香气成分[15]。此外,植物乳杆菌产生的细菌素能防止细菌污染,且细菌素达到一定量时还可提高植物乳杆菌的乙醇耐受性,有利于MLF的启动[16]。ENGLEZOS V等[17]研究发现,在接种酿酒酵母的发酵液中接种植物乳杆菌,植物乳杆菌可快速完成MLF过程,且发酵过程中酵母对糖的正常消耗不受影响。
因非酿酒酵母产胞外酶含量高、且植物乳杆菌有生物降酸作用,因此,本研究开展基于酿酒酵母、库德里阿兹威毕赤酵母和植物乳杆菌混合菌株发酵香梨百香果复合果酒的研究,以期通过混菌发酵改善香梨百香果复合果酒的品质,提高香梨百香果复合果酒的产品附加值,为香梨百香果复合果酒的进一步开发提供理论指导。
1 材料与方法
1.1 材料与试剂
百香果、库尔勒香梨:市售;酿酒酵母(Saccharomyces cerevisiae)SCFF211、库德里阿兹威毕赤酵母(Pichia kudriavzevii)SCFF165、植物乳杆菌(Lactobacillus plantarum)SCFF185:实验室保存;酿酒酵母(SY):安琪酵母股份有限公司。
焦亚硫酸钠(分析纯)、纤维素酶(40 000 U/g)、果胶酶(30 000 U/g):河南麦优甜贸易有限公司;柠檬酸(分析纯):日照金禾博源生化有限公司;羟自由基清除能力检测试剂盒、超氧阴离子自由基清除能力检测试剂盒:生物工程(上海)股份有限公司;酵母膏、蛋白胨(均为生化试剂):北京奥博星生物技术有限责任公司。
1.2 仪器与设备
PTX-JA510电子天平:华志(福建)电子科技有限公司;RT16000C高速冷冻离心机:上海容威仪器有限公司;BXG-4便携式折光仪:贝尔分析仪器(大连)有限公司;UV-1601紫外可见分光光度计:北京北分瑞利分析仪器(集团)有限责任公司;LC1100高效液相色谱仪:美国Agilent公司;TSQ 8000气相色谱-质谱联用仪:美国Thermo公司。
1.3 方法
1.3.1 香梨百香果复合果酒工艺流程及操作要点[18]
香梨、百香果→原料预处理→打浆→护色→酶解→调节pH→接种→发酵→自然澄清→陈酿→复合果酒
原料预处理、打浆:选取新鲜完好的香梨和百香果清洗。取出百香果果肉,用200目滤布过滤去籽,收集百香果原果浆。将百香果果皮切成1~2 cm2的小块,用料理机打浆,再将原果浆和果皮浆混合。香梨手动去皮去籽备用。随后将香梨、百香果果浆按7∶3的质量比进行混合打浆。
护色、酶解:加入0.8 g/L的异抗坏血酸钠、60 mg/L焦亚硫酸钠进行护色;再添加60 mg/L的果胶酶和纤维素酶,于25 ℃条件下酶解12 h,随后于75 ℃水浴锅中灭酶15 min,得到复合果浆。
调节pH:用白砂糖调整糖度为20°Bx,再用柠檬酸调节pH为3.5。
接种:接种前分别将酿酒酵母和植物乳杆菌于30 ℃和37 ℃条件下活化。将活化后的菌株按照试验设计单独或混合接种至复合果浆中,总接种量为果浆质量的5%。
发酵:置于20 ℃恒温培养箱中发酵,至还原糖低于4 g/L时停止发酵。
澄清、陈酿:倒罐后于4 ℃低温条件静置陈酿一个月。
1.3.2 香梨百香果复合果酒菌株接种组合设计
设置活化菌株总添加量为果浆量的5%,不同的菌株发酵实验组及编号见表1。
表1 香梨百香果复合果酒发酵菌株实验设计
Table 1 Experimental design of compound fruit wine of fragrant pear and passion fruit with different fermentation strains

1.3.3 香梨百香果复合果酒理化指标测定
基础理化指标测定:参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》测定香梨百香果复合果酒发酵过程中酒精度、总酸、还原糖;pH值采用pH计进行测定。
总酚含量测定:参照吴澎等[19]的方法,略微修改。以没食子酸的含量为x轴,吸光度值为y轴,进行标准曲线的绘制。采用与绘制标准曲线相同的方法测定样品吸光度值,每组样品平行测定3次。计算公式如下:
式中:W为香梨百香果复合果酒总酚含量,mg/L;C为香梨百香果复合果酒总酚的质量浓度,mg/L;m为香梨百香果复合果酒体积,mL;V为测定液体积,mL;N为稀释倍数。
1.3.4 香梨百香果复合果酒抗氧化性测定
(1)羟自由基清除率测定
采用羟自由基清除能力检测试剂盒比色法测定香梨百香果复合果酒羟自由基清除率。按说明书处理香梨百香果复合果酒样品,以H2O为对照,取各样品上清液在波长536 nm处测定吸光度值。以按以下公式计算羟自由基的清除率:
式中:D表示羟自由基的清除率,%;A测代表空白管吸光度值;A对表示对照管吸光度值;A空代表测定管吸光度值。
(2)超氧阴离子自由基清除率测定
取1 mL果酒稀释液加入试管中,依次加入4.5 mL Tris-HCl缓冲液和4 mL邻苯三酚溶液。常温下反应5 min后,加入1 mL 12 mol/L HCl溶液结束反应,并在波长320 nm处测定吸光度值,之后参照李斌等[20]的方法测定并计算超氧阴离子自由基清除率。
1.3.5 香梨百香果复合果酒有机酸测定
参考PENG W Y等[21]的方法,吸取1 mL香梨百香果复合果酒样品,经0.22 μm有机滤膜过滤后备用。高效液相色谱条件:Agilent ZORBAX SB-Aq色谱柱(4.6 mm×250 mm,5 μm),VWD检测器,检测波长210 nm,流动相A为磷酸二氢钾(pH=2.4)95%,流动相B为甲醇5%,进样量15 μL,流速0.4 mL/min,柱温25 ℃。
1.3.6 挥发性风味物质测定
挥发性风味物质的测定采用顶空固相微萃取-气相色谱-质谱联用法:参考程宏桢等[22]的方法进行测定并采用内标法定量。
1.3.7 香梨百香果复合果酒感官评价方法
邀请10名食品专业的学生(5男5女)组成品评小组并进行相关培训,分别从香梨百香果复合果酒的外观、香气、滋味、典型性四个方面对果酒进行评分,以平均值作为最终的感官评分,香梨百香果复合果酒感官评价评分标准见表2。
表2 香梨百香果复合果酒感官评分标准
Table 2 Sensory evaluation standards of compound fruit wine of fragrant pear and passion fruit

续表

1.3.8 数据整理与统计分析
采用Microsoft Excel 2019整理实验数据,以“平均值±标准差”形式表示试验结果。采用SPSS 26软件进行数据显著性分析,P<0.05表示差异具有统计学意义。采用Origin 2021绘图。
2 结果与分析
2.1 不同发酵体系理化指标的测定
2.1.1 还原糖和酒精度的测定
残糖量多少会影响果酒发酵及口感风味[23],也是判定香梨百香果复合果酒发酵性能的重要指标之一。五组香梨百香果复合果酒的还原糖变化如图1(A)所示,在前5 d各发酵组的还原糖均呈下降趋势,是由于发酵前期微生物以糖类为营养物质进行大量繁殖,同时酵母菌利用糖类进行酒精发酵。在后3 d各发酵组的还原糖趋于平稳,随着发酵的进行酒精含量不断上升,糖酵解过程中相关酶的活性受到影响,变化逐渐趋于平缓[24]。其中Fn组相较于其余四组对糖的利用率最低(P<0.05),Hs组的降糖速度最快且降糖能力更强,发酵结束时还原糖含量最低为(2.80±0.19)g/L(P<0.05),可能是因为混菌体系中不同微生物之间形成对营养物质的竞争关系,促进对糖的吸收与利用。
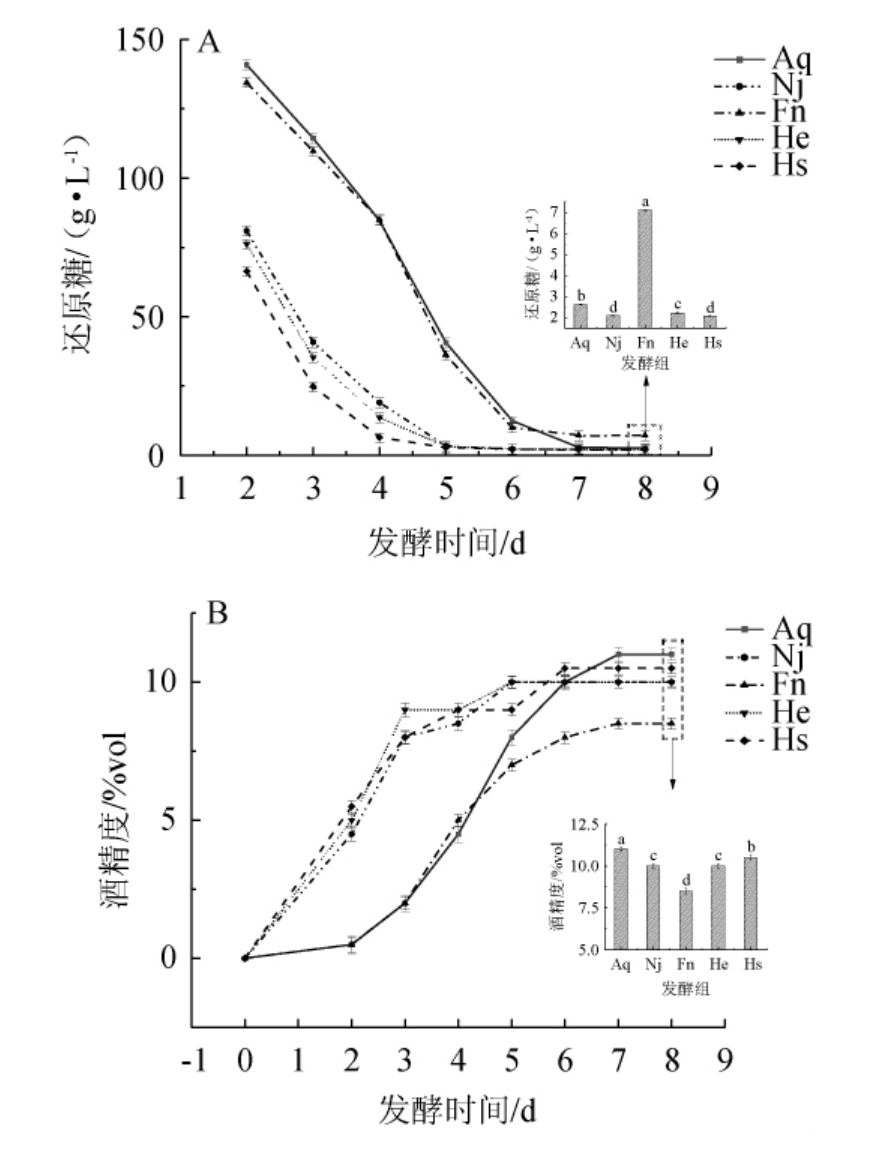
图1 香梨百香果复合果酒发酵过程中还原糖(A)和酒精度(B)变化
Fig.1 Changes of reducing sugar (A) and alcohol content (B) of compound fruit wine of fragrant pear and passion fruit during fermentation process
不同小写字母表示差异显著(P<0.05)。下同。
不同菌种发酵能力有显著差异,导致发酵结束的酒精度不同[25]。如图1(B)所示,五组香梨百香果复合果酒在发酵过程中,酒精度总体呈先上升后趋于平稳的趋势,可能是因为发酵前期糖浓度高,可以被酵母利用产生乙醇,酒精度上升较快;随着发酵的进行,由于糖类被大量消耗,不能为酵母菌提供足够的营养物质;此外,随着酒精度不断升高,酵母菌的活性受到影响,同时少部分酒精会进行酯化反应。因此,发酵一段时间后酒精度的增长趋于平缓。结合图1(A)可知,酒精度高低与糖利用率有一定联系,其中Fn组酒精度较其余四组最低为(7.50±0.28)%vol(P<0.05),这是由于非酿酒酵母在发酵过程中对糖的利用率相对较低,无法完成糖的充分利用,因此产酒精能力也相对较弱。从一定程度上说明,混菌发酵He组和Hs组较单菌发酵Aq组、Nj组和Fn组发酵效率有显著提升。
2.1.2 总酸和pH的测定
五组香梨百香果复合果酒的总酸和pH的变化见图2。
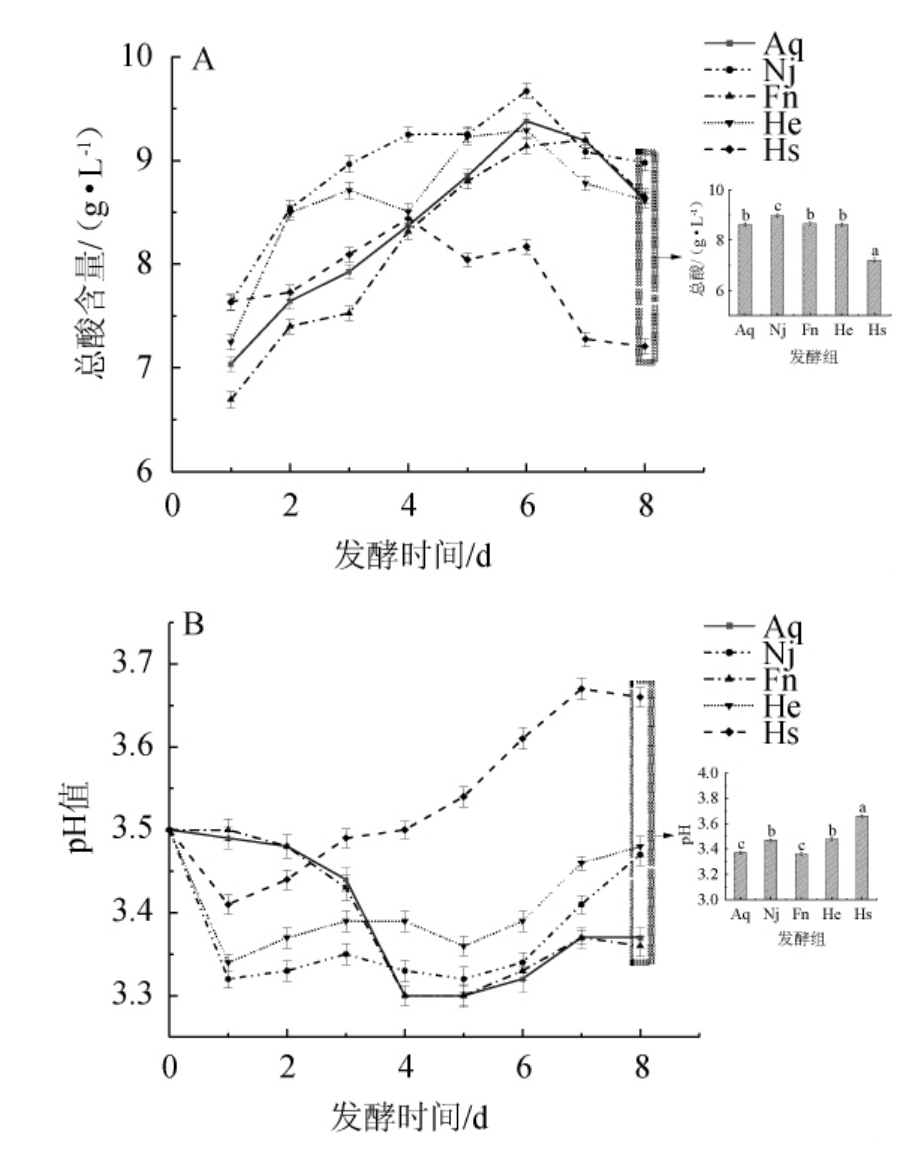
图2 香梨百香果复合果酒发酵过程中总酸含量(A)和pH(B)变化
Fig.2 Changes of total acid content (A) and pH (B) of compound fruit wine of fragrant pear and passion fruit during fermentation process
由图2可知,发酵前期总酸呈上升趋势而pH呈下降趋势,一方面是由于发酵前期微生物大量繁殖代谢产生了有机酸[26-27],另一方面发酵过程中生成的二氧化碳溶解于发酵液,此外高糖环境使酵母细胞产生了应激效应,产生了更多的酸[28]。发酵后期总酸呈下降趋势,pH呈上升趋势,随着发酵的进行部分有机酸会被微生物利用导致总酸下降,同时有机酸会和发酵产生的乙醇发生酯化反应。在发酵过程,Hs组总酸始终低于Nj组和He组,其含量为(7.18±0.21)g/L,可能是因为酵母添加量较大,与植物乳杆菌之间形成了对营养物质的竞争关系[29];发酵中后期Hs组总酸均低于其余四组(P<0.05),可能是因为发酵后期酵母的代谢产物促进了植物乳杆菌对大分子酸类物质的分解,从而使酸度降低。
2.2 抗氧化性测定结果
酚类物质在香梨百香果复合果酒中不仅可以影响果酒的口味、颜色、涩敛性等感官特性[26],还可通过与蛋白质、金属离子等发生络合作用影响果酒的稳定性,复合果酒总酚含量、超氧阴离子自由基和羟自由基清除能力测定结果如图3所示。
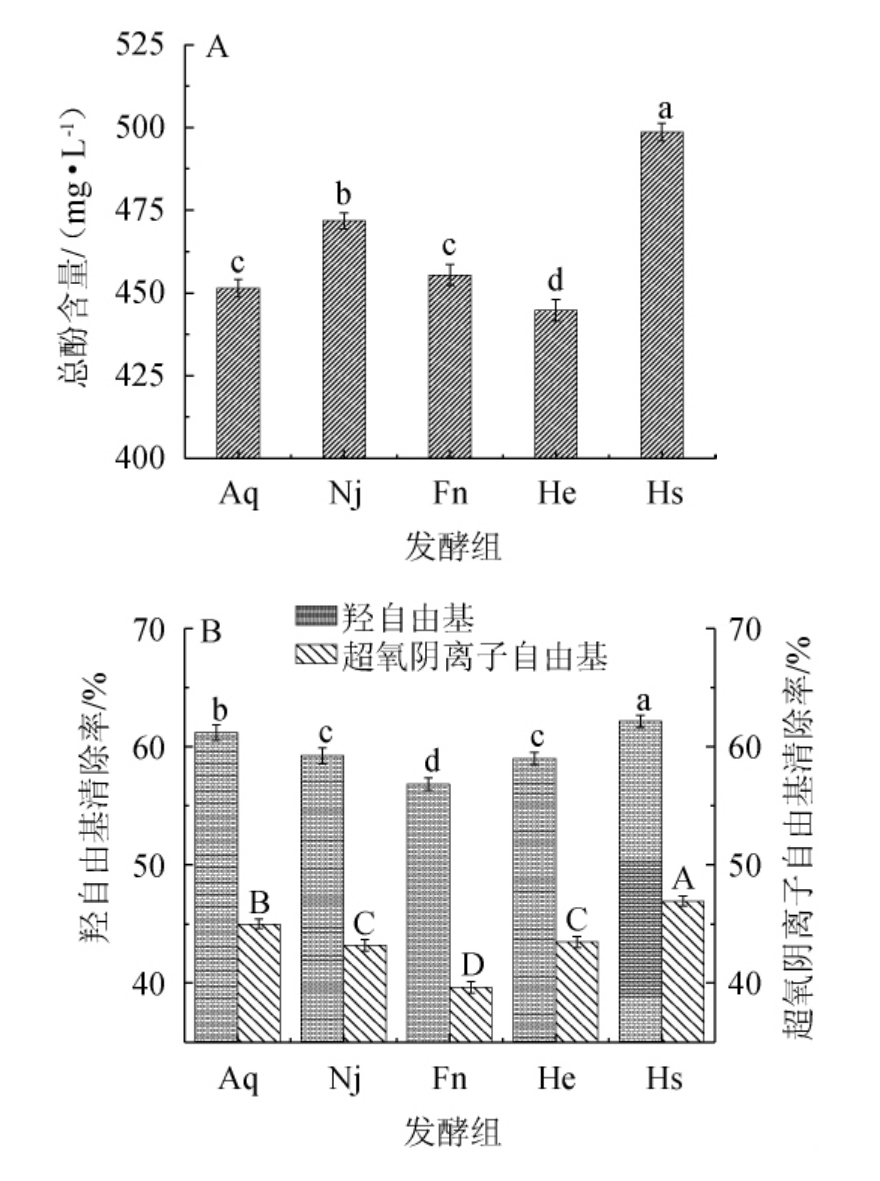
图3 香梨百香果复合果酒总酚含量(A)、超氧阴离子自由基和羟基自由基清除能力(B)
Fig.3 Total phenol contents (A),superoxide anion radical and hydroxyl radical scavenging ability (B) of compound fruit wine of fragrant pear and passion fruit
不同大、小写字母表示差异显著(P<0.05)。
由图3可知,经过发酵后,总酚含量、羟自由基清除率和超氧阴离子自由基清除率均存在差异,可能是微生物在发酵过程中合成大量次级代谢产物,与酚类物质发生各种氧化、聚合或沉淀等反应。相对于其他发酵组而言,三菌混合发酵组(Hs组)总酚含量最高为(498.62±3.21)mg/L(P<0.05),羟自由基清除率最高为(62.16±0.31)%,且超氧阴离子自由基清除率最高为(46.03±0.23)%,抗氧化能力明显优于其余四组(P<0.05)。这是由于发酵环境中酒精、pH等因素会导致微生物将大分子酚类物质分解、转化[30],植物乳杆菌的加入使Hs组发酵液的总酸得到明显改善,从而减少微生物对酚类物质的分解和转化。因此,Hs组的总酚含量最高且抗氧化活性优于其他组。
2.3 不同发酵体系中香梨百香果复合果酒香气成分测定
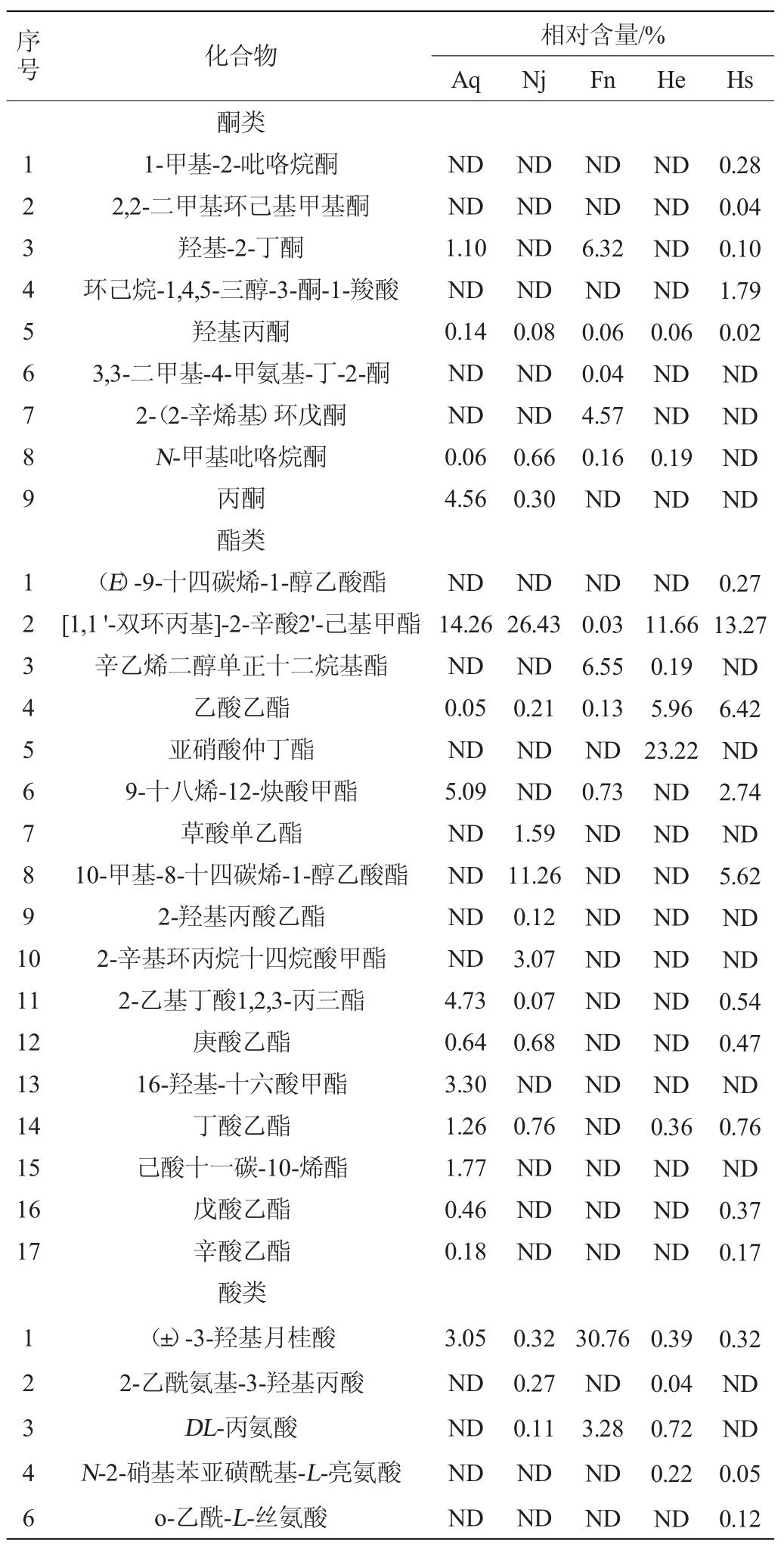
不同菌种组合酿造的香梨百香果复合果酒挥发性风味物质气质联用法测定结果见表3。
表3 香梨百香果复合果酒挥发性风味物质测定结果
Table 3 Determination results of volatile flavor substances in compound fruit wine of fragrant pear and passion fruit
续表
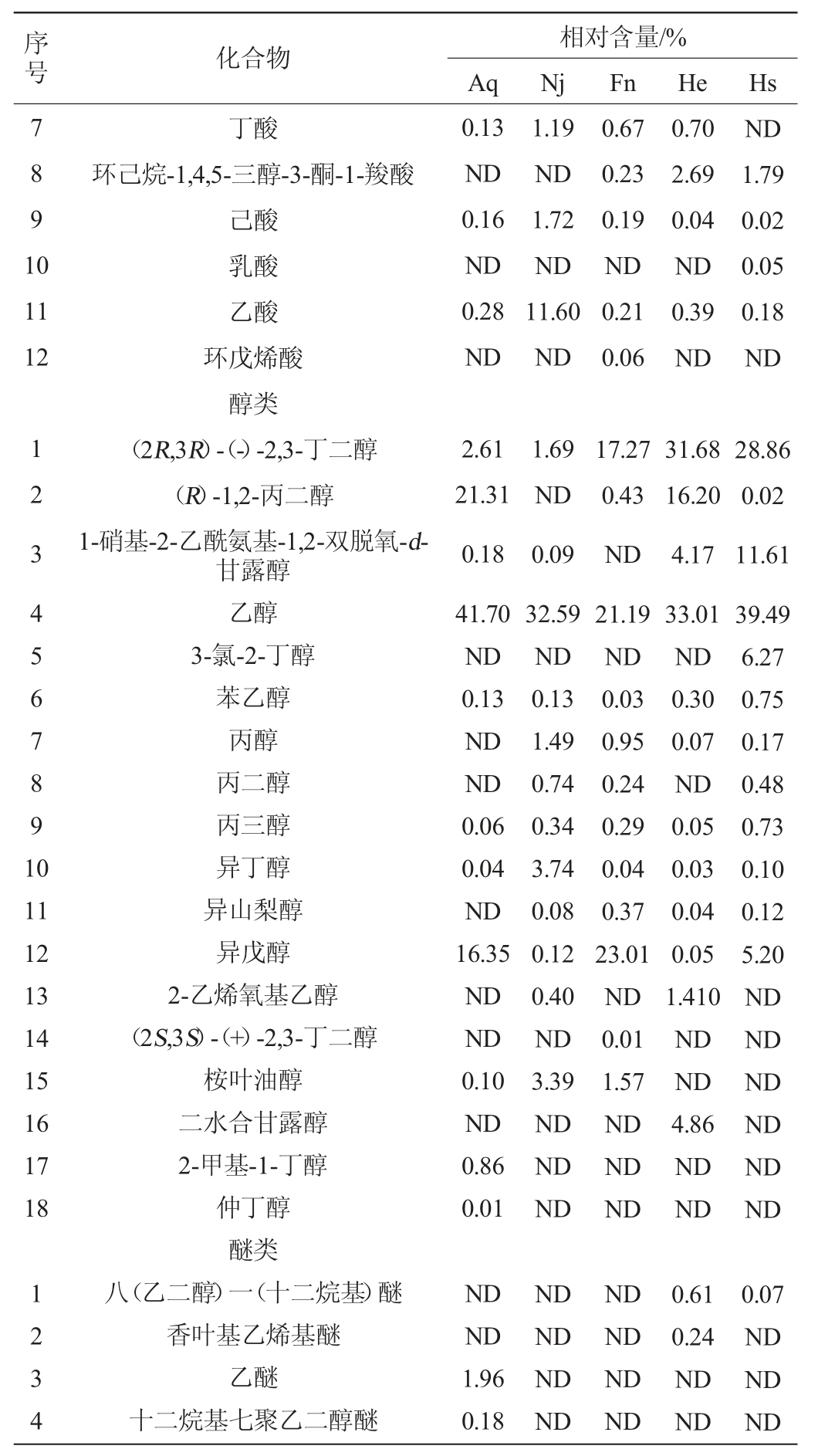
注:“ND”表示未检出。
由表3可知,采用GC-MS方法从五组香梨百香果复合果酒中共鉴定出60种挥发性香气成分,包括18种醇类、17种酯类、12种酸类、9种酮类和4种醚类。Hs组挥发物种类最多为34种,Nj组和Aq组次之,分别为30种和29种。
在发酵过程中,酯类物质主要由醇类和酸类经酯化生成,且酯类化合物大都具有良好的风味;其中包括乙酸乙酯、丁酸乙酯等,为香梨百香果复合果酒提供果香和甜香[31]。Hs组和He组混菌发酵的乙酸乙酯含量均高于三组单菌发酵,且Hs组含量最高,说明混菌发酵在一定程度上有促进酯类产生的作用。
醇类物质主要由葡萄糖酵解生产以及氨基酸通过酵母厌氧代谢发生脱氨反应降解生成,其对香梨百香果复合果酒的风味贡献较大,该果酒中主要包括乙醇、苯乙醇、2,3-丁二醇等,其中乙醇可以为香梨百香果复合果酒提供玫瑰香气[32],苯乙醇可提供花果香[33],2,3-丁二醇可提供青香味;Hs组的高级醇相对含量均高于其余四组,说明三菌混合发酵对调节香梨百香果复合果酒的香气有一定的正向作用,而相对含量的差异可能与菌株的代谢能力有关。
挥发性脂肪酸是酯类物质的重要前体,适量的酸可以为果酒带来圆润清爽的口感,过量则会造成刺鼻的气味[34];Hs组酸类物质的种类高于Aq组和Nj组,但相对含量低于其余四组,可能是因为植物乳杆菌产生的酶可改变挥发性脂肪酸的组成与含量。由于醛酮类物质在萃取时易被还原为醇类等,因此香梨百香果复合果酒中鉴定出的醛酮类物质较少。
此外,在香梨百香果复合果酒混菌发酵过程中还产生了众多微量但对香气有贡献的化合物,如羟基-2-丁酮、丙酮、羟基丙酮等,而且,发酵菌株不同,风味物质的含量也有显著差异。综上,混菌发酵体系和多种风味物质在香梨百香果复合果酒体系中相互作用,相辅相成,构成了风味独特的香梨百香果复合果酒。
2.4 有机酸含量比较分析
有机酸与香梨百香果复合果酒的酸涩味、颜色及化学稳定性等存在明显联系[35],是影响香梨百香果复合果酒品质的重要指标之一。不同菌种酿造的香梨百香果复合果酒有机酸含量测定结果见图4。由图4可知,五组香梨百香果复合果酒中柠檬酸含量相对较少,可能是因为在发酵过程中柠檬酸被微生物代谢利用,生成2,3-丁二醇等物质。酒石酸的相对含量较少,可能是因为其作为酒石酸氢钾沉淀或被微生物降解所致[36]。
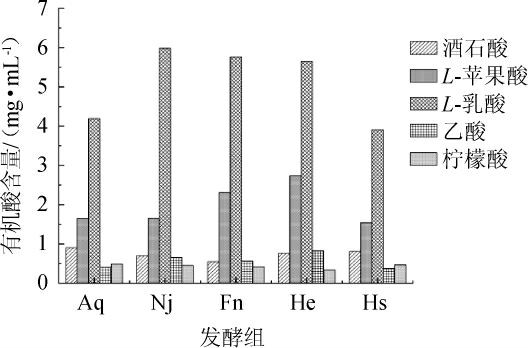
图4 香梨百香果复合果酒有机酸含量测定结果
Fig.4 Determination results of organic acid contents in compound fruit wine of fragrant pear and passion fruit
乙酸的含量过高会导致不良风味的产生,由图4可知,Nj组和He组乙酸含量最高,分别为6.52 mg/mL和8.27 mg/mL。Hs组的乙酸含量最低为3.69 mg/mL,可能是因为植物乳杆菌能将己糖分解使果酒发酵均匀,减少乙酸的生成,从而减少不良气味的生成[37]。
苹果酸可在酵母细胞中通过丙酮酸固定二氧化碳合成草酰乙酸,再将草酰乙酸还原为苹果酸[38];也可通过酵母菌将苹果酸分解为乙醇、异丁醇、戊醇和乳酸等产物[39]。在相同条件下,混菌发酵Hs组和He组苹果酸含量分别为1.53 mg/mL和2.73 mg/mL,可能是因为Hs组中植物乳杆菌主导了苹果酸-乳酸发酵,导致部分苹果酸被转化。
乳酸是香梨百香果复合果酒中的主要有机酸,是糖酵解的终产物,其口感相较于苹果酸更柔和。五组香梨百香果复合果酒的乳酸含量均较高,与发生的苹果酸-乳酸发酵有一定关系。Hs组的乳酸相对含量较Nj组、Fn组和He组更低,说明在其余条件一定的情况下,加入的植物乳杆菌对乳酸有一定的降解能力。
2.5 不同发酵体系中香梨百香果复合果酒感官评分
由表4可知,五组香梨百香果复合果酒中,Hs组的滋味评分较其余四组更高,植物乳杆菌可以通过MLF过程将口感尖酸的苹果酸转化为了较为柔和利口的乳酸,使果酒的口感更加柔和。因此,从感官评价情况来看Hs组三菌混合发酵的香梨百香果复合果酒感官评分为80分,酸甜适中、果香味突出、口感更佳。
表4 香梨百香果复合果酒感官评分结果
Table 4 Sensory evaluation scoring results of compound fruit wine of fragrant pear and passion fruit
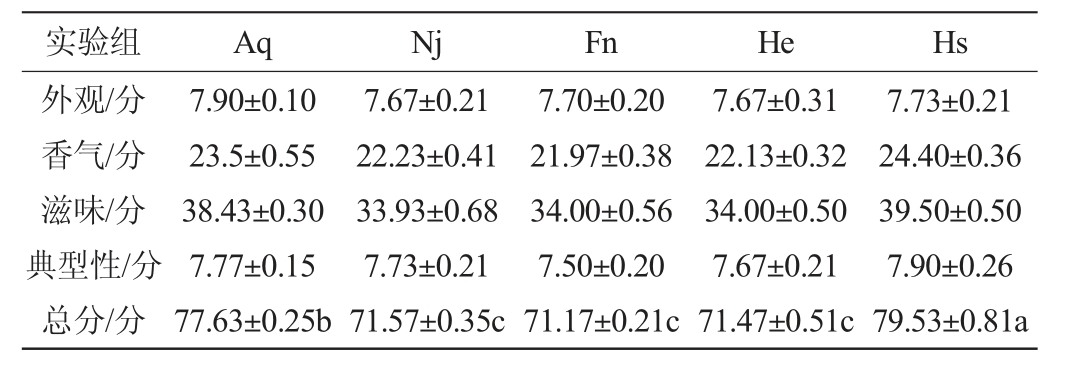
注:不同小写字母表示差异显著(P<0.05)。
3 结论
该研究通过对实验室筛选的酿酒酵母、库德里阿兹威毕赤酵母和植物乳杆菌进行单菌发酵和混菌发酵香梨百香果复合果酒,并将不同发酵组的理化特性、抗氧化性和风味物质进行对比。结果发现:与单菌相比,Hs组三菌混合发酵体系糖的利用率高,还原糖含量最低为(2.80±0.19)g/L,总酸为(7.18±0.21)g/L;且Hs组抗氧化性最强,总酚含量最高为(498.62±3.21)mg/L,超氧阴离子清除率最高为(46.03±0.23)%,羟自由基清除率最高为(62.16±0.31)%。在风味物质种类及其相对含量方面,Hs组挥发物种类最多为33种,产生的醇、酯类相对含量均优于其余四组。从感官评价结果表明,三菌混合发酵的香梨百香果复合果酒口感柔和、香气浓郁且颜色更加鲜亮,感官评分约为80分。
[1]PERERIRA D T V,BARRALES F M,PEREIRA E,et al.Phenolic compounds from passion fruit rinds using ultrasound-assisted pressurized liquid extraction and nanofiltration[J].J Food Eng,2022,325:110977.
[2]李莉萍.西番莲综合开发利用研究进展[J].安徽农业科学,2012,40(28):13840-13843.
[3] SAMAD N,MUNEER A,ULLAH N,et al.Banana fruit pulp and peel involved in antianxiety and antidepressant effects while invigorate memory performance in male mice:Possible role of potential antioxidants[J].Pak J Pharm Sci,2017,30(3):989-995.
[4]WATSON R R,VICTOR R P.Bioactive food as dietary interventions for arthritis and related inflammatory diseases[M].San Diego:Academic Press,2013,633-639.
[5]DE QUEIROZ M D S R,JANEBRO D I,DE CUNHA M A L,et al.Effect of the yellow passion fruit peel flour(Passiflora edulis f.flavicarpa deg.)in insulin sensitivity in type 2 diabetes mellitus patients[J].Nutr J,2012,11:89.
[6]马晓玲,唐凤仙,单春会.低温条件下库尔勒香梨果酒发酵工艺的研究[J].食品工业,2016,37(8):175-179.
[7]胡锐.库尔勒香梨出口欧盟贸易技术壁垒研究[D].乌鲁木齐:新疆农业大学,2005.
[8]贾娟,王婷婷,杨雯雯,等.香梨发酵酒发酵工艺的优化及其香气成分研究[J].中国酿造,2019,38(5):101-107.
[9]金海炎,王丰园,鲁云风,等.混菌发酵猕猴桃果酒工艺条件优化及抗氧化性研究[J].食品与发酵工业,2022,48(3):177-185.
[10]VARELA C,SIEBERT T,COZZOLINO D,et al.Discovering a chemical basis for differrentiating wines made by fermentation with'wild'indigenous and inoculated yeasts:role of yeast volatile compounds[J].Aust J Grape Wine R,2009,15(3):238-248.
[11]ALBERTIN W,ZIMMER A,MIOT-SERTIER C,et al.Combined effect of the Saccharomyces cerevisiae lag phase and the non-Saccharomyces consortium to enhance wine fruitiness and complexity[J].Appl Microbiol Biotechnol,2017,101:7603-7620.
[12] CONTRERAS A,HIDALGO C,HENSCHKE P A,et al.Evaluation of non-Saccharomyces yeasts for the reduction of alcohol content in wine[J].Appl Environ Microb,2014,80(5):1670-1678.
[13]DOMIZIO P,ROMANI C,LENCIONI L,et al.Outlining a future for non-Saccharomyces yeasts:Selection of putative spoilage wine strains to be used in association with Saccharomyces cerevisiae for grape juice fermentation[J].Int J Food Microbiol,2011,147(3):170-180.
[14]贾言言,刘四新,李卓婷,等.非酵母属酵母的接种顺序对混合发酵菠萝酒香气成分的影响[J].食品科学,2015,36(17):152-157.
[15]LUCIO O,PARDO I,HERAS J M,et al.Use of starter cultures of Lactobacillus to induce malolactic fermentation in wine[J].Aust J Grape Wine R,2017,23(1):15-21.
[16]李爱霞.植物乳杆菌苹果酸—乳酸发酵性能及其苹果酸—乳酸酶的研究[D].杨凌:西北农林科技大学,2014.
[17] ENGLEZOS V,TORCHIO F,VAGNOLI P,et al.Impact of Saccharomyces cerevisiae strain selection on malolactic fermentation by Lactobacillus plantarum and Oenococcus oeni[J].Am J Enol Vitic,2020,71:157-165.
[18]程宏桢,蔡志鹏,王静,等.基于GC-MS、GC-O和电子鼻技术评价百香果酒香气特征[J].食品科学,2021,42(6):256-264.
[19]吴澎,贾朝爽,李向阳,等.响应面分析优化福林酚法测定樱桃酒中总酚的含量[J].食品工业科技,2018,39(20):200-206.
[20]李斌,雷月,孟宪军,等.响应面试验优化超声波辅助提取蓝靛果多酚工艺及其抗氧化活性[J].食品科学,2015,36(22):33-39.
[21]PENG W Y,MENG D Q,YEU T L,et al.Effect of the apple cultivar oncloudy apple juice fermented by a mixture of Lactobacillus acidophilus,Lactobacillus plantarum,and Lactobacillus fermentum[J].Food Chem,2020,340:127922.
[22]程宏桢.百香果果酒酿造及果皮综合利用研究[D].南昌:江西农业大学,2021.
[23]周悦.柿子酒及柿子醋的发酵工艺研究[D].西安:陕西科技大学,2014.
[24]李国薇.苹果品种及酵母菌种对苹果酒品质特性影响的研究[D].杨凌:西北农林科技大学,2013.
[25]毕庆玲,马盈慧,韩喜田,等.沙地欧李果酒酿酒酵母的筛选[J].农业科学,2016,6(5):224-229.
[26]HE W J,LAAKSONEN O,TIAN Y,et al.Phenolic compound profiles in Finnish apple(Malus×domestica Borkh.)juices and ciders fermented with Saccharomyces cerevisiae and Schizosaccharomyces pombe strains[J].Food Chem,2022,373(PB):131437.
[27]GAO H,WEN J J,HU J L,et al.Momordica charantia juice with Lactobacillus plantarum fermentation: Chemical composition,antioxidant properties and aroma profile[J].Food Biosci,2019,29:62-72.
[28] BELY M,STOECKLE P,MASNEUF-POMARÈDE I,et al.Impact of mixed Torulaspora delbrueckii-Saccharomyces cerevisiae culture on high-sugar fermentation[J].Int J Food Microbiol,2008,122(3): 312-320.
[29] LUCIO O,PARDO I,HERAS J M,et al.Influence of yeast strains on managing wine acidity using Lactobacillus plantarum[J].Food Control,2018,92:471-478.
[30]张晶,左勇,谢光杰,等.发酵条件对猕猴桃果酒中多酚含量的影响[J].食品工业科技,2017,38(9):160-163.
[31]田怀香,熊娟涓,于海燕,等.果酒中香气化合物的生物转化与调控机制研究进展[J].食品科学,2022,43(19):36-47.
[32]孟金明,樊爱萍,和川琦,等.芒果、胡萝卜复合果酒发酵过程中理化成分和香气物质的变化[J].食品工业科技,2020,41(12):7-13.
[33]BISSON L F,KARPEL J E.Genetics of yeast impacting wine quality[J].Annu Rev Food Sci T,2010,1:139-162.
[34]HU L L,LIU R,WANG X H,et al.The sensory quality improvement of citrus wine through co-fermentations with selected non-Saccharomyces yeast strains and Saccharomyces cerevisiae[J].Microorganisms,2020,8(3):323.
[35]MASLOV BANDI L,ŽULJ M M,FRUK G,et al.The profile of organic acids and polyphenols in apple wines fermented with different yeast strains[J].J Food Sci Technol,2019,56:599-606.
L,ŽULJ M M,FRUK G,et al.The profile of organic acids and polyphenols in apple wines fermented with different yeast strains[J].J Food Sci Technol,2019,56:599-606.
[36] LI C X,ZHAO X H,ZUO W F,et al.The effects of simultaneous and sequential inoculation of yeast and autochthonous Oenococcus oeni on the chemical composition of red-fleshed apple cider[J].LWT-Food Sci Technol,2020,124:109184.
[37]ONETTO C A,BORDEU E.Pre-alcoholic fermentation acidification of red grape must using Lactobacillus plantarum[J].Anton Leeuw,2015,108:1469-1475.
[38]YE M Q,YUE T L,YUAN Y H.Evolution of polyphenols and organic acids during the fermentation of apple cider[J].J Sci Food Agr,2014,94(14):2951-2957.
[39]ZHANG H,ZHOU F,JI B P,et al.Determination of organic acids evolution during apple cider fermentation using an improved HPLC analysis method[J].Eur Food Res Technol,2008,227:1183-1190.