钙作为人体生命活动所必需的矿物元素,其含量约占体质量的1.5%~2.2%[1]。钙在人体中的存在形式包括结晶态(约99%)和游离态(约1%),其中结晶态的钙盐存在于骨骼和牙齿中,以维持骨骼强度;游离钙离子分布于血液和软组织中,以维持体内钙离子的动态平衡[2]。此外,钙参与人体的多种生理功能,如骨骼生长、血液凝结、胞内代谢、肌肉收缩、神经传递等[3]。机体长期缺钙会引起体内钙磷代谢的紊乱,进而引发软骨病、佝偻病、骨质疏松症以及妊娠期高血压综合症等[4]。钙作为骨骼基本原料,在骨质疏松症防治中扮演着不可或缺的角色。
在金属离子含量不同的情况下,细菌可以吸收各种重金属[5],乳杆菌作为一类常见的细菌,可以将金属离子附着在细菌的表面,或者将其转移到体内进行贮存,这为富集和利用微量元素奠定了基础[6]。廖洪波[7]研究发现,乳酸菌以氯化钙为钙源时,钙富集量明显高于碳酸钙和磷酸钙;原琦等[8]研究发现,乳酸菌富集牛骨中的骨钙,能促进牛骨中钙的最大化利用,强化矿物质微量元素钙;杨靖鹏[9]研究表明,来自不同种属的8株乳酸菌可以对无机态的铁、锌、硒进行富集,并且有较高的元素富集率;焦璐等[10]研究发现,乳酸菌可以吸收无机硒,经过菌体代谢还可以将不同价态的无机硒转换成有机硒,如硒蛋白、硒多糖、硒核酸等,以及单质硒。作为中国最大的畜牧生产基地,新疆拥有大量的奶源,少数民族从很早以前就有对发酵乳产品进行加工、食用的习惯,由于地域辽阔、少数民族众多,各种不同的发酵工艺导致了其具有丰富的乳酸菌资源[11-13]。现有文献对本土资源中存在的天然富钙微生物等的研究鲜见报道,这为富钙微生物资源的开发带来了诸多不便。
本研究采用传统培养分离法从新疆发酵酸奶中分离乳酸菌菌株,通过对菌株钙富集量、耐受性与肠道粘附能力测定筛选性能优良的富集钙菌株,通过测定抗生素敏感性、溶血活性与硝基还原酶产生能力对菌株进行安全性评价,并采用形态观察及分子生物学技术对其进行菌种鉴定。以期得到较高钙富集能力的乳酸菌,为开发我国具有自主知识产权的乳酸菌发酵剂,以及通过乳酸菌补钙预防骨质疏松产品开发提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
从2个新疆伊犁地区家庭采集6份传统发酵酸奶样品,将酸奶置于无菌采样袋中,于4℃保温7d运输至实验室备用。
1.1.2 试剂
无水氯化钙(分析纯)、二甲苯、氯仿(均为分析纯):天津市东丽区天大化学试剂厂;牛磺胆酸钠(分析纯)、胃蛋白酶(3 000~3 500 U/g)、胰蛋白酶(≥50 000 U/g):上海源叶生物科技有限公司;抗生素药敏纸片:上海比克曼生物科技有限公司。
1.1.3 培养基
MRS液体培养基[14]:蛋白胨10 g/L,牛肉膏10 g/L,葡萄糖30 g/L,无水乙酸钠5 g/L,酵母膏5 g/L,柠檬酸氢二胺2 g/L,K2HPO4 2 g/L,MgSO4 0.2 g/L,吐温-80 1 g/L。MRS固体培养基中添加琼脂20 g/L。
M17液体培养基[15]:大豆胨5 g/L,蛋白胨2.5 g/L,牛肉浸粉5 g/L,甘油磷酸钠19 g/L,硫酸镁0.25 g/L,抗坏血酸钠0.5 g/L,酪胨2.5 g/L,酵母浸粉2.5 g/L。固体培养基中添加琼脂20 g/L。
硝基还原酶检测培养基[16]:蛋白胨10 g/L,氯化钠10 g/L,硝酸钾5 g/L。
哥伦比亚血琼脂培养基[17]:胰酪蛋白胨12 g/L,动物组织蛋白消化物5 g/L,酵母提取物3 g/L,牛肉提取物3 g/L,玉米淀粉13 g/L,氯化钠5 g/L,琼脂13.5 g/L,脱纤维羊血50 g/L。
以上培养基均在121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
YXQ-LS-18S1灭菌锅:上海东亚压力容器制造有限公司;HZQ-X100振荡培养箱:哈尔滨市东明医疗仪器厂;PHS-3E pH计:上海仪电科学仪器股份有限公司;722型可见分光光度计:上海光谱仪器有限公司;BA210-T光学显微镜:麦克奥迪实业集团有限公司;TD5A离心机:湖南凯达科学仪器有限公司。
1.3 方法
1.3.1 乳酸菌菌株的分离纯化
采用平板涂布法[14],将0.5 mL发酵酸奶样品加入装有4.5 mL无菌水的试管中,进行10倍梯度稀释,取稀释度为10-5、10-6、10-7的稀释液0.1 mL分别涂布于MRS、M17固体培养基,于37 ℃恒温培养24 h,挑取典型的单菌落,连续划线分离纯化,并进行革兰氏染色和过氧化氢酶实验,确认获得不同细胞形态的乳酸菌菌株后于4 ℃斜面保存。
1.3.2 富集钙乳酸菌菌株的初筛
钙富集能力测定:参考张付云等[18]的方法,将过夜培养的菌悬液离心(8 000 r/min、20 min)获得湿菌体。采用无菌的磷酸缓冲盐溶液(phosphate buffer saline,PBS)将菌体重悬,调整菌体浓度为1×108 CFU/mL。按2%(V/V)的接种量将菌悬液分别接种于含1.2 mg/mL钙离子的MRS液体培养基及M17液体培养基中,37 ℃、200 r/min条件下振荡培养6 h后,8 000 r/min离心20 min,取上清液,利用乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)滴定法测定上清液中的钙离子含量,收集菌体,经105 ℃烘干至恒质量测定菌体质量,计算钙富集量,其计算公式如下:
1.3.3 富集钙乳酸菌菌株的复筛
富钙菌液的制备:将富集钙乳酸菌菌株以2%(V/V)的接种量接种于含1.2 mg/mL钙离子的MRS、M17液体培养基中,37 ℃、200 r/min条件下振荡培养6 h后,8 000 r/min离心20 min,收集菌体,以无菌的磷酸缓冲盐溶液(PBS)将菌体重悬制备富钙菌液。
耐酸性[19]:将MRS(M17)液体培养基的pH值分别调至3.0,将富钙菌液以3%(V/V)的接种量接种至培养基中,于37 ℃、200 r/min条件下振荡培养4 h,分别在0 h和4 h吸取0.1 mL,涂布于对应的MRS(M17)固体培养基上,37 ℃条件下静置培养24 h,测定其活菌数,并计算耐酸性,其计算公式如下:
式中:n为菌株在pH 3.0液体培养基中培养0 h的活菌数,CFU/mL;n0为菌株在pH 3.0液体培养基中培养4 h的活菌数,CFU/mL。
胆盐耐受性[14]:将富钙菌液以3%(V/V)的接种量接种至含有2 g/L胆盐的MRS(M17)液体培养基中,37 ℃、200 r/min条件下振荡培养8 h,吸取0.1 mL涂布于对应的MRS(M17)固体培养基上,37 ℃条件下静置培养24 h,测定其活菌数,并计算胆盐耐受性,其计算公式如下:
式中:p为菌株在含胆盐液体培养基中培养0 h的活菌数,CFU/mL;p0为菌株在含胆盐液体培养基中培养8 h的活菌数,CFU/mL。
疏水性[20]:将富钙菌液以5%(V/V)的接种量接种于MRS(M17)液体培养基中,37 ℃、200 r/min条件下振荡培养16 h后离心(5 000 r/min,15 min),收集菌体,利用无菌的PBS重悬菌体,调整菌液OD600nm值为1后,移取4 mL菌液,加入0.8 mL氯仿(或二甲苯)振荡,静置分层,取下层水相测定其在波长600 nm处的吸光度值(OD600nm值),计算菌株的疏水性,其计算公式如下:
式中:A0为PBS重悬后菌液吸光度值;A为下层水相吸光度值。
自凝聚能力[21]:将富钙菌液按5%(V/V)的接种量接种于MRS(M17)液体培养基中,置于37 ℃、200 r/min条件下振荡培养16 h后(5 000 r/min,15 min)离心,收集菌体,采用无菌的PBS重悬菌体,使其OD600nm值为1。菌液放置试管中37 ℃静置0 h、24 h、48 h,取1 mL上层菌液测定吸光度值(OD600nm值),计算菌株的自凝聚能力,其计算公式如下:
式中:A0为静置0 h时测得的吸光度值;At为24 h、48 h时测得的吸光度值。
胃液耐受性[22]:吸取1 mL富钙菌液接种于含9 mL过滤除菌处理的pH 3.0的人工胃液中,充分混匀后于37 ℃、200 r/min条件下振荡培养,在培养0 h和3 h分别取0.1 mL,涂布于相应的MRS(M17)固体培养基,37 ℃条件下静置培养24 h,测定其活菌数并计算存活率,其计算公式如下:
式中:W0为0 h时测得的活菌数,CFU/mL;W为3 h时测得的活菌数,CFU/mL。
肠液耐受性:移取1 mL经人工胃液中处理3 h后的菌液,接种至9 mL过滤除菌处理的pH 6.8的人工肠液中,37 ℃、200 r/min条件下振荡培养,于0 h、4 h、8 h分别取0.1 mL,涂布于相应的MRS(M17)固体培养基,37 ℃条件下静置培养24 h,测定其活菌数并计算存活率,其计算公式如下:
式中:C0为0 h时测得的活菌数,CFU/mL;C为4 h、8 h时测得的活菌数,CFU/mL。
1.3.4 富集钙乳酸菌菌株的安全性评价
抗生素敏感性测定:移取200 μL富钙菌液于MRS(M17)固体培养基均匀涂抹,将6种抗生素纸片(氨苄西林、红霉素、万古霉素、氯霉素、克林霉素、卡那霉素)贴于培养基表面,37 ℃静置培养24 h,采用游标卡尺测量抑菌圈直径大小。对照2012年美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)标准判定菌株抗生素敏感性[23]。
硝基还原酶产生能力测定[24]:吸取富钙菌液以3%(V/V)的接种量接种至硝基还原酶检测培养基,37 ℃、200 r/min振荡培养72 h左右后,取适量培养液滴入几滴对氨基苯磺酸-α-萘胺试液,混合均匀,静置后观察培养液颜色,以大肠杆菌作为阳性对照组[25]。
溶血活性测定[26]:将富钙菌液用接种环划线接种于哥伦比亚血琼脂培养基中,37 ℃静置培养48 h后,观察溶血圈是否存在于菌落周围,同等条件下培养金黄色葡萄球菌,作阳性对照。
1.3.5 富集钙乳酸菌菌株的鉴定
形态学鉴定:将筛选菌株涂布于MRS(M17)固体培养基,37 ℃静置培养24 h,采用革兰氏染液进行染色,并进行显微镜观察,根据《伯杰细菌鉴定手册》对乳酸菌进行菌落及细胞形态观察[27]。
分子生物学鉴定:采用细菌基因组DNA快速抽提试剂盒提取菌株DNA,选取通用引物27F(5'-AGTTTGATCMTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')对菌株的16S rRNA基因序列进行聚合酶链式反应(polymerase chain reaction,PCR)扩增[28]。PCR扩增产物送至上海生工生物工程股份有限公司进行测序,测序结果提交至美国国立生物技术信息中心(national center for biotechnol ogy information,NCBI)的GenBank数据库中,利用基本局部比对工具(basic local alignment search tool,BLAST)进行同源性比对搜索,选择序列同源性较高的模式菌株的16S rRNA基因序列,采用MEGAX软件中的邻接(neighborjoining,NJ)法构建系统发育树,分析分离菌株与已知菌株的同源性。
1.3.6 数据处理及分析
试验均重复3次,试验结果以“平均值±标准偏差”表示,采用Origin 9软件绘制图表,采用SPSS 20.0软件对数据进行分析处理。
2 结果与分析
2.1 富集钙乳酸菌菌株的分离及初筛
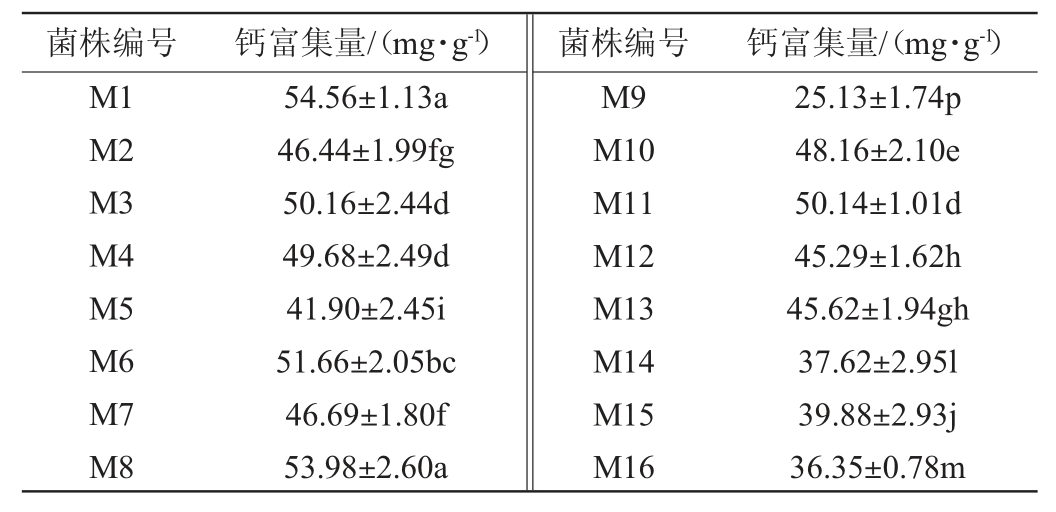
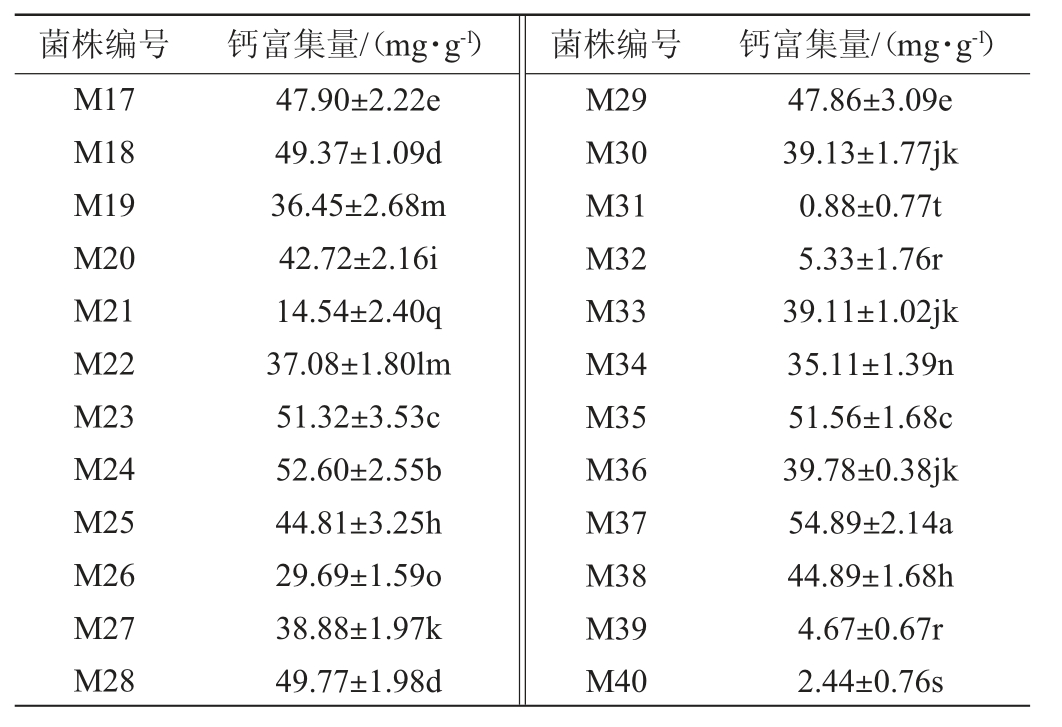
采用MRS固体培养基从新疆传统发酵酸奶中共分离得到20株乳酸菌菌株,编号为M1~M10、M31~M40,采用M17固体培养基从新疆传统发酵酸奶中共分离得到20株乳酸菌菌株,编号为M11~M30,其钙富集能力见表1。
表1 富集钙乳酸菌菌株的初筛结果
Table 1 Preliminary screening results of calcium-enriched lactic acid bacteria strains
续表
注:不同字母表示差异显著(P<0.05)。下同。
由表1可知,40株菌株的钙富集能力存在明显差异,钙富集量在0.88~54.89 mg/g,其中23株菌株的钙富集量>40mg/g,菌株M37的钙富集量最高,达到54.89mg/g,高于石月等[29]筛选出的植物乳杆菌钙富集能力(钙富集量45.41mg/g),因此,初筛出23株钙富集能力较高的菌株进行后续研究。
2.2 富集钙乳酸菌菌株的复筛结果
2.2.1 耐受性测定结果
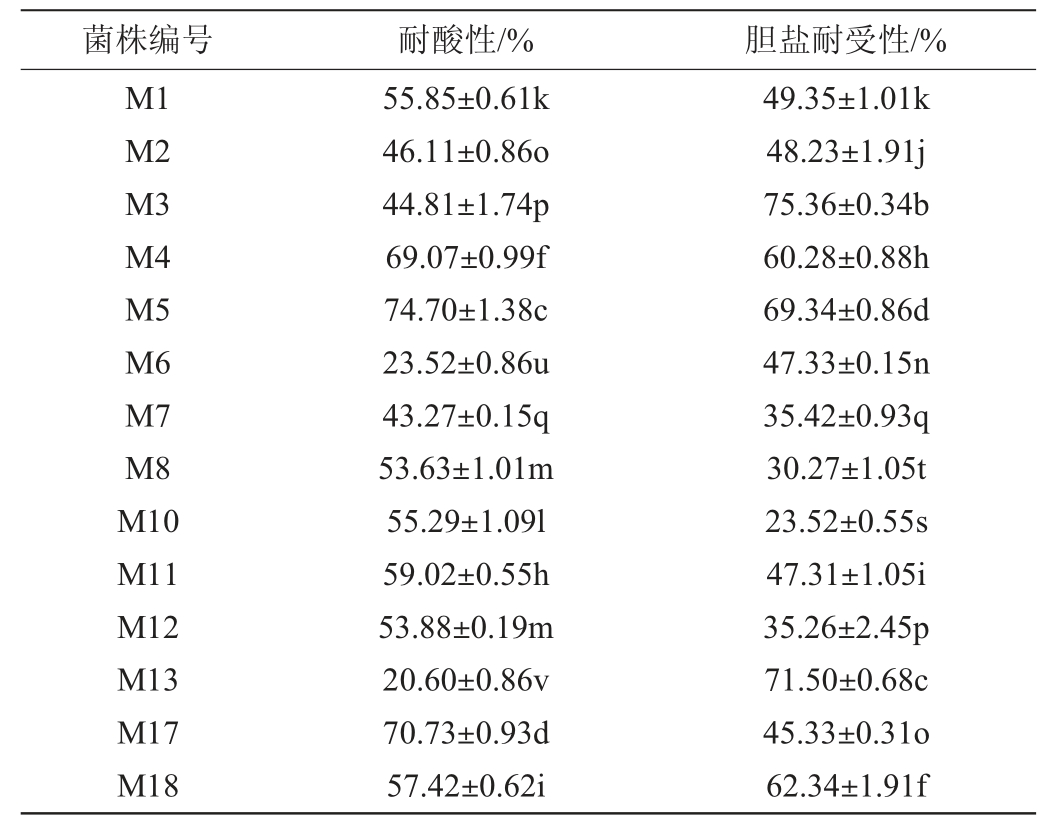
耐酸性是益生菌性能的重要筛选指标之一[30]。胃是抵御病原微生物进入体内的第一道屏障,其中胃酸发挥着十分重要的作用[31]。但是酸性环境会对益生菌的活性产生不利的影响,所以益生菌的耐酸性是其发挥功能所必须的条件[32]。人体胃液的酸碱度处于动态变化的过程中,pH一般维持在3.0左右[33]。而对胆盐的耐受性是细菌在宿主小肠中定植和代谢活动的先决条件,这有助于乳酸菌到达小肠和结肠,促进肠道菌群动态平衡[34]。23株富集钙乳酸菌菌株的耐酸性与胆盐耐受性见表2。
表2 23株富集钙乳酸菌菌株的耐酸性与胆盐耐受性
Table 2 Acid tolerance and bile salt tolerance of 23 calciumenriched lactic acid bacteria strains
续表
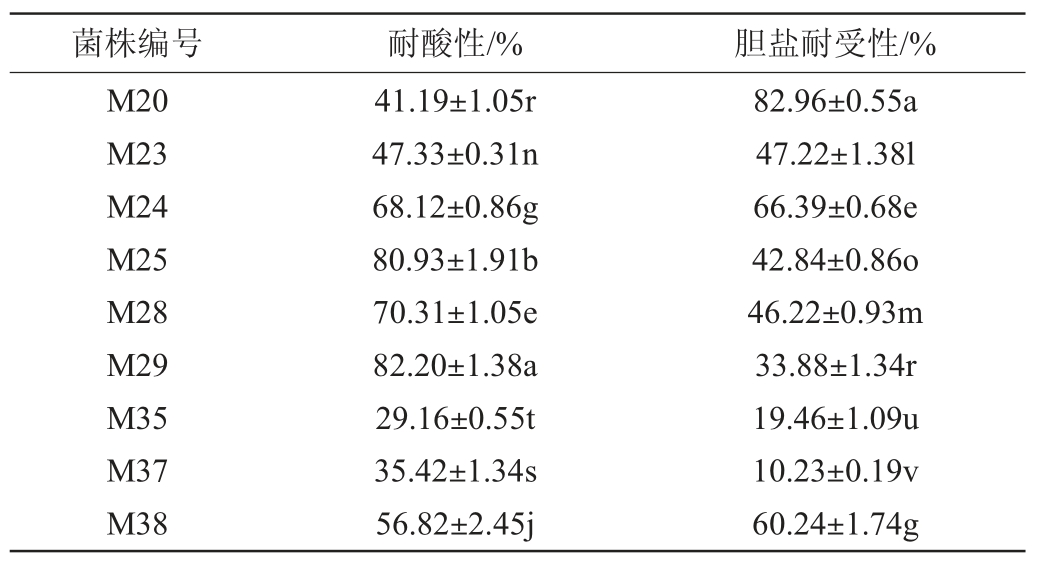
由表2可知,23株乳酸菌均表现出对酸和胆盐的耐受性,在pH值为3的酸性环境下和2 g/L的胆盐环境下,所有菌株均能够存活,其中菌株M29、M25、M5的耐酸性最高,分别为82.20%、80.93%和74.70%;菌株M20、M3、M13的胆盐耐受性较高,分别为82.96%、75.36%和71.50%;筛选出对酸和胆盐耐受性均达到55%以上的菌株M4、M5、M18、M24和M38作进一步研究。
2.2.2 肠道黏附能力的测定结果
益生菌发挥益生功效的关键在于其能够粘附于宿主肠道黏膜细胞表面[35-36],通过疏水性和自凝聚能力的测定可评价菌株的肠道黏附能力[37],5株富集钙乳酸菌菌株在氯仿与二甲苯中的疏水性及其自凝聚能力见图1。
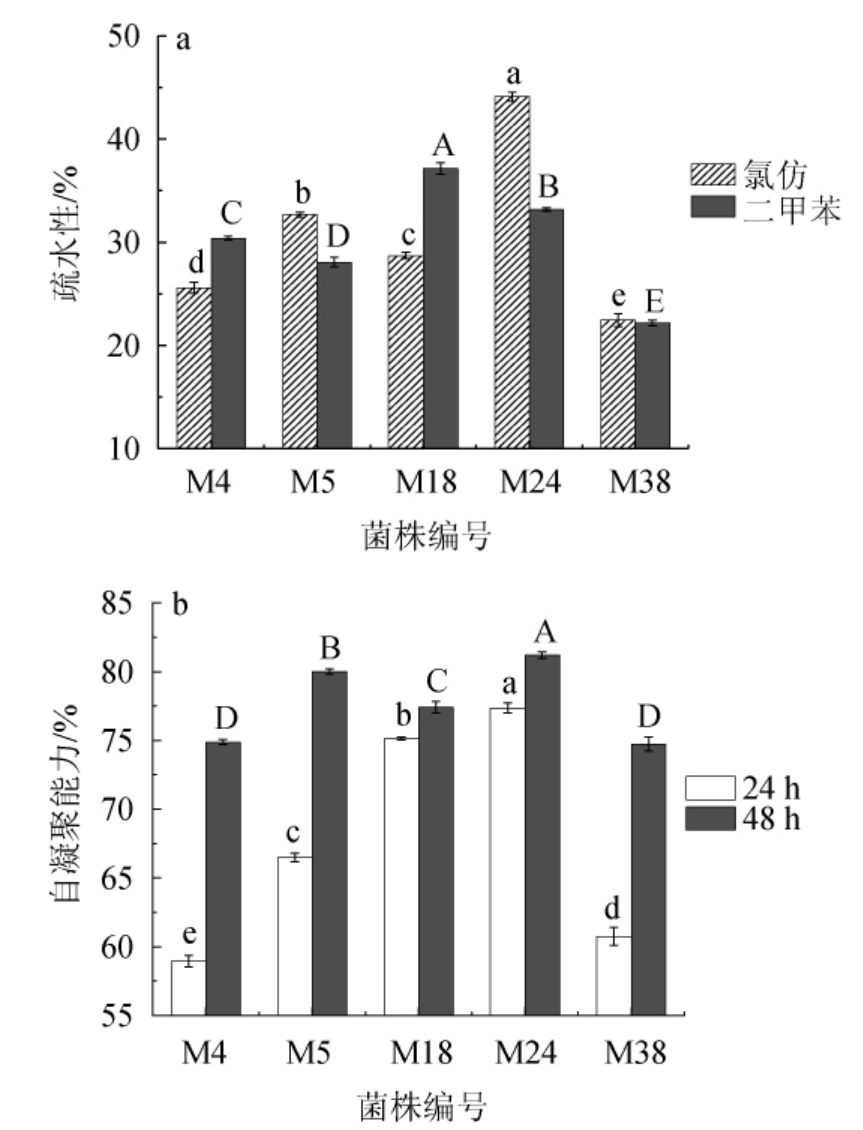
图1 5株富集钙乳酸菌菌株的疏水性(a)及自凝聚能力(b)
Fig.1 Hydrophobicity (a) and self-agglomerating ability (b) of 5 calcium-enriched lactic acid bacteria strains
由图1a可知,菌株M24在氯仿中的疏水性显著高于其他4株菌(P<0.05);菌株M18在二甲苯中的疏水性显著高于其他4株菌(P<0.05),这可能与不同菌株对有机溶剂的吸附性不同有关[38]。WADSTROUM T等[39]证实了疏水性高的乳酸菌对肠上皮细胞具有强的黏附性。所以菌株M18与M24可能会一定程度上黏附在人体肠道上皮细胞和黏膜表面上,发挥其益生功能。
有研究表明,菌株的自凝聚能力与其在肠道中的黏附力呈正相关,自凝聚能力高的菌株粘附力也强[40],而且自凝聚能力可以使益生菌形成空间位阻,阻碍病原菌在肠道上的定植[41]。由图1b可知,5株菌株的自凝聚能力均随时间的增加而提高,在37 ℃条件下放置48 h后,菌悬液上层均呈现澄清状态,其中菌株M5、M24的自凝聚能力达到80%以上。MONTORO P O等[42]提出,细菌的自凝聚能力可分为低(16%~35%)、中(35%~50%)和高(50%以上)3个水平。由此可见,这5株菌的自凝聚能力均处于较高水平。
2.2.3 胃肠液耐受性的测定结果
益生菌经过胃肠道转运,要耐受胃酸、胃蛋白酶以及胆汁、胆盐和胰蛋白酶的一系列作用,到达肠道定植,才能发挥其益生功能[43]。研究表明,益生菌经胃肠道处理后活菌数至少达106 CFU/mL才能产生有益作用[44]。5株富集钙乳酸菌菌株的胃液及肠液耐受性见图2。
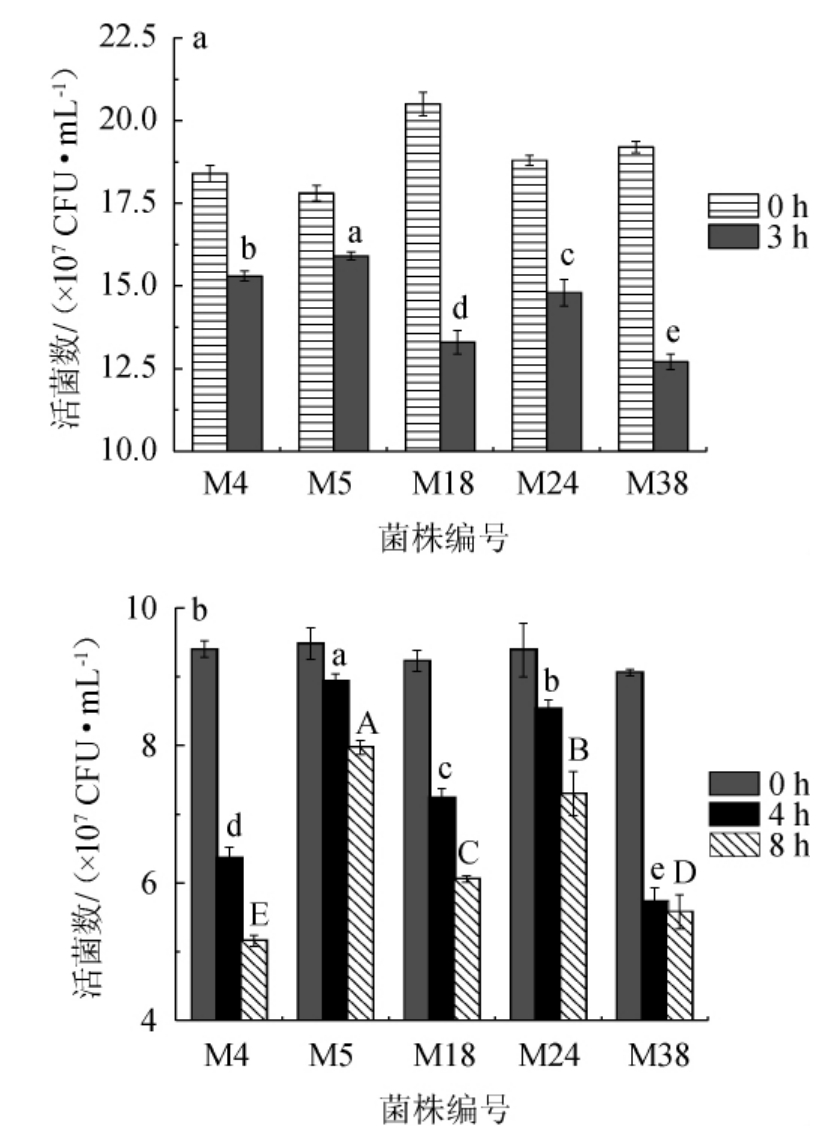
图2 5株富集钙乳酸菌菌株的胃液(a)及肠液(b)耐受性
Fig.2 Gastric fluid (a) and intestinal fluid (b) tolerance of 5 calciumenriched lactic acid bacteria strains
由图2a可知,经人工胃液消化3h后,5株富集钙乳酸菌菌株均对胃液有一定的耐受能力,活菌数均达到107 CFU/mL,其中菌株M4与M5存活率>80%。由图2b可知,5株富集钙乳酸菌菌株在人工胃液中处理后,随即转运至pH 6.8的人工肠液处理8 h后,存活率均下降,其中菌株M5、M18、M24的胃肠液耐受性较好,活菌数达到6×107 CFU/mL,且存活率>65%,所以选取这3株菌进行安全性评价。
2.3 安全性评价
2.3.1 抗生素敏感性测定结果
对抗生素的敏感性是评价益生菌安全性的标准之一[45],菌株对不同的抗生素敏感性存在差别,3株乳酸菌株对6大类6种抗生素的耐受性见表3。
表3 3株富集钙乳酸菌菌株的抗生素敏感性测定结果
Table 3 Determination results of antibiotic sensitivity of 3 calciumenriched lactic acid bacteria strains
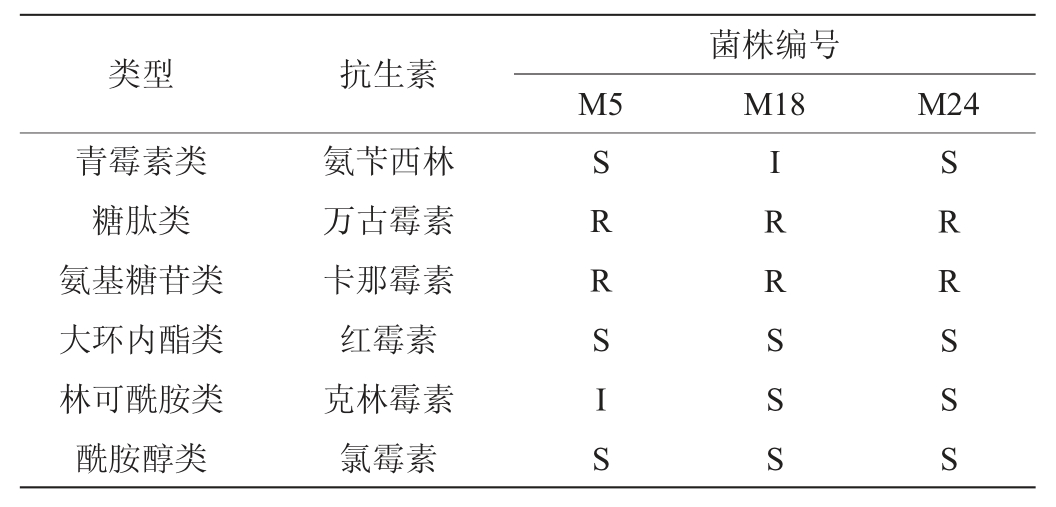
注:“R”代表低敏;“I”代表中敏;“S”代表高敏。
由表3可知,菌株M5、M18和M24对氨苄西林、红霉素、克林霉素、氯霉素均表现出敏感性,对万古霉素、卡那霉素表现出耐药性。据报道很多乳酸菌对卡那霉素、万古霉素具有天然的抗性,这种耐药性一般不会转移传递给致病菌[46]。初步认为菌株M5、M18和M24在抗生素药敏性方面具有较好的安全性。
2.3.2 硝基还原酶产生能力
硝基还原酶能够将食品中含有的硝酸盐还原为亚硝酸盐,亚硝酸盐是强致癌物亚硝胺的前体物质,可以与食品中含有的蛋白质分解中间产物仲胺反应形成亚硝胺,后者可诱发多种癌症[47]。研究结果发现,大肠杆菌的培养液呈现红色,硝基还原酶检测为阳性,而3株富集钙乳酸菌菌株的培养液均未出现红色,检测结果均为阴性,说明菌株M5、M18和M24不具备产生硝基还原酶的能力。
2.3.3 溶血性测定结果
溶血性细菌对人类健康造成危害,联合国粮农组织[48]规定,食品中的益生菌不允许有溶血性。溶血素可以溶解细胞,引起红细胞的内在缺陷与抗原抗体反应,进而引起败血症,这与菌株本身所携带的致病基因有关,大部分的乳杆菌没有溶血性,但ARGYRI A A等[49]从发酵橄榄中检测出4株乳杆菌有溶血性,所以溶血性是体外筛选有益微生物的一个重要指标。溶血性可分3类:α-溶血(在菌落周边有草绿色溶血圈,对人体的致死率较低)、β-溶血(在菌落周边出现透明溶血圈,对人致病力强)、γ-溶血(在菌落周围培养基没有变化即不溶血)。3株富集钙乳酸菌菌株M5、M18与M24均未出现溶血圈,表明这3株乳酸菌均不具有溶血性,不会引起溶血和红细胞聚集。
综上,本实验中筛选出的3株乳酸菌菌株M5、M18与M24均为安全菌株,可用于后续研究。
2.4 乳酸菌菌株的鉴定
2.4.1 形态学观察
菌株M5、M24在MRS固体培养基和菌株M18在M17固体培养基上的菌落及细胞形态见图3。由图3a可知,菌株M5的菌落扁平,边缘不规则;菌株M18的菌落呈圆形,光滑,边缘整齐;菌株M24的菌落呈圆形凸起,表面光滑细密。3株菌经过革兰氏染色处理后均呈紫色,表明为革兰氏阳性菌。由图3b可知,菌株M5细胞呈短杆状,成对或成链排列,不运动;菌株M18细胞呈球形,单个或成串状聚集;菌株M24细胞呈圆端直杆菌,单个、成对或成短链,无芽孢,无鞭毛。
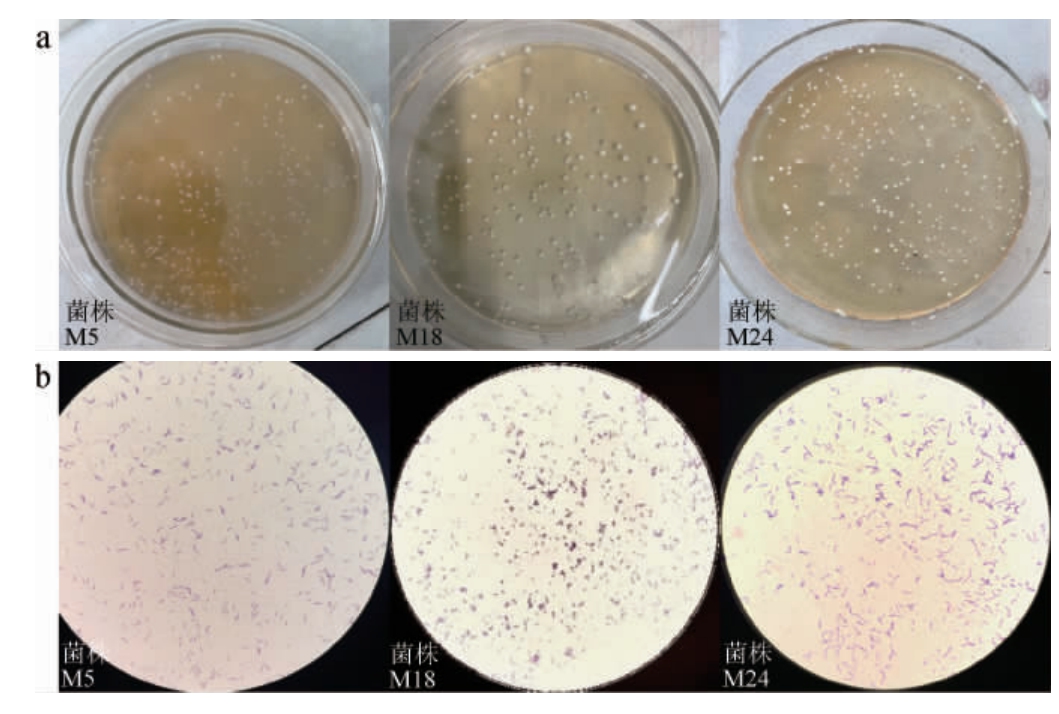
图3 3株富集钙乳酸菌菌株的菌落(a)及细胞(b)形态
Fig.3 Colony (a) and cell (b) morphology of 3 calcium-enriched lactic acid bacteria strains
2.4.2 分子生物学鉴定
基于16S rDNA基因序列,菌株M5、M18和M24的系统发育树见图4。

图4 基于16S rDNA基因序列3菌株的系统发育树
Fig.4 Phylogenetic tree of 3 strains based on 16S rDNA gene sequence
由图4可知,菌株M5、M18、M24分别与发酵乳杆菌(Lactobacillus fermentum)、乳酸片球菌(Pediococcus acidilactici)和植物乳杆菌(Lactiplantibacillus plantarum)聚于一支,亲缘关系最近,结合形态观察结果,最终鉴定菌株M5、M18、M24分别为发酵乳杆菌(Lactobacillus fermentum)、乳酸片球菌(Pediococcus acidilactici)、植物乳杆菌(Lactiplantibacillus plantarum)。
3 结论
本研究采用传统培养分离法从新疆传统发酵酸奶中分离出40株乳酸菌,经钙富集能力、耐受性及黏附能力测定,筛选出3株性能优良的富集钙菌株,分别为菌株M5、M18、M24。这3株菌均具有较高的钙富集能力,钙富集量分别达到41.90 mg/g、49.37 mg/g、52.60 mg/g,且菌株富集钙后仍有一定的酸与胆盐耐受性和良好的粘附性,能保证其在肠道发挥作用。经人工胃肠液消化后,活菌数均达到6×107 CFU/mL以上。此外,3株菌株对氨苄西林、红霉素、克林霉素、氯霉素均表现出敏感性,溶血试验和硝基还原酶试验结果均为阴性,判定3株菌为安全菌株。最终经形态观察及分子生物学鉴定分别为发酵乳杆菌(Lactobacillus fermentum)、乳酸片球菌(Pediococcus acidilactici)、植物乳杆菌(Lactiplantibacillus plantarum)。综上,3株菌株富集钙后性能优良且使用安全,为后续研发具有地域特色的发酵乳制品提供了菌株资源,同时为通过乳酸菌补钙抗骨质疏松奠定基础。
[1]汪学荣,彭顺清,吴峰.钙代谢及生理功能研究进展[J].中国食品添加剂,2005,16(2):42-44.
[2]DAENGPROK W,GARNJANAGOONCHORN W,NAIVIKUL O,et al.Chicken eggshell matrix proteins enhance calcium transport in the human intestinal epithelial cells,Caco-2[J].J Agr Food Chem,2003,51(20):6056-6061.
[3]WALTERS M E,ESFANDI R,TSOPMO A.Potential of food hydrolyzed proteins and peptides to chelate iron or calcium and enhance their absorption[J].Foods,2018,7(10):172.
[4]LIN J T,LANE J M.Osteoporosis:A review [J].Clin Orthop Rel Res,2004,425:126-134.
[5] GUPTA R,AHUJA P,KHAN S,et al.Microbial biosorbents: Meeting challenges of heavy metal pollution in aqueous solutions[J].Curr Sci,2000,78(8):967-973.
[6]MRVCˇIC′ J,STANZER D,ŠOLIC′ E,et al.Interaction of lactic acid bacteria with metal ions:opportunities for improving food safety and quality[J].World J Microbiol Biotechnol,2012,28:2771-2782.
[7]廖洪波.乳酸菌发酵超微骨泥生物特性与增强骨密度功能研究[D].重庆:西南大学,2008.
[8]原琦,邱燕燕,罗爱平.益生菌发酵牛骨粉研制高钙牛肉脯工艺初探[J].食品科技,2018,43(8):122-126.
[9]杨靖鹏.乳酸菌对微量元素的富集及其生物活性评估[D].杨凌:西北农林科技大学,2017.
[10]焦璐,巨家升,周连玉,等.乳酸菌富硒特性及生物活性的研究进展[J].食品研究与开发,2021,42(14):178-184.
[11]张兴吉.中国西部牧区乳源性乳酸菌分离鉴定及其发酵特性研究[D].杨凌:西北农林科技大学,2018.
[12]刘璐,迪娜热尔·迪力达西,吴禹澈,等.新疆发酵乳品中乳酸菌的分离鉴定及其耐药性[J].中国微生态学杂志,2017,29(7):745-749,753.
[13]魏艳,曾小群,潘道东,等.新疆地区不同酸奶中优势乳酸菌的分离与鉴定[J].中国食品学报,2012,12(12):161-166.
[14]玛丽娜·库尔曼,包怡红.传统酵素源高效降胆固醇菌株的筛选、鉴定及胆盐水解酶活性分析[J].中国食品学报,2021,21(1):266-275.
[15]刘绒梅,高达,孙金威,等.传统乳制品中乳酸菌的筛选及发酵性能研究[J].中国酿造,2022,41(5):78-83.
[16]张亮,于哲,张慧敏,等.具有吸附重金属铅能力乳酸菌的安全性评价[J].中国乳品工业,2022,50(6):33-38.
[17]矫艳平,余萍,赵迪,等.植物乳杆菌HCS03-001安全性评价及其益生特性分析[J].食品工业科技,2022,43(5):165-171.
[18]张付云,李云冰,杨晴宇,等.用螠蛏贝壳制备乳酸菌富集钙的工艺[J].食品研究与开发,2012,33(8):7-10.
[19]郑越,段涛,宋丹,等.六株植物乳杆菌的益生特性研究[J].食品与发酵工业,2022,48(10):119-125.
[20]KOTZAMANIDIS C,KOURELIS A,LITOPOULOU-TZANETAKI E,etal.Evaluation of adhesion capacity,cell surface traits and immunomodulatory activity of presumptive probiotic Lactobacillus strains[J].Int J Food Microbiol,2010,140(2-3):154-163.
[21]SHEKH S L,DAVE J M,VYAS B R M.Characterization of Lactobacillus plantarum strains for functionality,safety and γ-amino butyric acid production[J].LWT-Food Sci Technol,2016,74:234-241.
[22]冯沸,梅俊,李云飞.西藏灵菇中分离两株干酪乳杆菌及其益生特性比较研究[J].中国酿造,2016,35(6):35-39.
[23] GUNYAKTI A,ASAN-OZUSAGLAM M. Lactobacillus gasseri from human milk with probiotic potential and some technological properties[J].LWT-Food Sci Technol,2019,109:261-269.
[24]玛丽娜·库尔曼.降胆固醇益生菌的筛选鉴定及降血脂功能研究[D].哈尔滨:东北林业大学,2020.
[25]孟丹,王丽群,谢国梁,等.一株乳酸乳球菌产γ-氨基丁酸能力及其安全性评价[J].中国酿造,2017,36(4):72-77.
[26] NAMI Y,BAKHSHAYESH R V,MANAFI M,et al.Hypocholesterolaemic activity of a novel autochthonous potential probiotic Lactobacillus plantarum YS5 isolated from yogurt[J].LWT-Food Sci Technol,2019,111:876-882.
[27]梁小东,汤承,雷江英,等.传统牦牛酸奶中产细菌素乳酸菌的筛选及鉴定[J].中国酿造,2022,41(8):77-82.
[28]QIN L N,CAI F R,DONG X R,et al.Improved production of heterologous lipase in Trichoderma reesei by RNAi mediated gene silencing of an endogenic highly expressed gene[J].Bioresource Technol,2012,109:116-122.
[29]石月,王金厢,李学鹏,等.富集钙乳酸菌的筛选及培养条件对富集效果的影响[J].食品工业科技,2021,42(8):125-132.
[30]何杉杉,王晓蕊,彭禹熙,等.雪莲菌中乳酸菌的益生特性[J].食品科学,2022,43(2):210-216.
[31]罗强,张明,刘巧,等.产细菌素屎肠球菌SC-Y112的体外益生性及安全性评价[J].食品科学,2021,42(11):154-160.
[32]王建设,赵海燕,王凡,等.乳酸片球菌的分离鉴定与益生功能的初步研究[J].中国农学通报,2012,28(24):201-206.
[33] CHANDRAN A,DUARY R K,GROVER S,et al.Relative expression of bacterial and host specific genes associated with probiotic survival and viability in the mice gut fed with Lactobacillus plantarum Lp91[J].Microbiol Res,2013,168(9):555-562.
[34]PLESSAS S,NOUSKA C,KARAPETSAS A,et al.Isolation,characterization and evaluation of the probiotic potential of a novel Lactobacillus strain isolated from Feta-type cheese[J].Food Chem,2017,226:102-108.
[35] GARCIA-GONZALEZ N,PRETE R,BATTISTA N,et al.Adhesion properties of food-associated Lactobacillus plantarum strains on human intestinal epithelial cells and modulation of IL-8 release [J].Front Microbiol,2018,9:2392.
[36]OUWEHAND A C,SALMINEN S.In vitro adhesion assays for probiotics and their in vivo relevance:A review[J].Microb Ecol Health and Dis,2009,15(4):175-184.
[37]COLLADO M C,GUEIMONDE M,HERNÁNDEZ M,et al.Adhesion of selected Bifidobacterium strains to human intestinal mucus and the role of adhesion in enteropathogen exclusion[J].J Food Protect,2005,68(12):2672-2678.
[38]温贺,肖凤艳,段翠翠,等.植物乳杆菌Sc52益生特性评价及其在降血糖产品中的应用[J].食品科学,2018,39(6):148-154.
[39]WADSTROUM T,ANDERSSON K,SYDOW M,et al.Surface properties of Lactobacilli isolated from the small intestine of pigs[J].J Appl Bacteriol,1987,62(6):513-520.
[40]DEL RE B,SGORBATI B,MIGLIOLI M,et al.Adhesion,autoaggregation and hydrophobicity of 13 strains of Bifidobacterium longum[J].Lett Appl Microbiol,2000,31(6):438-442.
[41]SPENCER R J,CHESSON A.The effect of Lactobacillus spp.on the attachment of enterotoxigenic Escherichia coli to isolated porcine enterocytes[J].J Appl Bacteriol,1994,77(2):215-220.
[42]MONTOROPO,BENOMAR N,LAVILLA L L,et al.Fermented Aloreña table olives as a source of potential probiotic Lactobacillus pentosus strains[J].Front Microbiol,2016,7:1583.
[43]王彦萍,熊涛,黄涛,等.优良饲用乳酸菌的筛选及在模拟消化环境中的耐受性[J].食品与发酵工业,2016,42(10):56-60.
[44] FERRANDO V,QUIBERONI A,REINHEIMER J,et al.Functional properties of Lactobacillus plantarum strains:A study in vitro of heat stress influence[J].Food Microbiol,2016,54:154-161.
[45]冯程程,蔡子哲,陈琼,等.产β-葡萄糖苷酶乳酸菌益生特性研究[J].食品与发酵工业,2022,48(15):85-90.
[46]张灼阳,刘畅,郭晓奎.乳酸菌耐药性的研究进展[J].中国微生态学杂志,2007(5):478-480.
[47]王英,范琳琳,施亚萍,等.具有抗氧化功能的副干酪乳杆菌FM-LP-4和干酪乳杆菌FM-M9-1的安全性初步评价[J].中国乳品工业,2019,47(11):4-7,13.
[48]GANGULY N K,BHATTACHARYA S K,SESIKERAN B,et al.ICMRDBT guidelines for evaluation of probiotics in food[J].Indian J Med Res,2011,134(1):22-25.
[49]ARGYRI A A,ZOUMPOPOULOU G,KARATZAS K A G,et al.Selection of potential probiotic lactic acid bacteria from fermented olives by in vitro tests[J].Food Microbiol,2013,33(2):282-291.