发酵肉制品因其独特的风味而广受消费者的青睐,我国传统的发酵肉制品以自然风干发酵为主,依赖原料肉本身的内源酶和外界环境的微生物进行发酵,在发酵过程中,加入外源发酵剂,可以有效控制产品质量,提升产品风味和安全性[1]。肉制品常用的发酵剂有乳酸菌和凝固酶阴性球菌[2-3]。凝固酶阴性球菌主要包括凝固酶阴性葡萄球菌(Staphylococcus spp.)和考克氏菌(Kocuria spp.),前者属于葡萄球菌科(Staphylococcaceae),后者属于微球菌科(Micrococcaceae)[3-5]。乳酸菌在肉制品发酵过程中抑制腐败菌的生长,有助于提高产品性能,但会赋予发酵肉些许酸味[6]。凝固酶阴性葡萄球菌和微球菌在发酵过程中参与蛋白质水解和脂肪分解增加肉制品的风味,具有硝酸还原酶、过氧化氢酶活性等,增强发酵肉制品的感官属性[7],发酵肉中主要的考克氏菌种有变异考克氏菌(Kocuriavarians)、克氏考克氏菌(Kocuria kristinae)[8-9]。在近年研究中,嗜根考克氏菌(Kocuria rhizophila)在不同发酵肉原生菌群中被检出,被认为对香肠的香气特征有积极的影响[10-11]。
目前,肉制品专用发酵剂的研究主要集中在乳杆菌、片球菌和葡萄球菌以及这三类菌复配对发酵肉制品质的影响[12-15],鲜有报道将微球菌用于肉制品的加工,属于微球菌科的嗜根考克氏菌用于发酵肉制品则未见报道。
课题组前期从传统发酵诺邓火腿中分离得到8株嗜根考克氏菌(Kocuria rhizophila),基于抗逆性、酶活性、耐药性、毒力基因等体外筛选得到性能好的嗜根考克氏菌K45,经研究发现,菌株K45具有蛋白水解活性和硝酸还原酶活性,有改善发酵肉制品色泽、增强风味的潜能[11]。本实验将菌株K45作为发酵剂,以自然发酵为对照,探究菌株K45对发酵肉色泽和风味的影响,为肉制品发酵剂提供一种新的菌种选择。
1 材料与方法
1.1 材料与试剂
嗜根考克氏菌(Kocuria rhizophila)K45:保存于云南省农业科学院发酵食品微生物菌种库,作为本实验的发酵菌株。猪后腿肉:购于昆明家乐福超市。
盐酸(分析纯):天津市风船化学试剂科技有限公司;乙腈(纯度99.9%):瑞典Oceanpak公司;2-辛醇(纯度99.5%):日本东京化成工业株式会社;AccQ-Tag A溶液、混合氨基酸标准溶液、AccQFluor试剂盒(包括硼酸缓冲液1):美国Waters公司。
平板计数琼脂(plate count agar,PCA)培养基、甘露醇氯化钠琼脂(mannitol salt agar,MSA)培养基、营养肉汤(nutritional broth,NB)培养基:青岛高科园海博生物技术有限公司。
1.2 仪器与设备
CM-5台式色差仪:日本美能达公司;HP-7890/5977B型气相色谱-质谱联用仪、DB-Wax色谱柱(30 m×250 μm×0.25 μm):美国Agilent公司;手动固相微萃取装置(萃取纤维为50/30 μm DVB/CAR/PDMS):美国Supelco公司;2695高效液相色谱仪、2487紫外-可见光检测器、Empower色谱工作站、AccQ-Tag专用色谱柱(3.9 mm×150 mm,4.0 μm):美国Waters公司。
1.3 方法
1.3.1 样品制备
发酵剂的制备:将菌株K45接种于NB培养基在37 ℃静置培养至对数期,4 ℃、6 000 r/min离心10 min,弃上清,用无菌生理盐水洗脱3次,用生理盐水重悬至原培养基体积的50%,获得107 CFU/mL菌悬液。
发酵肉制备:取500 g猪后腿肉,修整规则,用无菌注射器均匀注入25 mL K45菌悬液,自然发酵对照组注射等体积无菌生理盐水,取质量分数3%食盐均匀涂抹于表面,在低温(9 ℃,相对湿度78%)条件下发酵3 d,然后悬挂于常温发酵至27 d,制得发酵肉样品。每个实验重复3次。
1.3.2 菌落计数
发酵第1、3、5、10、17、20、27天,在无菌条件下,每次在距表面1 cm处取样,磨碎混匀,取10 g样品加入90 mL生理盐水中,120 r/min频率均质10 min后,将样品稀释至合适浓度,涂布于PCA培养基和MSA培养基进行计数。
1.3.3 色度测定
将发酵27 d的猪肉样品,分割为大小均匀的小块,用台式色差仪测定颜色,通过内置的标准白板进行仪器校准,测量亮度(L*)、红度(a*)、黄度(b*)值。
1.3.4 挥发性风味物质的测定
顶空固相微萃取(headspace solid-phase microextraction,HS-SPME)条件:取一定量绞碎混合均匀的发酵肉样品,精确称(100±5)mg于20 mL顶空瓶中,再加入10 μL 2-辛醇(10 mg/L dH2O)为内标,将老化好的萃取头插入顶空瓶上部,水浴预热15 min,60 ℃水浴萃取30 min,萃取结束后在进样口解吸4 min。萃取头首次使用在气相色谱进样口250 ℃老化1 h,之后每次萃取前250 ℃老化45 min。
气相色谱条件:使用DB-Wax色谱柱(30 m×250 μm×0.25 μm),不分流进样,以氦气为载气,前入口吹扫流量为3 mL/min,通过柱的气体流量为1 mL/min。起始温度40 ℃,保持4 min,以5 ℃/min升温至245 ℃,保持5 min。注入线温度、转移线温度、离子源温度和四级杆温度分别为250 ℃、250 ℃、230 ℃和150 ℃。质谱条件:电离方式为电子电离(electron ionization,EI)源;电子能量70 eV。质谱数据采用扫描模式获得,质量扫描范围为20~400 m/z,溶剂延迟时间为0 min。
定性与定量分析:根据所得谱图与美国国家标准技术研究所(national institute of standards and technology,NIST)数据库提供的谱图对风味物质定性分析,选取正反匹配度均>800的化合物。利用内标归一化法计算各挥发性物质的相对含量,使用内标物的峰面积对所有物质进行相对矫正,矫正方法为:矫正峰面积=原峰面积/内标峰面积。
1.3.5 关键挥发性物质评价
参照刘登勇等[16]的方法,采用相对气味活度值(relative odor activity value,ROAV)法确定发酵肉中关键挥发性风味物质。首先定义对样品风味贡献最大的组分ROAVmax=100,对其他香气成分则有:
式中:C%i、Ti为测得的结果中各风味组分的相对百分含量和对应的感觉阈值;C%max、Tstan分别为设定的对样品风味贡献最大组分的相对百分含量和对应的感觉阈值。
1.3.6 游离氨基酸含量测定
样品前处理:取一定量的发酵肉样品,绞碎混合均匀,混匀样品冷冻干燥48 h,-20 ℃贮存备用。准确称量已处理好的样品1 g,用0.005 mol/L的盐酸10 mL超声萃取30 min。
衍生:按照WATERS AccQ-Fluor试剂盒说明书配制衍生试剂。移取10 μL样品注入6 mm×50 mm衍生管底部,加入70 μL硼酸缓冲液1,涡旋混合,再加入20 μL衍生试剂,涡旋混合10 s,在室温下放置1 min,将衍生管用石蜡膜封口,放在55 ℃加热5 min,加热后取出,即可用于进样。
色谱条件[17]:色谱柱为AccQ·Tag 柱(3.9 mm×150 mm),进样量为10 μL,梯度洗脱洗脱液A为AccQ·Tag A 液用水1∶10稀释;洗脱液B为乙腈;洗脱液C为高纯水。洗脱速度为1.0 mL/min,柱温37 ℃,紫外检测波长为248 nm。
1.3.7 数据处理
使用Excel 2019进行数据整理,数据均用“平均值±标准差”(X±SD)表示。使用Excel 2019软件对数据进行平均值、标准差等计算;SPSS 26.0对数据进行单因素方差分析和独立样本t检验,P<0.05为差异显著,P<0.01为差异极显著。使用Origin 8.0绘制;使用GraphPad Prism 8.0.2软件绘制柱状图、火山图。
2 结果与分析
2.1 发酵肉的菌落数测定
自然发酵和菌株K45发酵过程中菌落总数和凝固酶阴性球菌数变化结果见图1。
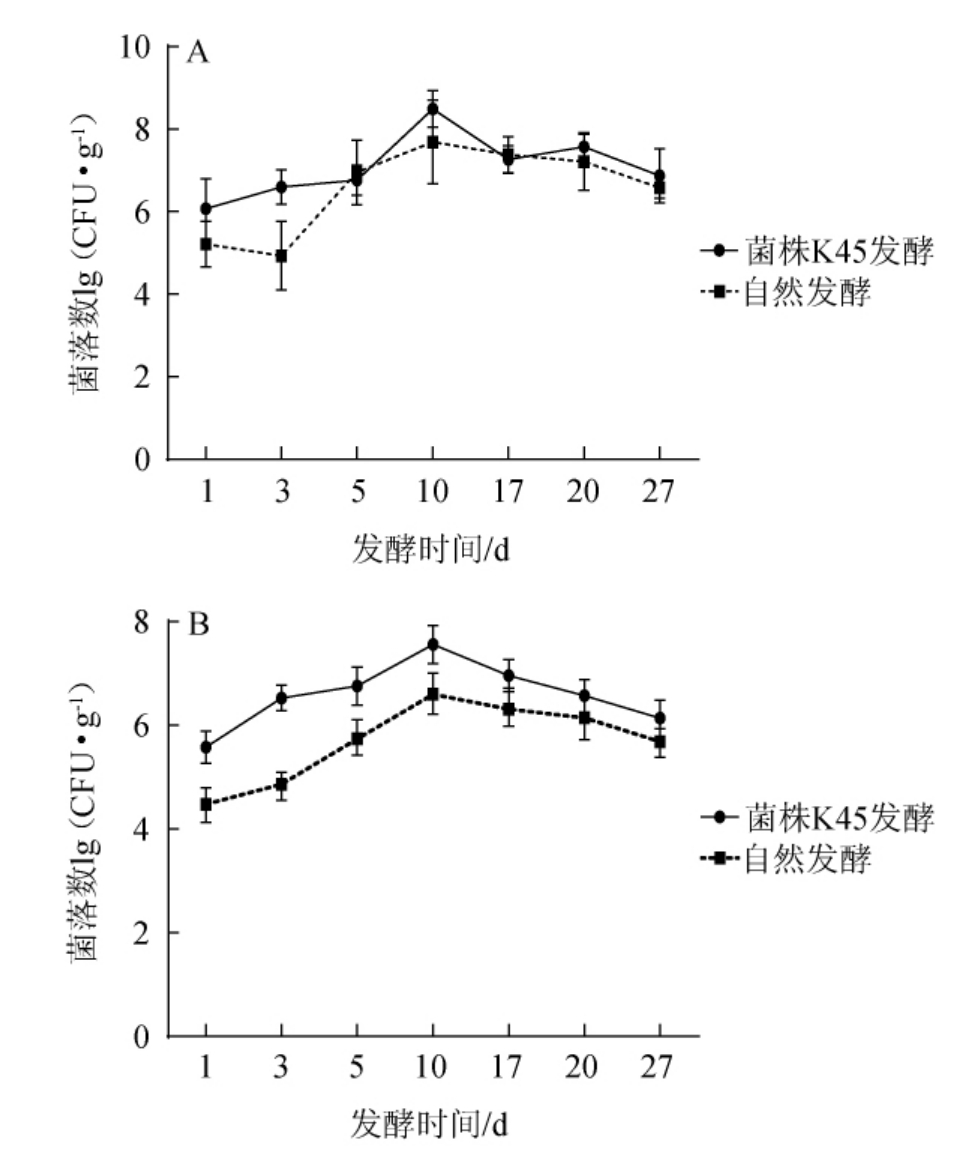
图1 自然发酵肉和菌株K45发酵肉菌落总数(A)及凝固酶阴性球菌数(B)变化
Fig.1 Changes of the total number of bacteria (A) and coagulasenegative cocci (B) in naturally fermented meat and strain K45 fermented meat
由图1A、图1B可知,随着发酵时间的延长,菌株K45发酵组与自然发酵组的菌落总数和凝固酶阴性球菌数菌群数均呈先升高后降低的趋势。发酵初期,由于肉块基质中含有丰富的营养物质,pH、水分活度适宜,有利于菌群生长,因而菌群数持续增加,在第10天达到最大水平,随后下降,这可能是由于成熟期发酵肉块基质中的水分含量下降,盐含量上升,同时因微生物的生长消耗,基质中还原糖含量减少,不适宜菌群生长[6],从而使菌群数呈下降趋势。整个发酵过程,菌株K45发酵组的凝固酶阴性球菌数均高于自然发酵组。
2.2 菌株K45对发酵肉色度的影响
自然发酵和菌株K45发酵肉的色泽对比结果见表1。结果表明,发酵27 d,菌株K45发酵组红度值a*明显高于自然发酵组,凝固酶阴性球菌具有发色的作用[4],这可能也是造成菌株K45发酵组红度值较高的原因。菌株K45具有的硝酸盐还原酶[11]将亚硝酸盐还原成NO后,再与肉中的肌红蛋白结合形成了亚硝基肌红蛋白,促进肉制品产生发酵后特有的红色。此外,菌株K45含有过氧化氢酶[11],能够催化过氧化氢分解,避免肉制品颜色变暗,使肉制品保持颜色鲜艳。
2.3 挥发性风味物质分析
2.3.1 挥发性风味物质检测结果
自然发酵和菌株K45发酵肉中的主要挥发性物质相对含量见表2,各类挥发性物质相对含量见表3。
表2 自然发酵肉和菌株K45发酵肉色泽对比
Table 2 Comparison of color between naturally fermented meat and strain K45 fermented meat
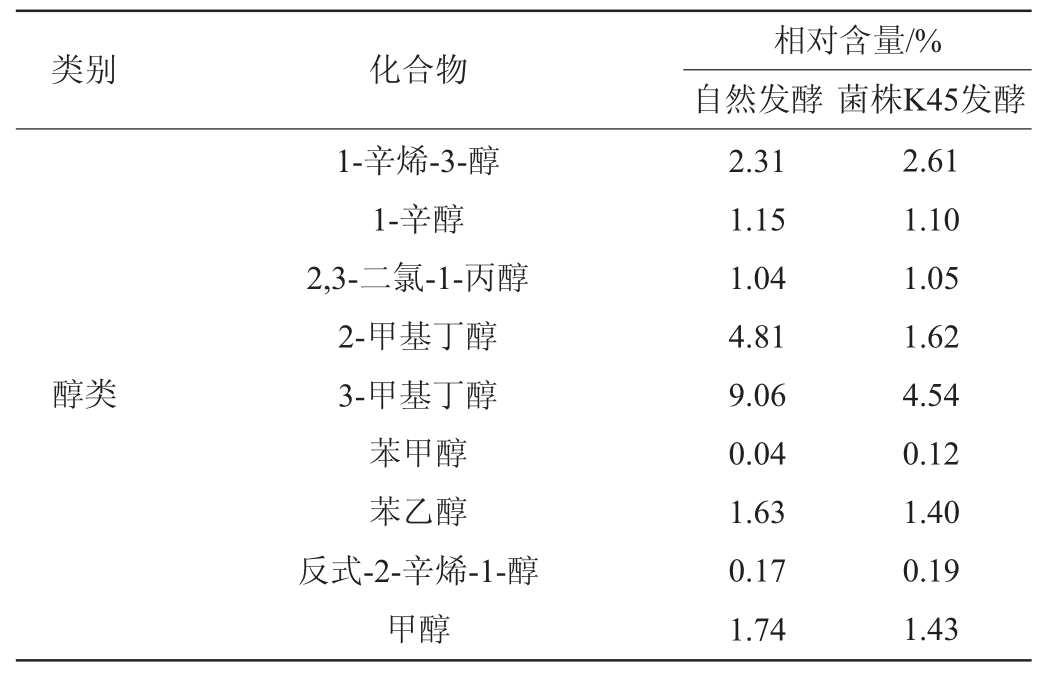
表2 自然发酵肉和菌株K45发酵肉中主要的挥发性风味物质成分相对含量
Table 2 Relative contents of main volatile flavor compounds in naturally fermented meat and strain K45 fermented meat
续表

续表
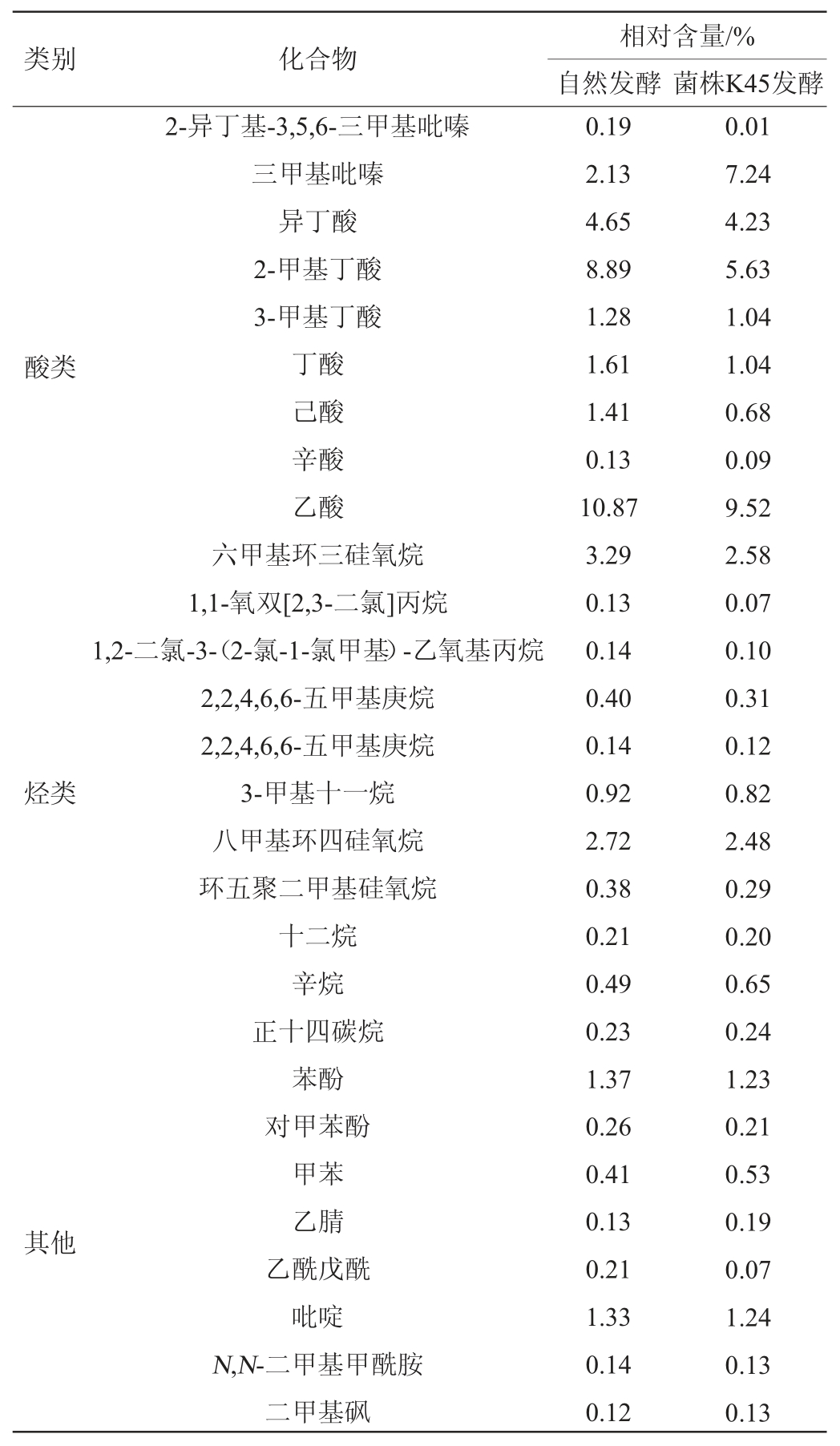
注:表中只列出在自然发酵或菌株K45发酵中相对含量高于0.1%的化合物,“-”表示未检出,下同。
表3 自然发酵肉和菌株K45发酵肉中各类挥发性风味物质相对含量
Table 3 Relative contents of volatile flavor compounds types in naturally fermented meat and strain K45 fermented meat
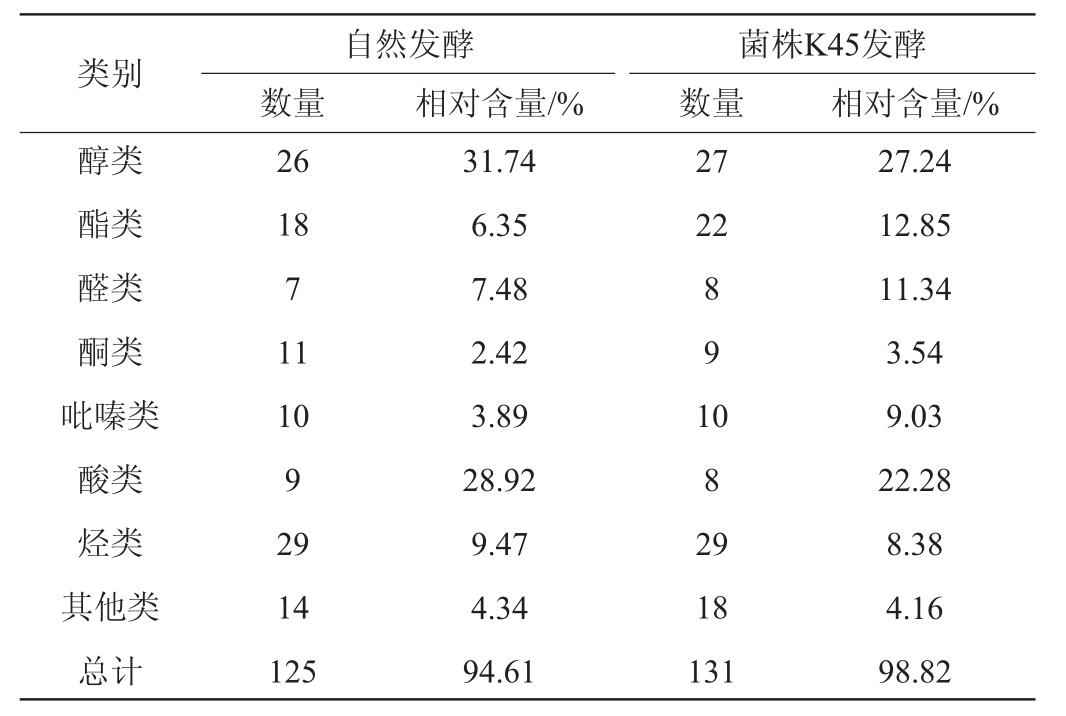
两组发酵肉共检测出136种挥发性物质,其中自然发酵肉中共检出125种,菌株K45发酵肉中共检出131种,其中包括醇类27种,酯类24种,醛类8种,酮类11种,吡嗪类11种,酸类9种,芳香族5种,烃类29种,其他类18种。由表3可知,菌株K45发酵组检测出的挥发性风味物质较多,共131种,有8种新挥发性物质在菌株K45发酵组中被检测出,相对含量为2.61%,其中相对含量最高的为乳酸乙酯(2.49%),贡献果香、酒香味[18]。
两组发酵肉中,醇类物质的相对含量最高,分别为31.74%、27.24%。醇类主要通过微生物对糖类的代谢产生,部分由脂肪氧化产生[19],醇类阈值相对普遍较高,但不饱和醇的香气阈值较低[17],对发酵肉风味的贡献不可替代。菌株K45发酵组中醛类和酯类物质比自然发酵组多,对发酵肉的风味存在一定的提升作用。醛类化合物主要来源于脂肪的氧化与氨基酸降解,醛的阈值一般很低,具有脂肪香味,是肉香味的主要成分[20],对风味的整体贡献较大。由表2可知,菌株K45发酵组中,醛类物质的相对含量为11.31%,高于自然发酵组6.99%的占比,其中,壬醛、乙醛、3-甲基丁醛和苯甲醛的相对含量均>1%。醇、酯类物质虽然多数阈值较高,但是一些低阈值醛类、酮类物质的前体物质,对风味具有潜在影响[21]。酯类物质是由醇和酸经过酯化反应生成的,多带有芳香味,其中短链酸形成的酯类多呈水果香,长链酸形成的酯多呈较淡的油脂味,对发酵香肠典型的风味形成有一定作用[22]。曹辰辰等[19]对比自然发酵与植物乳杆菌和模仿葡萄球菌(Staphylococcus simulans)为混合发酵剂对香肠风味的影响,发现醛类、醇类和酯类物质对发酵香肠的风味有重要影响,这与本试验结果一致。
自然发酵和菌株K45发酵肉中酸类物质含量较高,分别为28.92%、22.28%,酸类物质主要源于脂肪氧化和脂肪水解生成的小分子脂肪酸,酸类物质有助于酯类物质的形成[19],但酸类物质香气阈值较高,对香气贡献较小[17]。酮类和吡嗪类化合物在检测结果中相对含量较低,但对发酵肉的风味有其独特的贡献。经菌株K45发酵,酮类和吡嗪类化合物的相对含量增加。酮类和吡嗪类物质均来源于脂肪氧化产物参与美拉德反应[23-24],酮类物质具有花香香气,性质较为稳定且香气持久[25];吡嗪类主要呈现肉香味和烤香味,香气阈值较低[24]。烃类化合物在两组发酵肉中种类最多,但烷烃类化合物分子质量大且阈值高[26],香气不突出,对发酵肉风味贡献较小。
2.3.2 相对气味活度值分析
ROAV可以衡量挥发性风味物质中对整体风味有重要贡献的物质,ROAV越大,对样品总体风味的贡献也越大,一般认为ROAV≥1的物质为关键风味物质,0.1≤ROAV<1的物质则对总体风味具有重要修饰作用[16]。关键性组分的ROAV见表4。
表4 自然发酵肉和菌株K45发酵肉中关键性香气化合物及相对气味活度值
Table 4 Relative odor activity value of key volatile flavor compounds in naturally fermented meat and strain K45 fermented meat

注:“-”表示未检出。
根据所测风味物质的相对含量及其感觉阈值,确定各组分中的总体气味贡献最大的物质,2-甲基丙酸乙酯的阈值仅为0.001,其在自然发酵组、菌株K45发酵组的相对含量分别为0.3%、0.17%,所以定义2-甲基丙酸乙酯的ROAVmax为100。表中列出了ROAV≥0.1的风味物质。由表4可知,菌株K45发酵肉与自然发酵肉中共有的ROAV≥1关键风味物质有2-甲基丙酸乙酯、2-甲基丙醛、双乙酰、对甲酚、三甲基吡嗪、甲硫基丙醇、2-甲基丁酸、癸酸乙酯、异丁酸。2,5-二甲基吡嗪、3-甲基丁醛、2,3-二甲基吡嗪、甲苯、2-甲基丁酸乙酯、1-辛烯-3-醇和D-柠檬烯在菌株K45发酵肉中ROAV≥1,是菌株K45发酵肉风味的重要组成部分。2,5-二甲基吡嗪具有烤坚果香味[27],3-甲基丁醛是一种低阈值,具有坚果香,对肉制品整体风味有重要贡献作用[31]。甲苯具有水果甜味[32]。1-辛烯-3-醇是香肠中最具代表性的不饱和醇,具有蘑菇香气并且阈值较低,对发酵香肠的风味形成有重要影响[33];D-柠檬烯具有果香、柑橘香味,且阈值较低,易对风味产生影响[34]。另外,经菌株K45发酵香肠产生且ROAV≥0.1的风味物质有萘、1-羟基-2-丙酮、2-甲基丁醇、苯乙醛,苯乙醛具有香料味[35],这些物质对发酵肉制品特殊风味的形成具有重要贡献。可知菌株K45发酵肉制品可丰富肉制品风味,对发酵肉风味的形成起到促进作用。
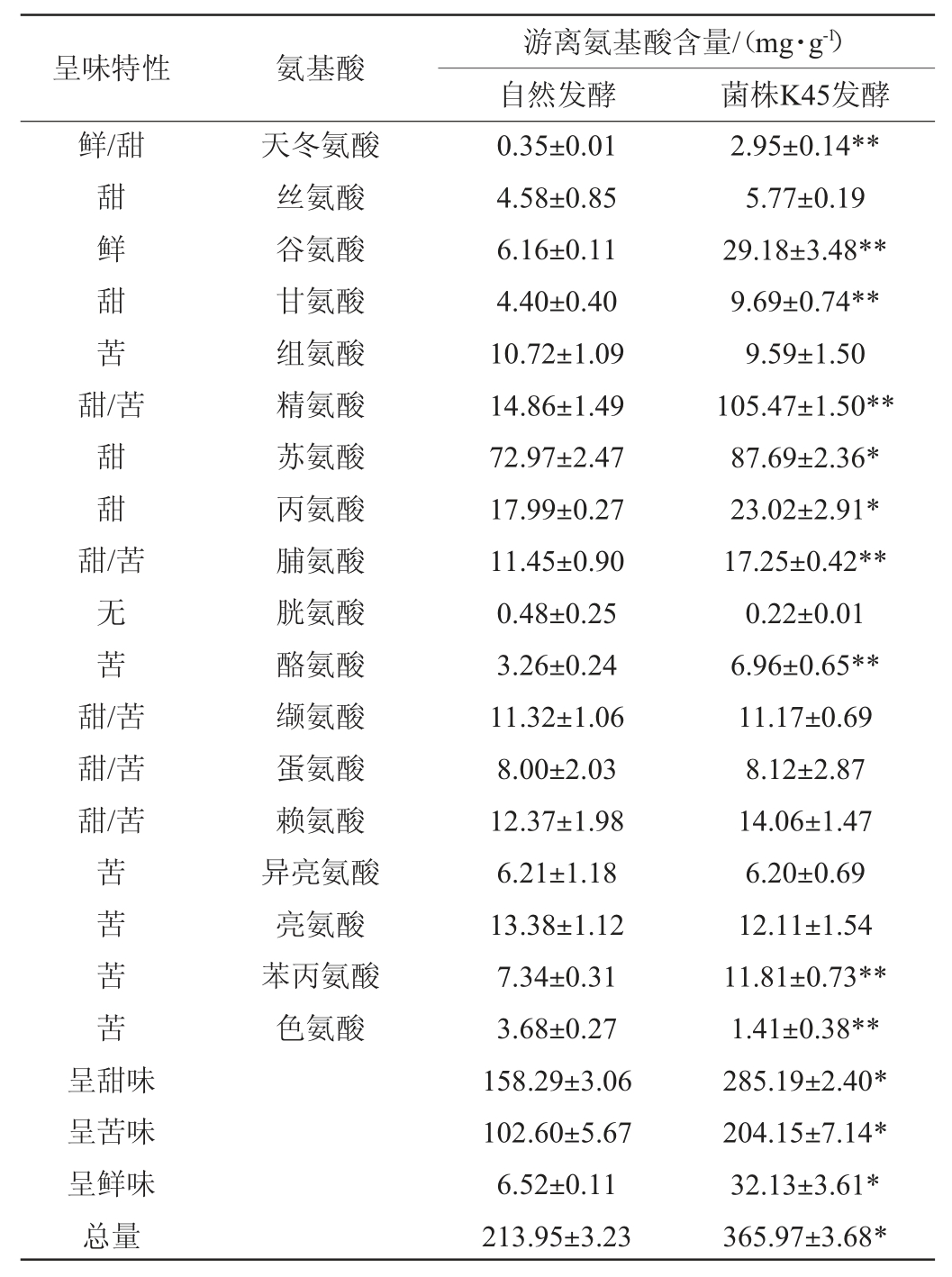
2.4 游离氨基酸结果分析
对发酵肉中的游离氨基酸进行分析,发现菌株K45发酵组总游离氨基酸含量为(365.97±3.68)mg/100 g,显著高于自然发酵组(213.95±3.23)mg/100 g(P<0.05)。发酵期间微生物产生的蛋白水解酶对蛋白有分解作用[36],促进氨基酸及小肽产生,菌株K45具有蛋白水解酶活性,促进了游离氨基酸的产生[11],促进发酵肉风味形成,且提升了发酵肉的营养价值。
由表5可以看出,经菌株K45发酵后,肉中的鲜、甜、苦味氨基酸含量均显著升高(P<0.05),其中,含量最高的是精氨酸、苏氨酸,其次是谷氨酸和丙氨酸,精氨酸与谷氨酸协同作用,产生令人愉快的整体味道。此外,精氨酸和赖氨酸能够将棕褐色的高铁肌红蛋白还原成亮红色的氧合肌红蛋白,从而改善香肠色泽[37]。鲜味氨基酸天冬氨酸和谷氨酸极显著升高(P<0.01),且谷氨酸的含量高于天冬氨酸。呈苦味的色氨酸含量在菌株K45发酵组中呈极显著降低(P<0.01)。呈甜味的苏氨酸和丙氨酸含量在菌株K45发酵组显著升高(P<0.05),天冬氨酸(鲜/甜)、谷氨酸(鲜味),甘氨酸(甜味),精氨酸(甜/苦)、脯氨酸(甜/苦)、酪氨酸(苦味)及苯丙氨酸(苦味)的含量极显著高于自然发酵组(P<0.01)。综上,说明菌株K45可促进呈味氨基酸的释放,影响发酵肉的风味和口感。氨基酸除本身呈味外,部分还可作为风味化合物的前体,进一步转化成更多的挥发性风味成分,从而增强发酵肉的风味。
表5 自然发酵肉和菌株K45发酵肉中游离氨基酸含量测定结果
Table 5 Determination results of free amino acid contents in naturally fermented meat and strain K45 fermented meat
注:“*”表示差异显著(P<0.05);“**”表示差异极显著(P<0.01)。
2.5 特征性气味物质和呈味氨基酸分析
将检测出的挥发性风味物质和游离氨基酸绘制火山图,以物质含量的倍数变化(fold change,FC)的对数为横坐标;以P值的对数为纵坐标,分析样品中差异性气味和滋味物质,结果见图2。以P<0.05且|FC|≥2为标准,筛选特征性滋、气味物质。当物质落在P<0.05且FC≥2区域时,表示该物质含量显著增加;当物质落在P<0.05且FC≤-2区域时,表示该物质含量显著减少[34]。
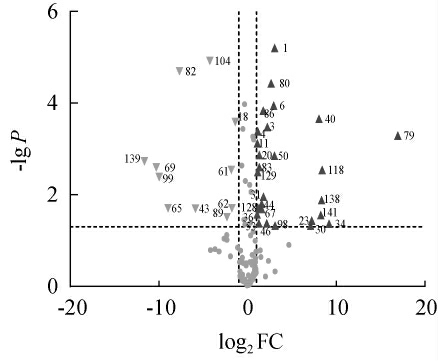
图2 自然发酵肉和菌株K45气味和滋味物质火山图
Fig.2 Volcano plot of odor and taste substances of naturally fermented meat and strain K45 fermented meat
P<0.05且FC≥|2|的物质:1.天冬氨酸3.谷氨酸4.甘氨酸6.精氨酸11.酪氨酸18.色氨酸20.乙醛23.9-十八烯酸乙酯30.领苯二甲酸二甲酯31.3-甲基丁醛34.2,4-二叔丁基苯酚36.双乙酰40.亚油酸乙酯43.丙醇44.2-甲基丁酸乙酯46.3-甲基丁酸乙酯50.异丁醇53.邻苯二甲酸二异丁酯61.2-甲基丁醇62.3-甲基丁醇63.癸酸乙酯65.3-甲基-3-丁烯-1-醇67.乙偶姻69.癸酸79.乳酸乙酯80.2,3-二甲基吡嗪82.3-乙酰基-2-丁酮83.2-乙基-6-甲基吡嗪86.三甲基吡嗪89.3-乙基-2,5-二甲基吡嗪98.2,5-二甲基吡嗪99.壬酸乙酯104.2-异丁基-3,5,6-三甲基吡嗪118.萘128.苯甲醇129.2,2,4-三甲基-1,3-戊二醇二异丁酸酯138.雪松醇139.2-哌啶酮141.苯甲酸-2-乙基己酯。
如图2所示,红色正三角表示的物质为菌株K45发酵后显著增加的物质,绿色倒三角表示菌株K45发酵后显著减少的物质。样品中共检测出136种挥发性风味物质和18种游离氨基酸。由图2可知,含量显著增加的物质有27种,其中风味物质22种,游离氨基酸5种;含量显著下降的物质有21种,其中风味物质19种,游离氨基酸2种。
结合ROAV分析结果,发现双乙酰、三甲基吡嗪、2,5-二甲基吡嗪、3-甲基丁醛、2,3-二甲基吡嗪、2-甲基丁酸乙酯和萘在菌株K45发酵组含量显著增加,同时这些物质的ROAV>1,说明这7种挥发性风味化合物是菌株K45发酵肉的特征性关键风味物质。葡萄球菌通过代谢糖类产生双乙酰,酯化产生2-甲基丁酸乙酯[13]。3-甲基丁醛对发酵香肠的香气有重要贡献[38],主要由微生物代谢支链氨基酸(亮氨酸、异亮氨酸、缬氨酸)产生[39]。据报道,凝固酶阴性球菌肉葡萄球菌(S.carnosus)、木糖葡萄球菌(S.xylosus)均能代谢亮氨酸产生3-甲基丁醛[40-41];STAHNKE L H[42]用木糖葡萄球菌和肉葡萄球菌接种发酵香肠,发现微生物通过分解亮氨酸、异亮氨酸、缬氨酸和苯丙氨酸,产生3-甲基丁醛。嗜根考克氏菌产生特征风味物质的机制有待进一步研究。
菌株K45发酵组天冬氨酸、谷氨酸、甘氨酸、精氨酸和酪氨酸含量极显著升高(P<0.01),且FC≥|2|,对发酵肉滋味特征有重要影响。天冬氨酸和谷氨酸呈鲜味,谷氨酸本身有酸味,但和钠盐并存时可提供强烈的鲜味,具有形成肉鲜味和缓冲咸与酸味的功效[17]。氨基酸的组成与小肽的滋味密切相关,当肽链末端连有精氨酸时,精氨酸易与甘氨酸形成氢键,促使此处肽键断裂,形成环状化合物,并促进含硫化合物和肉香味化合物的生成[43]。
3 结论
本实验考察嗜根考克氏菌对发酵肉色泽及风味的影响。接种嗜根考克氏菌K45发酵肉,能显著提升发酵肉的红度a*值(P<0.05);显著增加发酵肉挥发性风味化合物种类及游离氨基酸含量(P<0.05)。通过火山图分析,并结合ROAV值,发现双乙酰、三甲基吡嗪、2,5-二甲基吡嗪、3-甲基丁醛、2,3-二甲基吡嗪、2-甲基丁酸乙酯和萘是菌株K45发酵肉的特征性关键风味物质,提供脂肪味、水果味、肉味、酸味和烤香味等,丰富了发酵肉的风味。特征呈味氨基酸为天冬氨酸、谷氨酸、甘氨酸、精氨酸和酪氨酸,增加了发酵肉的鲜甜味。综上,接种菌株K45发酵可改善发酵肉制品的色泽和整体风味。考克氏菌K45具有可开发为肉制品发酵剂的潜质,为肉制品新型发酵剂的研制提供一定的理论依据。
[1]李珊珊,祝超智,崔文明,等.发酵肉制品中微生物发酵剂分离筛选及应用研究进展[J].肉类研究,2019,33(7):61-66.
[2]HU M Z,YU J S,YU J P,et al.Isolation and screening of Staphylococcus xylosus p2 from Chinese bacon:a novel starter culture in fermented meat products[J].Int J Food Eng,2019,15(1-2):1-7.
[3] TALON R,LEROY S,LEBERT I.Microbial ecosystems of traditional fermented meat products:The importance of indigenous starters[J].Meat Sci,2007,77(1):55-62.
[4]AQUILANTI L,GAROFALO C,OSIMANI A,et al.Ecology of lactic acid bacteria and coagulase negative cocci in fermented dry sausages manufactured in Italy and other Mediterranean countries:an overview[J].Int Food Res J,2016,23(2),429-445.
[5]MARTÍN A,COLÍN B,ARANDA E,et al.Characterization of micrococcaceae isolated from Iberian dry-cured sausages[J].Meat Sci,2007,75(4):696-708.
[6]邓展瑞,贠建民,郭娟,等.陇西腊肉加工过程中优势乳酸菌的分离及其发酵性能研究[J].生物技术进展,2019,9(2):200-209.
[7]张大磊,吴兰芳,程伟伟,等.添加葡萄球菌和微球菌对广式腊肠亚硝酸盐残留量和色泽研究[J].现代食品科技,2015,31(7):258-264.
[8]TREMONTE P,SUCCI M,REALE A,et al.Interactions between strains of Staphylococcus xylosus and Kocuria varians isolated from fermented meats[J].J Appl Microbiol,2007,103(3):743-751.
[9] RAGHUPATHI P K,HERSCHEND J,RØDER H L,et al.Genome sequence of Kocuria varians G6 isolated from a slaughterhouse in Denmark[J].Genome Announcement,2016,4(2):e00076-16.
[10]IACUMIN L,OSUALDINI M,BOVOLENTA S,et al.Microbial,chemicophysical and volatile aromatic compounds characterization of Pitina PGI,a peculiar sausage-like product of North East Italy[J].Meat Sci,2020,163:108081.
[11]SHI Q,WANG X R,JU Z J,et al.Technological and safety characterization of Kocuria rhizophila isolates from traditional ethnic dry-cured ham of Nuodeng,Southwest China[J].Front Microbiol,2021,12,761019.
[12]王娜,盛雅萍,徐君强,等.不同熟制方式对发酵牛肉干品质的影响[J].食品工业,2017(6):115-118.
[13]周慧敏,张顺亮,赵冰,等.木糖葡萄球菌和肉葡萄球菌混合发酵剂对腊肉品质的影响[J].食品科学,2018,39(22):32-38.
[14] KITTISAKULNAM S,SAETAE D,SUNTORNSUK W.Antioxidant and antibacterial activities of spices traditionally used in fermented meat products[J].J Food Process Preservat,2017,41(4):e13004.
[15] XIAO Y Q,LIU Y N,CHEN C G,et al.Effect of Lactobacillus plantarum and Staphylococcus xylosus on flavour development and bacterial communities in Chinese dry fermented sausages[J].Food Res Int,2020,135:109247.
[16]刘登勇,周光宏,徐幸莲.确定食品关键风味化合物的一种新方法:“ROA”法[J].食品科学,2008,29(7):370-374.
[17]刘毕琴,王馨蕊,赵文华,等.不同来源和年份诺邓火腿的理化和呈味性质[J].肉类研究,2021,35(8):1-8.
[18]王恺,慕妮,李亮,等.不同发酵剂对发酵香肠挥发性风味物质的影响[J].食品工业科技,2013,34(14):177-181,196.
[19]曹辰辰,冯美琴,孙健,等.功能性发酵剂对发酵香肠氧化稳定性及挥发性风味物质的影响[J].食品科学,2019,40(20):8.
[20]MOTTRAM D S.Flavour formation in meat and meat products:a review[J].Food Chem,1998,62(4):415-424.
[21]张琦梦,顾华蓉,穆洪涛,等.基于GC-MS分析传统鱼露发酵过程中挥发性风味物质变化[J].中国酿造,2022,41(9):242-251.
[22]于海,李想,葛庆丰,等.不同微生物菌株对干腌肉块挥发性风味化合物的影响[J].食品科学,2010,31(21):266-270.
[23]ELMORE J S,MOTTRAM D S,ENSER M,et al.Effect of the polyunsaturated fatty acid composition of beef muscle on the profile of aroma volatiles[J].J Agr Food Chem,1999,47(4):1619-1625.
[24]张左勇.基于豆粕美拉德反应的牛肉特征风味形成调控及应用研究[D].合肥:合肥工业大学,2022.
[25]POEHLMANN S,SCHIEBERLE P.Characterization of the aroma signature of styrian pumpkin seed oil(Cucurbita pepo subsp.pepo var.Styriaca)by molecular sensory science[J].J Agr Food Chem,2013,61(12):2933-2942.
[26]李贝贝.重庆牛油火锅底料风味和品质优化初探[D].重庆:西南大学,2021.
[27]张怀志.重要风味化合物2-乙基-3,5/3,6-二甲基吡嗪的微生物合成途径解析[D].无锡:江南大学,2020.
[28]里奥·范海默特.化合物香味阈值汇编[M].北京:科学出版社,2015:26-42.
[29]刘梦,陈松,张顺亮,等.微发酵对牛肉干风味的影响[J].食品科学,2021,42(14):232-239.
[30]王藤,施娅楠,李祥,等.SPME-GC-MS结合ROAV分析腌制时间对大河乌猪火腿挥发性风味物质的影响[J].食品工业科技,2021,42(18):317-324.
[31]毛永强,李彦虎,贠建民,等.传统陇西腊肉制作过程中挥发性风味物质变化分析[J].食品与发酵工业,2021,47(4):144-152.
[32]刘笑生,杨政茂,杜闪,等.金华火腿皮下脂肪中气味活性化合物研究[J].中国食品学报,2014,14(9):239-246.
[33]张旭,王卫,白婷,等.四川浅发酵香肠加工进程中挥发性风味物质测定及其主成分分析[J].现代食品科技,2020,36(10):274-283.
[34]黄苓,孙震,曾小群,等.多食材替代亚硝酸盐对腊肉挥发性风味的影响[J].中国食品学报,2021,21(3):324-333.
[35]冯美琴,张杰,孙健.模仿葡萄球菌接种对发酵香肠品质及氧化稳定性的影响[J].食品科学,2022,43(4):105-112.
[36]PASINI F,SOGLIA F,PETRACCI M,et al.Effect of fermentation with different lactic acid bacteria starter cultures on biogenic amine content and ripening patterns in dry fermented sausages[J].Nutrients,2018,10(10),1497.
[37] CHENG N,BAO P Q,ZHANG D J,et al.Reduction and coordination properties of l-Lysine/l-arginine/l-cysteine for the improvement of the color of cured sausage[J].Food Chem,2019,312:126122.
[38] JANSSENS M,MYTER N,DE VUYST L,et al.Species diversity and metabolic impact of the microbiota are low in spontaneously acidified Belgian sausages with an added starter culture of Staphylococcus carnosus[J].Food Microbiol,2012,29(2):167-177.
[39]SMIT B A,ENGELS W J M,SMIT G.Branched chain aldehydes:production and breakdown pathways and relevance for flavour in foods[J].Appl Microbiol Biotechn,2009,81(6):987-999.
[40] BECK H C,HANSEN A M,LAURITSEN F R.Metabolite production and kinetics of branched-chain aldehyde oxidation in Staphylococcus xylosus[J].Enzyme Microbial Technol,2002,31(1-2):94-101.
[41] MASSON F,HINRICHSEN L,TALON R,et al.Factors influencing leucine catabolism by a strain of Staphylococcus carnosus[J].Int J Food Microbiol,1999,49(3):173-178.
[42]STAHNKE L H.Technology Volatiles produced by Staphylococcus xylosus and Staphylococcus carnosus during growth in sausage minces part II.The influence of growth parameters[J].LWT-Food Sci Technol,1999,32(6):365-371.
[43]王然.基于肽的美拉德反应中关键肉香味化合物的形成机理研究[D].北京:北京工商大学,2012.