酸鱼是一种风味独特的传统发酵食品,是广西、贵州、湖南、四川等地少数民族的传统美食[1]。酸鱼发酵过程积累了大量微生物,主要是乳酸菌[2]。乳酸菌作为普遍存在于机体的益生菌,参与机体重要代谢活动,具有促进胃肠道蠕动、抗氧化能力[3-5]、抑制病原微生物活性[6]、降低胆固醇[7]、调节肠道菌群平衡[8]、激活机体细胞免疫[9]等功能。近年来,抗生素的滥用导致耐药基因在益生菌和致病菌之间水平传播,使得耐药性研究也从临床相关菌株扩展到食源性乳酸菌[10]。乳酸菌的耐药性对人体有两方面影响,有利的一面是在抗生素治疗期间可避免菌体被杀灭,另一方面,携带有耐药基因的乳酸菌进入体内可以成为耐药基因传播的中间宿主[11]。因此,食源性乳酸菌耐药性问题值得重视。研究表明,乳酸菌功能性食品的功效作用与其能否适应胃肠转运过程中低pH和高胆盐浓度的环境密切相关[12]。益生菌只有能够抵抗较低的酸性环境与较高浓度的胆盐才能使其在肠道中存活并正常发挥作用[13]。因此研究分离菌的耐酸耐胆盐能力是筛选益生菌的一个重要标志[14]。
食源性乳酸菌主要来源于发酵食品,蔡婷等[15]对四川泡菜发酵所用原料新鲜二荆条辣椒表面附着乳酸菌的耐药性与耐药基因进行研究发现,分离得到的菌株无红霉素耐药性,但部分菌株表现出四环素和链霉素耐药,tetB、tetC和strB基因的检出率最高;许女等[16]对山西老陈醋、农家泡菜和发酵乳制品中乳酸菌的抗生素耐药性和耐药基因进行了评估分析,结果发现,所分离乳酸菌对万古霉素、庆大霉素、卡那霉素、链霉素、四环素和替考拉宁的耐药性较强,携带最多的耐药基因是tetM和ermB。但目前对从酸鱼分离到的乳酸菌的耐药性与耐药基因的研究报道较少。
本研究以分离自酸鱼发酵后期的乳酸菌菌株LP224为研究对象,采用形态观察、生理生化试验及分子生物学技术对其进行菌种鉴定,并对其安全性、生长特性及耐受性进行研究,以期为筛选具有潜在应用价值的益生菌奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
乳酸菌菌株LP224:分离自广西南宁市隆安县当地农家自制酸鱼,保藏于本实验室;大肠杆菌(Escherichia coli)ATCC25922:广西壮族自治区兽医研究所。
1.1.2 试剂
MRS肉汤培养基、MRS琼脂培养基、牛胆盐:索莱宝生物科技有限公司;MH琼脂培养基、革兰氏染色液:北京陆桥技术股份有限公司;药敏纸片、细菌微量生化鉴定管:杭州滨和微生物试剂有限公司;细菌脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒:北京康为世纪生物科技有限公司;细菌质粒抽提试剂盒:南京诺维赞生物科技有限公司;DNA Ladder Marker、2×Taq Master Mix:日本TaKaRa公司;CaCO3(分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
JJ300电子天平:常熟市双杰测试仪器厂;BSA124S分析天平:德国赛多利斯集团;MSL-3020高压灭菌锅:日本SANYO公司;504G生物安全柜:美国Baker公司;Gel Doc XR+凝胶图像处理系统、T100梯度聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Bio-Rad公司;DYY-6C电泳仪:北京六一生物科技有限公司;TS-100C摇床:上海天呈实验仪器制造有限公司;NP80超微量紫外分光光度计:德国Implen公司;HH-2恒温水浴锅:江苏科析仪器有限公司;AG0025A smurf厌氧罐:美国GENE SCIENCE公司;ECLIPSE E200显微镜:日本Nikon公司;Starter 3100 pH计:美国奥豪斯仪器有限公司。
1.3 试验方法
1.3.1 乳酸菌菌株LP224的鉴定
形态观察及生理生化鉴定:取纯化的乳酸菌菌株LP224于载玻片用火焰固定,用革兰氏染液进行染色,镜检;参照《常见细菌系统鉴定手册》[17]与《乳酸细菌分类鉴定及实验方法》[18]进行糖酵解试验、硝酸盐还原试验、明胶液化试验、产H2S试验、过氧化氢酶试验等。
分子生物学鉴定:按细菌基因组DNA抽提试剂盒说明书提取DNA,以其为模板,采用16S rDNA通用引物F(5'-AGAGTTTGATCCATGGCTCAG-3')和R(5'-GTGTGACGGGCGGTGTGTAC-3')对菌株的16S rDNA基因序列进行PCR扩增[19]。PCR扩增体系:2×Taq酶12.5 μL、上下游引物各0.5 μL、双蒸水(ddH2O)10.5 μL、DNA模板1 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s、55 ℃退火45 s、72 ℃延伸1 min,30个循环;72 ℃再延伸5 min。PCR扩增产物经1%琼脂糖凝胶电泳检测后,将检测合格的PCR扩增产物委托华大基因有限公司进行测序。将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性搜索比对,选取同源性较高的模式菌株的16S rDNA序列,采用MEGA 5.0软件中的邻接法(neighbor-joining,NJ)构建系统发育树,确定其种属。
1.3.2 安全性评价
药物敏感性试验:选取氨苄西林、头孢氨苄、链霉素等9类31种抗菌药物,采用K-B纸片扩散法对分离菌株进行药敏试验[20]。取对数生长期的菌液,将菌体浓度调整为1×108CFU/mL,用无菌棉试子蘸取菌液均匀涂布于MH琼脂培养基,待菌液吸收完全后贴上抗生素纸片,每组重复3次,将平板置于37 ℃培养36 h后取出,采用游标卡尺测量抑菌圈直径(mm)。采用标准大肠杆菌(Escherichia coli)ATCC25922作为质控菌株,依据美国临床实验室标准化协会(clinical&laboratory standards institute,CLSI)微生物药物敏感试验执行标准判定结果。
耐药基因检测:分别以菌株LP224的基因组DNA和质粒作为模板,PCR扩增四环素类基因(tetA、tetB、tetC、tetD、tetM、tetG、tetO、tetE、CatI)、大环内脂类基因(ermA、ermB、ermC、msrA、mefA)、氨基糖苷类基因(Aph3、aadB、aph(3)-Iia、aac(3)-Iia)、β-内酰胺类基因(mecA、femA、AcrA、AcrB、norA)、磺胺类基因(Sul Ⅰ、Sul Ⅱ、Sul Ⅲ)、氟喹诺酮类基因(grlA、parC、GyrA)、氯霉素类基因(CmlA、floR)共7类31个耐药基因,PCR引物、扩增体系和条件参考文献[19],PCR扩增产物经2%琼脂糖凝胶电泳检测后判定结果。
1.3.3 生长特性试验
取-80 ℃保存的菌种溶解,灼烧接种环待冷却后,蘸取少量菌液采用三区划线的方法接种于MRS琼脂培养基,37 ℃培养48 h后,挑取单个菌落接种于MRS肉汤培养基,37 ℃、200 r/min条件下培养16 h。
取活化好的菌液,按1%(V/V)的接种量接种于装有100 mL MRS肉汤培养基的锥形瓶中,置于37 ℃、200 r/min条件下培养,分别于0、0.5 h、1 h、1.5 h、2 h、2.5 h、3 h、4 h、5 h、6 h、8 h、10 h、12 h、14 h、16 h、18 h、24 h取样,测定波长600 nm处的吸光度值,每组设置3个重复,绘制生长曲线。
1.3.4 耐受性分析
耐热性试验:将活化好的菌液,按1%(V/V)的接种量接种于装有100 mL MRS肉汤培养基的锥形瓶中,分别置于28 ℃、37 ℃(对照组)、45 ℃、55 ℃、60 ℃的水浴锅处理30 min,处理完毕后置于37 ℃、200 r/min条件下培养16 h,测定波长600 nm处的吸光度值(OD600nm值),并计算存活率,其计算公式如下:
耐酸性试验:参考文献[14],将活化好的菌液按1%(V/V)接种量接种于pH值分别为2.5、3.5、4.5的MRS肉汤培养基。以自然pH组(pH 6.2±0.2)作为对照组,置于37 ℃、200 r/min条件下培养16 h,测定OD600nm值,并计算存活率。
耐胆盐试验:参考文献[14],将活化好的菌液按1%(V/V)接种量接种于胆盐含量分别为0.03%、0.3%、0.6%的MRS肉汤培养基,以不含胆盐组作为对照组,37 ℃、200 r/min条件下培养16 h,测定OD600nm值,并计算存活率。
1.3.5 数据处理及分析
每个试验重复3次,试验结果用“平均值±标准差”表示,运用GraphPad Prism 6.0对试验数据进行统计分析并处理。
2 结果与分析
2.1 乳酸菌菌株LP224的鉴定
2.1.1 形态特征及染色结果
乳酸菌菌株LP224在MRS琼脂培养基上的菌落及细胞形态见图1。由图1a可知,菌株LP224的菌落呈圆形、乳白色,菌落直径为0.28 cm,表面光滑、湿润、有光泽,边缘整齐。由图1b可知,通过革兰氏染色镜检观察到菌体形态一致,均呈紫色,短小杆状,为革兰氏阳性杆菌。
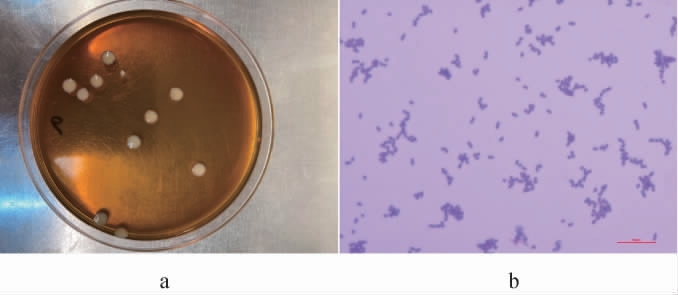
图1 乳酸菌菌株LP224的菌落(a)及细胞(b)形态
Fig.1 Colony (a) and cell (b) morphology of lactic acid bacterium strain LP224
2.1.2 生理生化鉴定结果
乳酸菌菌株LP224的生理生化鉴定结果见表1。由表1可知,菌株LP224的硝酸盐还原试验、明胶液化试验、产H2S试验及过氧化氢酶试验结果均为阴性,能分解葡萄糖、蔗糖、麦芽糖、果糖等,不能分解鼠李糖。根据《常见细菌系统鉴定手册》[17]与《乳酸细菌分类鉴定及实验方法》[18]初步鉴定该菌株为乳杆菌属(Lactobacillus sp.)。
表1 乳酸菌菌株LP224的生理生化试验结果
Table 1 Physiological and biochemical test results of lactic acid bacterium strain LP224

注:“+”表示结果呈阳性;“-”表示结果呈阴性。
2.1.3 分子生物学鉴定
将菌株16S rDNA测序结果与GenBank数据库进行同源性比对,采用Mega5.0软件的邻接法构建系统发育树,结果见图2。由图2可知,菌株LP224与已报道的植物乳杆菌(Lactobacillus plantarum)HBUAS58298(GenBank登录号:ON204551.1)和植物乳杆菌(Lactobacillus plantarum)FM02(GenBank登录号:MG913360.1)聚于一支,亲缘关系最近,相似度为100%,结合菌落、细胞形态和生化鉴定结果,将菌株LP224最终鉴定为植物乳杆菌(Lactobacillus plantarum)。

图2 基于16S rDNA基因序列菌株LP224的系统发育树
Fig.2 Phylogenic tree of strain LP224 based on 16S rDNA gene sequences
2.2 植物乳杆菌LP224的安全性评价
2.2.1 药物敏感性试验
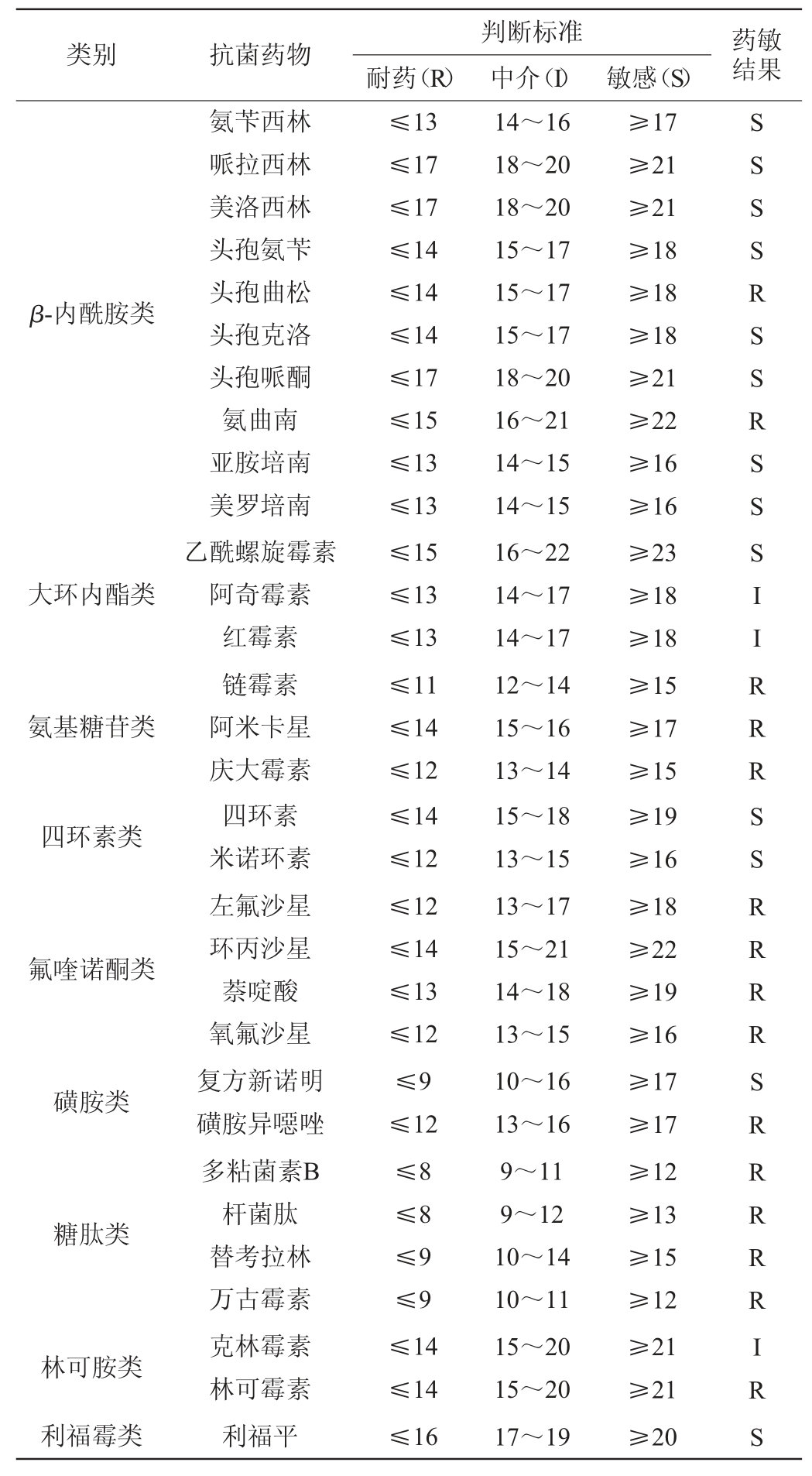
选用9大类31种抗生素药敏纸片对植物乳杆菌LP224的药物敏感性进行试验,结果见表2。
由表2可知,植物乳杆菌LP224存在多重耐药性,对四环素类、利福霉类抗生素敏感,对其他7类抗生素表现出不同程度耐药性,对绝大部分β-内酰胺类抗生素敏感,但对头孢曲松、氨曲南耐药;对所测试到的氨基糖苷类、糖肽类、氟喹诺酮类抗生素耐药;对乙酰螺旋霉素(大环内酯类)敏感,但对阿奇霉素、红霉素中介;对复方新诺明(磺胺类)敏感,磺胺异噁唑耐药;对林可胺类抗生素耐药或中介。
表2 植物乳杆菌LP224的药物敏感性试验结果
Table 2 Results of drug sensitivity tests of Lactobacillus plantarum LP224
2.2.2 耐药基因检测
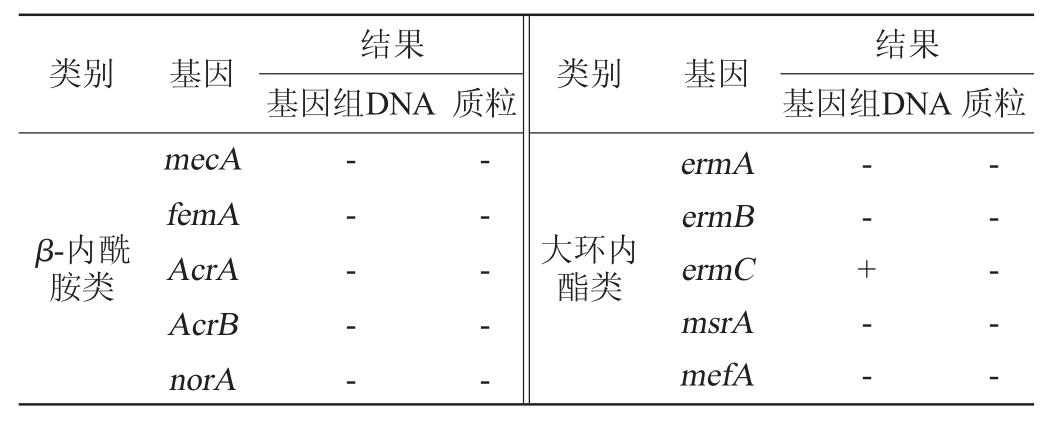
分别检测植物乳杆菌LP224基因组DNA和质粒的7大类31个耐药基因,结果见表3。
表3 植物乳杆菌LP224抗性基因检测结果
Table 3 Determination results of resistance gene of Lactobacillus plantarum LP224
续表
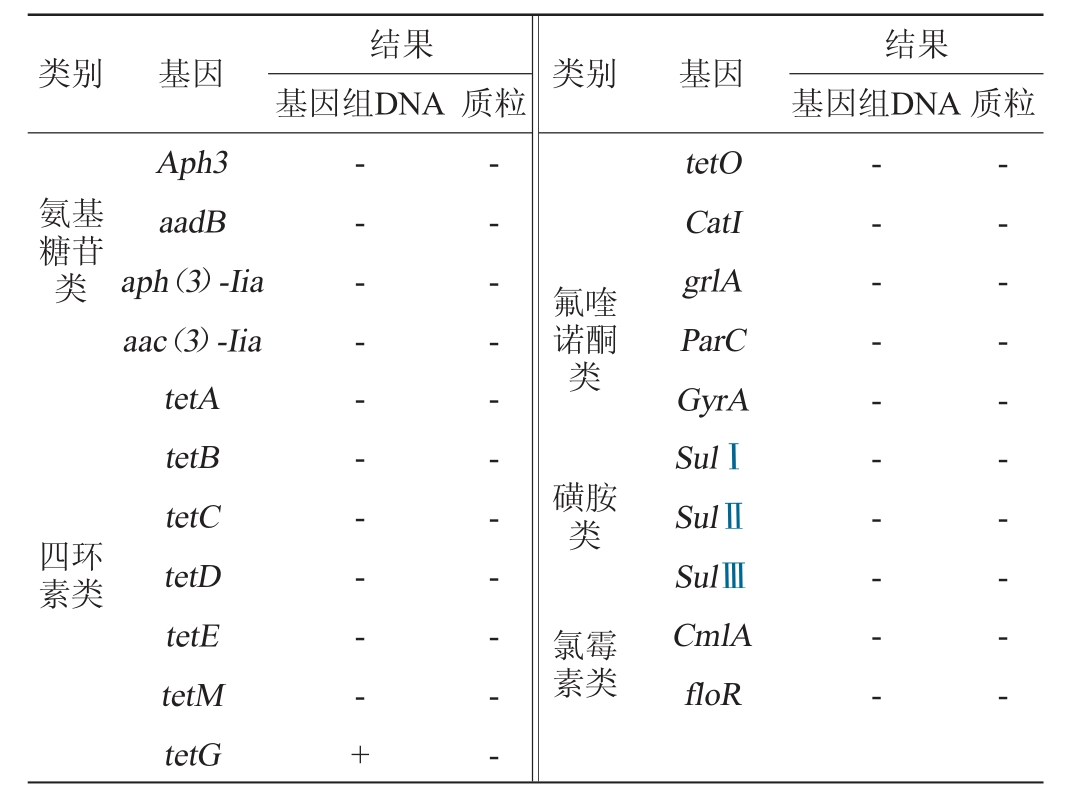
注:“+”表示结果呈阳性,“-”表示结果呈阴性。
由表3可知,在植物乳杆菌LP224的基因组DNA中检测到ermC(大环内酯类)和tetG(四环素类)2种耐药基因,其余29种耐药基因均未检出;而在植物乳杆菌LP224的质粒中31种耐药基因均未检出。植物乳杆菌LP224基因组DNA的耐药基因检出率为6.67%,而质粒的耐药基因检出率为0,说明该菌株相对安全。
2.3 植物乳杆菌LP224的生长特性
植物乳杆菌LP224的生长曲线见图3。由图3可知,植物乳杆菌LP224的生长曲线呈典型的S型,0~3 h为迟缓期,3 h后进入对数生长期,持续至12 h,12~18 h为稳定期,18 h后进入衰亡期。
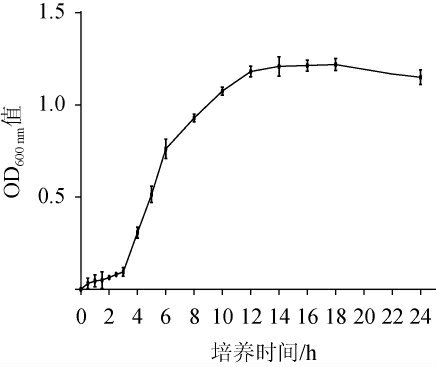
图3 植物乳杆菌LP224的生长曲线
Fig.3 Growth curve of Lactobacillus plantarum LP224
2.4 植物乳杆菌LP224的耐受性
2.4.1 耐热性试验
植物乳杆菌LP224的耐热性试验结果见图4。由图4可知,植物乳杆菌LP224随着培养温度的升高,OD600nm值呈下降的趋势。28 ℃、37 ℃均为菌株生长较适宜温度,28 ℃处理组菌株LP224的OD600nm值最高,为1.404±0.03;45 ℃处理后,菌株LP224生长略受影响,存活率下降9.27%;55 ℃处理后,菌株LP224生长明显受到抑制,存活率下降64.94%;60 ℃处理后菌株生长缓慢,存活率仅为24.55%。说明菌株对55 ℃以上的高温处理较为敏感,且具有一定高温耐受性。
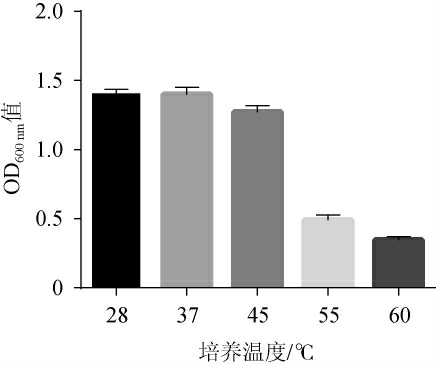
图4 植物乳杆菌LP224的耐热性试验结果
Fig.4 Results of heat tolerance tests of Lactobacillus plantarum LP224
2.4.2 耐酸性试验
植物乳杆菌LP224的耐酸性试验结果见图5。由图5可知,菌株LP224在培养基pH自然(pH6.2±0.2)条件下生长状况最佳,随pH值的降低,OD600nm值呈下降趋势。与对照组相比,在pH值为2.5、3.5、4.5的培养基中处理16 h后,存活率分别为52.60%、62.51%、90.58%。人体空腹时胃酸pH为1,进食后pH为4.5[21],益生菌进入肠道定植发挥作用的前提是要保证有一定数量的活菌能够耐受消化液的作用并存活下来,菌株LP224在pH 2.5条件下作用16 h后,存活率下降47.40%,说明菌株LP224对pH2.5的耐受性较好。
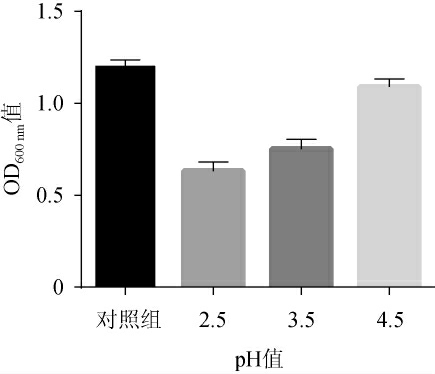
图5 植物乳杆菌LP224的耐酸性试验结果
Fig.5 Results of acid tolerance tests of Lactobacillus plantarum LP224
2.4.3 耐胆盐试验
植物乳杆菌LP224的耐胆盐试验结果见图6。由图6可知,随胆盐含量的升高,菌株LP224的OD600nm值呈下降趋势。与对照组相比,当胆盐含量分别为0.03%、0.3%、0.6%时,存活率分别为99.72%、31.67%、26.27%。人体小肠中胆盐含量一般在0.3%左右,食物在小肠中停留时间为1~4 h[12],本次分离菌株在0.6%的胆盐环境培养16 h后仍有一定的存活率,说明菌株有较好的耐胆盐能力。
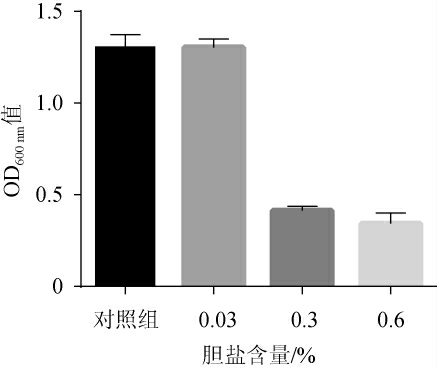
图6 植物乳杆菌LP224的耐胆盐试验结果
Fig.6 Results of bile salt tolerance tests of Lactobacillus plantarum LP224
3 讨论
本试验通过形态观察、革兰氏染色、生理生化试验和16S rDNA鉴定菌株LP224为植物乳杆菌(Lactobacillus plantarum),其对糖肽类、氨基糖苷类和氟喹诺酮类抗生素耐药,对四环素类、利福霉类抗生素敏感,对绝大多数β-内酰胺类抗生素敏感,对大环内酯类抗生素敏感或中介。大量研究表明,乳酸菌通常对抑制蛋白质合成的抗生素敏感,如氯霉素、红霉素、克林霉素和四环素,也对细胞壁合成抑制剂如β-内酰胺类抗生素敏感,但对大多数核酸抑制剂,如环丙沙星、诺氟沙星、左氟沙星等以及氨基糖苷类抗生素,如链霉素、卡那霉素、庆大霉素等具有耐药性[22]。在抑制细胞壁合成的抗生素中,几乎全部的干酪乳杆菌(Lactobacillus casei)和植物乳杆菌表现为万古霉素耐药[10]。HAMILTON-MILLERJMT等[23]也报道了德氏乳杆菌(Lactobacillus delbrueckii)和嗜酸乳杆菌(Lactobacillus acidophilus)对万古霉素有天然的抗性;郭凤茹等[24]对罗非鱼肠道乳酸菌抗生素药敏性的研究结果显示,戊糖乳杆菌(Lactobacillus pentosus)和植物乳杆菌(Lactobacillus plantarum)对卡那霉素、庆大霉素、万古霉素、环丙沙星、诺氟沙星和氧氟沙星等隶属于氨基糖苷类、糖肽类和氟喹诺酮类抗生素耐药,对四环素类抗生素敏感,表现多重耐药性,与本次试验结果基本一致。杨泽敏等[25]从鲤鱼肠道内容物分离获得一株植物乳杆菌,与本研究结果不同的是,菌株YY001对红霉素、克林霉素敏感,对庆大霉素表现为中度耐药,这表明菌株对抗生素的耐药情况可能和来源及其载体的生长环境与用药相关,从侧面反映出细菌耐药机理的复杂性。
结合药敏试验结果和耐药基因检测结果来看,植物乳杆菌LP224出现了耐药基因型和菌株的抗生素抗性表型不一致的情况。GAO P等[26]对抗生素抗性的表型和基因型分析发现,氟喹诺酮类、氨基糖苷类、大环内酯类耐药菌株中既存在只有抗性基因的菌株,也存在只有抗性表型性的菌株。本次试验在基因型上检测到tetG,但该菌株对四环素无抗性;药敏试验结果显示,植物乳杆菌LP224对环丙沙星和阿米卡星耐药,但在基因型上未检测到氟喹诺酮(grlA、parC、gyrA)和氨基糖苷类(Aph3、aadB、aph(3)-Iia、aac(3)-Iia)耐药基因,可能是该菌株携带耐药基因但不表达或是表达量低未能检测到其表达,又或者是还存在其他氟喹诺酮类和氨基糖苷类耐药基因本次试验并未对其研究。
马春艳等[27]综述了乳酸菌对氟喹诺酮类药物的耐药机制,主要有3个方面:一是药物作用靶位点的突变;二是外排泵系统借助于跨膜转运使药物排出胞外;三是质粒的介导。张刚等[28]综述了细菌固有耐药与获得性耐药的进化关系,并提示一些获得性耐药基因可能起源于固有耐药基因。细菌中的质粒、插入序列、转座子、原噬菌体和基因组岛等可移动遗传元件序列组成了可移动基因组,会帮助耐药基因在细菌中横向传播[29]。ZHANG H M等[30]研究认为,乳酸菌对红霉素、万古霉素和链霉素的耐药性是由于乳酸菌合成生物膜导致的,本次分离的植物乳杆菌LP224对氨基糖苷类、糖肽类以及氟喹诺酮类抗生素的耐药性是否与生物膜的形成有关,还需进一步研究。
植物乳杆菌LP224在pH 2.5的培养基及胆盐含量为0.3%的培养基培养16 h后,存活率分别为52.60%、31.67%,其耐酸、耐胆盐能力优于曲勤凤等[14]从臭豆腐、臭腐乳中分离到的植物乳杆菌和嗜酸乳杆菌。
4 结论
本研究以分离自酸鱼发酵后期的乳酸菌菌株LP224为研究对象,经形态观察、生理生化试验及分子生物技术鉴定其为植物乳杆菌(Lactobacillus plantarum),其对头孢曲松、链霉素、环丙沙星、磺胺异噁唑、万古霉素、林可霉素等6类15种抗生素耐药,基因组DNA检测出ermC和tetG 2种抗性基因,而细菌质粒未检测到耐药基因,说明该菌株相对安全。菌株LP224经55 ℃水浴处理30 min后存活率为35.06%;pH2.5环境下存活率为52.60%;0.3%胆盐浓度下存活率为31.67%。说明该菌株具有较强的耐热、耐酸、耐胆盐能力,可作为益生菌候选菌株作进一步的功能性研究。
[1]李河山.腌酸鱼的制作方法[J].农村百事通,2020(2):44.
[2]车科,麻成金,黄群,等.湘西传统酸肉乳酸菌分离、筛选及鉴定[J].中国酿造,2008,27(11):25-28.
[3]冯美琴,栾晓旭,孙健.3株发酵香肠源乳酸菌体外功能特性的比较[J].食品科学,2020,41(24):39-45.
[4]胡姝敏,刘宝华,孙欣瑶,等.植物乳杆菌和干酪乳杆菌的抗氧化活性研究[J].中国乳品工业,2018,46(5):4-8.
[5]吕青遥,雷霜江,包善思,等.基于基因分析的产胞外多糖乳酸菌的筛选及其体外抗氧化研究[J].中国乳品工业,2022,50(3):8-13.
[6]孙艳,冯晓微,刘佳玮,等.健康奶牛生殖道乳酸菌的分离鉴定及其抑菌活性研究[J].中国畜牧兽医,2022,49(5):1852-1859.
[7]肖琳琳,董明盛.干酪乳杆菌KM-16的筛选及其降胆固醇活性研究[J].中国乳品工业,2003,31(6):7-10.
[8]崔燕丽,徐晓芬,吴正钧,等.乳酸菌胞外多糖对人类肠道菌群的影响[J].中国微生态学杂志,2016,28(7):851-856.
[9] REN C C,CHENG L H,SUN Y,et al.Lactic acid bacteria secrete toll like receptor 2 stimulating and macrophage immunomodulating bioactive factors[J].J Funct Foods,2020,66(C):103783-103783.
[10]王炜哲,翟征远,郝彦玲.市售酸奶中发酵剂乳酸菌的耐药性及耐药基因研究进展[J].中国乳品工业,2022,50(2):34-37.
[11]张宏梅,黄绍松,周汉基,等.酸奶中乳酸菌对2种抗生素耐药性分析[J].中国公共卫生,2010,26(4):511-512.
[12]王祎然,韦明明,张涵,等.酸汤中乳酸菌的鉴定及其耐酸、耐胆盐和抗氧化活性[J].食品工业科技,2020,41(16):121-126,139.
[13]辛国芹,汪祥燕,曹斌,等.一株产酸凝结芽孢杆菌的筛选及耐受特性研究[J].中国酿造,2022,41(4):111-115.
[14]曲勤凤,俞漪,徐琼,等.臭味发酵食品中益生菌分离鉴定及功能性研究[J].食品安全质量检测学报,2020,11(3):792-798.
[15]蔡婷,徐顾榕,林凯,等.发酵用鲜辣椒中乳酸菌抗生素耐药性与耐药基因[J].食品与生物技术学报,2016,35(9):941-949.
[16]许女,李雅茹,王超宇,等.传统发酵食品中乳酸菌的抗生素耐药性评估及耐药基因分析[J].中国食品学报,2020,20(7):160-171.
[17]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:289-294.
[18]凌代文.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:117-128.
[19]曾文婷.广西源益生菌的筛选及功能活性鉴定[D].南宁:广西大学,2021.
[20]张在,郑瑞程,方庆励,等.广西猪源益生菌的分离鉴定与生物学特性研究[J].中国畜牧兽医,2020,47(6):1921-1933.
[21] QI H,KONG B H,CHEN Q,et al. In vitro comparison of probiotic properties of lactic acid bacteria isolated from Harbin dry sausages and selected probiotics[J].J Funct Foods,2017,32:391-400.
[22]党乔,孔令聪,刘洁,等.泡菜发酵乳酸菌的分离鉴定及耐药性分析[J].食品科学,2019,40(20):166-170.
[23] HAMILTON-MILLER J M T,SHAH S.Vancomycin susceptibility as an aid to the identification of the Lactobacilli[J].Lett Appl Microbiol,1998,26(2):153-154.
[24]郭凤茹,刘元雪,施文正,等.罗非鱼肠道乳酸菌对抗生素的药敏性[J].中国食品学报,2020,20(6):287-294.
[25]杨泽敏,李双,金正雨,等.1株鲤鱼源植物乳杆菌的分离鉴定及其生物学特性分析[J].中国畜牧兽医,2022,49(7):2805-2811.
[26]GAO P,MAO D Q,LUO Y,et al.Occurrence of sulfonamide and tetracycline-resistant bacteria and resistance genes in aquaculture environment[J].Water Res,2012,46(7):2355-2364.
[27]马春艳,李少英,宋晓敏,等.益生乳酸菌对氟喹诺酮类药物耐药机制的研究进展[J].中国酿造,2014,33(5):1-4.
[28]张刚,冯婕.细菌固有耐药的研究进展[J].遗传,2016,38(10):872-880.
[29] LI J,TI C,DENG Z X,et al.VRprofile: gene-cluster-detection-based profiling of virulence and antibiotic resistance traits encoded within genome sequences of pathogenic bacteria[J].Briefings Bioinformatics,2018,19(4):566-574.
[30]ZHANG H M,XIE L S,ZHANG W Y,et al.The association of biofilm formation with antibiotic resistance in lactic acid bacteria from fermented foods[J].J Food Safety,2013(3):114-120.