中国黄酒酿造历史悠久,黄酒以糯米、小米、黍米等为主要原料,并以酒药、麦曲、红曲等作为糖化发酵剂酿造而成的发酵酒。黄酒多数在开放的自然环境生产,尤其是传统酒曲的制作,富集了当地环境中大量微生物,其在黄酒酿造过程中的代谢物为黄酒提供了多样的风味。酯、醇、酸、酚、氨基酸和有机酸等作为黄酒主要风味成分[1],其形成与酿酒酵母属、曲霉属、糖多孢菌属、乳杆菌属、乳球菌属、肠杆菌属、明串珠菌属和假丝酵母属等微生物密切相关[2-3]。
黄酒在我国主要由南北两派组成,北代南绍体现了南北方黄酒的特色。代县黄酒作为我国北方黄酒的代表之一,迄今已有3 000年历史。“金波沉醉雁门州,端有人间六月秋”是最早记录代州黄酒的诗句。代县黄酒是以黍米为主要原料,通过传统工艺酿造的老黄酒。其独特的原料和生产工艺是代县黄酒特色。代县黄酒中营养成分丰富,酒精度低,但也对储存过程中安全控制提出了更高的要求。
黄酒腐败通常是由于在生产或储存过程中被杂菌污染,从而引起黄酒发生理化性质的改变,使黄酒失去原有的营养价值以及风味。腐败现象通常由细菌和霉菌引起的最为常见[4]。黄酒中含糖量较高,营养丰富,是腐败微生物良好的培养基,因此黄酒在储存过程中时有腐败问题,造成风味劣变。关于酒精饮料因腐败造成风味劣变的研究中,刘文容等[5]研究认为耐酸乳杆菌是黄酒腐败的最主要细菌。章志超等[6]通过传统培养发现食果糖乳杆菌是导致黄酒腐败的关键腐败菌,可导致黄酒变浑浊,产生异味。腐败过程中,一些微生物大量繁殖,代谢产生具有异味的挥发性化合物、酸和生物胺等[7-8]。目前研究者们对于黄酒酿造过程中的微生物菌群分析以及风味相关性研究,取得了一定的进展[9-10],然而,对于黄酒腐败过程中的腐败微生物与挥发性化风味化合物关系研究还比较少见。
本研究通过扩增子分析和顶空固相微萃取结合气相色谱质谱联用(head space solid phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)技术对山西代县所产的正常黄酒及腐败黄酒中的细菌群落和风味物质变化进行分析,并进行感官分析,旨在阐明造成黄酒腐败变质的关键微生物,以及其与关键风味化合物之间的关系,为提升黄酒产品质量控制水平提供依据。
1 材料与方法
1.1 材料与试剂
腐败黄酒1号(a1)、腐败黄酒2号(a2)、正常黄酒(a3)(酒精度≥13%vol):由山西晋臻黄酒有限公司提供,两种腐败黄酒均为室温下发生不同程度腐败样品;4-辛醇(纯度99.95%):北京百灵威科技有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
HP-WAX弹性石英纤维毛细管柱(30 m×0.25 mm,0.25 μm):美国Agilent公司;固相微萃取手柄:上海安谱科学仪器有限公司;固相微萃取纤维头(50/30 μm DVB/CAR/PDMS):美国Supelco公司;Trace 1300 ISQ气相色谱-质谱联用仪:赛默飞世尔科技(中国)有限公司。
1.3 方法
1.3.1 黄酒中挥发性风味物质的测定
样品前处理[11]:根据文献方法调整后,取5.0 mL混匀样品于20 mL顶空瓶内,添加2.0 g NaCl,加入1 000 mg/L内标4-辛醇5.0 μL,内标最终质量浓度为1.0 mg/L,旋紧样品瓶。萃取头在250 ℃下老化30 min后插入样品瓶,40 ℃平衡30 min,萃取40 min,将萃取头在GC进样口250 ℃下解吸3 min。
气相色谱条件[7]:色谱柱为HP-WAX弹性石英纤维毛细管柱(30 m×0.25 mm,0.25 μm);升温程序:40 ℃保持3 min,以4 ℃/min升至150 ℃,保持3 min,9 ℃/min升至240 ℃,保持9 min;载气为高纯氦气(He)(99.999%),流速0.80 mL/min,不分流进样。
质谱条件:电子轰击离子源;电子轰击能量70 eV;传输线温度230 ℃;四极杆温度150 ℃;离子源温度230 ℃;质量扫描范围35~600 m/z。
1.3.2 黄酒中细菌菌群多样性的分析
利用土壤脱氧核糖核酸(deoxyribonucleic acid,DNA)试剂盒从黄酒中抽提微生物DNA。完成基因组DNA抽提后,利用1%琼脂糖凝胶电泳检测基因组DNA质量和纯度。通过聚合酶链式反应(polymerase chain reaction,PCR)扩增细菌的16S rRNA基因的V3~V4高变区。引物为338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')[9]。PCR扩增产物进行纯化、建库。检测合格的文库根据插入片段大小,选择HiSeq平台进行测序。
下机数据过滤,将剩余的高质量Clean data用作后期分析;利用reads之间的overlap关系将reads拼接成Tags,通过FLASH(fast length adjustment of short reads)(v1.2.11)将数据合并[12]。利用软件USEARCH(v7.0.1090)[13]以97%相似性将拼接好的Tags聚类为操作分类单元(operational taxonomic units,OTU)进行物种注释。在聚类过程中去除嵌合体[14]。使用usearch_global[15]方法将所有Tags比对回OTU代表序列,得到每个样品的OTU丰度统计表。采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析。
1.3.3 黄酒感官品评方法
由12名专业感官品评人员组成感官评价小组,在评价前均接受了3周的香气区分训练后,分别对3种酒样进行感官评价[16]。将黄酒分别倒入50 mL的标准品酒杯中,由感官评价人员先对3种黄酒进行气味评分,再进行品尝,每品尝一个样品后进行漱口。评价人员按品评表对相应味道进行打分,打分范围为0~9分。打分规则为0分:没有味道;1~3分:香气及味道不明显,强度较弱;3~5分:香气及味道较明显,强度中等;5~7分:香气及味道明显,强度较强;7~9分:香气及味道非常突出,强度极强[17]。
1.3.4 数据处理
使用美国国家标准与技术研究院(national institute of standards and technology,NIST)17数据库对未知挥发性化合物谱图进行检索,相似度低于70视为未检出,并采用内标法进行半定量分析;使用Excel 2019和Origin 2021软件进行数据处理,使用SPSS 24.0软件对数据进行差异显著性分析。
2 结果与分析
2.1 黄酒细菌菌群多样性分析
2.1.1 黄酒中细菌菌群测序分析
通过HiSeq平台对正常黄酒和两种腐败黄酒测序后,结果见图1。由图1可知,在腐败黄酒1号和腐败黄酒2号中共有OTU数为34个,其中a1、a2特有的OTU数目分别为2和7个。腐败黄酒与正常黄酒共有OTU数为22个,腐败黄酒1号与正常黄酒共有OTU数为34个,腐败黄酒2号与正常黄酒共有OTU数为42个。
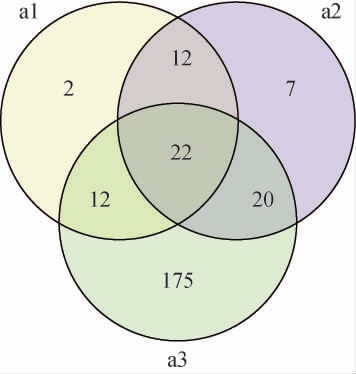
图1 正常黄酒与腐败黄酒细菌操作分类单元Venn图
Fig.1 Venn diagram of operational taxonomic unit of bacteria in normal Huangjiu and spoiled Huangjiu
2.1.2 黄酒中细菌菌群组成
对OTU代表序列按97%相似水平进行分类学分析,在各个生物学分类水平上分别获得1界,11门,5纲,5目,8科,6属。门和属水平细菌的相对丰度见图2。由图2可知,厚壁菌门(Firmicutes)是门水平上的最优势菌门,在腐败黄酒中的相对丰度为99.7%~99.9%。腐败黄酒中,属水平上的最优势菌属为乳杆菌属(Lactobacillus),相对丰度为99.7%~99.9%。与正常黄酒相比,乳杆菌的繁殖抑制了黄酒中其他菌属的生长。
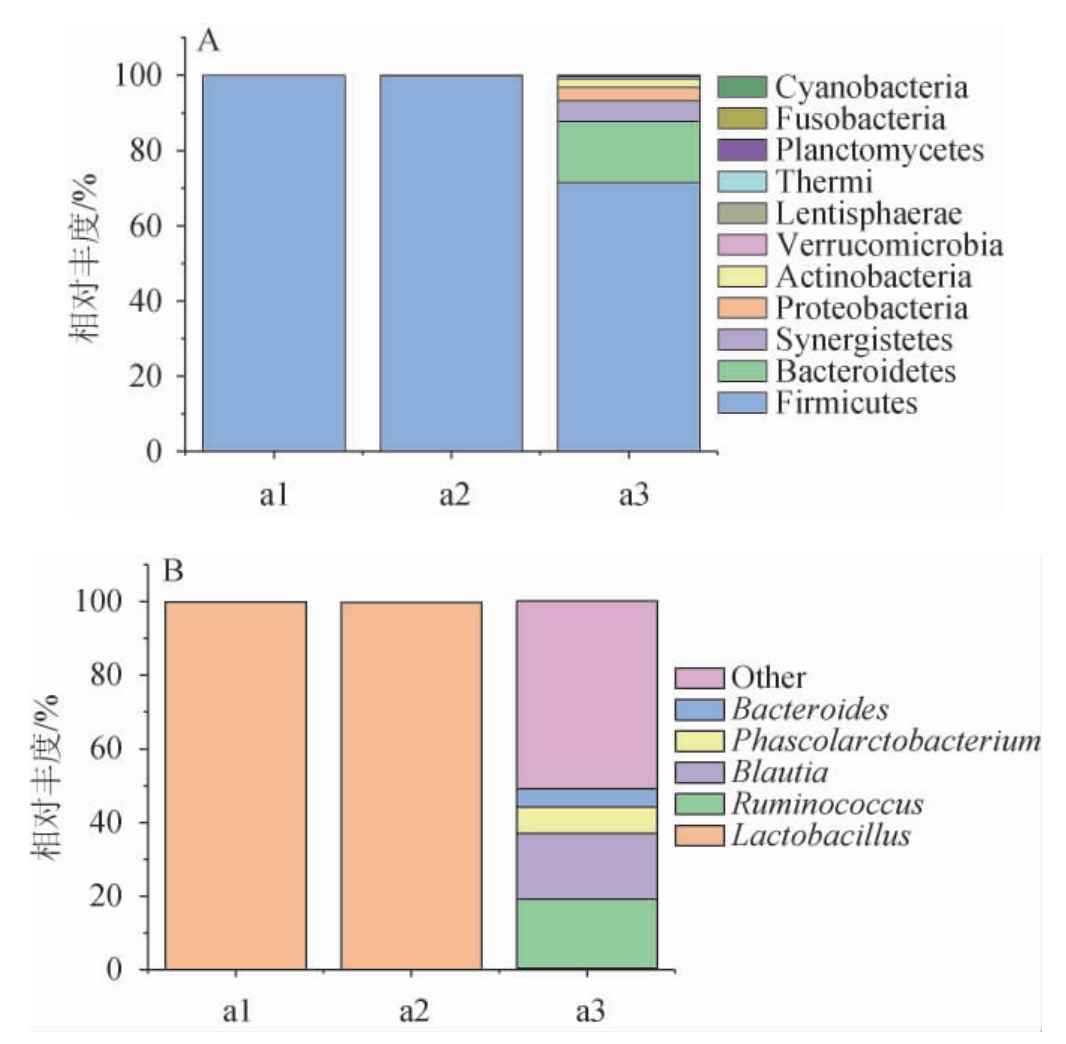
图2 正常黄酒与腐败黄酒门(A)及属(B)水平细菌菌群结构
Fig.2 Bacterial community structure of normal Huangjiu and spoiled Huangjiu based on phylum (A) and genus (B) level
Other:相对丰度<0.5%的属。
腐败黄酒各分类水平的物种组成见图3。由图3可知,通过不同颜色及节点大小反映了物种丰度最高的是乳杆菌属,根据OTU所代表的物种及物种丰富度可知,乳杆菌属是腐败黄酒中的优势微生物,也是引起黄酒腐败变质的主要菌属[18]。
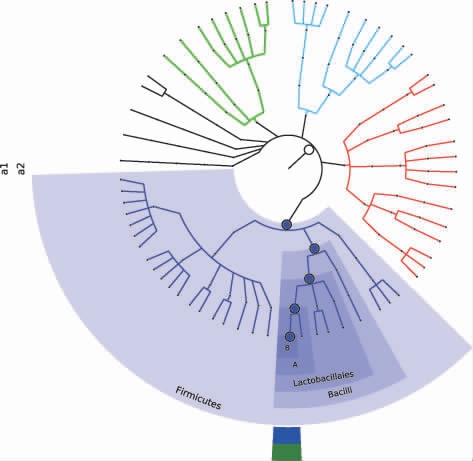
图3 腐败黄酒各分类水平的物种组成
Fig.3 Species composition of spoiled Huangjiu based on different taxonomic levels
2.2 黄酒挥发性风味物质分析
利用HS-SPME-GC-MS技术检测正常黄酒、腐败黄酒的挥发性风味化合物,结果见表1和图4。
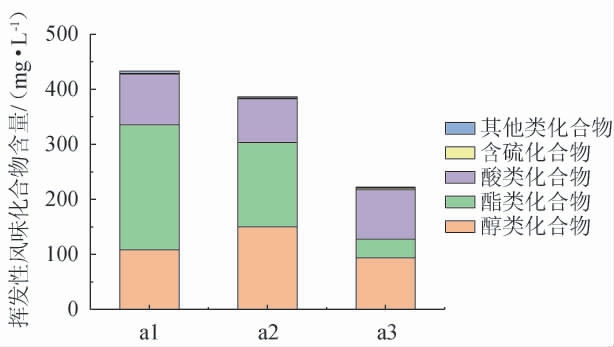
图4 正常黄酒与腐败黄酒挥发性风味化合物含量的变化
Fig.4 Changes of volatile flavor compounds in normal Huangjiu and spoiled Huangjiu
表1 正常黄酒与腐败黄酒挥发性风味物质含量测定结果
Table 1 Determination results of volatile flavor compounds contents in normal Huangjiu and spoiled Huangjiu

续表
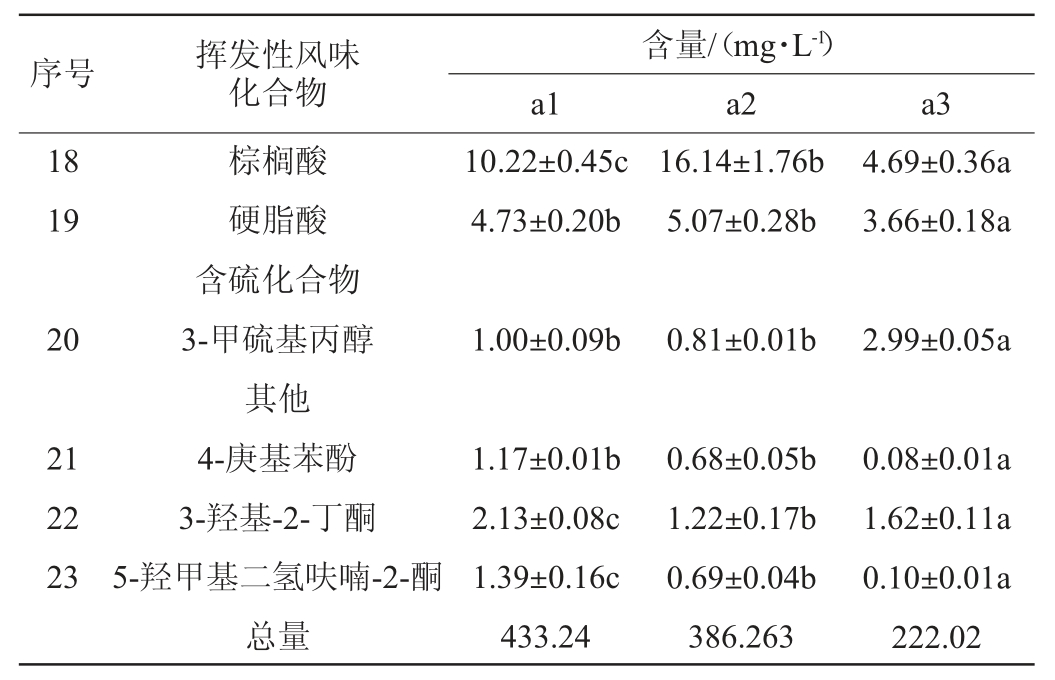
注:同行不同字母表示差异显著(P<0.05)。
由表1可知,在正常黄酒和腐败黄酒1号、腐败黄酒2号中共检测出5类挥发性风味化合物,包括23种挥发性风味化合物,8种醇,4种酯,7种酸,1种含硫化合物以及3种其他化合物。其中,含量较高的化合物有L(-)-乳酸乙酯、乙酸、异戊醇、甲羟丙二酸、苯乙醇和对羟基苯乙醇等。
由图4可知,黄酒被微生物污染发生腐败后,挥发性风味物质含量总体较正常黄酒升高,酯类化合物含量在黄酒腐败后变化最显著,其中L(-)-乳酸乙酯、丁二酸二乙酯、丁二酸单乙酯含量相对于正常黄酒升高,尤其是L(-)-乳酸乙酯含量显著高于正常黄酒(P<0.05)。
腐败黄酒中的醇类化合物中,正丙醇、异丁醇、2,3-丁二醇、糠醇等含量显著增加(P<0.05)。杂醇油类异丁醇、异戊醇,是酵母代谢产乙醇时的副产物,含量过高还会给酒的风味带来邪杂、苦涩味[19]。
酸类化合物中,乙酸含量有所下降,异丁酸、4-羟基丁酸乙酰酯、丁酸、棕榈酸、硬脂酸含量均有上升。乙酸、丁酸、异丁酸等是黄酒中重要的有机酸,乙酸可以调节酒的风味,也可以作为丁酸、己酸、乙酸乙酯风味化合物的前体,丁酸等有机酸还可以通过丁酸菌等厌氧菌利用黄酒中糖、乙酸和酒精生成[20]。
腐败黄酒中3-甲硫基丙醇含量较正常黄酒显著减少。4-庚基苯酚、5-羟甲基二氢呋喃-2-酮等化合物相对于正常黄酒的含量也有显著上升(P<0.05)。上述黄酒中挥发性风味化合物含量的变化表明微生物繁殖代谢对风味造成了显著影响,尤其是腐败后黄酒中L(-)-乳酸乙酯含量升高,占挥发性风味化合物的33%~45%。
黄酒腐败前后挥发性风味化合物热图见图5。由图5可知,腐败和正常黄酒中的风味物质含量存在显著性差异,而两个腐败后的黄酒a1、a2挥发性风味物质却很相近。可见,通过挥发性风味化合物可将正常黄酒和两种腐败黄酒区分开。
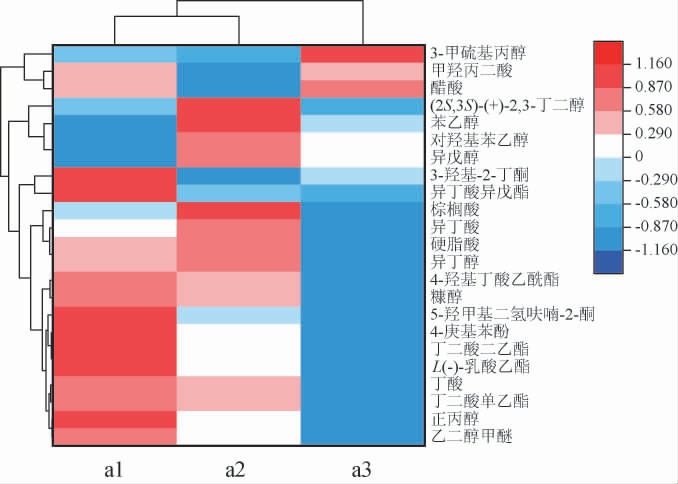
图5 黄酒腐败前后挥发性风味化合物热图分析
Fig.5 Heat map analysis of volatile flavor compounds before and after Huangjiu spoilage
2.3 黄酒腐败微生物与风味的相关性分析
乳酸乙酯是由乳酸菌先利用己糖、戊糖等糖类生成乳酸,再在其他微生物产生的酯酶催化作用下,与乙醇结合形成[21-23]。章银珠[24]发现的2株乳杆菌(乳杆菌MDx和乳杆菌LZY)能明显提高乳酸和乙酸的含量。PANG X等[25]在白酒中接入乳酸菌,发现耐酸乳杆菌显著促进乙酸乙酯、乳酸乙酯等重要风味物质的形成。说明风味化合物的产生与乳酸菌的繁殖代谢密切相关。
黄酒中细菌属和挥发性风味化合物之间的Spearman秩相关关系如图6所示,Spearman等级相关系数在1.0~-1.0之间,相关性从强正相关到强负相关。比例条的颜色表示相关性的正负,蓝色表示正相关,红色表示负相关。圆的大小表示相关性的强弱,大圆为强相关性,小圆为弱相关性。由图6可知,乳杆菌与大部分挥发性风味化合物呈正相关关系,包括正丙醇、异丁醇、L(-)-乳酸乙酯和糠醇等15种化合物;与异戊醇、3-甲硫基丙醇、甲羟丙二酸和醋酸等化合物呈负相关。瘤胃球菌属、布劳特氏菌属等菌属与多数挥发性化合物呈负相关关系。黄酒腐败后乳杆菌大量繁殖,成为腐败黄酒中主要微生物,造成腐败黄酒中L(-)-乳酸乙酯含量明显上升,丁二酸单乙酯、丁二酸二乙酯、乙二醇甲醚、2,3-丁二醇等化合物含量也有所上升,与前人研究的在黄酒酿造中接种干酪乳杆菌、植物乳杆菌后,挥发性香气化合物含量升高结论一致[26-27]。腐败黄酒中乳杆菌属是最主要微生物,对黄酒中酯类化合物含量影响最大,其次是醇类化合物。

图6 黄酒中细菌属与风味化合物的Spearman相关性分析
Fig.6 Spearman correlation analysis between bacterial genera and flavor compounds in Huangjiu
乳杆菌是黄酒酿造过程中常见微生物[28-29],以黄酒丰富的糖类作为能源物质,经过分解代谢产生有机酸,如乙酸、乳酸、脂肪酸和苯乳酸等[30-31],适量的有机酸可直接作为风味物质前体,改善酒的风味[32]。黄酒腐败过程中乳杆菌繁殖过剩,造成乳酸乙酯含量急剧上升,此时的乳酸菌被认为是有害细菌[21]。因此,黄酒腐败前后挥发性风味的变化与乳杆菌属的代谢活动具有紧密联系,乳杆菌繁殖产生大量的L(-)-乳酸乙酯,是黄酒风味特征改变的主要原因。
2.4 黄酒感官评价分析
为了进一步解析腐败黄酒的风味变化,由12名感官评价小组成员对3种黄酒的香气特征进行感官评价,结果见图7。
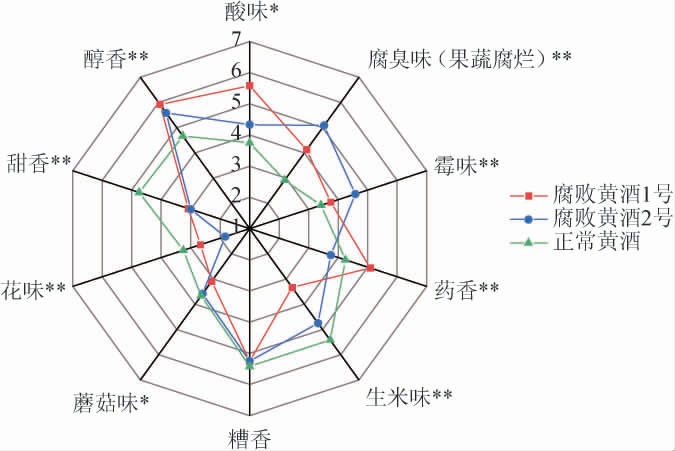
图7 正常黄酒与腐败黄酒的感官评价
Fig.7 Sensory evaluation of normal Huangjiu and spoiled Huangjiu
“*”表示具有显著差异(P<0.05),“**”表示具有极显著差异(P<0.01)。
由图7可知,腐败后黄酒与正常黄酒的风味存在较大差异,3种黄酒能很好的区分开。腐败后的黄酒甜香、花香、生米香较正常黄酒明显降低,醇香、酸味、腐臭味和霉味明显高于正常黄酒,酸味、腐臭味和霉味造成腐败黄酒异味增强。3种黄酒糟香、蘑菇味未见明显差异。正常黄酒甜香、糟香强度较高,腐臭味和霉味强度较弱,整体风味无异味。
腐败黄酒1号醇香、酸味和药香增强。腐败黄酒2号腐臭味、霉味增强。结合风味分析数据可知,正丙醇、异丁醇和2,3-丁二醇等醇类化合物含量增加与醇香提升有密切关系。腐败黄酒1号的酸类化合物含量增加使腐败黄酒酸味增强;腐败黄酒2号的酸类化合物含量虽与正常黄酒无明显差异,但甜味的下降,导致酸味增强。丁酸含量升高会带来不愉悦的气味,腐败黄酒中丁酸含量升高,腐臭味、霉味明显增强。
3 结论
该研究采用高通量测序分析了腐败后黄酒细菌群落结构,并对正常黄酒和腐败黄酒进行风味分析与感官评价。乳杆菌属是腐败后黄酒中的优势微生物,是引起黄酒腐败变质的主要细菌。在黄酒腐败过程中,乳杆菌繁殖代谢产生大量L(-)-乳酸乙酯,使腐败黄酒与正常黄酒的挥发性风味物质产生显著差异,导致黄酒风味不协调。细菌属与挥发性风味化合物间相关性分析也显示乳杆菌与大部分挥发性风味化合物呈正相关关系。通过感官分析对比了质量良好的黄酒和腐败黄酒的香气特征,正常黄酒甜香、花香、生米香较强,腐败的黄酒酸味、腐臭味和霉味明显。微生物代谢产生的风味物质改变了黄酒的香气,通过探究微生物与风味物质间关系,为黄酒腐败后香气特征变化提供理论依据。黄酒是乳杆菌属微生物生长繁殖的优良培养基,在储存及放置过程中应尽量避免乳酸菌等微生物的污染,通过低温储藏减缓乳酸菌的大量繁殖。
[1]LIU S P,CHEN Q L,ZOU H J,et al.A metagenomic analysis of the relationship between microorganisms and flavor development in Shaoxing mechanized huangjiu fermentation mashes[J].Int J Food Microbiol,2019,303:9-18.
[2]刘芸雅.绍兴黄酒发酵中微生物群落结构及其对风味物质影响研究[D].无锡:江南大学,2015.
[3]陈青柳.绍兴机械化黄酒风味形成途径和功能微生物的研究[D].无锡:江南大学,2018.
[4]陈岑.泡菜中腐败微生物的分离、鉴定及其对泡菜品质的影响[D].雅安:四川农业大学,2015.
[5]刘文容,陈双,徐岩.黄酒贮存酸败关键微生物的分离鉴定[J].微生物学通报,2018,45(1):120-128.
[6]章志超,吴鑫,朱应飞.导致黄酒腐败的食果糖乳杆菌的分离、鉴定及其检测条件优化[J].食品科学,2018,39(20):161-166.
[7]郑鄢燕,魏亚博,王宇滨,等.气调贮藏对腐败菌引起的鲜切黄瓜品质、滋味和挥发性物质变化的影响[J].食品科学,2021,42(5):252-261.
[8]WANG W,LIU Y W,SUN Z,et al.Hop resistance and beer-spoilage features of foodborne Bacillus cereus newly isolated from filtration-sterilized draft beer[J].Ann Microbiol,2017,67:17-23.
[9]孙乐平,张伟,徐嘉良,等.燕麦黄酒发酵过程中微生物群落结构变化及对高级醇的影响[J].食品科学技术学报,2020,38(1):43-52.
[10]马琳娜,邱树毅,王啸.不同黄酒酒曲的酿造微生物与风味物质之间的关系[J].食品与发酵科技,2021,57(3):81-89.
[11]江伟,兰玉倩,黄毅,等.固相微萃取与气相色谱-质谱联用法对不同酒龄黄酒的微量风味分析与应用[J].食品与发酵工业,2011,37(2):144-150.
[12] MAGOC T,SALZBERG S L.FLASH: fast length adjustment of short reads to improve genome assemblies[J].Bioinformatics,2011,27(21):2957-2963.
[13]EDGAR R C.UPARSE:highly accurate OTU sequences from microbial amplicon reads[J].Nat Methods,2013,10(10):996-998.
[14] EDGAR R C,HAAS B J,CLEMENTE J C,et al.UCHIME improves sensitivity and speed of chimera detection[J].Bioinformatics,2011,27(16):2194-2200.
[15]WANG Q,GARRITY G M,TIEDJE J M,et al.Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J].Appl Environ Microbiol,2007,73(16):5261-5267.
[16]WANG J,YUAN C,GAO X,et al.Characterization of key aroma compounds in Huangjiu from northern China by sensory-directed flavor analysis[J].Food Res Int,2020,134:109238.
[17]谢静茹.传统绍兴酒关键苦味物质及其影响因素研究[D].上海:上海应用技术大学,2021.
[18]毛青钟.引起陈酿黄酒腐败乳酸杆菌的检测方法和培养基研究及初步鉴定[J].酿酒,2014,41(3):45-50.
[19]唐洁,陈申习,林斌,等.清香小曲白酒新工艺中微生物及环境因子对酒体风味变化的影响[J].食品与发酵工业,2019,45(17):40-47.
[20]张方,邓波,张宿义,等.春夏两季浓香型白酒糟醅中四大有机酸的变化及其对酒质的影响[J].酿酒科技,2016(5):70-74.
[21]李维青.浓香型白酒与乳酸菌、乳酸、乳酸乙酯[J].酿酒,2010,37(3):90-93.
[22]周北龙.豉香型米酒生产中微生物作用机理[J].现代食品,2016(10):53-55.
[23]HOLLAND R,LIU S Q,CROW V L,et al.Esterases of lactic acid bacteria and cheese flavour:Milk fat hydrolysis,alcoholysis and esterification[J].Int Dairy J,2005,15(6-9):711-718.
[24]章银珠.陈化传统黄酒腐败微生物的分离鉴定和特性研究[D].无锡:江南大学,2008.
[25] PANG X,CHEN C,HUANG X,et al.Influence of indigenous lactic acid bacteria on the volatile flavor profile of light-flavor Baijiu[J].LWTFood Sci Technol,2021,147:111540.
[26]洪家丽,陈敏,周文斌,等.乳酸菌对红曲黄酒酿造过程酵母菌生长及风味物质形成的影响[J].中国食品学报,2020,20(1):91-100.
[27]钱桢文,吴宗文,吴殿辉,等.强化乳酸菌酿造高酸黄酒工艺研究[J].食品与发酵工业,2022,48(6):168-173.
[28]刘文容.黄酒陈酿过程中腐败乳酸菌的分离鉴定及其特性研究[D].无锡:江南大学,2017.
[29]朱小芳,张凤杰,俞剑燊,等.黄酒浸米水中细菌群落结构及优势菌代谢分析[J].食品科学,2017,38(10):82-86.
[30]吕懿超,李香澳,王凯博,等.乳酸菌作为生物保护菌的抑菌机理及其在食品中应用的研究进展[J].食品科学,2021,42(19):281-290.
[31]罗雪,柯锋,刘文容,等.黄酒贮存陈酿关键腐败微生物的生物学特征[J].食品与发酵工业,2021,47(23):106-111.
[32]孔小勇,王鹏举.黄酒发酵过程中腐败现象的研究[J].酿酒科技,2011(8):47-50.