四甲基吡嗪(tetramethylpyrazine,TTMP)最开始是从川芎中分离得到的,因此又称川芎嗪,属于生物碱类,是一种含氮杂环化合物,具有扩张血管、改善微循环及抑制血小板集聚等作用,现已广泛应用于心脑血管疾病、呼吸系统疾病、慢性肾功能衰竭疾病等的临床治疗[1]。
白酒中四甲基吡嗪的研究已有近20年的历史。2006年,吴建峰[2]率先提出了四甲基吡嗪是白酒中的主要功能性成分之一。自然界中存在的四甲基吡嗪主要是通过食物加热过程中的美拉德反应生成,美拉德反应产吡嗪类物质的最佳温度在120~180 ℃,而白酒生产大多达不到这个温度,但吴建峰[2]研究发现,白酒生产的各个环节都伴随有四甲基吡嗪的产生。2011年,徐岩等[3]研究发现并证实了白酒中的四甲基吡嗪主要来源于微生物发酵而不是美拉德反应,并确定了枯草芽孢杆菌(Bacillus subtilis)代谢产生四甲基吡嗪的详细过程,其代谢过程是由功能菌株糖降解产生丙酮酸,两分子的丙酮酸经一系列反应产生乙偶姻,乙偶姻和氨经过非酶促反应生成四甲基吡嗪。功能菌株产生乙偶姻需要在37 ℃微酸环境,而从乙偶姻到四甲基吡嗪则需要中性环境高温。在此之前对白酒中四甲基吡嗪的研究主要集中在酱香型及芝麻香型白酒中,与以上两种香型白酒对比,清香型白酒中的四甲基吡嗪含量较低[3]。主要是由于清香型白酒大曲是低温曲,不满足四甲基吡嗪产生温度,其次发酵过程中少了堆积发酵这一高温阶段,从而难以从乙偶姻转变成四甲基吡嗪[4]。由于清香型白酒酿造工艺不利于四甲基吡嗪的积累,所以考虑从菌株方面入手来提高其产量。2016年,李晓霞[5]将从汾酒大曲中筛选得到的高产四甲基吡嗪的枯草芽孢杆菌在拌曲阶段加入白酒生产中,发现白酒中的四甲基吡嗪含量提高了近3倍,达到5.3 mg/L,已高于酱香型白酒中四甲基吡嗪含量。
孙宝国等[6]在健康白酒的发展趋势中首次提出健康白酒应该通过“内寻外加自然强化”来实现,即一方面通过系统分析发现白酒中对人体有益的成分并通过传统发酵过程的创新增加这些成分的含量,另一方面向白酒中合理添加其他对人体有益的成分。故通过强化白酒中四甲基吡嗪含量有利于健康白酒产业升级,尤其是提高清香型白酒中四甲基吡嗪含量,以提高其在白酒市场竞争力[7],而这一关键则在于优势菌株资源的开发。本研究以清香型白酒大曲为研究对象,从中筛选高产四甲基吡嗪的菌株,并通过优化培养基成分来提高菌株产四甲基吡嗪含量,以期为优化其发酵工艺以提高四甲基吡嗪的产量并将功能菌液应用于清香型白酒生产过程以提高清香型白酒中的功能性成分奠定基础[8-12]。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
清香型白酒大曲:山西杏花村汾酒厂股份有限公司。
1.1.2 培养基
牛肉膏蛋白胨培养基[13-14]:牛肉膏3 g,蛋白胨10 g,氯化钠5 g,蒸馏水1 000 mL。121 ℃高压蒸汽灭菌20 min。固体培养基中加入15~17 g琼脂。
发酵培养基[13-14]:葡萄糖80 g,蛋白胨10 g,酵母浸粉20 g,磷酸氢二铵30 g,蒸馏水1 000 mL。121 ℃高压蒸汽灭菌20 min。
1.1.3 试剂
四甲基吡嗪标准品(纯度>98%):上海融禾医药科技有限公司;二氯甲烷(色谱纯):天津市登峰化学试剂厂;无水乙醇(分析纯):天津市风船化学试剂科技有限公司;细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:无锡百泰克生物技术有限公司。
1.2 仪器与设备
BXM-30R立式压力蒸汽灭菌器:上海博讯实业有限公司医疗设备厂;H2100R高速冷冻离心机:湖南湘仪实验室仪器开发有限公司;SW-CJ-1FD净化工作台:上海跃进医疗器械有限公司;HNY-1102智能恒温培养振荡器:天津欧诺仪器股份有限公司;JA1203N电子天平:上海精密科学仪器有限公司;DZKW-D-2电热恒温水浴锅:天津市大港区红杉实验设备厂;D1008E低速离心机:大龙兴创实验仪器股份公司;TC-96/G/H(b)c基因扩增仪:杭州博日科技有限公司;LRH-70生化培养箱:上海一恒科学仪器有限公司;GC-2010气相色谱(gas chromatography,GC)仪:岛津企业管理(中国)有限公司;Vortex-6涡旋混合器:海门市其林贝尔仪器制造有限公司;Powerpac Basic蛋白电泳仪:伯乐生命医学产品(上海)有限公司。
1.3 实验方法
1.3.1 芽孢杆菌的筛选与纯化
准确称取大曲样品5 g,加入盛有45 mL无菌水且装有5颗玻璃珠的250 mL锥形瓶中,在恒温振荡培养箱中37 ℃、160 r/min振荡30 min。振荡培养完成后85 ℃水浴加热30 min,通过芽孢杆菌的耐热性筛选大曲中的芽孢杆菌。
吸取上清液1.00 mL加入50 mL的牛肉膏蛋白胨培养基中,37 ℃、200 r/min振荡富集处理24 h,按10倍梯度稀释至10-12,制备菌悬液。分别吸取稀释度为10-8~10-12的菌悬液0.2 mL于牛肉膏蛋白胨培养基,设3个平行,涂布,37 ℃培养48 h。观察菌落形态,将形态不同的单菌落挑出重新划线接种至牛肉膏蛋白胨固体平板上,37 ℃条件下培养2 d,重复多次,直至分离纯化得到单菌落[15-17]。
1.3.2 高产四甲基吡嗪菌株的筛选
将分离纯化得到的菌株接至牛肉膏蛋白胨液体培养基中,37 ℃振荡培养15~18 h,按6%(V/V)的接种量接入100 mL的发酵培养基中,37 ℃振荡培养5 d。
在100 mL发酵液中加入50 mL体积分数为95%的乙醇蒸馏得到100 mL蒸馏液,将100 mL蒸馏液按蒸出时间分为前段(30 mL)、中段(30 mL)、后段(40 mL)分别编号,采用气相色谱法测定后段TTMP含量,筛选产四甲基吡嗪的菌株。
1.3.3 四甲基吡嗪含量的测定
气相色谱条件[18-19]:AC-20毛细管色谱柱;柱流速1.0 mL/min;分流比15∶1,进样量1 μL,进样口温度250 ℃;升温程序为初始温度50 ℃,以8 ℃/min升温至100 ℃,保持5 min;以10 ℃/min升温至170 ℃,保持3 min,总分析时间为20.25 min。
定性定量方法:根据保留时间定性,采用外标法定量。
1.3.4 高产四甲基吡嗪菌株的鉴定
形态观察:将筛选得到的菌株在牛肉膏蛋白胨固体培养基上活化,再以点接法接种到牛肉膏蛋白胨固体培养基上,在恒温培养箱中37 ℃培养48 h后,观察其在培养基上的大小、形状、质地、颜色等菌落形态特征。挑取生长期的菌株涂片,干燥,固定,进行革兰氏染色,通过光学显微镜观察其细胞形态特征。
分子生物学鉴定:根据细菌基因组DNA提取试剂盒说明书提取DNA,以其为模板,采用细菌通用引物27F(5'-AGAGTTTGATCCGGCTCAG-3')、1492R(5'-GGTTACCTTGTTACGACTT-3')对菌株的16S rDNA基因序列进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。PCR扩增体系:上、下游引物1492R和27F各2.5 μL,TaqMasterMix 12.5 μL,细菌DNA 1 μL,双蒸水(ddH2O)6.5 μL。PCR扩增条件:94 ℃预变性5 min;94 ℃变性0.5 min,55 ℃退火0.5 min,72 ℃延伸1 min,30个循环;72 ℃再延伸5 min。PCR扩增结束后4 ℃保存。PCR扩增产物经2%琼脂糖凝胶电泳检测合格后委托生工生物工程(上海)股份有限公司进行测序。将测序结果提交至美国国家生物信息技术中心(national center for biotechnology information,NCBI)的GenBank数据库中进行基本局部比对搜索工具(basiclocal alignment search tool,BLAST)比对,采用邻接法(neighbor-joining,NJ)构建目标菌株的系统发育树[20-21]。
1.3.5 高产四甲基吡嗪菌株生长曲线的绘制
将高产四甲基吡嗪菌株接种于装有100 mL发酵培养基的500 mL锥形瓶中,37 ℃、180 r/min振荡培养,每隔1 h取一次样,采用紫外分光光度计在波长600 nm处测定吸光值度,以培养时间(x)为横坐标,吸光度值(y)为纵坐标绘制生长曲线。
1.3.6 发酵培养基的优化
(1)碳源种类及添加量的确定
在发酵培养基其他成分不变的情况下分别以乳糖、蔗糖、果糖、糊精、可溶性淀粉代替葡萄糖作为碳源。待菌液在牛肉膏蛋白胨培养基中富集培养9 h后,分别以6%(V/V)的接种量接种到含有50 mL 6种发酵培养基的250 mL锥形瓶中,37 ℃、180 r/min条件下发酵5 d。取5 mL发酵液,采用2 mL二氯甲烷萃取后,采用气相色谱法检测四甲基吡嗪含量。筛选得到最适碳源之后对其添加量(40 g/L、60 g/L、80 g/L、100 g/L、120 g/L)进行优化,确定最适添加量。
(2)氮源复配比例及添加量的确定
在优化碳源的基础上,固定蛋白胨与酵母浸粉总添加量为30 g/L,考察蛋白胨与酵母浸粉不同比例(1∶0、5∶1、2∶1、1∶1、1∶2、1∶5、0∶1)对菌株产四甲基吡嗪含量的影响。考察碳源总添加量分别为18 g/L、24 g/L、30 g/L、36 g/L、42 g/L,测定四甲基吡嗪含量,确定最适碳源添加量。
(3)无机盐的确定
在优化碳源和氮源的基础上,以不添加无机盐为对照,向培养基中加入15 g/L无机盐,考察不同无机盐(硝酸钾、磷酸二氢钾、磷酸氢二钾、氯化钠、氯化钾、磷酸二氢钠、磷酸氢二钠)对菌株产四甲基吡嗪含量的影响。筛选得到最适无机盐种类后,更改其添加量为10.0 g/L、12.5 g/L、15.0 g/L、17.5 g/L、20.0 g/L,测定四甲基吡嗪含量,确定最无机盐最适添加量。
2 结果与分析
2.1 芽孢杆菌的筛选
利用芽孢杆菌耐热的原理85 ℃水浴加热大曲样品溶液,以杀灭除芽孢杆菌以外的微生物。并通过稀释涂布、划线分离等方法共分离纯化得到31株芽孢杆菌。
2.2 高产四甲基吡嗪菌株的筛选
通过气相色谱法共筛选得到7株产四甲基吡嗪的菌株,结果见图1。由图1可知,菌株q94四甲基吡嗪产量较高,为(0.36±0.01)g/L,其次为菌株q33,四甲基吡嗪产量为(0.16±0.02)g/L,其他菌株的四甲基吡嗪产量较低,为(0.014±0.000 4)~(0.017±0.003 8)g/L。最终确定菌株q94为高产四甲基吡嗪的菌株。
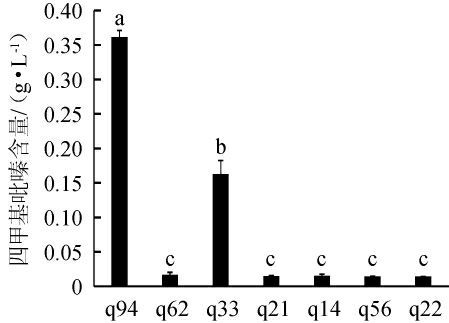
图1 不同菌株产四甲基吡嗪的含量
Fig.1 Content of tetramethylpyrazine produced by different strains
不同字母表示差异显著(P<0.05)。下同。
2.3 高产四甲基吡嗪菌株的鉴定
2.3.1 菌株q94的形态学观察
采用点接法将高产四甲基吡嗪的菌株q94接种于牛肉膏蛋白胨培养基上,观察其菌落及细胞形态特征,结果见图2。由图2a可知,菌株q94的菌落呈白色圆形,边缘整齐,表面粗糙有褶皱,无光泽,菌落质地为膜状,不透明。由图2b可知,经染色后,细胞形态为短杆状。
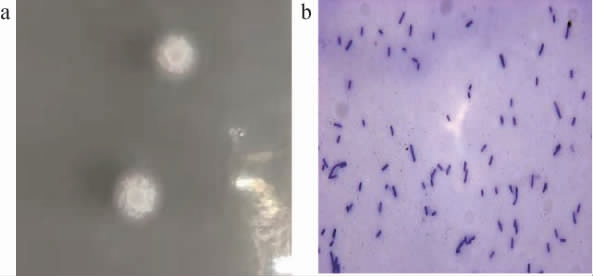
图2 菌株q94的菌落(a)及细胞(b)形态
Fig.2 Colony (a) and cell (b) morphology of strain q94
2.3.2 菌株q94的分子生物学鉴定
基于16S rDNA基因序列构建菌株q94的系统发育树,结果见图3。由图3可知,菌株q94与枯草芽孢杆菌(Bacillus subtilis)聚于一支,亲缘关系最近。结合形态观察,将菌株q94鉴定为枯草芽孢杆菌(Bacillus subtilis)[22-23]。
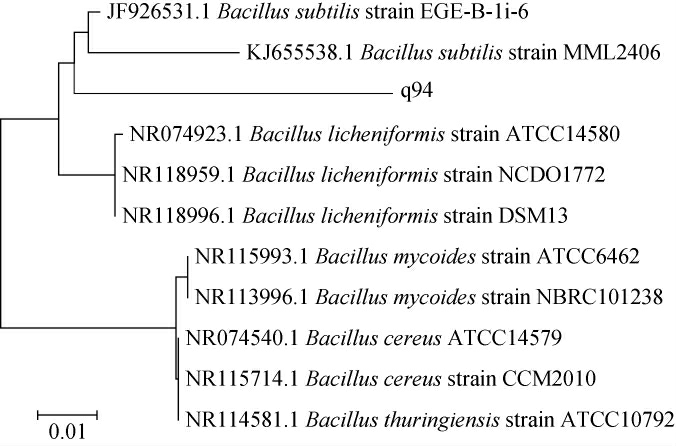
图3 基于16S rDNA基因序列菌株q94的系统发育树
Fig.3 Phylogenetic tree of strain q94 based on 16SrDNA gene sequence
2.4 枯草芽孢杆菌q94的生长曲线
功能菌株q94在牛肉膏蛋白胨培养基中的生长曲线见图4。由图4可知,菌株q94在0~4 h为迟缓期,4 h~11 h为对数生长期,11 h之后为稳定期。因此,确定菌株q94转接时间为9 h。
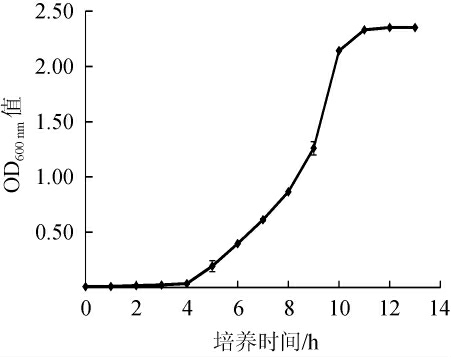
图4 枯草芽孢杆菌q94的生长曲线
Fig.4 Growth curve of Bacillus subtilis q94
2.5 枯草芽孢杆菌q94产四甲基吡嗪培养基配方研究
2.5.1 碳源种类及添加量的优化
碳源是微生物生长必不可少的能量来源[13]。四甲基吡嗪的前体物质乙偶姻是菌株发酵过程中碳源经一系列反应产生的,因此,选择合适的碳源对于四甲基吡嗪含量的提高有着重要的作用[15,24]。不同碳源种类及最适碳源添加量对菌株q94产四甲基吡嗪的影响结果见图5。由图5a可知,不同碳源对菌株q94产四甲基吡嗪的影响较大,其中蔗糖>可溶性淀粉>果糖>葡萄糖,而乳糖和糊精不产四甲基吡嗪。分析原因可能是糊精溶于水时粘性过大,阻碍了培养基中氧气的传递,从而影响四甲基吡嗪产量[24];葡萄糖、果糖过多易产生底物阻遏效应,大量积累丙酮酸、乳酸等导致pH下降影响酶活,影响四甲基吡嗪前体物质乙偶姻的产量[25]。张温清[14]在功能菌液的制备中也发现以乳糖为碳源时不产生四甲基吡嗪。当蔗糖为碳源时,菌株q94产四甲基吡嗪含量最高,达到(1.93±0.17)g/L,可见蔗糖为最佳碳源。由图5b可知,随着蔗糖添加量的增加,四甲基吡嗪含量呈先升高后下降的趋势,当蔗糖添加量为80 g/L时,四甲基吡嗪产量最高,达到(1.95±0.06)g/L。分析原因可能是蔗糖添加量过低会影响四甲基吡嗪前体物质乙偶姻的产生,从而影响四甲基吡嗪产量;添加量过高则会导致渗透压过高不利于菌体生长[24]。因此,蔗糖最适添加量为80 g/L。
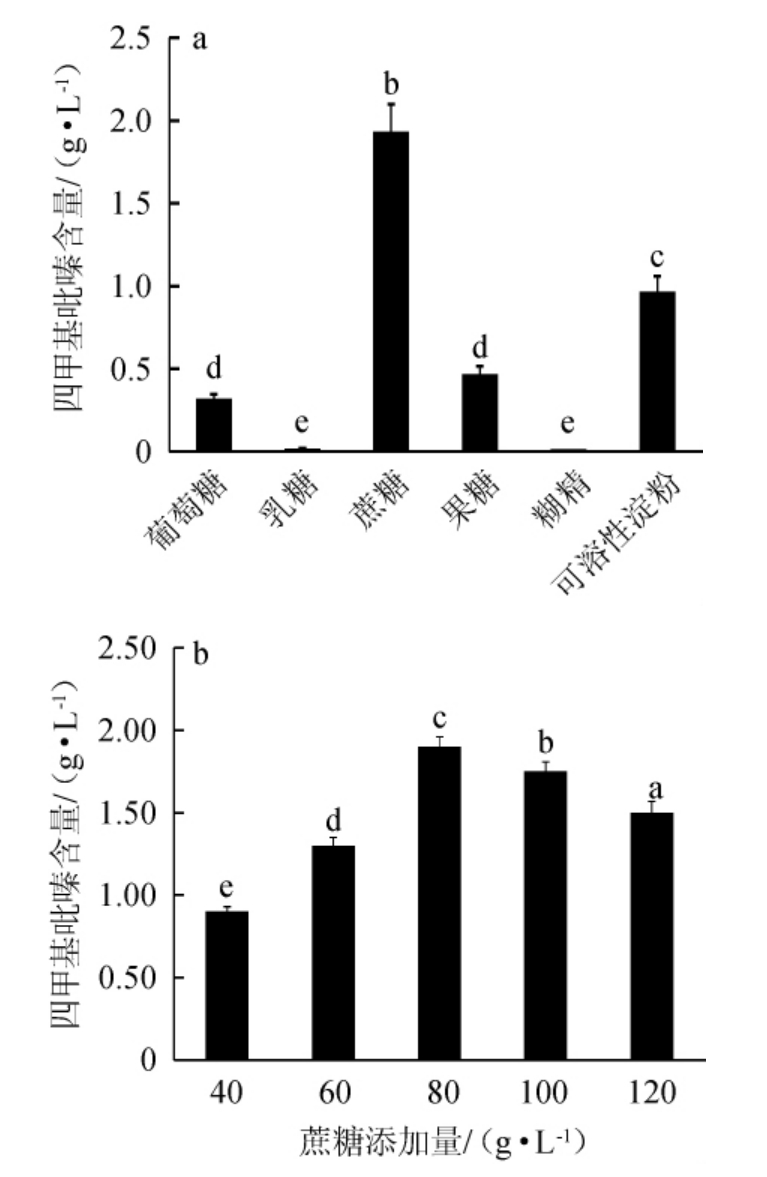
图5 碳源种类(a)及添加量(b)对枯草芽孢杆菌q94产四甲基吡嗪的影响
Fig.5 Effects of carbon source type (a) and sugar addition (b) on tetramethylpyrazine produced by Bacillus subtilis q94
2.5.2 有机氮源复配比例及添加量的优化
氮源分为无机氮源和有机氮源,其中有机氮源又包含迟效氮源、速效氮源两种[15]。在发酵培养基中一般需要速效和迟效氮源相互搭配,速效氮源用于微生物的生长,迟效氮源用于生产发酵产物。本研究所用发酵培养基中迟效氮源和速效氮源分别为蛋白胨和酵母浸粉,考察两种氮源不同复配比例及总添加量对枯草芽孢杆菌q94产四甲基吡嗪的影响,结果见图6。由图6a可知,当所用氮源全部为酵母浸粉时,枯草芽孢杆菌q94的四甲基吡嗪产量高于所用氮源全部为蛋白胨的,但是不如两种氮源合理搭配产量高,当蛋白胨与酵母浸粉比例为1∶2时,枯草芽孢杆菌q94功能菌株产四甲基吡嗪含量最高,可达到(1.89±0.05)g/L,此时虽没有上一步产量高但是在误差范围内差异不显著。由图6b可知,随着氮源添加量的增加,四甲基吡嗪含量呈先升高后下降的趋势,当氮源总添加量为30 g/L(即10 g/L蛋白胨和20 g/L酵母浸粉)时,四甲基吡嗪含量最高,可达到(1.89±0.05)g/L。因此,蛋白胨与酵母浸粉最适配比为1∶2,二者总添加量为30 g/L。
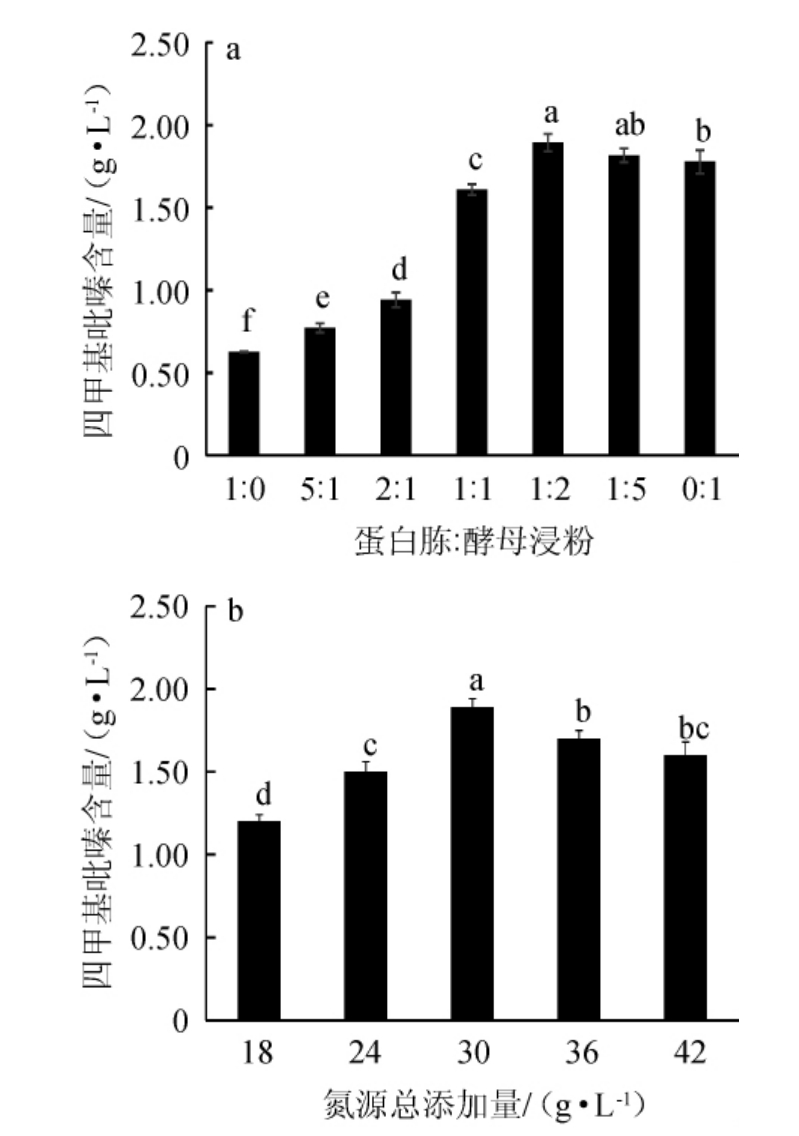
图6 有机氮源复配比例(a)及总添加量(b)对枯草芽孢杆菌q94产四甲基吡嗪产量的影响
Fig.6 Effects of organic nitrogen source ratio (a) and total addition(b) on the yield of tetramethylpyrazine produced by Bacillus subtilis Q94
2.5.3 无机盐种类及添加量的优化
无机盐可以通过作为菌体发酵过程中酶的抑制剂或激活剂来影响反应产物[15],无机盐种类及KH2PO4添加量对菌株q94产四甲基吡嗪的影响结果见图7。由图7a可知,当所加无机盐为磷酸二氢钾时,枯草芽孢杆菌q94产四甲基吡嗪含量最高,可达到(3.11±0.20)g/L,可见一些无机盐离子的参与可以促进四甲基吡嗪的合成,这与文献[25]报道相一致,钾离子可以通过影响细胞膜的通透性加快微生物对糖类的代谢,磷酸根离子可以在乙偶姻与铵根离子热反应阶段起到质子供体与受体的作用。且磷酸二氢钾显酸性,江南大学在中国白酒169计划中对四甲基吡嗪产生机制进行了深入研究,发现四甲基吡嗪前体物质乙偶姻在微酸环境产生含量更多[3]。实验证明添加氯化钠和硝酸钾完全不产四甲基吡嗪。由图6b可知,随着磷酸二氢钾添加量的增加,四甲基吡嗪含量呈先升高后下降的趋势,当培养基中磷酸二氢钾添加量为15 g/L时,四甲基吡嗪含量最高,可达(3.32±0.18)g/L,低浓度时四甲基吡嗪会随着磷酸根离子的增多而增多,当磷酸二氢钾添加量>15 g/L之后,外界渗透压过高会影响细菌的生长,从而导致四甲基吡嗪含量降低。李晓霞[5]从汾酒大曲中筛选得到的功能菌株四甲基吡嗪产量为0.9 mg/L;张温清[14]从芝麻香型白酒中筛选得到的菌株四甲基吡嗪产量达到3.65 g/L。由于乙偶姻与氨热反应生成四甲基吡嗪时需要高温,所以此时还有大量乙偶姻未转化成四甲基吡嗪,因此四甲基吡嗪含量并未达到最高。
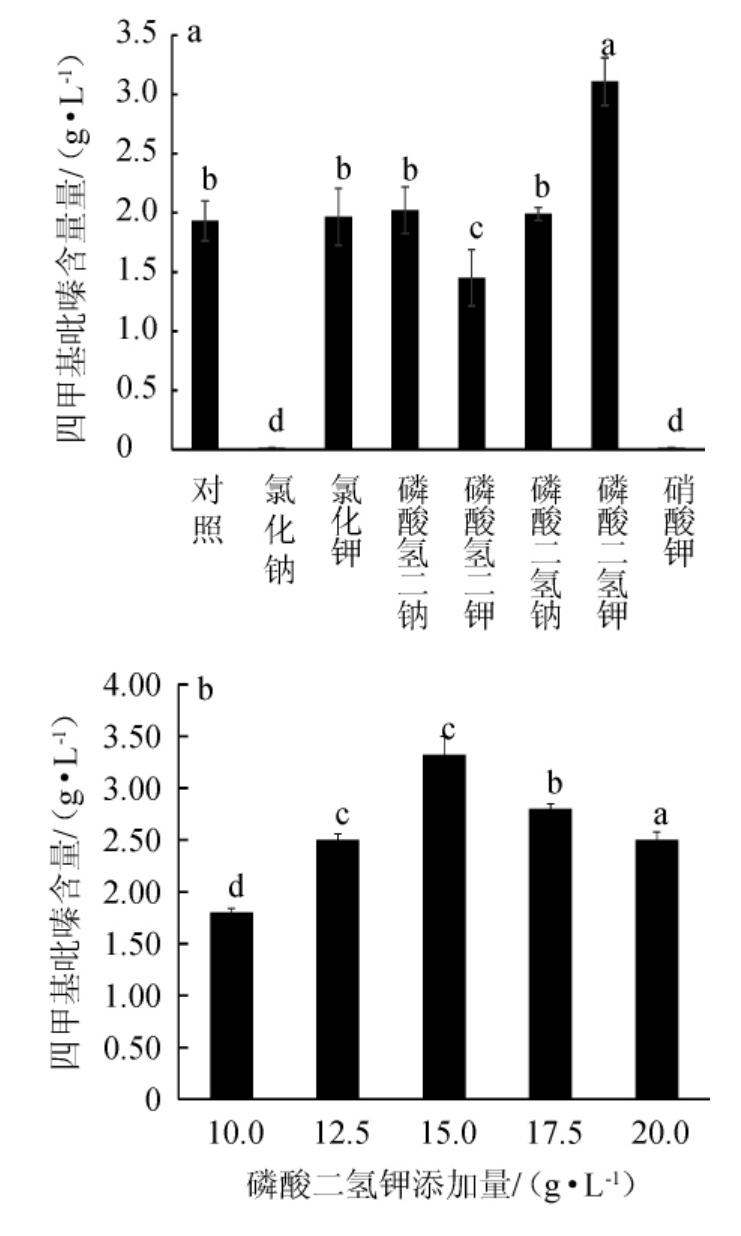
图7 无机盐种类(a)及磷酸二氢钾添加量(b)对枯草芽孢杆菌q94产四甲基吡嗪的影响
Fig.7 Effects of inorganic salts types (a) and KH2PO4 addition (b) on tetramethylpyrazine produced by Bacillus subtilis Q94
3 结论
采用传统培养分离方法从清香型大曲中分离得到31株芽孢杆菌,通过气相色谱法从中筛选得到7株产四甲基吡嗪的芽孢杆菌,其中菌株q94的四甲基吡嗪产量最高,为(0.36±0.01)g/L,通过形态观察和分子生物学鉴定,菌株q94被鉴定为枯草芽孢杆菌(Bacillus subtilis),其产四甲基吡嗪的最优培养基成分为蔗糖80 g/L、蛋白胨10 g/L、酵母浸粉20 g/L、磷酸氢二铵30 g/L、磷酸二氢钾15 g/L,在此优化条件下,菌株Q94产四甲基吡嗪含量最高,可达(3.32±0.18)g/L。
[1]胡国芬,王建平.川芎嗪的药理作用及临床应用进展[J].中国药物与临床,2006,6(10):773-774.
[2]吴建峰.中国白酒中健康功能性成分四甲基吡嗪的研究[J].酿酒科技,2007(1):117-120.
[3]徐岩,吴群,范文来,等.中国白酒中四甲基吡嗪的微生物产生途径的发现与证实[J].酿酒科技,2011(7):37-40.
[4]吴建峰.白酒中四甲基吡嗪全程代谢机理研究[D].无锡:江南大学,2013.
[5]李晓霞.汾酒大曲中高产四甲基吡嗪菌株的筛选及其在酿酒中的应用研究[D].临汾:山西师范大学,2016.
[6]孙宝国,李贺贺,胡萧梅,等.健康白酒的发展趋势[J].中国食品学报,2016,16(8):1-6.
[7]苏金兰,徐柏田,林培.中国白酒香型发展的进展研究[J].酿酒科技,2017(8):102-111.
[8]ZHANG W Q,SI G R,RAO Z M,et al.High yield of tetramethylpyrazine in functional Fuqu using Bacillus amyloliquefaciens[J].Food Biosci,2019,31:100435.
[9]陈诗佳,李玲玲,陈叶福,等.高产乙偶姻酵母菌种的选育与提高白酒中四甲基吡嗪含量的研究[J].酿酒科技,2018(10):114-119.
[10]马美荣,周林艳,王德斌,等.高产四甲基吡嗪芽孢杆菌的筛选及在清香型原酒生产中的应用研究[J].酿酒科技,2018(7):104-107.
[11]卢君,张颖,李福荣,等.菌种强化结合工艺优化提高酱香白酒基酒中四甲基吡嗪含量的研究[J].中国酿造,2020,39(10):162-166.
[12]HE G Q,DONG Y,HUANG J,et al.Alteration of microbial community for improving flavor character of Daqu by inoculation with Bacillus velezensis and Bacillus subtilis[J].LWT-Food Sci Technol,2019,111:1-8.
[13]李晓欢,葛向阳,汤有宏,等.古井桃花曲中高产四甲基吡嗪功能微生物筛选及其发酵条件优化[J].酿酒,2016,43(3):52-56.
[14]张温清.芝麻香型白酒四甲基吡嗪形成及其高产TTMP酿造工艺研究[D].合肥:合肥工业大学,2020.
[15]张颖,李霄霄,李景辉,等.高产四甲基吡嗪芽孢杆菌的筛选及其对酱香型白酒堆积过程的影响[J].食品工业科技,2022,43(2):142-149.
[16]吴钱弟,吴茗花,沈毅,等.芽孢杆菌与酵母菌和根霉曲混合发酵提高四甲基吡嗪含量的研究[J].酿酒科技,2021(5):17-21,31.
[17]黄晓润.枯草芽孢杆菌产酱香相关基因的筛选及功能研究[D].贵阳:贵州大学,2020.
[18]孙啸涛,王宗元,刘淼,等.涡旋辅助液液微萃取结合GC-MS法检测67种白酒中四甲基吡嗪、4-甲基愈创木酚和4-乙基愈创木酚[J].食品科学,2017,38(18):73-79.
[19]YAN Y,CHEN S,HE Y X,et al.Quantitation of pyrazines in Baijiu and during production process by a rapid and sensitive direct injection UPLCMS/MS approach[J].LWT-Food Sci Technol,2020,128(4):109371.
[20] TAN Y W,ZHONG H P,ZHAO D,et al.Succession rate of microbial community causes flavor difference in strong-aroma Baijiu making process[J].Int J Food Microbiol,2019,311:108350.
[21]钟桂芳,张帆,郭辉祥,等.高温大曲中产四甲基吡嗪细菌的筛选及鉴定[J].中国酿造,2020,39(8):107-111.
[22]陈梦圆,李志军,罗爱民.高温大曲中高产四甲基吡嗪菌株的筛选及鉴定[J].酿酒科技,2018(8):24-29.
[23]CUI K X,WU Q,XU Y,et al.Biodegradation of ethyl carbamate and urea with Lysinibacillus sphaericus MT33 in Chinese liquor fermentation[J].J Agr Food Chem,2018,66:1583-1590.
[24]朱兵峰.枯草杆菌两步法生产四甲基吡嗪的调控及机制的研究[D].无锡:江南大学,2010.
[25]汤丹丹.枯草芽孢杆菌产吡嗪发酵条件的研究[D].济南:齐鲁工业大学,2015.