果酒一般是指以水果为原料经发酵及一系列工艺处理得到的低酒精度饮料酒,由于原料或生产环节的影响,果酒酿制过程中不可避免有甲醇、杂醇的产生[1-2]。甲醇的摄入过量会对人体健康构成威胁,GB 15037—2006《葡萄酒》中规定白葡萄酒中甲醇含量不得高于250 mg/L,白红葡萄酒中甲醇含量不得高于400 mg/L,但目前我国对其他水果酿造的发酵酒中甲醇含量尚无明确规定,主要参考葡萄酒标准[3-5]。杂醇是具有三个及以上碳原子的一元醇类脂肪醇混合物的俗称,果酒中的杂醇主要是丙醇、丁醇、异丁醇、戊醇、异戊醇等[6-8]。适量的杂醇可以衬托酯香,增强果酒的风味,但过量则不仅导致果酒产生异杂味,而且对人体神经系统有毒害作用,是导致“上头”的主要因素之一[9-10],因此果酒中甲醇及杂醇的含量是评价果酒品质的重要考量因素。
目前测定果酒中甲醇及杂醇的方法有分光光度法[11-13]、气相色谱法[14]、气相色谱-质谱联用(gas chromatographymass spectrometer,GC-MS)法[15-16]等。分光光度法虽然可以测定果酒中各类醇的含量,但是操作步骤繁琐、耗时较长、目标组分选择性不强;气相色谱-质谱联用法由于质谱仪设备昂贵,测样成本高,限制了方法的普及性。本实验拟采用气相色谱仪,并通过顶空固相微萃取的条件优化,尝试建立一种快速、准确、重复性好的顶空固相微萃取与气相色谱联用(headspace solid phase microextraction-gas chromatography,HS-SPME-GC)的方法,来检测果酒中的甲醇、杂醇,并为其方法的可推广性进行验证。旨在为酿造果酒过程中对甲醇及杂醇含量及时监测和调控,对提升果酒的品质和安全性具有重要意义。
1 材料与方法
1.1 材料与试剂
甲醇(99.9%)、正丙醇(99.9%)、异丙醇(99.9%)、异丁醇(99.9%)、正丁醇(99.9%)、异戊醇(99.9%)、活性戊醇(99.8%)、正戊醇(99.9%)标准品:美国Sigma公司;实验用水均为一级纯化水;酿酒原料:市售。其他试剂均为国产分析纯。
1.2 仪器与设备
6820型气相色谱仪(配有氢火焰离子化检测器):美国Agilent公司;XS204电子分析天平:瑞士梅特勒-托利多集团;TG-35MS(60 m×250 μm×0.25 μm)、HP-5MS(60 m×250 μm×0.25 μm)、CP-WAXMS(60 m×250 μm×0.25 μm)色谱柱:美国安捷伦公司;聚二甲基硅氧烷(polydimethylsiloxane,PDMS)固相微萃取头、聚丙烯酸酯(polyacrylate,PA)固相微萃取头、聚二甲基硅氧烷/二乙烯基苯(PDMS/DVB)固相微萃取头;二乙烯基苯/聚乙二醇/聚二甲基硅氧烷(DVB/Carbowax/PDMS)固相微萃取头:美国Supelco公司。
1.3 实验方法
1.3.1 果酒酿造方法
以传统果酒发酵工艺为基础,参照相关文献研究[17-19],分别进行山楂酒、猕猴桃酒以及葡萄酒的酿造以及陈酿,并在酿造后0、30 d、60 d、90 d、120 d、150 d、180 d、210 d、240 d取样进行甲醇及杂醇的测定。
1.3.2 顶空固相微萃取条件的优化
将萃取头插入GC进样口中,于250 ℃老化2 h。称取2 mL样品超声5 min赶去不同果酒样品中的气泡后,置于10 mL顶空进样瓶中,插入萃取头,于不同的萃取温度下顶空萃取一段时间,于250 ℃解吸5.0 min。
根据以上条件为基础,分别比较不同的萃取头(PDMS固相微萃取头、PA固相微萃取头、DVB/Carbowax/PDMS固相微萃取头、PDMS/DVB固相微萃取头);萃取温度(40 ℃、50 ℃、60 ℃、70 ℃)、萃取时间(20 min、30 min、40 min、50 min)条件下的相对峰面积,考察不同条件对样品中甲醇及杂醇组分萃取效果的影响。
1.3.3 气相色谱条件优化
CP-WAXMS毛细管色谱柱(60 m×250 μm×0.25 μm);进样口温度220 ℃;升温程序:初始温度40 ℃,保持10 min,以5℃/min升至150℃,保持10 min,再以10 ℃/min升至270℃,保持10 min;分流比20∶1;载气为高纯氮气(N2)(99.99%);空气流速为300 mL/min;氢气流速为20 mL/min;采用氢火焰离子化检测器,温度230 ℃进样方式为取顶空进样瓶上部气体,进样体积1.0 mL。
根据以上条件为基础,分别比较了3款毛细管色谱柱[TG-35MS(60 m×250 μm×0.25 μm)、HP-5MS(60 m×250 μm×0.25 μm)、CP-WAXMS(60 m×250 μm×0.25 μm)]、不同的柱初始温度(40 ℃、45 ℃、50 ℃、55 ℃、60 ℃、65 ℃)、载气流速(10 mL/min、15 mL/min、20 mL/min、25 mL/min、30 mL/min)以及分流比(10∶1、20∶1、30∶1、40∶1)对待测8种组分分离效果的影响。
1.3.4 定性定量方法
依据标样中各组分的保留时间对样品中各组分定性,采用外标法定量。
1.3.5 方法学考察
称取适量标准品,分别配制甲醇质量浓度为0.1~50 mg/mL,正丙醇、异丙醇、异丁醇、正丁醇、异戊醇、活性戊醇、正戊醇质量浓度为0.01~5.0 mg/mL的混合标准溶液系列,并对方法的加标回收率、精密度进行测定。
1.3.6 样品分析
将不同果酒样品按气相色谱条件进行测定。并利用该方法对陈酿于常用容器中的葡萄酒(陈酿于橡木桶中)、山楂酒(陈酿于白锈钢容器中)、猕猴桃酒(陈酿于白锈钢容器中)3种果酒中的甲醇、杂醇进行测定,并跟踪测定3种果酒陈酿过程中8种组分的含量变化。
1.3.7 数据分析
实验数据均重复3次,采用IBM SPSS Statistics 24软件对数据进行显著性分析,采用Origin 8.5和TBtools软件作图。
2 结果与分析
2.1 顶空固相微萃取条件的优化
2.1.1 固相微萃取头的选择
不同类型固相微萃取头涂层材料的不同,对果酒中甲醇及杂醇的萃取效果不一样[20],比较不同类型固相微萃取头对8种组分萃取效果的影响,结果见图1。
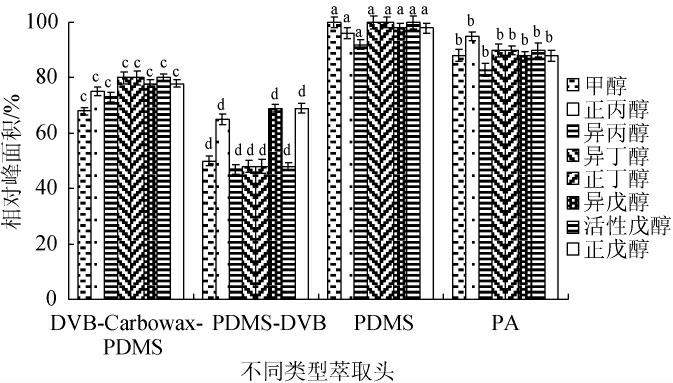
图1 不同萃取头对各组分萃取效果的影响
Fig.1 Effect of different extraction heads on extraction efficiency of each component
同组间字母不同代表有显著性差异(P<0.05)。下同。
由图1可知,PDMS固相微萃取头的顶空萃取效果最好,8种组分测定的相对峰面积都>90%,其次是PA固相微萃取头,而DVB/Carbowax/PDMS固相微萃取头和PDMS/DVB固相微萃取头对8种组分的顶空萃取效果不佳,相对峰面积<80%。这主要因为固相微萃取过程中萃取效果主要受萃取头涂层极性以及表面积的影响,非极性涂层萃取非极性化合物效果较好,果酒样品的甲醇及杂醇属偏非极性,而PDMS属于偏非极性的固相微萃取头,而Carbowax和DVB固相微萃取头更适用于偏极性化合物的萃取,因此本试验顶空萃取选择PDMS固相微萃取头。
2.1.2 萃取温度的选择
顶空萃取过程中萃取温度对萃取效果有双重作用[21-22]。萃取温度越高时,果酒中的甲醇及杂醇分子扩散速度加快,萃取时间变短;但是萃取温度越高,甲醇及杂醇在固相微萃取头的涂层中分配系数也会降低,吸附量会减小,影响萃取头的灵敏度。本研究在上述实验条件下,分别在40 ℃、50 ℃、60 ℃、70 ℃的温度下萃取60 min,比较不同萃取温度对各组分顶空吸附的影响,结果见图2。
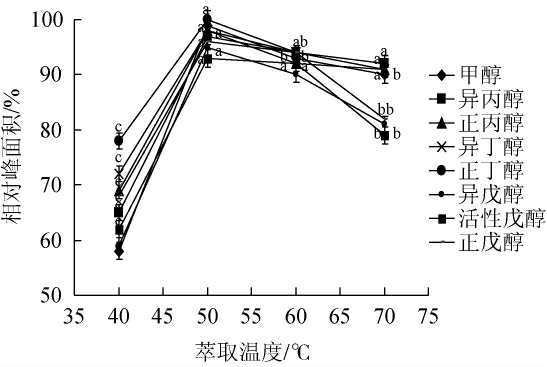
图2 萃取温度对各组分萃取效果的影响
Fig.2 Effect of extraction temperature on extraction efficiency of each component
由图2可知,50 ℃条件下的PDMS萃取头对果酒样品中的甲醇及杂醇的吸附量最大,说明在此温度下的顶空萃取效果最佳。而萃取温度为40 ℃时,甲醇及杂醇的扩散速度较慢或挥发不完全,萃取效果不佳;而萃取温度达到60 ℃以上时,样品中甲醇及杂醇组分在PDMS固相萃取头的涂层中分配系数降低,各组分的吸附量均有不同程度的减小。综合考虑,选择50 ℃作为萃取温度。
2.1.3 萃取时间的选择
不同萃取时间对果酒样品中甲醇及杂醇顶空萃取效果的影响见图3。
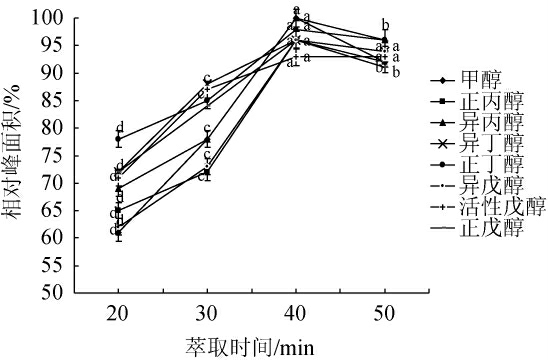
图3 萃取时间对各组分萃取效果的影响
Fig.3 Effect of extraction time on extraction efficiency of each component
由图3可知,随着顶空萃取时间的延长,固相萃取头对样品中甲醇及杂醇的吸附量逐渐增加;当萃取时间超过40 min后,固相萃取头吸附量趋于饱和,吸附能力减弱,但同时分子扩散还同时在进行,表现为甲醇及杂醇的吸附量开始有不同程度下降。因此,选择40 min作为固相微萃取时间。
2.2 气相色谱条件优化
2.2.1 色谱柱的选择
由于不同果酒经发酵陈酿后成分复杂,酒体中挥发性组分较多,易对待测组分造成干扰,故要选择一款能将待测8种目标组分分离的毛细管色谱柱,以便在后续样品分析中对目标物进行准确定量,3款毛细管色谱柱对8种待测物分离效果的影响见图4。由图4可知,TG-35MS、HP-5MS两款毛细管色谱柱分离8种待测组分时,部分目标组分分离度不佳、峰形不理想;而CP-WAXMS毛细管色谱柱由于口径小,涂层较厚,能将甲醇与杂醇分离,且异戊醇与活性戊醇这两种性质相近的杂醇也能有效被分离,能满足分离低沸点、成分复杂的果酒样品检测需求。
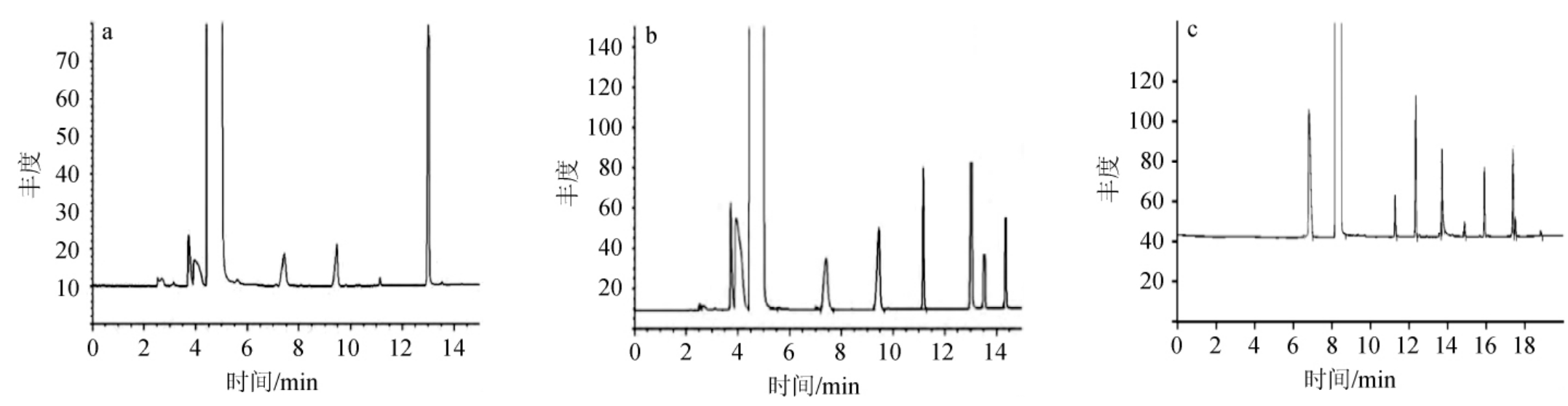
图4 不同色谱柱的分离效果
Fig.4 Separation effect of different chromatographic columns
a.TG-35MS色谱柱;b.HP-5MS色谱柱;c.CP-WAXMS色谱柱。
2.2.2 色谱条件的优化
毛细管气相色谱分析待测物组分时,在选用上述CPWAXMS毛细管色谱柱的条件下,对影响8种组分分离的其他气相色谱条件进行优化,分别比较不同的柱初始温度、载气流速以及分流比对待测8种组分分离效果的影响。结果发现,待测组分的分离度、保留时间和灵敏度均受到柱初始温度直接影响。当柱初始温度为40 ℃时,甲醇与异丙醇分离度差,之后逐步升温,发现最佳温度为50 ℃,分离效果好;而载气流速较小时,分析时间长,载气流速太大,分离效果差,最佳载气流量为15 mL/min。选择分流比时分流歧视会受到一般分流比大小的影响,通常分流歧视会因比值越大则可能性越大,比值越小,甲醇峰出现扁平现象,所以选择20∶1的分流比。故最佳色谱条件为初始温度50 ℃,载气流速15 mL/min,分流比20∶1,此时8种组分的分离效果较好,具有较高的准确度,混合标准品的气相色谱图见图5。由图5可知,此条件下各物质分离情况良好。
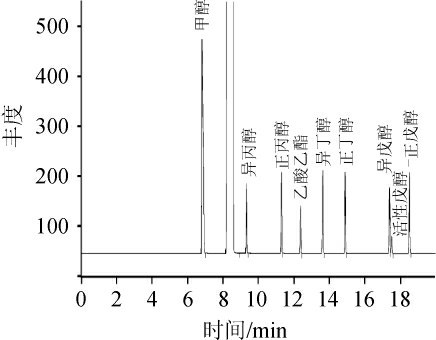
图5 甲醇及杂醇混合标准品的气相色谱图
Fig.5 Gas chromatogram of methanol and fusel mixed standards
2.3 方法学考察
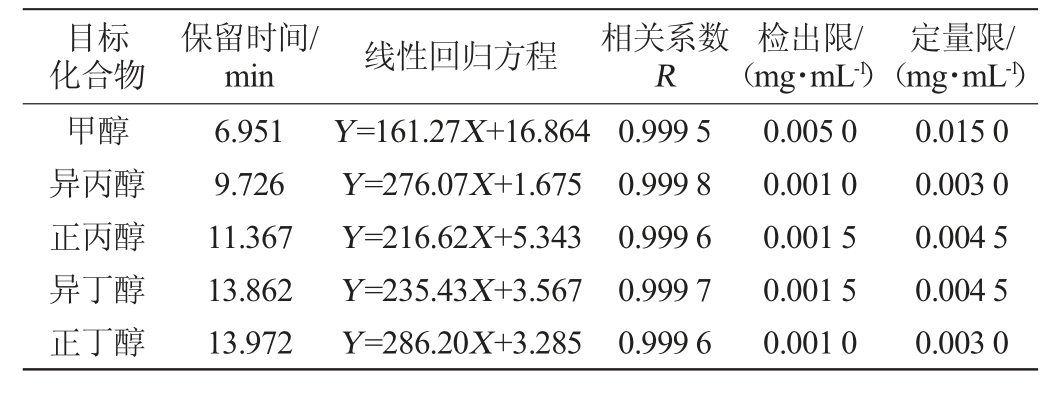
2.3.1 果酒中甲醇、杂醇的保留时间、线性回归方程、相关系数、检出限、定量限
分别配制甲醇质量浓度为0.1~50 mg/mL,正丙醇、异丙醇、异丁醇、正丁醇、异戊醇、活性戊醇、正戊醇质量浓度为0.01~5.0 mg/mL的混合标准溶液系列上机进行检测,绘制标准曲线,其中检出限(limit of detection,LOD)以信噪比(S/N)=3计算,定量限(limit of quantitation,LOQ)以信噪比(S/N)=10计算,结果如表1所示。
表1 8种组分的保留时间、线性回归方程、相关系数、检出限、定量限
Table 1 Retention time,standard curve,correlation coefficient,detection limit and quantitative limit of 8 kinds of components
续表
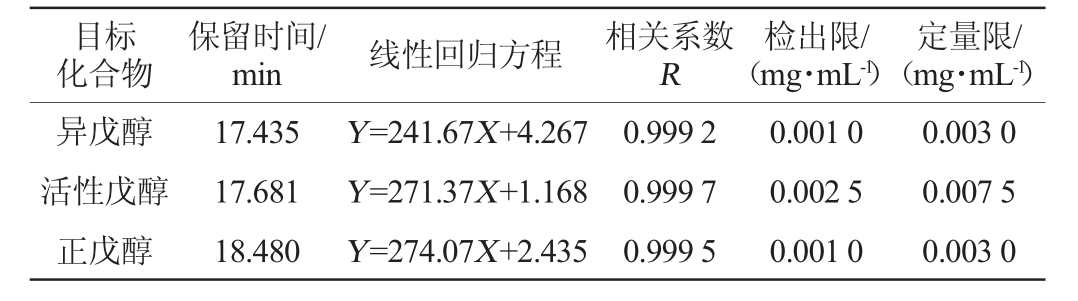
由表1可知,8种组分在标准溶液质量浓度范围内均具有良好的线性关系(R>0.999),并得到8种目标组分的检出限为0.001 0~0.005 0 mg/mL,定量限为0.003 0~0.015 0 mg/mL。
2.3.2 加标回收及精密度试验
分别添加0.010 mg/mL、0.10 mg/mL、1.0 mg/mL 3个梯度浓度的甲醇及杂醇混合溶液到已知本底浓度果酒样品中,每个水平测定5次,计算加标回收率以及相对标准偏差(relative standard deviation,RSD),试验结果见表2。
表2 方法的回收率及精密度试验结果(n=5)
Table 2 Recovery and precision test results of the method (n=5)

由表2可知,8种组分的3个水平的加标回收率为88.3%~96.7%,重复测定5次的精密度试验结果RSD范围为2.7%~5.1%,表明本实验所建立的方法能够满足检测实际样品需要的准确度和精密度,可以用于果酒样品中杂醇的分析检测。
2.4 样品中目标物的测定
按照确定的测定方法,对3种果酒6批样品进行气相色谱分析,采用外标法定量,测定结果见表3。
表3 果酒样品中醇类物质含量的测定结果
Table 3 Determination results of alcohols in fruit wine samples
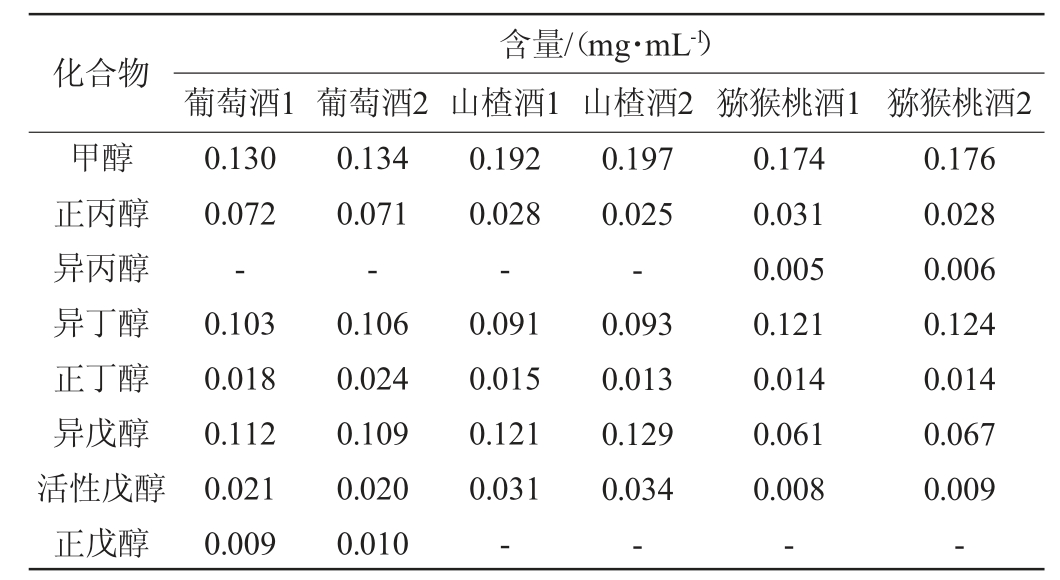
注:“-”表示未检出。
从表3可知,3种果酒成品中主要的杂醇为正丙醇、异丁醇、异戊醇,杂醇总量均<0.4 mg/mL,甲醇含量<0.2mg/mL,各组分含量适中,赋予了果酒芳香的口味和酒体的醇厚感。
2.5 陈酿时间对甲醇和杂醇含量的影响
新酿制的果酒一般需贮存一段时间,以减少新酒中的辛辣性[23-24],使酒体更绵软和适口。本研究选择3种果酒(葡萄酒、山楂酒、猕猴桃酒)为研究对象,分别研究在常用陈酿容器中陈酿240 d酒体中甲醇、杂醇含量的变化,结果分别见图6和图7。
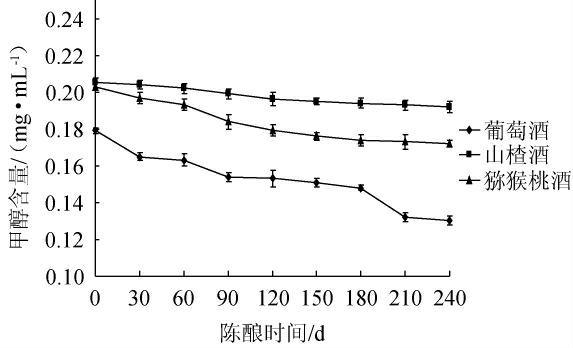
图6 陈酿时间对甲醇含量的影响
Fig.6 Effect of aging time on methanol content
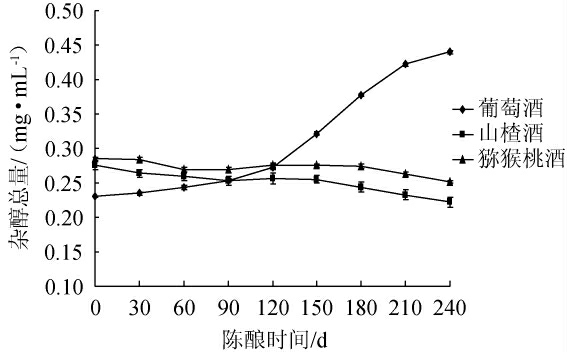
图7 陈酿时间对杂醇含量的影响
Fig.7 Effect of aging time on fusel content
由图6可知,随着陈酿时间的延长,葡萄酒中的甲醇含量下降趋势明显,陈酿240 d后甲醇含量由最初的0.181 mg/mL下降到0.139 mg/mL;而山楂酒和猕猴桃酒中的甲醇含量呈缓慢下降趋势,变化不显著。这可能是与不同果酒的酒体特性以及选用的陈酿容器有关,甲醇为低沸点易挥发物质,选用的陈酿容器气孔率越高、致密度越小,越有利于其挥发至外界中,葡萄酒陈酿时使用的橡木桶的孔隙较大,与外界气体交换率高,故葡萄酒的酒体中甲醇含量下降最多。
由图7可知,随着陈酿时间的延长,葡萄酒中的杂醇总量呈现增长趋势,陈酿240 d后杂醇总量由0.235 mg/mL上升到0.449 mg/mL;而山楂酒、猕猴桃酒中的杂醇总量随着陈酿时间的延长呈现出下降趋势。在陈酿过程中,由于杂醇的挥发性较小,随着乙醇和水的挥发,导致了杂醇总量相对浓缩;但同时杂醇也会在陈酿的过程中被酒中的溶氧缓慢氧化分解成醛,醛再被氧化成酸,这会导致杂醇含量的下降。葡萄酒在陈酿过程中,一般使用的橡木桶孔隙较大,与外界气体交换率高,这会导致含量升高的浓缩作用大于降低含量的化学反应,致使葡萄酒在陈酿过程中杂醇总量变现为上升趋势;而山楂酒与猕猴桃酒陈酿使用的不锈钢容器与气体交换率低,含量升高的浓缩作用小于降低含量的化学反应,故杂醇含量呈下降趋势。何琼等[25]研究了无花果酒陈酿期甲醇及杂醇含量的变化趋势,发现无花果酒陈酿9个月后,酒体中正丙醇、正丁醇、异戊醇的含量都随着陈酿时间的增加而呈现下降趋势,同时甲醇含量也下降了27.58%,与本研究中山楂酒与猕猴桃酒陈酿过程中的趋势相同,进一步验证了本研究的结论。这些果酒中杂醇在陈酿过程下降的原因可能是转化为相应醛类及酸类物质,如异丁醇、异戊醇可以转化形成乙酸酯,而甲醇的下降是陈酿过程中转化为了甲酸。
3 结论
该研究建立了一种利用HS-SPME-GC法同时测定果酒中甲醇和杂醇的研究方法,并优化了其试验条件,并利用建立的方法对葡萄酒、山楂酒、猕猴桃酒3种果酒陈酿过程中的甲醇、杂醇含量进行了测定。结果表明,各化合物在0.01~50 mg/mL范围内线性关系良好(R>0.999),该方法的检出限为0.001~0.005 mg/mL,定量限为0.003~0.015 mg/mL,加标回收率达到88.3%~96.7%,精密度试验结果RSD为2.7%~5.1%。随着陈酿时间的延长,3种果酒中的甲醇均有不同程度的下降,其中下降最快的是葡萄酒中的甲醇;而随着陈酿时间的延长,葡萄酒酒样中的杂醇总量呈现增长趋势,山楂酒、猕猴桃酒酒体中的杂醇总量均呈现出下降趋势。该方法准确、快速、操作简单,利用该方法可对不同果酒中甲醇、杂醇进行分析和测定,有助于提高检测和分析此类样品的效率,为果酒行业的质量改进提供试验依据。
[1]张香,秦丹,曾璐.发酵型果酒中甲醇和杂醇油的研究进展[J].中国酿造,2020,39(8):17-21.
[2]黄桂东,吴子蓥,唐素婷,等.黄酒中高级醇含量控制与检测研究进展[J].中国酿造,2018,37(1):7-10.
[3]中华人民共和国国家质量监督检验检疫总局.GB15037—2006 葡萄酒[J].北京:中国标准出版社,2006.
[4]MANETTA A C,GIUSEPPE L D,TOFALO R,et al.Evaluation of biogenic amines in wine:Determination by an improved HPLC-PDA method[J].Food Control,2016,62(2):351-356.
[5]柳新宇,石韶琦,武宇昊,等.果蔬发酵酒中高级醇的研究进展[J].中国果菜,2022,40(12):19-23.
[6]袁国亿,王春晓,何宇淋,等.酶标仪比色法检测浊米酒中高级醇含量的研究[J].食品与发酵工业,2020(11):21-26.
[7]孟雄飞,彭加强,寸宇智,等.气相色谱法同时测定酒中的甲醇、乙酸乙酯、己酸乙酯等10种成分[J].云南化工,2017,44(4):73-77.
[8]杨东升,朱齐南.低压贮藏对甜米酒高级醇和酯的影响[J].食品研究与开发,2017,38(9):200-204.
[9]黄桂东,吴子蓥,唐素婷,等.黄酒中高级醇含量控制与检测研究进展[J].中国酿造,2018,37(1):7-10.
[10]柳新宇,石韶琦,武宇昊,等.果蔬发酵酒中高级醇的研究进展[J].中国果菜,2020,20(12):19-23.
[11]张建才,孟军,王雷.比色法测啤酒中杂醇油含量的方法优化[J].中国酿造,2015,32(5):121-124.
[12]范衍琼.分光光度法测定蒸馏酒及配制酒中杂醇油[J].光谱实验室,2015,22(2):304-306.
[13]陈丽娟,郭春芳.比色法测白酒中杂醇油含量方法探讨[J].酿酒,2016,28(5):71-72.
[14]李惠民,冯锁民,张博,等.气相色谱法测定桑葚酒中甲醇限度及乙醇含量[J].中国食品添加剂,2019(7):204-208.
[15]GARDE-CERDAN T,ANCIN-AZPILICUETA C.Effect of the addition of different quantities of amino acids to nitrogen-deficient must on the formation of esters,alcohols,and acids during wine alcoholic fermentation[J].LWT-Food Sci Technol,2014,41(3):501-510.
[16]LEE Y M,YOON Y,YOON H,et al.Dietary anthocyanins against obe-sity and inflammation[J].Nutrients,2017,9(10):1089.
[17]缪成鹏,张晓红,张晓敏,等.葡萄酒醋的发酵工艺及风味的研究现状[J].现代食品,2020(19):29-32.
[18]梁艳玲,陈麒,伍彦华,等.果酒的研究与开发现状[J].中国酿造,2020,39(12):5-9.
[19]孙锐劼,李刚,刘瑶.猕猴桃果酒酿造工艺优化研究[J].现代食品,2021,32(18):109-112.
[20]IBARZ M J,CACHO J.Effect of the addition of ammonium and amino acids to musts of Airen variety on aromatic composition and sensory properties of the obtained wine[J].Food Chem,2015,89(2):163-174.
[21]李惠民,冯锁民,张博,等.气相色谱法测定桑葚酒中甲醇限度及乙醇含量[J].中国食品添加剂,2019(7):204-208.
[22]CHEN E C H.The relative contribution of Ehrlich and biosynthetic pathways to the formation of fusel alcohols[J].J Am Soc Brew Chem,2015,36(1):39-43.
[23]周扬,李思伦,李晓娟,等.百香果降酸及混合果汁酿酒研究[J].酿酒科技,2018(2):91-96.
[24]莫燕霞,殷居易,顾晓俊,等.气相-内标法测定白兰地中甲醇、乙酸乙酯、糠醛和高级醇[J].食品研究与开发,2015,36(11):150-152.
[25]何琼,郑彦伯,姜钰虹,等.无花果酒陈酿期品质变化规律探究[J].食品与发酵工业,2022,36(11):150-156.