咪唑啉酮类除草剂作为一种高选择性、高效的手性除草剂[1],主要包含咪唑乙烟酸、甲咪唑烟酸、咪唑烟酸等,这些农药广泛应用于林地、农作物及草场等[2-5],造成了农药残留[6-8]、环境污染[9-12]和生物毒性[13-17]等问题,带来食品安全隐患问题。咪唑烟酸是咪唑啉酮类除草剂中发现最早的一个品种,其农药残留通过污染土壤、水和空气等直接或间接的在动物和人类体内累积并引发长时间微剂量的慢性中毒或通过皮肤接触、呼吸吸入等途径短时间内引发急性中毒,在人体生理、自身免疫功能等方面造成伤害。我国是农药生产和消费大国,而农药使用欠缺规范化操作,致使农药污染和残留问题相对更加严重,因此,农药残留状况研究是持续的、必要的。国家标准GB 2763—2021《食品中农药最大残留限量》[18]明确规定,生乳中咪唑烟酸最大残留量为0.01 mg/kg,大豆中咪唑烟酸最大残留量为5 mg/kg。生乳和大豆是乳与乳制品和豆制饮品的重要原料,但是迄今尚无专门针对生乳和大豆原浆豆奶等豆制饮品中咪唑烟酸检测的标准方法。随着乳与乳制品和豆制饮品需求量日益增加,为防止咪唑烟酸的滥用,保证生乳和豆制饮品的品质,亟需建立生乳和豆制饮品中咪唑烟酸的检测方法。
当前咪唑烟酸残留的主要检测方法有气相色谱-质谱联用法(gas chromatography-mass spectrography,GC-MS)[19]、高效液相色谱法(high performance liquid chromatography,HPLC)[20-22]、高效液相色谱-串联质谱法(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)[23-26]。与检测方法结合的前处理方法有衍生法、基质分散法、凝胶色谱法和固相萃取法等,其中衍生法操作步骤复杂、实验条件要求多;基质分散法技术简单、快捷,但无法充分净化复杂基质的样品;凝胶色谱法对复杂基质处理的效果比较好,但操作耗时长,消耗溶剂比较多;固相萃取法有操作步骤少、使用的有机试剂少,可以有效地降低基质干扰等优点,但是目前分析样本主要是土壤、水体、药材、果蔬和谷物等,对生乳和豆制饮品的检测报道较少,沈雪等[27]采用高效液相法测定牛奶中咪唑烟酸含量和石家庄君乐宝乳业有限公司[28]检测牛乳中农药残留相关报道,但是这些方法存在灵敏度比较低,不能满足国家规定的限量要求和适用范围有限的问题。因此,建立一种生乳与豆制饮品中咪唑烟酸残留的检测方法对保障食品安全具有重要意义。
本研究考察不同前处理条件对生乳及豆制饮品中咪唑烟酸检测效果的影响,旨在开发一种简便、高效、准确测定生乳和豆制饮品中咪唑烟酸的超高效液相色谱-串联质谱(ultra high performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)检测方法。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
0.2 μm通用亲水性聚丙烯(general hydrophilicity polypropylene,GHP)滤膜、PRIME HLB和HLB固相萃取柱:美国Waters公司;氨基固相萃取柱:美国安捷伦公司;生乳样品(牛乳):来自不同牧场;豆制饮品(大豆原浆豆奶):市售。
1.1.2 试剂
咪唑烟酸标品(纯度≥98.0%):德国Dr.Ehrenstorfe公司;氯化钠(分析纯):天津市富宇商贸有限公司;乙腈、甲酸(均为色谱纯):美国Fisher公司;二氯甲烷(色谱级):德国CNW科技公司。其他试剂均为国产分析纯。
1.2 仪器与设备
TQ-D超高效液相色谱-串联质谱仪(配有电喷雾电离(electron spray ionization,ESI)源):美国Waters公司;57250-U Visiprep固相萃取(solid phase extraction,SPE)装置:美国Sigma-Aldrich集团公司;MS3 basic涡旋振荡器:德国IKA公司;BIOFUGE STRATOS台式高速冷冻离心机:美国Thermo Fisher公司;TurboVap氮吹仪:瑞典Biotage公司。
1.3 方法
1.3.1 样品前处理
提取:称取生乳、豆制饮品试样各2 g(精确到0.1 mg),分别加入乙腈10 mL,经10 min的涡旋提取后,加0.5 g氯化钠,涡旋混匀5 min,在低温条件(0~4 ℃)下,15 000 r/min离心10 min,得到上清液。
净化:采用3 mL乙腈活化HLB固相萃取柱后,将5 mL上清液转移到固相萃取柱中,再加入3 mL乙腈对固相萃取柱进行淋洗,收集全部流出液。设置氮吹仪的温度为40 ℃,用氮气(N2)吹至近干后,再采用乙腈定容至1.0 mL,经过1 min涡旋溶解后,转移至1.5 mL离心管中,在低温条件(0~4 ℃)下,20 000 r/min离心5 min后,上清液过0.22 μm滤膜,供UPLC-MS/MS测定。
在此基础上,依次考察不同提取试剂(甲酸∶乙腈=1∶999(V/V)、甲酸:乙腈=5∶995(V/V)、甲酸∶乙腈=10∶990(V/V))和固相萃取柱(氨基柱、HLB和PRIME HLB)对生乳和豆制饮品中咪唑烟酸回收率的影响,最后考察不同定溶液(乙腈、50%乙腈水溶液和20%乙腈水溶液)对咪唑烟酸峰型的影响。
1.3.2 超高效液相色谱-串联质谱条件
(1)超高效液相色谱条件
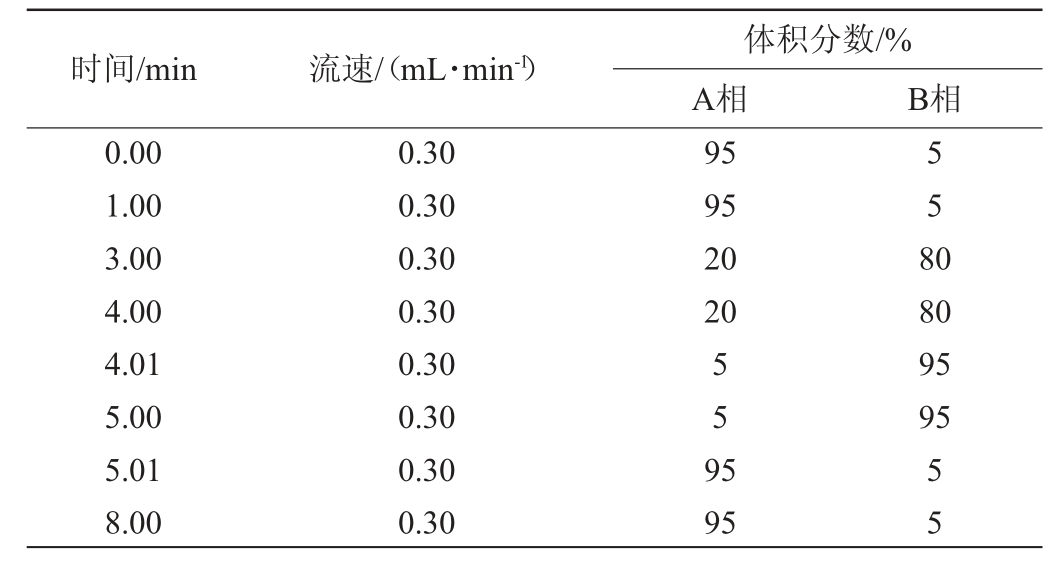
Waters C18(50 mm×2.1 mm,1.7 μm)色谱柱;A流动相为0.1%甲酸水溶液,B流动相为乙腈;柱温为35 ℃;进样体积为3 μL;梯度洗脱程序见表1。
表1 超高液相色谱的梯度洗脱程序
Table1 Gradient elution procedure of ultra high performance liquid chromatography
(2)质谱条件
电喷雾离子源正离子(ESI+)模式;离子源温度120 ℃;毛细管电压1.13 kV;脱溶剂温度350 ℃;锥孔气流量50 L/h;脱溶剂气流量800 L/h;检测方式为多反应监测(multiple reaction monitoring,MRM);其他质谱条件见表2。
表2 生乳与豆制饮品中咪唑烟酸测定的质谱参数
Table 2 Parameters of mass spectrometry for the determination of imazapyr in raw milk and soybean drinks
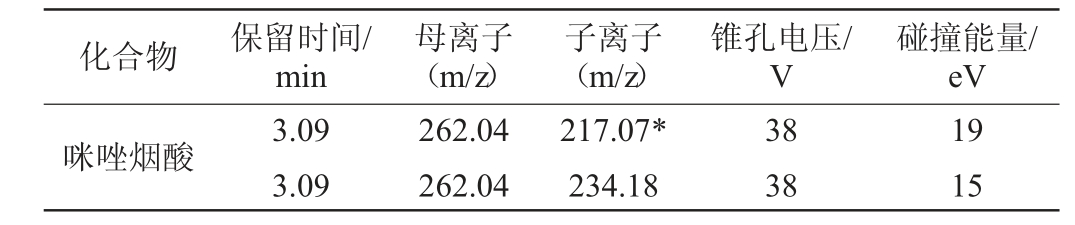
注:“*”代表定量离子对。
(3)定性定量方法
定性:根据保留时间(retention time,RT)和离子的相对丰度(relative abundance of ions)定性。
定量:采用外标法定量。
1.3.3 基质效应分析
基质标准曲线的绘制:选择5份无咪唑烟酸的样品,采用最优的前处理条件对样品进行提取、净化后,制备空白基质溶液。精密量取质量浓度为100 ng/mL的咪唑烟酸标准工作溶液20 μL、50 μL、100 μL、200 μL、300 μL至不同的进样小瓶中,分别用空白基质溶液稀释,配制成质量浓度依次为2 μg/L、5 μg/L、10 μg/L、20 μg/L、30 μg/L的系列标准工作液,采用UPLC-MS/MS测定,以峰面积(Y)为纵坐标,以质量浓度(X)为横坐标绘制基质标准曲线。
溶剂标准曲线的绘制:精密量取质量浓度为100 ng/mL的咪唑烟酸标准工作溶液20 μL、50 μL、100 μL、200 μL、300 μL至不同的进样小瓶中,分别用体积分数20%乙腈水溶液稀释,配制成质量浓度依次为2 μg/L、5 μg/L、10 μg/L、20 μg/L、30 μg/L的系列标准工作液,采用UPLC-MS/MS测定,以峰面积(y)为纵坐标,以质量浓度(x)为横坐标绘制溶剂标准曲线。
根据两种标准曲线,计算基质效应(matrix effect,ME)[29-30],其计算公式如下:
1.3.4 检出限和定量限
按照3倍信噪比(S/N)计算检出限(limit of detection,LOD),10倍信噪比(S/N)计算定量限(limit of quantitation,LOQ)。
1.3.5 回收率及精密度试验
称取无咪唑烟酸的生乳、豆制饮品试样后,添加终质量浓度分别为0.005 mg/kg、0.010 mg/kg、0.030 mg/kg的咪唑烟酸,涡旋混匀后,对样品进行提取和净化,每个水平重复试验6次,采用UPLC-MS/MS测定咪唑烟酸含量,并计算回收率和相对标准偏差(relative standard deviations,RSD)。
1.3.6 实际样品的测定
利用本研究建立的前处理方法和仪器方法对100批市售生乳和100批市售豆制饮品进行检测。
1.3.7 数据处理及分析
使用赛默飞TraceFinder 4.1 General Quan软件对数据进行采集,采用Origin 8.0绘图,采用Microsoft Excel 2016软件对数据进行处理。
2 结果与分析
2.1 前处理方法的选择
2.1.1 提取试剂的选择
根据GB/T 20769—2008《水果和蔬菜中450种农药及相关化学品残留量的测定液相色谱-串联质谱法》[31]采用乙腈作为提取试剂检测生乳和豆制饮品中的咪唑烟酸时发现,咪唑烟酸的回收率均<25%,说明目标化合物不能被完全提取,因为咪唑烟酸为两性化合物,在酸性条件下,咪唑烟酸更稳定且主要以分子状态存在,有利于有机溶剂对其提取,因此,考虑在乙腈中添加甲酸后对其进行提取,并分析比较提取试剂中不同甲酸含量对咪唑烟酸回收率的影响,结果见图1。
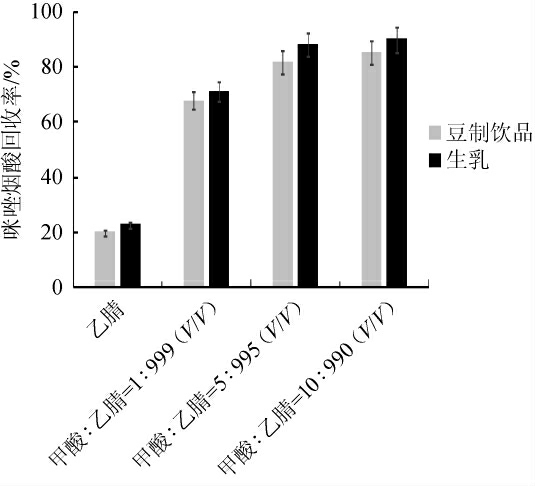
图1 不同的提取试剂对咪唑烟酸回收率的影响
Fig.1 Effect of different extraction reagents on imazapyr recovery
由图1可知,生乳和豆制饮品样品经甲酸∶乙腈=1∶999(V/V)提取后,咪唑烟酸的回收率在68%~71%之间;采用甲酸∶乙腈=5∶995(V/V)提取后,平均回收率在82%~88%之间;采用甲酸∶乙腈=10∶990(V/V)提取后,回收率在85%~90%之间,其与提取试剂甲酸∶乙腈=5∶995(V/V)相比,没有明显的提高。因此,选择使用甲酸∶乙腈=5∶995(V/V)作为提取试剂,既能保证目标化物基本上被完全提取,又可以节约酸的用量。
2.1.2 固相萃取柱的选择
分析对比氨基柱、HLB和PRIME HLB 3种不同固相萃取柱对咪唑烟酸回收率的影响,结果见图2。
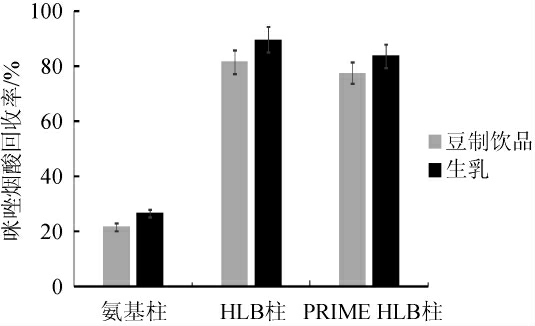
图2 不同固相萃取柱对咪唑烟酸回收率的影响
Fig.2 Effect of different solid phase extraction columns on imazapyr recovery
由图2可知,生乳和豆制饮品样品经过氨基柱净化后,部分目标峰被吸附,回收率<30%;当使用HLB、PRIME HLB柱净化时,目标化合物基本被完全淋洗下来,回收率均可达78%~90%,满足实验要求,但是PRIME HLB柱是一款新型产品,价格相对比较贵。因此,该方法选择通用型的HLB固相萃取柱进行净化。
2.1.3 定容液的选择
定容液中有机相比例高时能更有效的将咪唑烟酸溶解,但是高比例的有机相在液相分离易造成严重的溶剂效应,因此,考察乙腈、50%乙腈水溶液和20%乙腈水溶液3种定容液对咪唑烟酸峰型的影响,结果见图3。
由图3可知,当使用乙腈定容时,咪唑烟酸的色谱峰比较宽且有前延现象;当使用50%乙腈水溶液定容时,色谱峰的峰宽和前延现象有明显的改善;当使用20%乙腈水溶液定容时,色谱峰的峰宽和峰型都良好。因此,选择20%乙腈作为定容液。

图3 不同定容液对咪唑烟酸峰型的影响
Fig.3 Effect of different constant volume solutions on peak type of imazapyr
a:乙腈为定容液;b:50%乙腈水溶液为定容液;c:20%乙腈水溶液为定容液。
2.2 基质效应
在质谱检测中需要考察基质效应,因为基质效应会对分析方法的准确度、灵敏度、重复性等产生影响,表现为基质抑制或增强效应[32]。ME>100%称为基质增强效应,ME<100%称为基质抑制效应,ME在80%~120%称为弱基质效应,受基质效应影响不显著;ME在70%~80%和120%~130%之间称为较强基质效应,受基质效应影响较显著;ME在以上范围之外称为强基质效应,受基质效应影响强显著[33]。通过基质效应公式计算得到,豆制饮品的ME为85%,生乳的ME为90%。结果表明,豆制饮品和生乳的ME均在80%~120%之间,为弱基质效应,受基质效应影响不显著。因此,可以采用20%乙腈水溶液配制的标准曲线进行外标法定量。
2.3 方法的标准曲线、检出限和定量限
使用20%乙腈水溶液配制质量浓度在2.0~30.0 μg/L的咪唑烟酸标准溶液,以峰面积(y)为纵坐标,质量浓度(x)为横坐标绘制标准曲线,标准曲线回归方程为y=314.344x+17.143 3,R2=0.999 5,说明在2.0~30.0 μg/L质量浓度范围内线性关系良好。生乳和豆制饮品中咪唑烟酸的LOD均为0.002 mg/kg,LOQ均为0.005 mg/kg,可以满足分析的需要。
2.4 方法的回收率和精密度
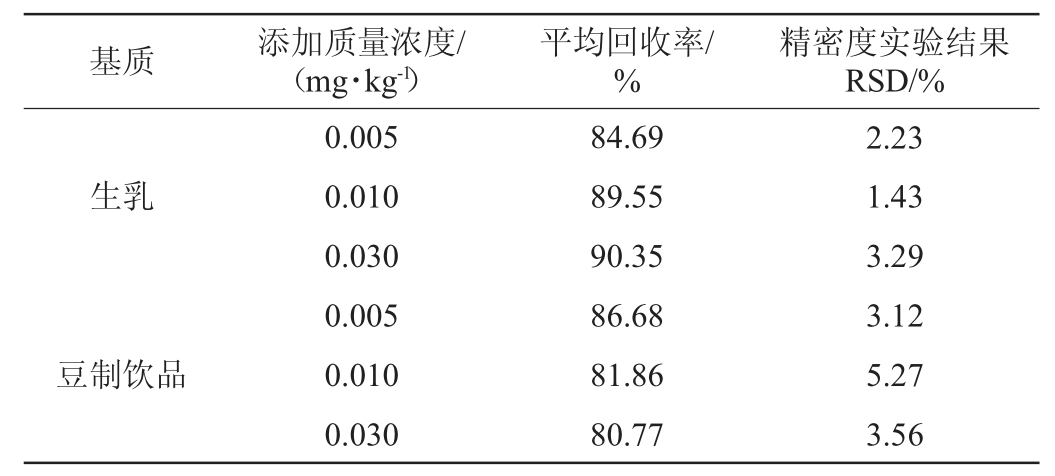
在无咪唑烟酸的生乳和豆制饮品样品中分别添加0.005 mg/kg、0.010 mg/kg和0.030 mg/kg的咪唑烟酸,进行3个质量浓度水平的加标回收率实验,各个水平进行6个平行,计算每个质量浓度水平的平均回收率和RSD,结果见表3。由表3可知,平均回收率在80.77%~90.35%之间,精密度试验结果的RSD在1.43%~5.27%之间,回收率及精密度均满足GB/T 27417—2017《合格评定化学分析方法确认和验证指南》[34]相关要求,表明该方法具有良好的准确度、精密度。
表3 方法的加标回收率和精密度实验结果
Table 3 Recovery and precision tests results of the method
2.5 实际样品的测定
利用本研究建立的前处理方法和仪器方法对100批市售生乳和100批市售豆制饮品进行检测,结果发现,咪唑烟酸均未检出。虽然当前抽检的样品均没有检出,但是介于目前农药滥用的现状,会持续对该项目进行监督检测,以降低食品安全风险。
3 结论
本研究建立UPLC-MS/MS法测定生乳和豆制饮品中咪唑烟酸残留,以甲酸∶乙腈=5∶995(V/V)溶液为提取试剂,采用通用型的HLB固相萃取柱净化,20%乙腈溶液定容,UPLC-MS/MS检测,外标法定量。该方法条件下,生乳和豆制饮品中咪唑烟酸的检出限均为0.002 mg/kg,定量限均为0.005 mg/kg,在2.0~30.0 μg/L质量浓度范围内相关系数R2>0.99,线性关系良好,在0.005 mg/kg、0.010 mg/kg、0.030 mg/kg 3个质量浓度水平下的回收率为80.77%~90.35%,精密度试验结果的RSD为1.43%~5.27%,说明该方法简便、准确、精密度好、灵敏度高和推广应用性强,适用于生乳和豆制饮品中咪唑烟酸的日常检测。
[1]HU M F,LIU K F,QIU J S,et al.Behavior of imidazolinone herbicide enantiomers in earthworm-soil microcosms:degradation and bioaccumlation[J].Sci Total Environ,2020,707:135476.
[2]边强,于淑晶,寇俊杰,等.25%咪唑烟酸水剂对非耕地杂草和狗牙根的防除效果[J].农药,2019,58(3):223-225,234.
[3]泰尔格力,蔡金宏,崔凤超,等.野牛草草坪除草剂安全施用策略[J].草地学报,2021,29(9):1865-1876.
[4]GANIE Z,JHALA A J.Weed control and crop safety in sulfonylurea/glyphosateresistant soybean[J].Can J Plant Sci,2020,100(6):629-641.
[5]GOVINDASAMY P,SINGH V,PALSANIYA D R,et al.Herbicide effect on weed control,soil health parameters and yield of Egyptian clover(Trifolium alexandrinum L.)[J].Crop Prot,2021,139:105389.
[6]沈雪,赵福阳,郑俊雅,等.粮食中咪唑啉酮类农药的检测方法研究[J].食品安全导刊,2020(9):101-102.
[7]AICHELE T A,PENNER D.Adsorption,desorption,and degradation of imidazolinones in soil[J].Weed Technol,2005,19(1):154-159.
[8]黄志勇,李汶鲜,陈艳,等.高效液相色谱法测定花生仁中甲咪唑烟酸残留[J].中国果菜,2019,39(5):22-24,61.
[9]张可鑫.5种大豆田除草剂残留的垂直分布及对后茬作物生长的影响[D].大庆:黑龙江八一农垦大学,2020.
[10]方丽,李建波.赤霉素、芸苔素对小麦上甲咪唑烟酸的解毒作用[J].农业科技通讯,2020(11):87-91.
[11]杨志富,高川,韦婧,等.固相萃取-高效液相色谱法同时检测土壤中4种咪唑啉酮类除草剂残留[J].农药学学报,2014(4):433-438.
[12]王新,侯佳文,柳文睿,等.典型咪唑啉酮类除草剂的微生物降解研究进展[J].农药学学报,2021,23(3):469-475.
[13]QU Q,ZHANG Z,LI Y,et al.Comparative molecular and metabolic responses of wheat seedlings (Triticum aestivum L.) to the imazethapyr enantiomers S-IM and R-IM[J].Sci Total Environ,2019,692:723-731.
[14]HOSEINY-RAD M,AIVAZI A A.Biochemical and cytogenetic effects of imazethapyr on Cicer arietinum L.[J].J Appl Biol Biot,2020,8(2):73-77.
[15]LIU W,ZHAO Q,ZHANG Z,et al.Enantioselective effects of imazethapyr on Arabidopsis thaliana root exudates and rhizosphere microbes[J].Sci Total Environ,2020,716:137121.
[16]包蔓欣.手性除草剂咪唑乙烟酸诱导的小麦幼苗次级代谢扰动及HO-1介导机制[D].杭州:浙江大学,2021.
[17]YAO C,SHENG J,YAN S,et al.Enantioselectivity effects of imazethapyr enantiomers to metabolic responses in mice[J].Pestic Biochem Phys,2020,168:104619.
[18]中华人民共和国国家卫生健康委员会,中华人民共和国农业农村部,国家市场监督管理总局.GB 2763—2021 食品中农药最大残留限量[S].北京:中国标准出版社,2021.
[19]丁立平,福清出入境检验检疫局综合技术服务中心.一种测定豆粉中三种痕量咪唑啉酮类除草剂的气相色谱-质谱联用法:CN201811163760.9[P].2019-01-18.
[20]陈夏娇.咪唑烟酸的高效液相色谱法测定[J].广西植保,2014,27(2):15-17.
[21]阚晓丽,朱利利,包素萍.高效液相色谱法测定咪唑烟酸原药[J].农业科学与管理,2014,35(6):33-35.
[22]李成,锁然,王凤池,等.固相萃取-高效液相色谱法同时检测红小豆中咪唑啉酮类除草剂[J].中国食品学报,2008,8(5):142-147.
[23]李成,锁然,王凤池,等.高效液相色谱-串联质谱法同时测定红小豆中残留的6种咪唑啉酮类除草剂[J].色谱,2008,26(6):726-730.
[24]刘思洁,方赤光,李青,等.超高效液相色谱-质谱法测定粮食中三嗪类和咪唑啉酮类除草剂的残留[J].农业与技术,2012,32(2):7-10,18.
[25]张玉婷,李娜,邵辉,等.超高效液相色谱-串联质谱法测定人参、黄芪中多种除草剂残留量[J].分析实验室,2011,30(8):27-32.
[26]张璐,孔祥虹,何强,等.Turbo flow在线净化-超高效液相色谱-串联质谱法检测水果中5种咪唑类农药残留[J].色谱,2014(6):559-565.
[27]沈雪,赵福阳,吴越,等.高效液相色谱法测定牛奶中咪唑啉酮类除草剂-灭草烟的含量[J].食品安全导刊,2021(23):73-74.
[28]石家庄君乐宝乳业有限公司.牛乳中农药残留含量测定的样品前处理及检测方法:CN202110619647.2[P].2021-10-01.
[29]张立佳,胡雪,文静,等.UPLC-MS/MS同时检测婴幼儿配方乳粉中氯酸盐和高氯酸盐残留[J].中国酿造,2021,40(6):162-166.
[30]ZHAO X,KONG W,WEI J,et al.Gas chromatography with flame photometric detection of 31 organophosphorus pesticide residues in Alpinia oxyphylla,dried fruits[J].Food Chem,2014,162(11):270-276.
[31]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 20769—2008 水果和蔬菜中450种农药及相关化学品残留量的测定液相色谱-串联质谱法[S].北京:中国标准出版社,2008.
[32]韩世明,李志,王月霞,等.基于QuEChERS-GC-MS/MS法同时测定猕猴桃中15种有机磷农药残留[J].中国酿造,2022,41(5):223-228.
[33]周雨佳,张菊华,李涛,等.气相色谱法检测辣椒中有机磷农药的基质效应[J].湖南农业科学,2022(6):67-71.
[34]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 27417—2017 合格评定化学分析方法确认和验证指南[S].北京:中国标准出版社,2017.