红曲是指以大米为原料,接种红曲霉经固态发酵而成的红曲米[1]。现代研究表明,红曲发酵产物含有莫纳克林K、红曲色素、γ-氨基丁酸、支链氨基酸、麦角固醇、酶类活性物质等多种有益成分[2-3]。莫纳克林K是红曲发酵产物中的主要活性成分,莫纳克林K以酸型(开环)和内酯型(闭环)两种形态存在,其中内酯型莫纳克林K的稳定性较酸型莫纳克林K更高。在酸性条件下,酸型莫纳克林K会向内酯型不断转化[3],内酯型莫纳克林K具有降血脂、降胆固醇的活性。
羟甲基戊二酰单酰辅酶A(hydroxymethylglutaryl CoA,HMG-CoA)还原酶是人体中胆固醇生物合成限速酶,而莫纳克林K可以与HMG-CoA还原酶受体竞争性结合,从而抑制HMG-CoA还原酶活性,进一步减少胆固醇的合成[4-5]。同时,莫纳克林K还可以通过提升肝细胞膜上的低密度脂蛋白受体的数量、活性及其亲和力,促使胆固醇转化为胆汁而排出体外,从而降低血浆中的胆固醇含量[6]。
在提高红曲发酵产物中莫纳克林K的方法中,常见的有菌种分离鉴定[7],发酵工艺优化[8]、诱变育种[9]、基因编辑[10]等方法;还有一些新兴的育种技术,如常压室温等离子体[11]、氮离子束[12]、高能混合粒子场[13]等。紫外诱变即通过以紫外线照射微生物,促使微生物核酸上的嘌呤和嘧啶碱基生成嘧啶二聚体,从而阻碍碱基之间的正常配对,导致微生物发生突变甚至死亡,提高突变频率,通过适当的方法筛选育种[14]。共酵培养则是通过将红曲霉菌与其他菌液混合一起参与发酵,目前已报道的研究表明,红曲霉菌与多种酵母进行共酵均可提高发酵产物中莫纳克林K含量[15-16]。但以往研究中大多只采用一种方法提高莫纳克林K产量,对同时采用紫外诱变和共酵的研究报道较少。该研究选用紫外诱变筛选红曲菌株,结合与酿酒酵母共酵培养的方法,以期进一步提高红曲发酵产物中莫纳克林K含量。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与试剂
紫色红曲霉(Monascus purpureus)MY-11:实验室保藏;酿酒酵母(Saccharomyces cerevisiae)2.2084:中国普通微生物菌种保藏管理中心;葡萄糖、七水硫酸镁、无水氯化钙、磷酸二氢铵、蛋白胨(均为分析纯或生化试剂)、体积分数为95%乙醇(分析纯):国药集团化学试剂公司;大米粉:五常市万福米业有限公司;土豆:市售;马铃薯葡萄糖琼脂培养基:北京陆桥技术股份有限公司;乙腈、三氟乙酸(均为色谱纯):美国Fisher公司;莫纳克林K标准品(色谱纯):中国食品药品检定研究院;超纯水:实验室自制。
1.1.2 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:取PDA培养基干粉46.0 g,加入1 000 mL 蒸馏水中,121 ℃高压灭菌30 min,备用。
液体发酵培养基[17]:葡萄糖80 g/L,蛋白胨10 g/L,NH4H2PO4 2 g/L,MgSO4·7H2O 0.5 g/L,CaCl2 0.1 g/L,以土豆汁溶解上述药品,121 ℃灭菌20 min。
大米培养基[18]:大米粉38.5%,麸皮7.5%,水50%,葡萄糖2.5%,蛋白胨1.5%,pH值为5,121 ℃灭菌20 min。
1.2 仪器与设备
ZHWY-2102恒温培养振荡器:上海智诚有限公司;LRH-250-HSE恒温恒湿培养箱:珠江泰宏君仪器设备有限公司;BXM-110VE立式压力蒸汽灭菌器:上海博讯医疗生物仪器股份生物有限公司;WGL-230B电热鼓风干燥箱、FW80高速万能粉碎机:天津市泰斯特仪器有限公司;岛津LC-20AT型高效液相色谱(high performance liquid chromatography,HPLC)仪:日本岛津公司;KQ5200DE型超声波清洗机:昆山合创超声仪器有限公司;METTLER XPE205DR型电子天平:梅特勒托利多公司;超纯水仪:美国PALL公司。
1.3 方法
1.3.1 孢子菌悬液的制备
取一支斜面菌种,加入少量无菌水,用接种环刮下斜面上的孢子,装入三角瓶中振摇15 min,使孢子充分散开,用带有4层擦镜纸漏斗过滤掉菌丝,定容至50 mL,制成孢子菌悬液。
1.3.2 紫外诱变方法[19]
取6份10 mL孢子菌悬液于无菌培养皿中,置于15 W紫外灯下30 cm处,分别照射0、10 s、20 s、30 s、40 s、60 s。取诱变后各照射时间段孢子悬液0.5 mL,稀释至10-4。取各稀释液0.1 mL涂布于固体培养基,30 ℃避光培养7 d,记录平板菌落数,计算诱变致死率,其计算公式如下:

1.3.3 菌株筛选
紫色红曲霉初筛[20]:观察平板上长出的菌落,挑取生长速度较快或形态、颜色变化的菌株转接到PDA培养基30 ℃培养。
紫色红曲霉复筛:将筛选得到的红曲霉菌株按照5%(V/V)接种于液态发酵培养基中,30 ℃摇床培养2 d。吸取液体种子于大米培养基中,搅拌混匀,30 ℃培养25 d,得到红曲。按照1.3.6步骤进行莫纳克林K的检测,筛选莫纳克林K含量高的诱变菌株。
1.3.4 遗传稳定性实验
将筛选得到的高产莫纳克林K的诱变菌株接种到PDA斜面培养基上,连续转接5代,相同条件下发酵培养,通过HPLC法测定每代菌株发酵液的莫纳克林K含量,分析诱变菌株的遗传稳定性。
1.3.5 共酵培养
将酿酒酵母于12°Bx的麦芽汁中进行活化,28 ℃活化24 h,得到酵母菌液。将诱变菌株接种于液体发酵培养基中,30 ℃振荡培养48 h,得到红曲霉菌液。
将酵母菌液和红曲霉菌液接入大米培养基内,20%(以大米培养基为基准)红曲菌液体分别与0、1%、2%、3%、4%(109 CFU/mL)的酵母菌液进行共酵培养,搅拌混匀,30 ℃培养25 d,得到红曲。
1.3.6 莫纳克林K的测定
取红曲采用HPLC法进行莫纳克林K的检测。红曲于90 ℃干燥24 h后,用高能粉碎机粉碎成红曲粉。检测红曲粉中酸型莫纳克林K和内酯型莫纳克林K的含量[21]。
1.3.7 数据处理与分析
实验数据用Excel 2016软件进行整理和统计和分析。
2 结果与分析
2.1 不同紫外照射时间下的致死率
不同紫外照射时间对致死率的影响结果见图1。对红曲霉菌MY-11进行紫外诱变,采用致死率来考察紫外线对红曲霉的损伤作用。为获得较高的正突变率,方便诱变菌株的筛选,选取致死率在70%~80%的最佳[22]。由图1可知,紫外诱变剂量达到20 s时,红曲菌的致死率达到76%,所以确定紫外诱变的最佳照射时间为20 s。
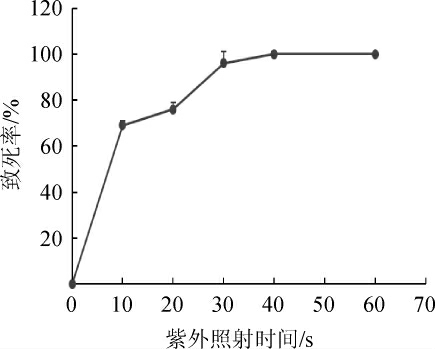
图1 紫外诱变时间对致死率的影响
Fig.1 Effect of UV mutation time on lethality
2.2 产莫纳克林K菌株的筛选
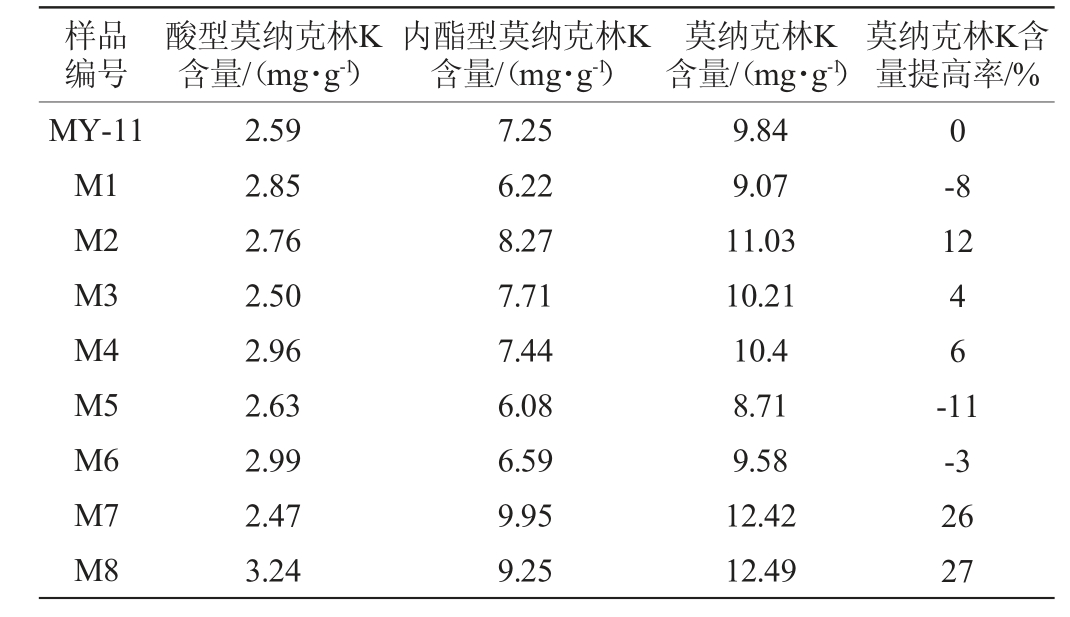
以紫色红曲霉MY-11为出发菌株进行紫外诱变,经菌落形态初筛,获得紫外诱变菌株8株,编号为M1~M8,分别对其进行固态发酵并测定莫纳克林K的含量,检测其是否高于出发菌株莫纳克林K的含量,测定结果见表1。由表1可知,与出发菌株相比,诱变菌株M7、M8的莫纳克林K的含量均有较大提高,含量分别达到了12.42 mg/g、12.49 mg/g;相比出发菌株MY-11分别提高了26%、27%,因此选择诱变菌株M7和M8作为共酵培养的菌种。
表1 红曲霉MY-11紫外诱变菌株复筛结果
Table 1 Rescreening results of UV mutagenesis strains of Monascus MY-11
2.3 诱变菌株M7、M8产莫纳克林K的稳定性
单一紫外诱变初筛效果较好,但紫外诱变后的突变菌株性状具有不稳定性,传代培养过程中会出现性状衰退,需要遗传稳定性试验进行验证。对M7和M8分别连续传代5次,进行固态发酵实验,并检测其莫纳克林K产量,结果见表2。
表2 红曲霉诱变菌种的遗传稳定性
Table 2 Genetic stability of mutated Monascus strain
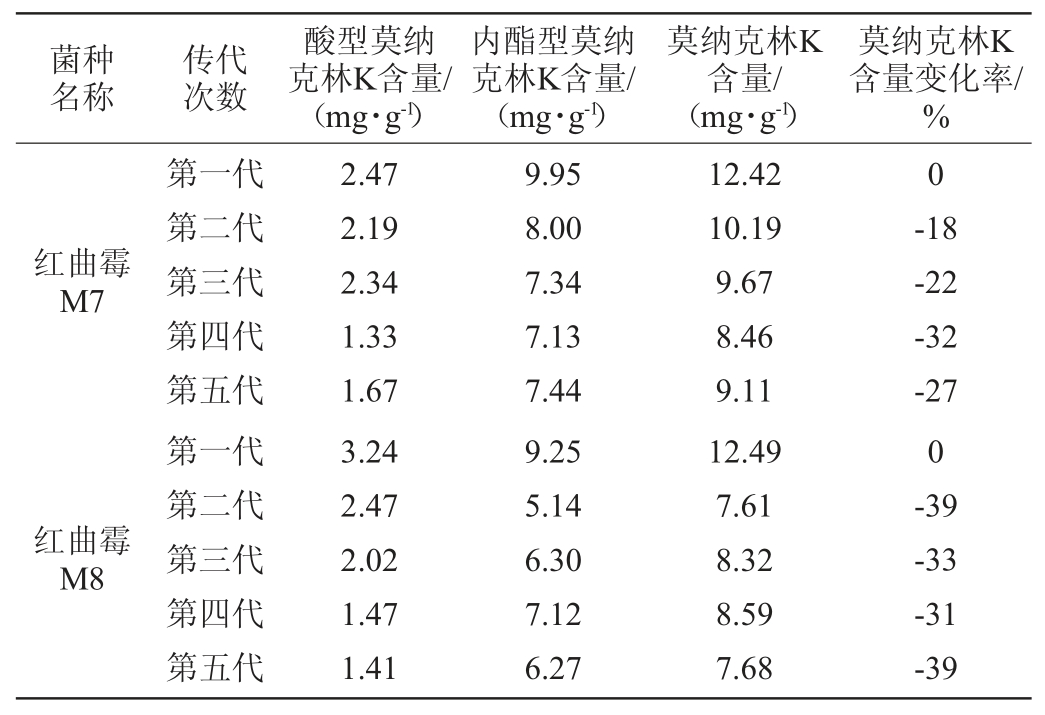
由表2可知,诱变菌株M7、M8传代5次后,红曲霉M7、M8传代培养发酵的莫纳克林K含量均有不同程度的下降,红曲霉M8的衰减幅度明显高于红曲霉M7,M7的遗传稳定性优于M8,与第一代菌株相比,第五代的菌株莫纳可林K产量分别降低了27%和39%。可能是因为单一的紫外诱变使得菌株易产生“疲劳效应”,引起菌种的活性代谢物质减少[23]。
2.4 共酵培养对莫纳克林K含量的影响
由于单一的紫外诱变方法使得红曲霉产莫纳克林K能力呈现衰退的趋势,有研究表明,红曲霉菌与多种酵母进行共酵均可提高发酵产物中莫纳克林K含量[15-16]。因此该研究采用与酵母共酵的方法继续提高红曲霉诱变菌株产莫纳克林K的能力。为探究酵母共酵对莫纳克林K产量的影响,以第5代的紫外诱变筛选菌株M7、M8为研究对象,分别与不同添加量酵母菌菌液共酵25 d,测定菌株的莫纳克林K产量,结果见表3。
表3 红曲霉M7、M8分别与酵母固态共酵25 d的莫纳克林K含量测定结果
Table 3 Determination results of Monaklin K content of solid-state fermentation Monascus strains M7 and M8 with yeast for 25 d
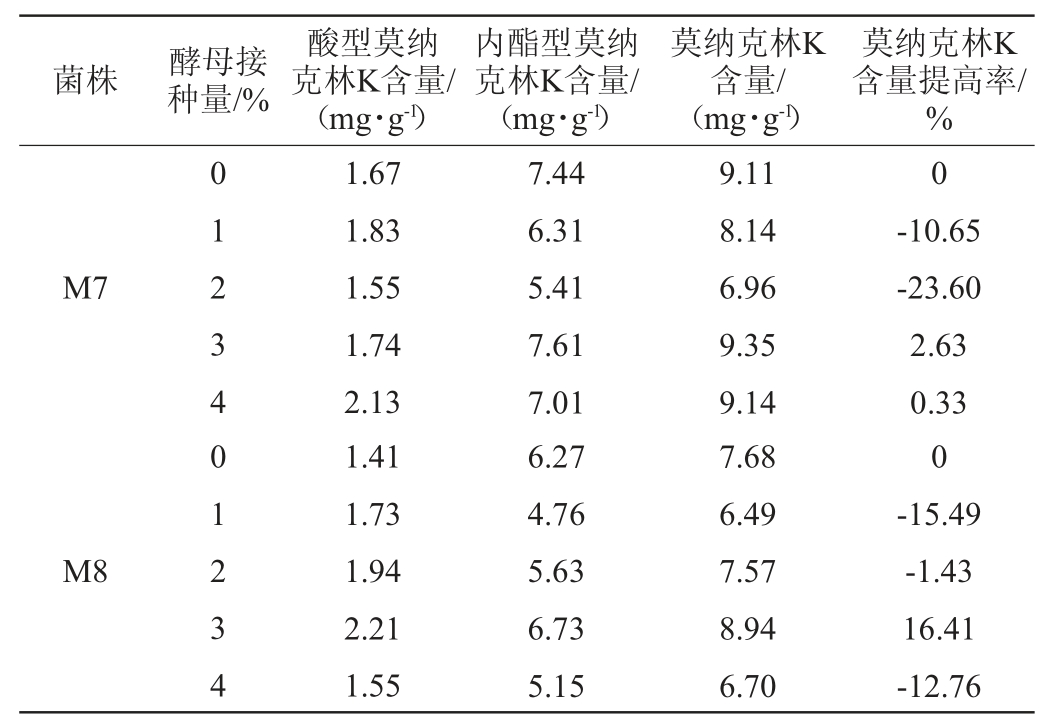
由表3可知,酵母接种量的大小会影响红曲霉M7发酵的莫纳克林K含量。适宜的接种量有利于微生物的生长代谢和次级代谢产物的积累[24-25]。当酵母接种量为3%时,红曲霉M7发酵的莫纳克林K含量最高为9.35 mg/g,相比不加酵母液,提高了2.63%。同样,当酵母接种量为3%时,红曲霉M8发酵的莫纳克林K含量最高为8.94 mg/g,相比不加酵母液提高16.41%。当接种量小于3%时,莫纳克林K的含量较低,推测酵母在固态发酵过程中与红曲霉共酵,释放出较少对莫纳克林K产量提高有益的诱导因子,不足以使产量显著提高。当接种量大于3%时,可能是由于引入的水分较多,不利于菌体的生长。可能由于红曲霉与酵母共酵生长,能够持续释放更多对莫纳克林K有益的诱导因子,使得含量提高[16]。朱蕊等[16]做过类似的研究,加入酵母共酵使得洛伐他汀的含量可达12.93 mg/g。综上,添加适量的酵母菌对固态发酵有益,对于红曲霉M7、M8,加入3%的酵母菌液共酵均能提高莫纳克林K产量。
3 结论
为提高红曲霉固态发酵产莫纳克林K能力,加快红曲霉固态发酵生产莫纳克林K工业化进程。该研究以红曲霉MY-11为原始菌株,经紫外诱变筛选出M7、M8两株诱变菌株,其莫纳克林K含量分别达到了12.42 mg/g、12.49 mg/g;相比原始菌株MY-11分别提高了26%、27%。单一的紫外诱变方法使得红曲霉产莫纳克林K能力呈现衰退的趋势,将诱变菌株M7、M8分别与酿酒酵母共酵培养25 d,发现加入3%的酵母菌液共酵均能提高莫纳克林K产量,对比不加酵母液,分别提高了2.63%、16.41%。总体来说,单一紫外诱变相比共酵在提高菌株产莫纳克林K含量上具有较大的优势,但紫外诱变存在遗传稳定性不足的缺陷,紫外诱变筛选结合共酵培养方法会提高红曲中莫纳克林K含量。后续研究采用复合诱变、优化诱变菌株的发酵工艺等方法解决遗传稳定性不足等问题。
[1]黄志兵,许杨,张泓,等.红曲菌几种主要次级代谢产物及其生物活性的研究进展[J].食品与发酵工业,2010,36(4):143-148.
[2]逯慎杰,刘秀河.功能性红曲中功能成分的研究进展[J].江苏调味副食品,2011,28(1):17-21.
[3]蒋沅岐,董玉洁,周福军,等.红曲的化学成分、药理作用及临床应用研究进展[J].中草药,2021,52(23):7379-7388.
[4]游玟娟.产洛伐他汀的红曲霉诱变育种研究[J].轻工科技,2016,32(9):14-15,18.
[5]李滔滔,李小龙,张凤琴.高产洛伐他汀红曲菌株的诱变选育[J].食品工业科技,2012,33(24):246-248,388.
[6]胡伟莲,戴德慧.红曲霉MY9原生质体诱变育种及遗传稳定性研究[J].食品研究与开发,2013,34(18):78-81
[7]吴芳彤.高产洛伐他汀红曲菌的分离鉴定及其红曲发酵条件的优化[D].福州:福建农林大学,2014.
[8]赵秀举,刘志国.红曲洛伐他汀发酵条件优化及降脂功能[J].中国酿造,2014,33(1):32-35.
[9]游玟娟,温拥军,李援.高产洛伐他汀红曲霉复合诱变育种[J].食品工业科技,2014,35(22):213-215,225.
[10]唐光甫,桂艳玲,满海乔,等.利用CRISPR/Cas 9编辑红曲霉pyrG基因对其次生代谢的影响[J].生物技术通报,2022,38(9):1-8.
[11]祁田甜,张婵,胡济美,等.常压室温等离子体诱变技术选育高产Monacolin K 紫色红曲霉突变株[J].食品科学,2015,36(9):66-70
[12]李阔阔,王钰,万田,等.高产洛伐他汀红曲霉氮离子束诱变育种[J].食品与发酵工业,2016,42(4):98-102.
[13]郎天丹,梁健,王成涛,等.利用高能混合粒子场诱变选育高产Monacolin K、低产桔霉素的红曲霉菌株[J].食品工业科技,2016,37(2):165-169.
[14]陈秉梅.高产洛伐他汀红曲霉菌诱变育种研究进展[J].广东化工,2020,47(15):106-107.
[15]SUN J L,ZOU X,LIU A Y,et al.Elevated yield of monacolin K in Monascus purpureus by fungal elicitor and mutagenesis of UV and LiCl[J].Biol Res,2011,44(4):377-382
[16]朱蕊,彭林,刘双平,等.高产洛伐他汀红曲菌的筛选及菌种共酵对红曲固态发酵的影响[J].食品工业科技,2019,40(11):168-173,177.
[17]吴双双,刘文龙,邓雪菲,等.紫外-化学诱变筛选高产莫纳可林K或色素的红曲菌株[J].中国酿造,2018,37(11):116-121
[18]李同乐,刘秀河,颜丽.功能性红曲发酵条件的优化[J].中国酿造,2019,38(3):144-148.
[19]麻成金,黄群,傅伟昌,等.红曲霉紫外诱变选育及其发酵特性研究[J].食品科学,2009,30(19):181-184.
[20]李玲,陈凯,王贻莲,等.高产Monacolin K的红曲霉诱变育种[J].科学技术与工程,2018,18(3):189-194.
[21]李雪梅,薛岚,符鹏,等.HPLC法测定血脂康胶囊中洛伐他汀和洛伐他汀酸的含量[J].中国药师,2012,15(2):164-166.
[22]夏诗棋,管轶男,付正,等.高产Monacolin K红曲霉菌株选育及发酵条件的优化[J].中国酿造,2017,36(8):62-66.
[23]王雅君,陈力力,廖杰琼,等.微生物物理诱变育种方法的研究进展[J].农产品加工(学刊),2013(3):25-31.
[24]毛继龙,张建辉,王璨,等.一株高产洛伐他汀红曲霉的筛选与液态发酵条件优化[J].微生物学通报,2022,49(6):2221-2232.
[25]蒲立柠,陈光静,阚建全.响应面试验优化青稞麸皮薏仁红曲霉发酵工艺[J].食品科学,2017,38(2):264-270.