几丁质和胶原蛋白都属于难降解的有机高分子化合物。几丁质酶是几丁质生物降解的关键酶类,广泛存在于各类物种中[1]。利用几丁质酶降解几丁质生产几丁寡糖和壳聚糖等降解产物的方法具有反应条件温和、绿色环保等优点[2]。胶原蛋白酶是一类能够在适宜条件下水解胶原蛋白,并且不损伤其他蛋白和结构的酶类[3]。利用胶原蛋白酶水解胶原蛋白,产物多为多肽和L-氨基酸,具有反应条件温和、耗时短、无污染、产品营养价值高、产物易于消化吸收等优点[4]。并且微生物胞外酶还具有来源广、可分泌到胞外、生产周期短、易发酵、易提取、操作性强、经济效益好等优点,在医学、食品、化工和饲料等领域具有广阔的应用前景和现实意义[5-6]。
目前比较常见的产几丁质酶细菌有气单胞菌属、沙雷氏菌属、弧菌属和芽孢杆菌属[7]。有研究表明,来自枯草芽孢杆菌的几丁质酶在将废弃的粗制蟹壳转化为N-乙酰葡糖胺时的效果优于作为商业化产品的灰色链霉菌的几丁质酶,转化率可达60%[8]。LI Z K等[9]研究发现,产几丁质酶的珊瑚球菌EGB和链霉菌DA11对植物病原体米曲霉、黑曲霉和白色念珠菌有抑制效果。此外,有研究者通过优化菌株发酵生产几丁质酶的工艺来制备几丁寡糖或几丁单糖[10-11]。目前研究较多的产胶原蛋白酶细菌主要有溶组织梭菌、产气荚膜梭菌和溶藻弧菌[12],其制备的胶原蛋白酶已作为商品酶进行出售。来自假交替单胞菌SM9913的胶原蛋白酶MCP-01在肉味改善和肉质嫩化方面表现出良好的应用潜力[13]。但细菌在应用过程中可能会存在一定的安全风险,如某饲料添加剂中的蜡状芽孢杆菌因携带含四环素耐药基因(tetracyclin resistant gene B,tetB)的质粒,存在潜在的安全风险而被停用[14]。
前期实验从环洞庭湖水系的3个淡水湖渔场的表层底泥中筛选得到5株降解有机高分子化合物的细菌,其中2株为产几丁质酶菌株,3株为产胶原蛋白酶菌株,但尚不了解这5株产酶菌株的生物安全性。本研究以筛选到的2株产几丁质酶菌株及3株产胶原蛋白酶菌株为研究对象,对其酶活力进行分析,对菌株进行分子生物学鉴定,并通过药敏实验、溶血性实验、氨基酸脱羧酶活性和硝酸还原酶活性检测实验对其安全性进行评价,以期为产酶菌株的开发和利用奠定科学基础,更好地实现产酶菌株的工业化应用,并充分开发菌株的利用价值。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
2株降解几丁质的菌株:菌株AL1分离自汉寿县安乐湖表层底泥,菌株BM1分离自澧县北民湖表层底泥;3株降解胶原蛋白的菌株:菌株ALJ1分离自汉寿县安乐湖表层底泥,菌株BMJ1分离自澧县北民湖表层底泥,菌株DJ2分离自华容县东湖表层底泥。所有菌株都保存于本实验室。
1.1.2 试剂
EasyTaq  脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶、EasyPure
脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶、EasyPure  细菌基因组DNA提取试剂盒、核酸染料GelStain GS101-02:北京全式金生物技术股份有限公司;硝酸还原酶活性测定试剂盒:南京建成生物工程研究所;含抗生素的滤纸片(直径6 mm):湖南比克曼生物科技有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、L-赖氨酸、L-精氨酸、L-鸟氨酸:上海麦克林生化科技有限公司;所用试剂均为分析纯或生化试剂。
细菌基因组DNA提取试剂盒、核酸染料GelStain GS101-02:北京全式金生物技术股份有限公司;硝酸还原酶活性测定试剂盒:南京建成生物工程研究所;含抗生素的滤纸片(直径6 mm):湖南比克曼生物科技有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、L-赖氨酸、L-精氨酸、L-鸟氨酸:上海麦克林生化科技有限公司;所用试剂均为分析纯或生化试剂。
1.1.3 培养基
血琼脂平板培养基:江门市凯林贸易有限公司;LB液体/固体培养基:按照文献[15]配制;明胶发酵培养基:按照文献[16]配制。上述培养基均采用115 ℃高压蒸汽灭菌30 min。
氨基酸脱羧酶测定培养基:0.5%蛋白胨,0.3%酵母粉,0.1%葡萄糖,0.1%1.6%溴甲酚紫-乙醇溶液,0.5%L-赖氨酸/L-精氨酸/L-鸟氨酸(对照组不加氨基酸),pH 6.8,115 ℃高压蒸汽灭菌10 min。
胶体几丁质发酵培养基:0.2%蛋白胨、0.1%葡萄糖、0.2%酵母粉、0.03%KH2PO4、0.07%K2HPO4、0.002%FeSO4、0.05% MgSO4·7H2O、0.001% ZnSO4、0.3%胶体几丁质,蒸馏水配制,pH 7.5,115 ℃高压蒸汽灭菌30 min。
1.2 仪器与设备
THZ-98C恒温振荡器:上海一恒科学仪器有限公司;5417R台式冷冻离心机:德国艾本德股份公司;Synergy HTX酶标仪:美国伯腾仪器有限公司;TC-96/G/H(b)C基因扩增仪:杭州博日科技有限公司;SPX-250生化培养箱:北京中兴伟业仪器有限公司;KW-1000DC HH恒温水浴锅:金坛市中大仪器厂;JY96-IIN超声波细胞粉碎机:宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 有机高分子化合物降解菌产酶活力的测定
(1)几丁质酶活测定
菌液按1%接种量接种于胶体几丁质发酵培养基中,28 ℃、180 r/min振荡培养3 d,取发酵液上清,采用DNS法[17]进行几丁质酶活测定。以N-乙酰葡糖胺浓度(μmol/mL)(X)为横坐标,OD550nm值(Y)为纵坐标绘制N-乙酰葡糖胺标准曲线,得到标准曲线回归方程Y=0.789X-0.145。根据回归方程计算筛选菌株产几丁质酶活。
几丁质酶活单位定义:在28 ℃、pH 7.5的条件下,1 mL酶液每小时催化产生1 μmol还原糖所需的酶量为一个酶活单位(U)。
(2)胶原蛋白酶活测定
菌液按0.1%接种量接种于明胶发酵培养基中,28 ℃、180 r/min振荡培养1 d。取发酵液上清,采用甘氨酸-茚三酮显色法[18]进行胶原蛋白酶活测定。以甘氨酸质量浓度(μg/mL)(X)为横坐标,OD570nm值(Y)为纵坐标,绘制甘氨酸标准曲线,得到标准曲线回归方程Y=0.006 86X+0.026 09。根据回归方程计算筛选菌株产胶原蛋白酶活。
胶原蛋白酶活单位定义:在28 ℃、pH 7.5的条件下,1 mL酶液每分钟水解胶原蛋白产生相当于1 μg甘氨酸的酶量为一个酶活单位(U)。
1.3.2 分子生物学鉴定
DNA提取:采用EasyPure 细菌基因组DNA提取试剂盒提取细菌基因组DNA。
细菌基因组DNA提取试剂盒提取细菌基因组DNA。
16S rDNA基因序列的扩增:以上述DNA为模板,使用细菌通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-TACGGCTACCTTGTTACGACTT-3')进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,PCR扩增体系和PCR扩增程序参考文献[19]中的方法。
16S rDNA基因序列的测序及分析:将扩增得到的DNA片段送至擎科生物科技有限公司测序,测序结果通过美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank数据库和Eztaxon数据库中的序列进行比对。随后将菌株及其近缘种的16SrRNA基因序列通过分子进化遗传分析(molecular evolutionarygenetics analysis,MEGA)7.0软件的Clutal W程序进行比对,在MEGA 7.0中使用邻接(neighbor joining,NJ)法构建系统发育树。用Bootstrap值分析(1 000个重复)来评估进化树的拓扑关系,并使用Jukes和Cantor提出的模型对进化距离进行计算。
1.3.3 菌株的安全性评价
(1)抗生素敏感性检测
采用常规纸片扩散法(Kirby-Bauer,K-B)对5株降解有机高分子化合物的细菌进行抗生素敏感性检测实验[20]。依据抑菌圈直径大小结合《药敏试验纸片法的抑菌范围解释标准》判断菌株对20种抗生素的敏感性[21]。抗生素敏感性可表明菌株抵抗外来药物干扰的能力及抗性基因转移的潜在风险。
(2)溶血性检测
使用血琼脂平板,通过划线法检测菌株的溶血性。用无菌接种环沾取少量菌液于血琼脂平板表面,通过四区划线法于血平板上划出目标菌株的单菌落。将血琼脂平板放入恒温培养箱中28 ℃培养1~2 d,观察菌落周围有无溶血现象出现,结果判断依据Luis-Villasenor的方法[22]。若菌落周围出现草绿色环,则为α-溶血;若菌落周围出现透明溶血环,则为β-溶血;若菌落周围无任何变化,则为γ-溶血,即不溶血。
(3)氨基酸脱羧酶活性检测
分别设置无氨基酸的菌株组和分别含L-赖氨酸、L-精氨酸或L-鸟氨酸的菌株组。取50 μL OD600nm值约为1.0的5株待测菌的菌液分别接种到5 mL氨基酸脱羧酶测定培养基,向试管中加入无菌液体石蜡覆盖液面,液体石蜡的高度为3~6 mm,从而形成一个密封的无氧环境。每组设3次重复,在28 ℃下静置培养48 h后观察培养基颜色变化[23]。当指示剂呈紫色为阳性结果,呈黄色为阴性结果,无氨基酸的菌株组为对照组,应呈黄色。
(4)硝酸还原酶活性检测
有些细菌具有硝酸还原酶活性,可将硝酸盐还原成亚硝酸盐。按照硝酸还原酶活性测定试剂盒的说明书进行菌株硝酸还原酶活性的测定[23]。
2 结果与分析
2.1 有机高分子化合物降解菌产几丁质酶和产胶原蛋白酶酶活力测定结果
5株降解有机高分子化合物菌株的产几丁质酶及产胶原蛋白酶酶活力测定结果见图1。
由图1可知,菌株AL1和菌株BM1可降解几丁质,菌株ALJ1、菌株BMJ1和菌株DJ2可降解胶原蛋白。菌株AL1、菌株BM1的几丁质酶活分别为(0.54±0.01)U/mL和(0.47±0.02)U/mL。菌株ALJ1、菌株BMJ1、菌株DJ2的胶原蛋白酶活分别为(82.38±3.00)U/mL、(71.24±4.19)U/mL和(53.78±3.74)U/mL。有研究从其他环境中分离到的产几丁质酶菌株酶活在0.25~3.48 U/mL之间[24-25],产胶原蛋白酶菌株酶活在21.19~36.80 U/mL之间[26-31]。本研究中的2株产几丁质酶菌株酶活为0.47~0.54 U/mL,3株产胶原蛋白酶菌株酶活为53.78~82.38 U/mL。
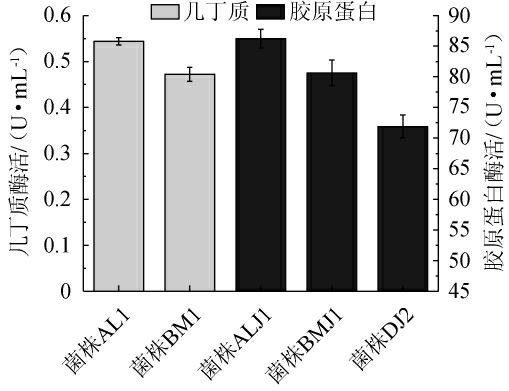
图1 5株菌株产几丁质酶及产胶原蛋白酶酶活力测定结果
Fig.1 Determination results of enzyme activities of chitinase and collagenase produced by 5 strains
2.2 有机高分子化合物降解菌的分子生物学鉴定
对5株产酶菌株的16SrRNA基因进行测序,基于16SrRNA基因序列构建系统发育树,结果见图2。
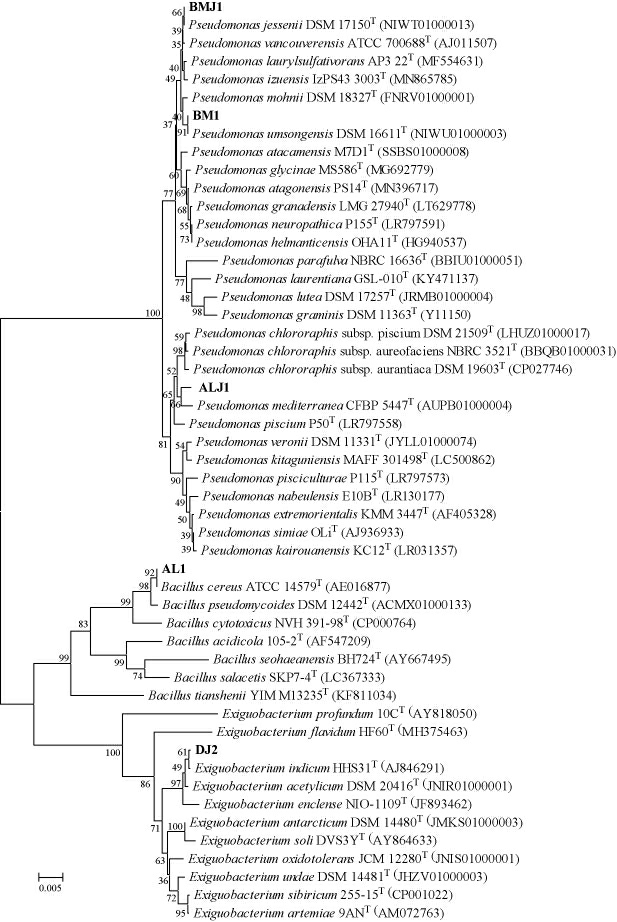
图2 基于16S rRNA基因序列5株菌株的系统发育树
Fig.2 Phylogenetic trees of 5 strains based on the 16S rRNA gene sequences
由图2可知,菌株AL1、BM1、ALJ1、BMJ1、DJ2分别与蜡样芽孢杆菌(Bacillus cereus)ATCC 14579T(AE016877)、阴城假单胞菌(Pseudomonas umsongensis)DSM 16611T(NIWU 01000003)、地中海假单胞菌(Pseudomonas mediterranea)CFBP 5447T(AUPB01000004)、杰西尼假单胞菌(Pseudomonas jessenii)DSM 17150T(NIWT01000013)和印度微小杆菌(Exiguobacterium indicum)HHS31T(AJ846291)以≥60%的自展值在系统发育树上形成一个内分支,说明两者之间具有较近的亲缘关系。将菌株AL1、BM1、ALJ1、BMJ1、DJ2分别鉴定为Bacillus sp.、Pseudomonas sp.、Pseudomonas sp.、Pseudomonas sp.和Exiguobacterium sp.。
2.3 安全性评价
2.3.1 耐药性
随着抗生素的广泛使用,细菌耐药性问题也日益突出,减少耐药菌株的传播成为维护公共卫生安全的关键之一。2013年欧洲食品安全局安全资格认证列表中将抗生素耐药性列为微生物菌种通用安全评估项目[32]。采用K-B法对5株菌进行了20种抗生素敏感性检测,结果见表1。由表1可知,Bacillus sp.AL1对13种抗生素表现为耐药,对6种抗生素表现为中度敏感,对1种抗生素表现为高度敏感。Pseudomonas sp.BM1对16种抗生素表现为耐药,对3种抗生素表现为中度敏感,对1种抗生素表现为高度敏感。Pseudomonas sp.ALJ1对18种抗生素表现为耐药,对1种抗生素表现为中度敏感,对1种抗生素表现为高度敏感。Pseudomonas sp.BMJ1对16种抗生素表现为耐药,对4种抗生素表现为高度敏感。Exiguobacterium sp.DJ2对7种抗生素表现为耐药,对7种抗生素表现为中度敏感,对6种抗生素表现为高度敏感。结果表明,Exiguobacterium sp.DJ2的安全性较好,Pseudomonas sp.ALJ1的安全风险较高。
表1 5株菌株抗生素敏感性试验结果
Table 1 Test results of antibiotic sensitivity of 5 strains
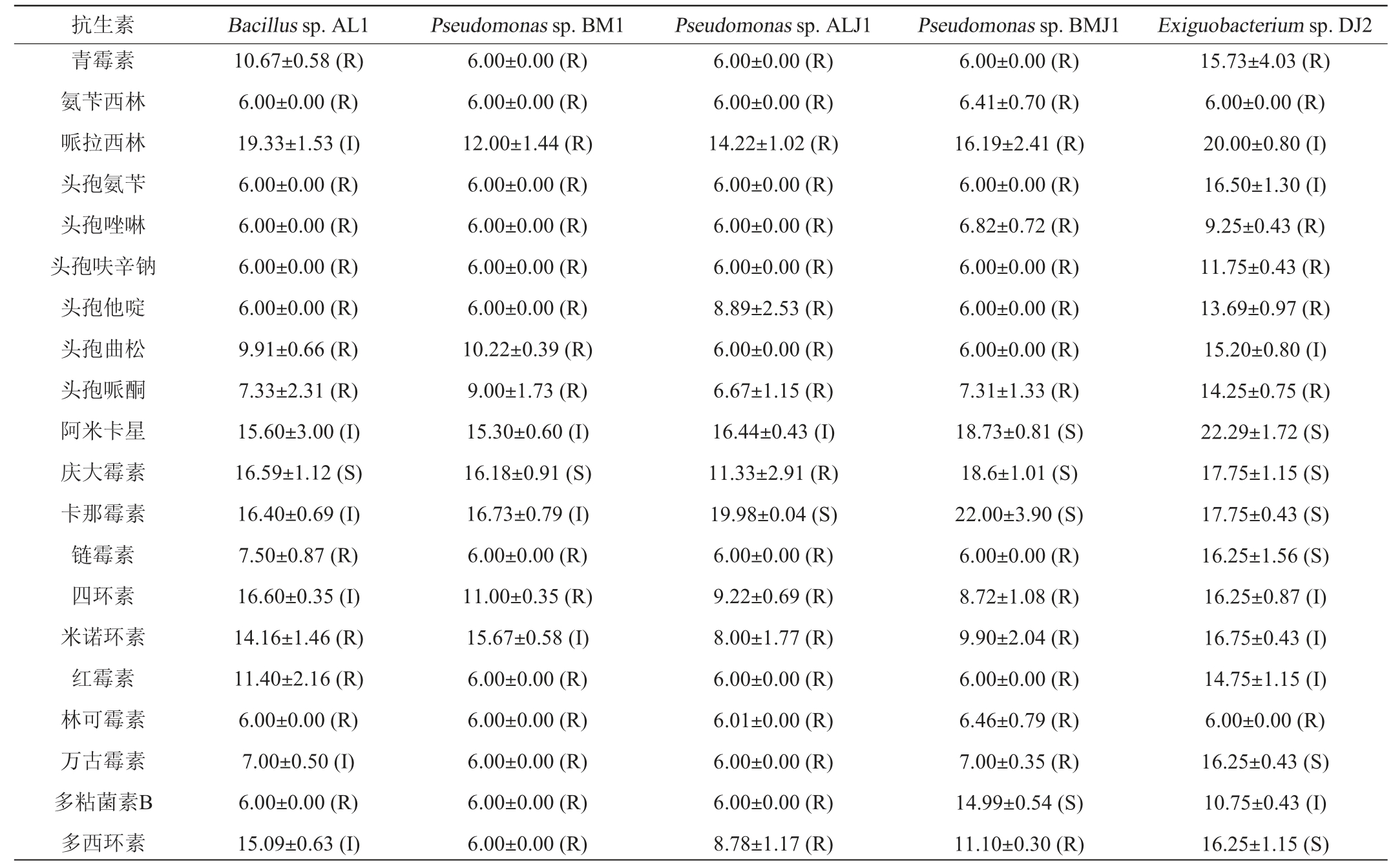
注:R-耐药;I-中度敏感;S-高度敏感。
2.3.2 溶血性的测定
菌株分泌的溶血素能够溶解细胞,使机体发生红细胞内在缺陷、抗原抗体反应、细胞死亡等,从而导致败血症[33],并且溶血素还能引起有核细胞和血小板的损伤和死亡[34]。5株降解有机高分子化合物的细菌的溶血性结果见图3。
由图3可知,产几丁质酶菌株Bacillus sp.AL1菌落周围由于红细胞的完全破裂形成了透明溶血环,有溶血现象,为β-溶血,表明Bacillus sp.AL1具有溶血性,能产生致病物质溶血素;其他4株菌菌落周围均没有明显的变化,无溶血现象,呈γ-溶血,表明这4株菌都没有溶血性,不具有引发败血症的隐患。结果表明,产几丁质酶菌株Bacillus sp.AL1存在潜在的安全性风险。
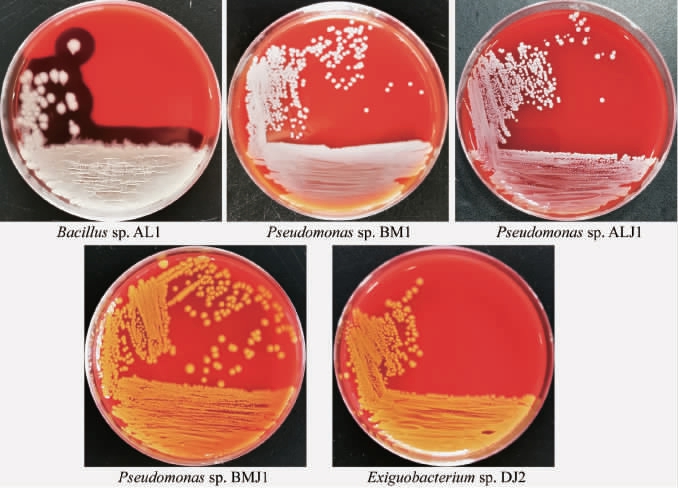
图3 5株菌株溶血性试验结果
Fig.3 Hemolytic test results of 5 strains
2.3.3 氨基酸脱羧酶活性的测定
生物胺主要存在于蛋白质含量丰富的发酵食品中,由微生物分泌的氨基酸脱羧酶催化游离氨基酸形成[35]。生物胺是世界范围内公认的影响人体健康的物质,食品中的生物胺是潜在的食品安全问题[36]。为确保产品的安全性,有必要对生物胺的产生进行研究[37]。5株降解有机高分子化合物菌株的氨基酸脱羧酶活性测定结果表明,L-赖氨酸菌株组中Pseudomonas sp.BM1和Exiguobacterium sp.DJ2呈黄色,为阴性;Bacillus sp.AL1和Pseudomonas sp.BMJ1出现蓝紫色,为阳性。L-精氨酸菌株组除Exiguobacterium sp.DJ2呈黄色,结果为阴性外,其他菌株均呈蓝紫色,为阳性。L-鸟氨酸菌株组中Pseudomonas sp.BM1和Exiguobacterium sp.DJ2呈黄色,为阴性,Bacillus sp.AL1、Pseudomonas sp.ALJ1和Pseudomonas sp.BMJ1出现蓝紫色,为阳性。结果表明,Exiguobacterium sp.DJ2无赖氨酸、精氨酸和鸟氨酸脱羧酶活性,不会将氨基酸分解成相应的生物胺,具有较好的安全性。
2.3.4 硝酸还原酶活性的测定
具有硝酸还原酶的菌株,能将硝酸盐还原成亚硝酸盐,进而形成肠毒素和致癌物质,危害健康[23]。因此,对菌株硝酸还原酶活性的测定也是菌株安全性评价必不可少的[38]。结果表明,5株菌均没有硝酸还原酶的产生,不会将硝酸盐还原成亚硝酸盐,具有一定的安全性。
3 讨论
目前,安全性评价的研究以乳酸菌为主,但是相关的安全性评价方法和体系还不完善。一般都是从耐药性评价、有害代谢产物评价和动物性实验几个方面进行菌株的安全性评估[39]。抗生素敏感性实验结果表明5株菌对多种抗生素表现为耐药。在使用过程中,应防止菌株成为抗生素耐药基因的来源,对于存在耐药性的菌株应尽可能地消除其耐药性。目前,对病原菌耐药性及耐药消除的研究较多,而对工业发酵菌株的耐药消除和消除后菌株的特性变化的研究还不够全面。干酪乳杆菌携带的四环素耐药基因tetW和林肯酰胺克林霉素耐药基因lnuA的耐药质粒消除后,菌株耐药性消失但益生特性得到保留[40]。采用十二烷基硫酸钠(sodium dodecyl sulfate,SDS)结合高温培养对乳酸菌的耐药性质粒进行消除,消除后乳酸菌的生长速度、产酸能力以及后储过程中的存活率均受到了影响[41]。进一步研究产酶菌株的发酵特性及降解有机高分子化合物的作用在消除耐药性后的变化,可为发酵企业获得低耐药性或非转移耐药性的工业菌株提供理论保证。溶血性细菌的侵入会引起溶血现象,从而导致败血症。除Bacillus sp.AL1具有溶血性,其他4株菌都没有溶血性,不会引起溶血现象。Bacillus sp.AL1使用时应防止接触伤口或进入人体。氨基酸脱羧酶能够将氨基酸脱羧还原成生物胺,造成安全隐患。该酶的产生需要酸性条件,并且氨基酸的分解需要在厌氧条件下进行。5株菌中仅Exiguobacterium sp.DJ2的氨基酸脱羧酶活性试验结果为阴性,对氨基酸脱羧酶活性试验阳性的菌株,在其应用时可对pH进行调节,避免菌株处于酸性条件,并保证通氧量,防止氨基酸分解。硝酸还原酶可将硝酸盐还原成亚硝酸盐,5株菌株均没有检测到硝酸还原酶活性。由菌株产几丁质酶和产胶原蛋白酶活力测定结果可知,5株菌具有进一步发酵产酶及降解高分子化合物产生有应用价值的小分子物质的潜力。
4 结论
该研究对来自环洞庭湖水系的3个淡水湖渔场的表层底泥样品中的2株产几丁质酶菌株及3株产胶原蛋白酶菌株的酶活进行分析,结果表明菌株具有产几丁质酶和胶原蛋白酶的能力,经16S rRNA序列比对和系统发育树分析,2株产几丁质酶菌株AL1和BM1分别被鉴定为芽孢杆菌(Bacillus sp.)和假单胞菌(Pseudomonas sp.);3株产胶原蛋白酶菌株ALJ1、BMJ1及DJ2分别被鉴定为Pseudomonas sp.、Pseudomonas sp.和微小杆菌(Exiguobacterium sp.)。安全性试验结果表明,菌株BMJ1、DJ2分别对4种和6种抗生素高度敏感,其余菌株仅对1种抗生素高度敏感;除菌株AL1外,其他4株菌无溶血性;除菌株DJ2外,其他4株菌具有氨基酸脱羧酶活性;5株菌均无硝酸还原酶活性。由此可知,菌株BM1和DJ2是降解有机高分子化合物的较安全菌株,更适合于进一步应用。
[1]RATHORE A S,GUPTA R D.Chitinases from bacteria to human:properties,applications,and future perspectives[J].Enzyme Res,2015,2015:791907.
[2]柴金龙,王敏卜,杭加豪,等.产几丁质脱乙酰酶海洋细菌的筛选鉴定及产酶条件优化[J].中国酿造,2019,38(10):89-95.
[3]RASKOVIC B,BOZOVIC O,PRODANOVIC R,et al.Identification,purification and characterization of a novel collagenolytic serine protease from fig(Ficus carica var.Brown Turkey)latex[J].J Biosci Bioeng,2014,118(6):622-627.
[4]宋易航,王楚浩,方柏山.胶原酶研究进展与应用[J].化工学报,2019,70(9):3213-3227.
[5]张新军,范丽卿,岳海梅,等.几丁质酶产生菌发酵条件初步研究[J].中国农学通报,2010,26(24):42-46.
[6]王学川,王雪莹,杨淑琴,等.微生物胶原酶研究进展[J].皮革科学与工程,2021,31(2):16-22,27.
[7]VELIZ E A,MARTÍNEZ-HIDALGO P,HIRSCH A M.Chitinase-producing bacteria and their role in biocontrol[J].AIMS Microbiol,2017,3(3):689-705.
[8]WANG D,LI A J,HAN H Y,et al.A potent chitinase from Bacillus subtilis for the efficient bioconversion of chitin-containing wastes[J].Int J Biol Macromol,2018,116:863-868.
[9]LI Z K,WANG T,LUO X,et al.Biocontrol potential of Myxococcus sp.strain BS against bacterial soft rot of calla lily caused by Pectobacterium carotovorum[J].Biol Control,2018,126:36-44.
[10]SONGSIRIRITTHIGUL C,LAPBOONRUENG S,PECHSRICHUANG P,et al.Expression and characterization of Bacillus licheniformis chitinase(ChiA),suitable for bioconversion of chitin waste[J].Bioresource Technol,2010,101(11):4096-4103.
[11]SURESH P V.Biodegradation of shrimp processing bio-waste and concomitant production of chitinase enzyme and N-acetyl-D-glucosamine by marine bacteria: production and process optimization[J].World J Microbiol Biotechnol,2012,28(10):2945-2962.
[12]DUARTE A S,CORREIA A,ESTEVES A C.Bacterial collagenases-A review[J].Crit Rev Microbiol,2016,42(1):106-126.
[13]ZHAO G Y,ZHOU M Y,ZHAO H L,et al.Tenderization effect of cold-adapted collagenolytic protease MCP-01 on beef meat at low temperature and its mechanism[J].Food Chem,2012,134(4):1738-1744.
[14]ELSHAGHABEE F M F,ROKANA N,GULHANE R D,et al.Bacillus as potential probiotics:Status,concerns,and future perspectives[J].Front Microbiol,2017,8:1490-1504.
[15]李茂琳,谭军,王红英,等.一株产胶原蛋白酶细菌的鉴定及产酶条件优化[J].食品工业科技,2019,40(14):118-126.
[16]孙佳佳,王红英,钱斯日古楞,等.产胶原蛋白酶枯草芽孢杆菌的筛选[J].大连工业大学学报,2010,29(4):248-250.
[17]王艳君.海洋假交替单胞菌属细菌降解几丁质的特性及新型几丁质酶的表征[D].济南:山东大学,2020.
[18]周强强.胶原蛋白酶产生菌的筛选及其产酶特性研究[D].长春:吉林大学,2009.
[19]张科,苏智鹏,许阳,等.蟋蟀后肠纤维素降解细菌的分离与鉴定[J].生物资源,2020,42(2):228-233.
[20]ANDREWS J M.BSAC standardized disc susceptibility testing method(version 6)[J].J Antimicrob Chemother,2007,60(1):20-41.
[21]罗方兴.一株嗜水气单胞菌对中华鳖腐皮症的致病性及其生物学特性研究[D].长沙:湖南农业大学,2013.
[22]LUIS-VILLASEÑOR I E,MACÍAS-RODRÍGUEZ M E,GÓMEZ-GIL B,et al.Beneficial effects of four Bacillus strains on the larval cultivation of Litopenaeus vannamei[J].Aquaculture,2011,321(1-2):136-144.
[23]凌宇恒.饲用海洋动物源益生菌在幼鲍养殖中的初步应用研究[D].厦门:厦门大学,2017.
[24]张瑶心,王亮节,郑文,等.2021.产几丁质酶的无色杆菌ZWW8的发酵产酶及酶学性质研究[J].生物技术通报,37(4):96-106.
[25]MERIEM G,MAHMOUD K.Optimization of chitinase production by a new Streptomyces griseorubens C9 isolate using response surface methodology[J].Ann Microbiol,2017,67(2):175-183.
[26]刘丽莉,马美湖,余秀芳,等.胶原蛋白酶产生菌的筛选及酶的分离纯化[J].生物工程学报,2010,26(2):194-200.
[27]李星硕,朱玥明,管于平,等.产胶原酶菌株的筛选鉴定、发酵优化及胶原酶纯化[J].微生物学报,2016,56(6):1034-1043.
[28]邓加聪,郑虹,陈丽琴.胶原蛋白酶产生菌的筛选及初步鉴定[J].中国酿造,2013,32(4):78-81.
[29]刘丽莉,杨协力.产骨胶原蛋白酶菌种的筛选与鉴定[J].食品与生物技术学报,2011,30(6):917-923.
[30]赵海霞,赵培培,陈惠,等.一株产胶原蛋白酶沙雷氏菌的分离及鉴定[J].中国饲料,2012(1):9-11,14.
[31]马蕾,王红英,钱斯日古楞.一株产胶原蛋白酶嗜虫沙雷氏菌的分离与鉴定[J].食品工业科技,2012,33(13):143-145.
[32]赵婷,姚粟,徐友强,等.欧洲食品安全局(EFSA)细茵耐药性评估概述[J].食品与发酵工业,2014,40(10):162-167.
[33]林杨,顾美英,孙建,等.阿克苏地区传统酸乳中乳酸菌筛选及安全性初步评价[J].微生物学杂志,2022,42(1):26-33.
[34]马碧书,马丽娜,林旭瑷,等.细菌溶血素毒性和致病机制研究进展[J].中国人兽共患病学报,2018,34(2):175-181.
[35]何一龙,刘晓艳,钱敏,等.发酵酱油中生物胺的产生及其控制研究进展[J].中国酿造,2020,39(9):37-41.
[36]TOFALO R,PERPETUINI G,SCHIRONE M,et al.Biogenic amines:toxicology and health effect[M].Oxford:Academic Press,2016:424-429.
[37]何璇,马堃,哈斯,等.食品中生物胺形成与抑制的研究进展[J].食品与发酵工业,2021,47(18):294-300.
[38]杨埔,孔文涛,孙芝兰,等.食源性乳酸菌安全性的评价[J].食品科学,2014,35(19):169-173.
[39]贡汉生,孟祥晨.益生菌的安全性评价[J].现在食品科技,2011,86(4):76-79.
[40]ROSANDER A,CONNOLLY E,ROOS S.Removal of antibiotic resistance gene-carrying plasmids from Lactobacillus reuteri ATCC 55730 and characterization of the resulting daughter strain, L.reuteri DSM 17938[J].Appl Environ Microb,2008,74(19):6032-6040.
[41]张爱民.不同来源乳酸菌的耐药性分析及药敏性乳酸菌的应用[D].扬州:扬州大学,2008.