辣椒(chili)富含维生素(维生素B、维生素C、维生素E)、类胡萝卜素(叶黄素、β-胡萝卜素、β-隐黄质、玉米黄质)、矿物质、酚类化合物(槲皮素、木犀草素等黄酮类化合物和酚酸类化合物)、辣椒素等营养物质[3]。其中,辣椒素是辣椒辣味成分的主要来源,其含量约占辣椒干质量的0.3%~1.0%[4]。辣椒具有开胃、活血、健脾胃、散寒除湿、活血消肿、促进肠胃蠕动、抑制肠癌等功效及防腐、抗转移、抗真菌、抗病毒、抗炎、免疫调节等作用[4-5]。辣椒是世界上种植面积最广、消费量最大的香料作物之一[1-2],广泛用于川菜、渝菜、滇菜等菜系食品加工[6]。此外,辣椒还被用于开发着色剂、日化品、抗虫剂、抑菌剂、作园艺装饰品等多种产品[7]。然而,由于辣椒具有较高的pH值,利于真菌生长,容易受到青霉属(Penicillium)、曲霉属(Aspergillus)以及镰刀菌属(Fusarium)等产毒真菌的污染而产生真菌毒素[8]。
黄曲霉毒素(aflatoxins,AFs)是由各种寄生曲霉和黄曲霉产生的次级代谢产物和强致癌物,主要包括黄曲霉毒素B1(aflatoxin B1,AFB1)、黄曲霉毒素B2(aflatoxin B2,AFB2)、黄曲霉毒素G1(aflatoxin G1,AFG1)和黄曲霉毒素G2(aflatoxin G2,AFG2)[9-10]。AFs在谷物、花生、小麦、玉米、大豆和辣椒等食品和农产品中污染较为普遍,会对人畜健康造成严重威胁,并造成巨大的经济损失[11-12]。由于AFs具有较高的暴露风险,各监管机构对这四种黄曲霉毒素(AFB1、AFB2、AFG1和AFG2)之和进行了限量,黄曲霉毒素限量值为10 μg/kg[13]。我国国家标准GB 2761—2017《食品安全国家标准食品中真菌毒素限量》规定香辛料中AFB1限量值为5 μg/kg[14]。四川、重庆和云南是中国西南地区辣椒的主要生产地和出口地,且气候和土壤条件都适宜真菌生长,对其在生长、加工、运输和储藏等过程中的AFB1、AFB2、AFG1和AFG2等黄曲霉毒素污染及暴露风险进行评估很有必要。目前,国内外对于辣椒等基质较为复杂的食品中黄曲霉毒素的分析检测方法报道较多,如高效液相色谱法(high performance liquid chromatography,HPLC)[15]、高效液相色谱-串联质谱法[16]、酶联免疫吸附测定法[17]和分子检测方法等[15,18]。但鲜有文献对辣椒干制品中黄曲霉毒素等的污染情况和暴露风险进行报道分析[19]。
本研究以来自西南地区(四川、重庆和云南)超市、农贸市场和零售店的干辣椒及辣椒粉为研究对象,样品经研碎、过筛、提取、衍生等前处理后,采用高效液相色谱法测定黄曲霉毒素含量。以期探究不同辣椒干制品在不同加工和储藏条件下的黄曲霉毒素污染现状,为辣椒食品的安全性评估提供参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
辣椒干制品:共60份样品,20份购自四川地区(宜宾、泸州和南充等地),20份购自重庆地区(万州、北碚和涪陵等地),20份购自云南地区(昆明、昭通和丽江等地)。分别对辣椒样品进行编号,编号为1~60。其中,1~6号来自四川,7~11号来自云南,12~19号来自四川,20~30号来自重庆,31~36号来自四川,37~51号来自云南,52~60号来自重庆。
四川地区辣椒干制品中,10份为干辣椒(4份购自超市,3份购自农贸市场,3份购自零售店),10份为辣椒粉(3份购自超市,4份购自农贸市场,3份购自零售店)。重庆地区辣椒干制品中,10份为干辣椒(3份购自超市,3份购自农贸市场,4份购自零售店),10份为辣椒粉(4份购自超市、3份购自农贸市场、3份购自零售店)。云南地区辣椒干制品中,10份为干辣椒(3份购自超市,4份购自农贸市场,3份购自零售店),10份为辣椒粉(3份购自超市、3份购自农贸商店、4份购自零售店)。所有待分析的辣椒干制品样品质量≥500 g,并保存在0~4 ℃的条件下。
1.1.2 试剂
黄曲霉毒素(AFB1、AFB2、AFG1和AFG2)标准品(纯度≥98%):美国Sigma-Aldrich公司;AflastarTM免疫亲和柱(immunoaffinity chromatography,IAC)3 mL:奥地利Romer Labs公司;三氟乙酸(纯度≥98%)、正己烷(分析纯):成都市科龙化工试剂厂;乙腈(纯度≥98%)、甲醇(纯度≥98%):美国TEDIA公司。其他化学试剂均为国产分析纯。
1.2 仪器与设备
LC-20高效液相色谱仪:日本岛津公司;反相HPLC色谱柱Extend C18(150 mm×4.6 mm,5 μm):美国Agilent公司;GDS-1030超声波清洗机:深圳市光点超声波设备有限公司;SCI-VS旋涡混合器:拓赫机电科技有限公司;SECURA324-1CN电子天平:青岛明博环保科技有限公司;JTN200可视氮吹仪:杭州聚莱仪器设备有限公司;HH-6数显恒温搅拌水浴锅:上海向帆仪器有限公司;NE663型凌生粉碎机:永康市红太阳机电有限公司;Sorvall ST 16R型高速冷冻离心机:美国Thermo Fisher公司。
1.3 实验方法
1.3.1 前处理方法
辣椒干制品前处理条件参照分析化学家协会(association of official analytical chemists,AOAC)999.07[6]中的方法并稍作修改,准确移取5.0 g干辣椒或辣椒粉样品,粉碎后过60目筛,转入50 mL离心管中,加入30 mL甲醇-水溶液(70∶30,V/V)、涡旋混匀30 min,在4 ℃条件下,以6 000 r/min转速离心10 min,过滤取上清液,得样品提取液。
1.3.2 衍生方法
准确移取4 mL上述提取液至50 mL离心管中,加入24 mL磷酸盐缓冲液,混匀后过免疫亲和柱,控制流速为2~3 mL/min,待样液过柱后,立即用15 mL 蒸馏水洗柱,弃去清洗液。最后用甲醇(共1.25 mL)分多次进行洗脱,收集洗脱液。经氮气(N2)吹干后,依次加入200 μL正己烷和100 μL三氟乙酸进行衍生,并于40 ℃避光反应15 min。最后用氮气吹干,然后用1 mL流动相重新溶解,用0.22 μm微孔滤膜过滤后,移入进样瓶,供液相色谱测定。
1.3.3 标准溶液的配制
准确称取AFB1、AFB2、AFG1和AFG2标准品各0.001 0 g(精确至0.000 1 g),分别置于1.5 mL棕色瓶中,用1.0 mL的乙腈溶解,混匀,配制成质量浓度均为1.000 mg/mL的黄曲霉毒素单标储备液,在-20 ℃条件下避光保存。随后,将各个单标储备液用乙腈稀释并配制成系列浓度的混合标准品工作溶液。其中,混标中AFB1和AFG1的系列质量浓度分别为0、0.1 ng/mL、0.25 ng/mL、0.5 ng/mL、2.0 ng/mL、5.0 ng/mL、10.0 ng/mL和20.0 ng/mL;混标中AFB2和AFG2的系列质量浓度分别为0.08 ng/mL、0.16 ng/mL、0.64 ng/mL、1.6 ng/mL、3.2 ng/mL、6.4 ng/mL和12.8 ng/mL。
1.3.4 高效液相色谱分析
HPLC检测条件:色谱柱为反相HPLC色谱柱Extend C18(150 mm×4.6 mm,5 μm);流动相A为超纯水;流动相B为甲醇-乙腈(28∶12,V/V);柱温40 ℃;进样量50 μL;流速0.8 mL/min;激发波长340 nm;发射波长440 nm;检测时间20 min。整个检测过程均采用等度洗脱方式,分析过程中保持流动相A和流动相B的比例分别为65%和35%。
定性定量方法:在色谱分析中,分别以标准品的保留时间定性,峰面积进行定量。
1.3.5 HPLC方法学考察(1)加标回收率试验及精密度试验
在未污染样品中加入已知浓度的黄曲霉毒素标准溶液,来评估该方法的准确性。其中,AFB1和AFG1加标质量浓度为2.00 ng/mL、5.00 ng/mL、20.00 ng/mL三个水平,AFB2和AFG2的加标质量浓度为0.64 ng/mL、1.60 ng/mL、12.80 ng/mL三个水平。此外,通过在同一天重复测定3次同一种黄曲霉毒素的浓度,来评估HPLC方法的精密度。
(2)线性回归方程、检测限及定量限的测定
将黄曲霉毒素混合标准品工作溶液分别用乙腈溶液配制成系列浓度梯度,混标中AFB1和AFG1的质量浓度均分别为0.10 ng/mL、0.25 ng/mL、0.50 ng/mL、2.00 ng/mL、5.00 ng/mL、10.00 ng/mL和20.00 ng/mL;AFB2和AFG2的质量浓度均分别为0.08ng/mL、0.16ng/mL、0.64ng/mL、1.60ng/mL、3.20 ng/mL、6.40 ng/mL和12.80 ng/mL,经衍生后(衍生方法同1.3.2),用高效液相色谱进行测定。以黄曲霉毒素的质量浓度(X)为横坐标,峰面积(Y)为纵坐标,制作黄曲霉毒素标准工作曲线,得黄曲霉毒素线性回归方程。根据信噪比(signal-noise ratio,S/N)≥3,得出检测限;根据信噪比S/N≥10,得出定量限。
1.3.6 食品中污染物风险评估方法
一般来说,食品中污染物的消费数据和污染水平通常是暴露风险评估过程中需要考虑的两个基本因素[20]。本研究中,用黄曲霉毒素引起的急性(短期)暴露风险来预测和评估其对健康的不利影响。暴露风险可以通过膳食暴露量及人群暴露率进行评估,其数学式如下:

1.3.7 数据统计与分析
使用Microsoft Excel 2019软件进行数据处理,数据结果以“平均值±标准偏差”的形式表示。采用Origin 2018、Adobe Photoshop CS 5.1和IBM SPSS Statistics 20.0进行图像绘制及数据处理。
2 结果与分析
2.1 方法学考察
2.1.1 加标回收率试验及精密度试验结果
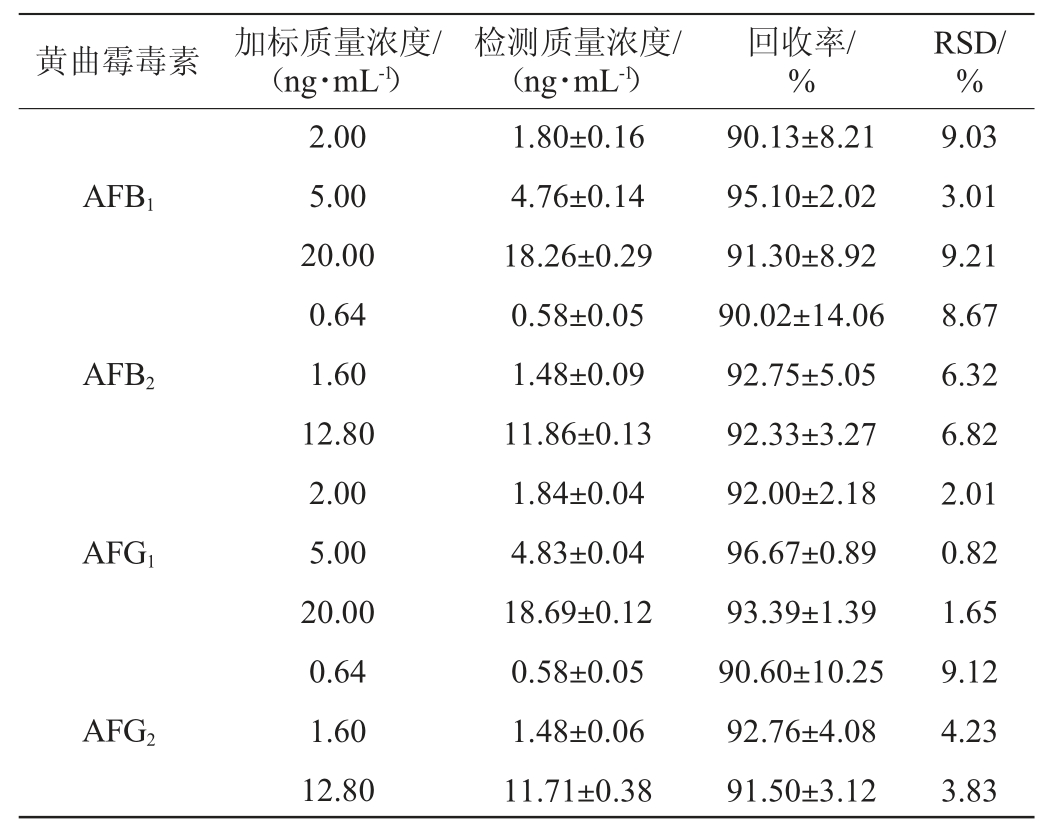
辣椒干制品中不同黄曲霉毒素的加标回收率及精密度试验结果相对标准偏差(relative standard deviation,RSD)见表1。由表1可知,AFB1的加标回收率在90.13%~95.10%之间;AFB2的加标回收率在90.02%~92.75%之间;AFG1的加标回收率在92.00%~96.67%之间;AFG2的加标回收率在90.60%~92.76%之间。由此可知,在该检测条件下,4种黄曲霉毒素的加标回收率较好,可用于样品中黄曲霉毒素的分析检测。精密度试验结果相对标准偏差结果表明,辣椒干制品中所有真菌毒素的RSD均<10%,表明该方法的精密度较好。
表1 辣椒干制品中黄曲霉毒素加标回收率及精密度试验结果
Table 1 Results of standard recovery and precision test of aflatoxins in dried chili products
2.1.2 黄曲霉毒素线性回归方程及检出限、定量限
选择质量浓度范围为0.1~20.0ng/mL和0.08~12.80ng/mL的标准溶液,对黄曲霉毒素的峰面积(Y)与质量浓度(X)进行线性回归,得到AFG1的线性回归方程Y=8 595.001X+870.900 9,相关系数R2=0.999 6;AFB1的线性回归方程Y=26 104.882 19X-1 645.068 99,相关系数R2=0.999 8;AFG2的线性回归方程Y=16 690.238 91X-452.235 74,相关系数R2=0.9999;AFB2的线性回归方程Y=29372.33286X-1737.76621,相关系数R2=0.999 8,所有黄曲霉毒素的线性相关系数R2均>0.999,说明线性关系良好。AFB1和AFG1的检测限均为0.05 ng/mL,AFB2和AFG2的检测限均为0.03 ng/mL;AFB1和AFG1的定量限均为0.15 ng/mL,AFB2和AFG2的定量限均为0.10 ng/mL。
2.2 辣椒干制品中黄曲霉毒素污染情况
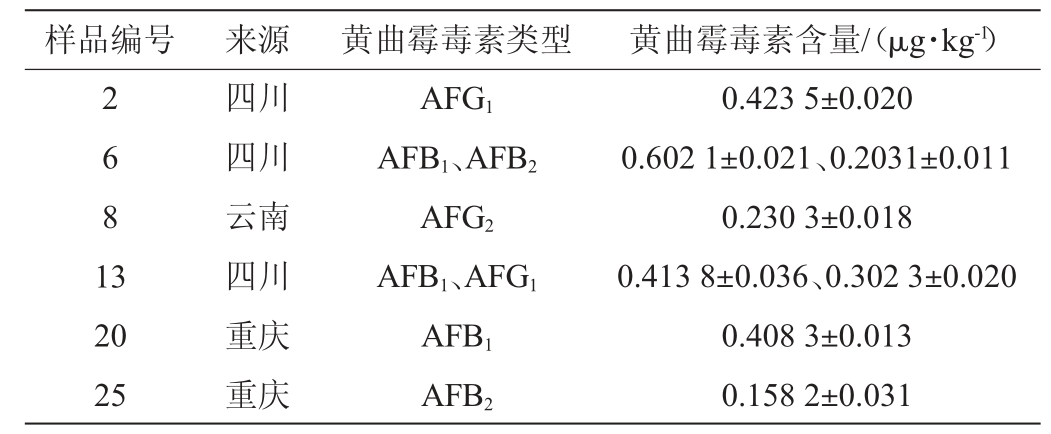
所有辣椒干制品样品黄曲霉毒素的污染情况见表2。由表2可知,在60份辣椒干制品样品中,有6份样品检测结果为阳性,3份(5%)来自四川,2份(3.33%)来自重庆,1份(1.67%)来自云南。在所有辣椒干制品样品中,黄曲霉毒素的阳性率为10%。来自四川地区的样品6、13同时受到2种黄曲霉毒素污染,分别为AFB1和AFB2以及AFB1和AFG1。在所有阳性样品中,AFs的含量在0.158 2~0.602 1 μg/kg之间,有50%阳性样品检出AFB1。AFB1、AFB2、AFG1和AFG2 4种真菌毒素的含量分别为0.408 3~0.602 1 μg/kg、0.158 2~0.2031μg/kg、0.3023~0.4235μg/kg和0.2303μg/kg。四川、重庆和云南地区辣椒干制品中AFs的污染量分别为1.944 8 μg/kg、0.566 5 μg/kg和0.230 3 μg/kg,平均污染量分别为0.097 24 μg/kg、0.028 33 μg/kg和0.011 52 μg/kg。四川、重庆和云南辣椒干制品中黄曲霉毒素的阳性率分别为15%、10%和5%。
表2 辣椒干制品中黄曲霉毒素的污染水平
Table 2 Contamination levels of aflatoxins in dried chili products
AFB1是西南地区辣椒干制品中主要存在的一类黄曲霉毒素。四川地区辣椒干制品的AFs阳性率和平均污染含量均高于重庆地区和云南地区。研究表明,四川、重庆和云南地区的辣椒干制品都有黄曲霉毒素污染风险,四川地区辣椒干制品中黄曲霉毒素污染风险更大,但未发现超标样品,西南地区辣椒干制品易受AFs污染的原因可能是西南地区气候普遍温暖湿润,为黄曲霉和寄生曲霉提供了良好的生长繁殖和产毒条件[21]。研究表明,全球变暖可能加重食品中的真菌毒素污染[22]。由于AFs具有较大的毒害作用,因此,西南地区辣椒中存在的AFs可能会带来较为严重的食品安全问题,消费者应引起重视,相关部门应加强监测和管控[23]。
2.3 不同类型辣椒干制品中黄曲霉毒素污染情况
不同类型辣椒干制品中AFs含量的检测结果见表3。由表3可知,在30份干辣椒样品中,有2份样品为阳性(阳性率为6.67%),AFs的平均含量为0.012 95 μg/kg。在30份辣椒粉样品中,有4份为阳性样品(阳性率为13.33%),AFs的平均含量为0.078 43 μg/kg。
表3 不同类型辣椒干制品中黄曲霉毒素含量检测结果
Table 3 Determination results of aflatoxins in different types of dried chili products

由表3亦可知,辣椒粉中AFs的污染率和含量均高于干辣椒。可能是由于辣椒粉的暴露面积比干辣椒更大,因此含水量和含氧量更高,这些条件有利于真菌的生长繁殖,从而导致黄曲霉毒素等真菌毒素的污染。此前,也有研究发现,辣椒粉中黄曲霉毒素的含量比干辣椒高,该研究进一步证实了这一现象[24-25]。因此,如果没有特殊要求,应尽量将辣椒以干辣椒状态存放,这样可以降低辣椒干制品样品中真菌和真菌毒素(如黄曲霉毒素)的污染风险。
2.4 不同来源辣椒干制品中黄曲霉毒素污染情况
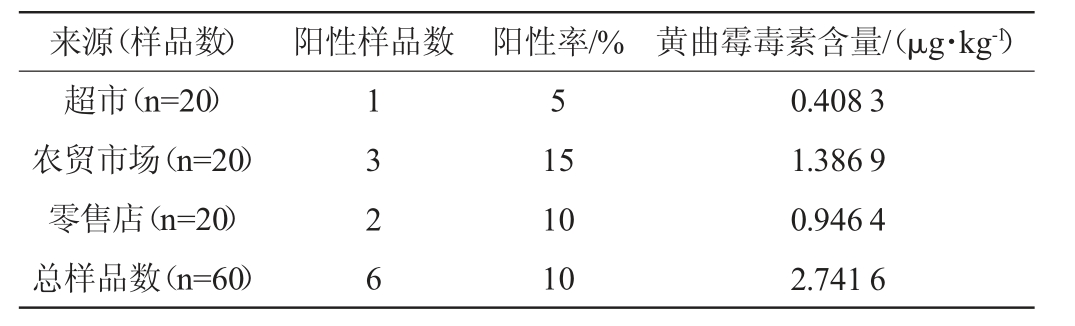
超市、农贸市场和零售店的辣椒干制品中AFs含量见表4。由表4可知,来自超市、农贸市场和零售店的辣椒干制品样品数均为20份。其中,来自超市、农贸市场和零售店的辣椒干制品中黄曲霉毒素的阳性率分别为5%、15%和10%,黄曲霉毒素含量分别为0.408 3 μg/kg、1.386 9 μg/kg和0.946 4 μg/kg。研究表明,与来自超市的辣椒干制品相比,来自农贸市场和零售店的辣椒干制品更易受到黄曲霉毒素的污染,该研究结果与JALILI M等[26]的研究结果一致。
表4 不同来源辣椒干制品中黄曲霉毒素含量
Table 4 Content of aflatoxins in dried chili products from different locations
通常,来自农贸市场和零售店的辣椒干制品很容易受潮,而来自超市的辣椒干制品处于相对干燥且干净的环境中。因此,来自农贸市场和零售店的辣椒干制品更易滋生真菌。同时,来自农贸市场和零售店的辣椒干制品通常是用密封性较差的黄麻袋或透明塑料袋包装,而超市的辣椒干制品一般采用密封性良好的聚乙烯袋包装[26]。此外,超市的各类食物一般有专人负责管理和定期的整理,摆放位置也比较讲究,一般干货在一个区域售卖,而水产品及其他比较潮湿的食品则在另外的区域售卖,不会形成交叉污染。而农贸市场和零售店的食物摆放位置相对随意,加之摆放空间相对有限,容易造成不同食物的交叉污染。因此,从总体来看,来自超市的辣椒干制品安全性相对较高。
2.5 辣椒干制品中黄曲霉毒素暴露风险评估
根据食品中污染物风险评估方法及参考指南,对于每千克体质量的人,每日可耐受摄入量为1 ng[27-28]。考虑到一个正常成年人的体质量大概为60 kg[29],所以对于每个成年人来说,每天可耐受摄入量为60 ng。调查发现,巴基斯坦人均每天的辣椒消费量为1.91 g[30]。目前,关于中国人的辣椒摄入量信息不详,因此,中国人均辣椒摄入量数据以巴基斯坦的人均摄入量数据为依据。经高效液相色谱法检测,所有辣椒样品的平均黄曲霉毒素含量为0.045 69 μg/kg。因此,辣椒中黄曲霉毒素的膳食暴露量为0.001 455 ng/(kg体质量·d),西南地区的人群暴露率为0.15%。从目前的情况来看,西南地区辣椒中存在黄曲霉毒素的潜在暴露风险。
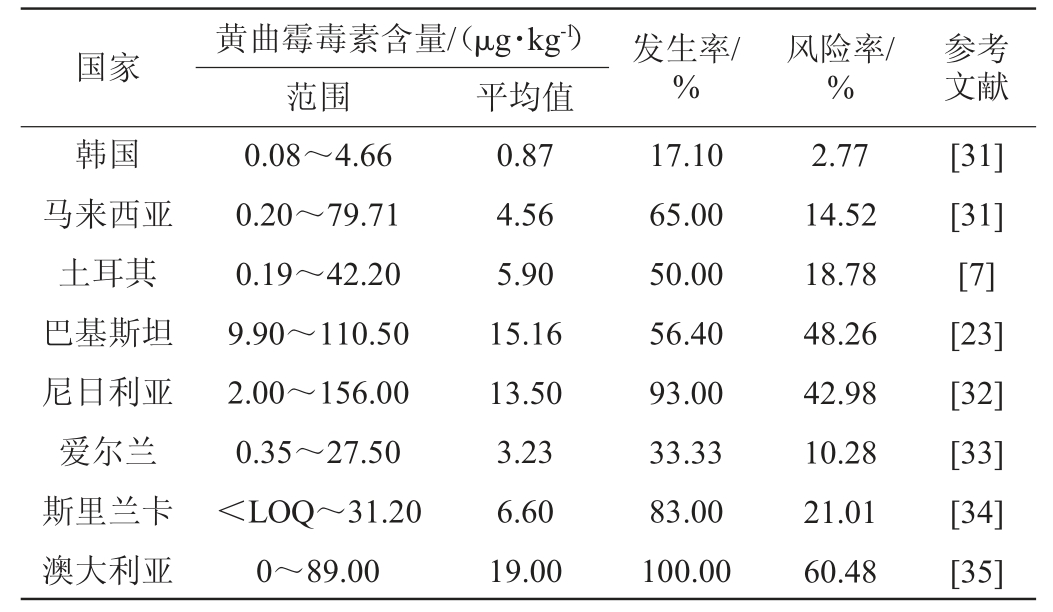
此外,还对来自不同国家的辣椒中的黄曲霉毒素污染风险进行了评估,结果见表5。由表5可知,许多国家的黄曲霉毒素暴露风险率均>1%,且很多国家的黄曲霉毒素最大污染水平高于欧盟的建议限量值(10 μg/kg),表明辣椒中普遍存在黄曲霉毒素污染风险[13]。
表5 不同国家辣椒中黄曲霉毒素的风险评估
Table 5 Risk assessments of aflatoxins in chili samples from different countries
3 讨论
本研究主要对西南地区辣椒干制品中的黄曲霉毒素污染情况进行了检测和分析,并对黄曲霉毒素的暴露风险进行了评估。研究表明,西南地区普遍存在黄曲霉毒素污染现象,尤其是四川和重庆地区中辣椒干制品的黄曲霉毒素污染最为严重,可能是由于川渝地区温度和湿度较高,有利于真菌的繁殖和真菌毒素的产生[9]。与干辣椒相比,辣椒粉更容易受到黄曲霉毒素污染,这主要是由于辣椒粉与外界的接触面积更大,更易吸湿,导致含水量增加。因此,在辣椒采摘后,需尽快对辣椒进行干制处理,尽量将辣椒的水分降低到10%以下,并置于阴凉、干燥和通风良好的条件下储存。此外,在没有特殊要求的情况下,建议优先选择购买干辣椒,以降低黄曲霉毒素的污染风险。
农贸市场和零售店的辣椒干制品中AFs污染较为严重,而超市的辣椒干制品中AFs污染相对较低。这主要是由于不同来源辣椒干制品的存储环境和包装材料存在差异。已有研究表明,与聚乙烯袋相比,存放在黄麻袋中的辣椒中AFs污染更为严重[36]。因为黄麻袋多孔且透气,辣椒能从空气中吸收水分。加之真菌的生长和霉菌毒素的产生是需氧过程,因此黄麻袋包装不利于预防真菌毒素的产生。
4 结论
采用HPLC检测方法对来自西南地区(四川、重庆和云南)辣椒干制品中黄曲霉毒素(AFB1、AFB2、AFG1和AFG2)的含量进行分析。结果表明,该方法的精密度及准确度较好,线性相关系数R2均>0.999,AFB1、AFG1的检出限和定量限均分别为0.05 ng/mL、0.15 ng/mL;AFB2、AFG2的检出限和定量限均分别为0.03 ng/mL、0.10 ng/mL,四川、重庆和云南地区辣椒干制品阳性率分别为15%、10%和5%;干辣椒和辣椒粉的阳性率分别为6.67%和13.33%;超市、农贸市场和零售店的辣椒干制品中黄曲霉毒素的阳性率分别为5%、15%和10%。总体而言,我国西南地区辣椒中黄曲霉毒素阳性率为10%,人群暴露率风险为0.15%,存在一定的暴露风险。虽然所有阳性样品均低于国家现有推荐限值,短期内不会对公众健康带来较大风险,但若长期摄入,则存在慢性中毒风险。考虑到我国及世界各国对辣椒的需求量越来越大,因此,需定期监测辣椒中的黄曲霉毒素污染情况,以保护消费者的健康。此外,食品生产商和加工商需要保持警惕,以确保供应的辣椒品质符合要求。由于辣椒中黄曲霉毒素的污染情况受包装方式和包装材料影响,因此,建议选用聚乙烯袋进行包装或进一步开发具有一定抑菌功能的天然型、环保型包装材料。
[1]SONG L,HAN Y T,YANG J,et al.Rapid single-step cleanup method for analyzing 47 pesticide residues in pepper,chili peppers and its sauce product by high performance liquid and gas chromatography-tandem mass spectrometry[J].Food Chem,2019,279:237-245.
[2]ROMERO-DÁVILA E,MIRANDA J,PINEDA J C.X-Ray fluorescence analysis of Mexican varieties of dried chili peppers[J].J Food Compos Anal,2020,93:103592-103598.
[3]BAENAS N,BELOVIC′ M,ILIC N,et al.Industrial use of pepper (Capsicum annum L.)derived products:Technological benefits and biological advantages[J].Food Chem,2019,274:872-885.
[4]LU M,CHEN C,LAN Y,et al.Capsaicin-the major bioactive ingredient of chili peppers:bio-efficacy and delivery systems[J].Food Funct,2020,11(4):2848-2860.
[5]ANTONIO A S,WIEDEMANN L S M,VEIGA JUNIOR V F.The genus Capsicum:A phytochemical review of bioactive secondary metabolites[J].RSC Adv,2018,8(45):25767-25784.
[6]迟雪梅,张庆芳,迟乃玉.发酵蔬菜安全性的研究进展[J].中国酿造,2018,37(8):5-8.
[7]SIMO-TAGNE M,NDUKWU M C,ZOULALIAN A,et al.Numerical analysis and validation of a natural convection mix-mode solar dryer for drying red chilli under variable conditions[J].Renew Energ,2020,151:659-673.
[8]GAMBACORTA L,MAGISTÀ D,PERRONE G,et al.Co-occurrence of toxigenic moulds,aflatoxins,ochratoxin A,Fusarium and Alternaria mycotoxins in fresh sweet peppers (Capsicum annuum) and their processed products[J].World Mycotoxin J,2018,11:159-174.
[9]COSTA J,RODRÍGUEZ R,GARCIA-CELA E,et al.Overview of fungi and mycotoxin contamination in Capsicum pepper and in its derivatives[J].Toxins,2019,11(1):27-42.
[10]HOSSAIN M N,TALUKDER A,AFROZE F,et al.Identification of aflatoxigenic fungi and detection of their aflatoxin in red chilli (Cap-sicum annuum)samples using direct cultural method and HPLC[J].Adv Microbiol,2018,8(1):42-53.
[11]PELES F,SIPOS P,KOVÁCS S,et al.Biological control and mitigation of aflatoxin contamination in commodities[J].Toxins,2021,13(2):104-122.
[12]EZEKIEL C N,ORTEGA-BELTRAN A,OYEDEJI E O,et al.Aflatoxin in chili peppers in Nigeria:Extent of contamination and control using atoxigenic Aspergillus flavus genotypes as biocontrol agents[J].Toxins,2019,11(7):429-442.
[13]SAVIC′ Z,DUDAŠ T,LOC M,et al.Biological control of aflatoxin in maize grown in Serbia[J].Toxins,2020,12(3):162-172.
[14]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 2761—2017 食品中真菌毒素限量[S].北京:中国标准出版社,2017.
[15]周丽,杨清山,连运河,等.辣椒及辣椒提取物中黄曲霉毒素含量的测定及迁移规律分析[J].食品科学,2016,37(14):165-168.
[16]李浩.中药材中黄曲霉毒素B1,B2,G1,G2测定方法研究[J].中国药业,2015,24(10):57-59.
[17]陈彤,王常青,李小凡,等.间接ELISA检测不同贮存条件下花生中黄曲霉毒素B1[J].中国油脂,2014,39(9):88-91.
[18]陈露,尹礼国,张超,等.干制辣椒中黄曲霉毒素B1污染及暴露风险研究进展[J].云南化工,2022,49(1):6-9.
[19]GALLO P,IMBIMBO S,ALVINO S,et al.Contamination by aflatoxins B/G in food and commodities imported in southern Italy from 2017 to 2020:A risk-based evaluation[J].Toxins,2021,13(6):368-380.
[20]YAN H B,ZHANG L,YE Z L,et al.Determination and comprehensive risk assessment of dietary exposure to ochratoxin A on fermented teas[J].J Agr Food Chem,2021,69(40):12021-12029.
[21]LIEW W P P,MOHD-REDZWAN S.Mycotoxin:Its impact on gut health and microbiota[J].Front Cell Infect Microbiol,2018,26(8):60-76.
[22]SINGH P,MEHL H L,ORBACH M J,et al.Genetic diversity of Aspergillus flavus associated with chili in Nigeria and identification of haplotypes with potential in aflatoxin mitigation[J].Plant Dis,2022,6:1818-1825.
[23]IQBAL S Z,ASI M R,MEHMOOD Z,et al.Survey of aflatoxins and ochratoxin A in retail market chilies and chili sauce samples[J].Food Control,2017,81:218-223.
[24]IQBAL S Z,PATERSON R R M,BHATTI I A,et al.Survey of aflatoxins in chillies from Pakistan produced in rural,semi-rural and urban en-vironments[J].Food Addit Contam B,2010,3(4):268.
[25]BIRCAN C.The determination of aflatoxins in spices by immunoaffinity column extraction using HPLC[J].Int J Food Sci Technol,2005,40(9):929-934.
[26]JALILI M,JINAP S.Natural occurrence of aflatoxins and ochratoxin A in commercial dried chili[J].Food Control,2012,24(1-2):160-164.
[27]JOINT F A O,BEND J,BOLGER M,et al.Evaluation of certain food additives and contaminants[J].World Health Organ Tech Rep Ser,2007(947):1-225.
[28]BOGALHO F,DUARTE S,CARDOSO M,et al.Exposure assessment of Portuguese infants to Aflatoxin M1 in breast milk and maternal socialdemographical and food consumption determinants[J].Food Control,2018,90:140-145.
[29]IQBAL S Z,ASI M R,AKRAM N,et al.Aflatoxin contamination in different fractions of rice from Pakistan and estimation of dietary intakes[J].Mycotoxin Res,2012,28(3):175-180.
[30]NAWAB J,FAROOQI S,WANG X P,et al.Levels,dietary intake,and health risk of potentially toxic metals in vegetables,fruits,and cereal crops in Pakistan[J].Environ Sci Pollut Res Int,2018,25(6): 5558-5571.
[31]CHO S H,LEE C H,JANG M R,et al.Aflatoxins contamination in spices and processed spice products commercialized in Korea[J].Food Chem,2008,107(3):1283-1288.
[32]SINGH P,COTTY P J.Aflatoxin contamination of dried red chilies:Contrasts between the United States and Nigeria,two markets differing in regulation enforcement[J].Food Control,2017,80:374-379.
[33]RIORDAN M J O,WILKINSON M G.A survey of the incidence and level of aflatoxin contamination in a range of imported spice preparations on the Irish retail market[J].Food Chem,2008,107(4):1429-1435.
[34]YOGENDRARAJAH P,JACXSENS L,SAEGER S D,et al.Co-occurrence of multiple mycotoxins in dry chilli(Capsicum annum L.)samples from the markets of Sri Lanka and Belgium[J].Food Control,2014,46:26-34.
[35]KLIEBER A.Aflatoxin contamination and its management in chilli and paprika products in Australia[J].Food Aust,2001,53(3):90-92.
[36]IQBAL Q,AMJAD M,ASI M R,et al.Assessment of hot peppers for aflatoxin and mold proliferation during storage[J].J Food Prot,2011,74(5):830-835.