我国具有传统深厚的酒文化,酒在生活中成为不可缺少的饮品。乙醇进入机体后,10%由肾脏和肺排出,90%在肝脏内进行代谢和分解[1],在肝脏中由乙醇脱氢酶(alcohol dehydrogenase,ADH)氧化为乙醛,乙醛经乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)氧化为乙酸进入三羧酸循环,最终代谢为二氧化碳和水[2]。饮酒过量会产生酒精中毒,长期嗜酒会形成酒精依赖症[3],长期饮酒诱发肝硬化以及肝癌[4],还会引起肥胖、高血脂症、动脉硬化等[5]。世界卫生组织指出,酒精性肝损伤已成为仅次于病毒性肝炎的第二大肝脏疾病[6]。如何降低饮酒对肝脏的损伤成为当前研究的热点问题。研究表明,生物小分子肽具有较高的抗氧化、抗肿瘤、抗衰老活性、易吸收[7],促进乙醇脱氢酶及乙醛脱氢酶活性,能加快酒精代谢速率,减少代谢产物对肝组织的损害作用[8]。LI G M等[9]研究发现,玉米肽具有抗氧化、抗高血压、保肝、促进酒精代谢等功能;陈頔等[10]用鱼皮低聚肽灌胃酒精性肝损伤小鼠,发现鱼皮低聚肽对酒精性肝损伤小鼠具有保护作用。
大鲵(Andrias davidianus)属大型两栖纲、有尾目、隐鳃鲵科,在地球上有3.5亿年生活史,具有极强的耐饥能力和抗逆境能力[11]。大鲵肝脏占体质量的3%~5%,是大鲵加工的主要副产物[12]。大鲵肝脏具有较高营养价值,含有丰富的蛋白质和酶[13],富含不饱和脂肪酸[14],但大鲵肝脏腥味重,难以加以利用,多作为废弃物直接丢弃,将肝脏制备小分子肽,提高大鲵附加值[15]。近年来,将多肽与酒结合制备多肽保健酒是多肽利用的重要途径,关于多肽酒的研究报道越来越多,如植物源的多肽酒:山药肽酒[16]、柠檬肽酒[17],蚕豆肽酒[18]等;动物物源多肽酒:海参肽酒[19]、甲鱼肽酒[20]、鹿茸血肽酒[21]、大鲵肽酒[22]、牡蛎肽酒[23]等,但是以大鲵肝肽(giant salamander liver peptide,GSLP)制备的大鲵肝肽酒研究较少。
本研究以大鲵肝脏与白酒为原料制备大鲵肝肽酒,通过酶解法制备肝肽,对其体外乙醇脱氢酶(ADH)激活活性、体外抗氧化活性和溶解度进行测定,并测定大鲵肝肽酒对小鼠肝脏乙醇脱氢酶(ADH)和乙醛脱氢酶(ALDH)、超氧化物歧化酶(superoxide dismutase,SOD)活力与还原型谷胱甘肽(reduced glutathione,GSH)、丙二醛(malonaldehyde,MDA)、甘油三酯(triglyceride,TG)含量及血清中谷丙转氨酶(alanine aminotransferase,ALT)和谷草转氨酶(aspartate aminotransferase,AST)活性的影响,以期探讨大鲵肝肽酒对酒后小鼠的肝脏保护作用,为大鲵肝脏高值化利用和多肽酒的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
大鲵肝脏:陕西鲵生元科技有限公司;53%vol酱香型白酒:贵州茅台酒厂保健酒业有限公司;无特定病原体(specific pathogen free,SPF)级雄性昆明种小鼠:4周龄,体质量(22±2)g,实验动物使用许可证号SCXK(陕)2018-001,由西安交通大学医学院部实验动物中心提供,饲养条件为温度(22±2)℃,湿度50%~60%,昼夜交替。
1.1.2 试剂
风味蛋白酶(酶活40000U/g)、胰蛋白酶(酶活4000U/g):广西南宁庞博生物工程有限公司;碳酸氢钠、柠檬酸:天津市富宇精细化工有限公司;乙醇脱氢酶(ADH)(1.0 U/mL):美国Sigma公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、邻苯三酚、三羟甲基氨基甲烷:上海源叶生物科技有限公司;硫酸亚铁、水杨酸:天津市北联精细化学品开发有限公司;铁氰化钾:成都市科龙化学试剂厂;三氯乙酸:上海精析化工科技有限公司;三氯化铁:天津市福晨化学试剂厂;维生素C(vitamin C,VC):成都市科龙化工试剂厂;二喹林甲酸(bicinchoninic acid,BCA)法微量蛋白定量试剂盒、血乙醇(blood ethanol,ALC)试剂盒、谷丙转氨酶(ALT)试剂盒、谷草转氨酶(AST)试剂盒、超氧化物歧化酶(SOD)试剂盒、还原型谷胱甘肽(GSH)试剂盒、丙二醛(MDA)试剂盒、甘油三酯(TG)试剂盒、乙醇脱氢酶(ADH)试剂盒、乙醛脱氢酶(ALDH)试剂盒:南京建成生物工程研究所。本研究所用试剂均为分析纯。
1.2 仪器与设备
DK-98-Ⅱ恒温水浴锅:天津市泰斯特仪器有限公司;TGL-20M冷冻离心机:湖南湘仪离心机仪器有限公司;LC-800低速台式离机:科大创新股份有限公司中佳分公司;Xinyi-100F真空冷冻干燥机:宁波新艺超声设备有限公司;Epoch 2酶标仪:美国BioTek公司;UV-1750紫外-可见分光光度计:日本岛津仪器公司;PE28型pH计:梅特勒-托利多仪器有限公司;陶瓷膜过滤机、纳滤膜过滤机及超滤膜(截留分子质量3 000 Da):南京艾宇琦膜科技有限公司。
1.3 方法
1.3.1 大鲵肝肽酒的加工工艺流程及操作要点

操作要点:
原料预处理:流水清洗大鲵肝脏,按料液比1∶5(g∶mL)添加0.9%生理盐水浸泡30 min,1%酵母发酵液(按大鲵肝脏质量1%酵母粉和2%白砂糖在37 ℃活化1 h)浸泡30 min,清洗沥干,绞碎制成肝糜。
酶解:在肝糜中加入1%的风味蛋白酶,以肝糜和蒸馏水的料液比为1∶1(g∶mL)添加蒸馏水、于pH 7.0、53 ℃条件下搅拌酶解4 h;再添加0.5%胰蛋白酶,于pH 8.0、37 ℃条件下酶解3 h;灭酶活(95 ℃、10 min)。
离心、脱色脱腥:酶解液离心(5 500 r/min、15 min),去除上清液中油脂及沉淀,收集上清液。在上清液中加入1%活性炭,50 ℃、0.08 Pa下抽真空,搅拌脱色脱腥1 h。
过滤、超滤:用过压滤机脱活性炭后陶瓷膜过滤,得到分子质量<10 000 Da多肽的酶解液。用截留分子质量3 000 Da的超滤膜对其进行超滤分级分离,得到3种不同分子质量段的多肽液。
冷冻干燥:在温度-50~20 ℃、真空度13~40 Pa条件下,经冷冻干燥后制得大鲵肝肽粉:GSLP-Ⅰ(分子质量>10 000 Da)、GSLP-Ⅱ(分子质量3 000~10 000 Da)、GSLP-Ⅲ(分子质量<3 000 Da)。
调配:于1%大鲵肝肽粉中,按料液比1∶100(g∶mL)添加53%vol酱香型白酒,即得大鲵肝肽酒。
1.3.2 不同分子质量大鲵肝肽体外ADH激活活性
大鲵肝肽ADH激活率参考刘鹏[24]的方法进行测定,其计算公式如下:

式中:A1为样品反应初始的OD340nm值;A2为样品反应结束的OD340nm值。
1.3.3 不同分子质量大鲵肝肽体外抗氧化活性测定
DPPH自由基(DPPH·)清除率的测定[25]:将不同分子质量肝肽加蒸馏水溶解,配制样品质量浓度为10.0 mg/mL。取3 mL样品溶液于试管中,加入3 mL 0.1 mmol/L DPPH溶液,振荡混匀后避光放置30 min,在波长517 nm处测吸光度值,用蒸馏水调零,抗坏血酸溶液(0.5 mg/mL)作阳性对照。平行测定吸光度值3次。DPPH·清除率计算公式如下:
式中:A0为蒸馏水-DPPH溶液的吸光度值;A1为样品-DPPH溶液的吸光度值;A2为样品-乙醇溶液的吸光度值。
羟自由基(·OH)清除率的测定[26]:将不同分子质量肝肽加蒸馏水溶解,配制样品质量浓度为10.0mg/mL。取2mL样品溶液于试管中,加2 mL 9 mmol/L FeSO4溶液、2 mL 9 mmol/L水杨酸乙醇溶液,再加2 mL 9 mmol/L H2O2溶液,于37 ℃水浴条件下加热30 min,待冷却后离心。以蒸馏水作为空白对照,抗坏血酸溶液(0.5 mg/mL)作阳性对照。在波长510 nm处测定吸光度值,实验重复3次,·OH的清除率计算公式如下:
式中:A0为蒸馏水-水杨酸乙醇吸光度值;A1为样品-水杨酸乙醇溶液吸光度值;A2为加入样品溶液但不加水杨酸乙醇溶液吸光度值。
超氧阴离子自由基(O-2·)清除率测定[27]:采用邻苯三酚自氧化法测定,将不同分子质量肝肽加蒸馏水溶解,配制样品质量浓度为10.0 mg/mL。取1 mL样品溶液于试管中,各加入4.5 mL 50 mmol/L Tris-HCl缓冲液和0.1 mL 3 mmol/L邻苯三酚溶液充分混匀,于25 ℃水浴反应10 min,加入1 mL 8 mmol/L HCl溶液终止反应。在波长320 nm处测定吸光度值,以蒸馏水作为空白对照,抗坏血酸溶液(0.5 mg/mL)作为阳性对照。实验重复3次,O-2·清除率计算公式如下:
式中:A0为不加样品溶液,加邻苯三酚溶液的吸光度值;A1为加样品溶液和邻苯三酚溶液的吸光度值;A2为加样品溶液但不加邻苯三酚溶液的吸光度值。
总还原力的测定[28]:将不同分子量肝肽加蒸馏水溶解,配制样品质量浓度为10.0 mg/mL。取样品溶液2 mL,加入2 mL 0.2 mol/L pH 6.6磷酸盐缓冲液和2 mL 1%铁氰化钾溶液充分混匀后,于50 ℃水浴条件下静置20 min后,加入10%三氯乙酸2 mL,充分混合,4 000 r/min离心10 min,取2.5 mL上清液,再加入2 mL蒸馏水和0.5 mL 0.1%三氯化铁后混匀,室温条件下静置10 min,在波长700 nm处测定吸光度值,实验重复3次,以蒸馏水作为空白对照,抗坏血酸溶液(0.5 mg/mL)作为阳性对照。
1.3.4 不同分子质量大鲵肝肽溶解度的测定
称取0.250 0 g 3个不同分子质量大鲵肝肽粉置入50 mL于离心管中,再分别加入酒精度为12%vol、35%vol、45%vol、53%vol的酱香型白酒25 mL摇匀,室温静置7 d后4 000 r/min离心15 min,上清液倒入坩锅置于105 ℃烘箱,烘至恒质量[29],计算溶解度,其计算公式如下:
式中:m为坩锅的质量,g;M为坩锅和溶解肽粉的质量,g;w为肽粉的质量,g。
1.3.5 大鲵肝肽酒的动物实验
遵循实验动物伦理规程和标准,取昆明种雄性小鼠45只,经7 d适应期,按随机数字标法分3组,即空白对照组、白酒组、大鲵肝肽酒组,每组15只。空白对照组小鼠每日灌胃生理盐水(0.12 mL/10 g体质量),白酒组小鼠每日灌胃53%vol酱香型白酒(0.12 mL/10 g体质量)[30],大鲵肝肽酒组小鼠每日灌胃最适条件制备的大鲵肝肽酒(0.12 mL/10 g体质量),连续灌胃10 d。
1.3.6 样品的采集及处理
末次灌胃2 h后从每个实验组中各取3只小鼠,眼球取血(4 ℃、3 000 r/min离心15 min,取上层血清保存于-80 ℃冰箱中),解剖小鼠取肝脏,在4 ℃的生理盐水中反复冲洗,滤纸吸干后称取肝脏质量,剪取一部分肝组织,用10%甲醛溶液固定;剩余肝组织-80 ℃冰箱保存,其他小鼠用于血液和肝脏的生化指标检测。在实验期间,每日固定时间对小鼠灌胃前进行称量并记录,及时调整给酒灌胃体积,观察小鼠有无死亡、精神状态、活动能力等。
1.3.7 生化指标的测定
(1)血液乙醇含量
根据血乙醇试剂盒的说明书测定小鼠血液乙醇含量。
(2)肝脏生化指标
以9倍肝组织体积加入预冷生理盐水,冰浴条件下匀浆制成10%肝组织匀浆,离心(3 000 r/min、4 ℃、20 min),取上清液,按照试剂盒的说明书测定小鼠肝脏SOD活力、GSH、MDA、TG含量,以及乙醇代谢相关酶ADH、ALDH活力。
(3)血清生化指标
根据试剂盒的说明书测定小鼠血清的谷丙转氨酶(ALT)和谷草转氨酶(AST)活力。
1.3.8 数据分析
采用OriginPro 2018软件进行绘图,SPSS 20.0软件进行数据统计分析,P<0.05,表示差异显著。
2 结果与分析
2.1 不同分子质量肝肽对ADH激活率的影响
ADH是一种含锌金属蛋白酶,主要存在于肝脏,是酒精代谢最主要的参与酶和代谢酶,不同分子质量的多肽对ADH激活率不同[31]。不同分子质量肝肽对体外ADH的激活作用见图1。
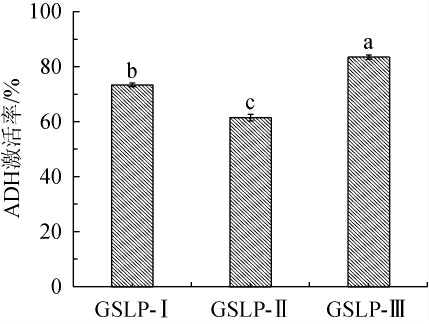
图1 不同分子质量肝肽对体外乙醇脱氢酶的激活作用
Fig.1 Activation of liver peptides with different molecular mass on alcohol dehydrogenase in vitro
不同小写字母表示差异显著(P<0.05)。下同。
由图1可知,在相同质量浓度下,不同分子质量的肝肽对体外ADH激活作用具有显著性差异(P<0.05),对ADH激活率从大到小排序为:GSLP-Ⅲ>GSLP-Ⅰ>GSLP-Ⅱ,其中,GSLP-Ⅲ对ADH激活率最高,达83.53%,GSLP-Ⅰ激活率为73.47%,GSLP-Ⅱ激活率最低,为61.53%。结果表明,大鲵肝肽对体外ADH的激活作用并不受分子质量大小的影响,这与张帅[32]的研究结果一致。
2.2 不同分子质量肝肽体外抗氧化活性测定
不同分子质量肝肽的体外抗氧化活性测定结果见表1。
表1 不同分子质量肝肽体外抗氧化活性
Table 1 Antioxidant activity in vitro of liver peptides with different molecular mass
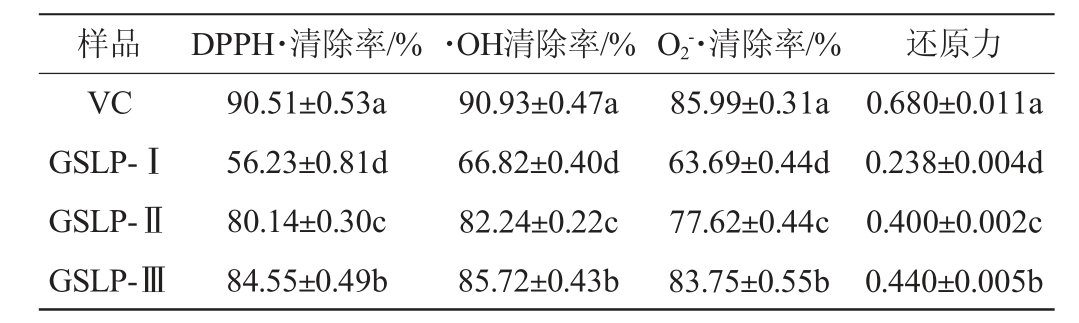
注:同列不同小写字母表示差异显著(P<0.05)。下同。
由表1可知,VC的抗氧化能力最强,不同分子质量肝肽对DPPH·、·OH和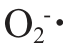 均具有较强清除能力,按抗氧化能力大小对肝肽样品排序为:GSLP-Ⅲ>GSLP-Ⅱ>GSLP-Ⅰ。其中,GSLP-Ⅲ肝肽对DPPH·、·OH和
均具有较强清除能力,按抗氧化能力大小对肝肽样品排序为:GSLP-Ⅲ>GSLP-Ⅱ>GSLP-Ⅰ。其中,GSLP-Ⅲ肝肽对DPPH·、·OH和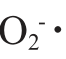 清除率均达到了83.50%以上,显著高于其他肝肽组分;GSLP-Ⅲ肝肽还原力显著高于其他肝肽组分(P<0.05)。在相同质量浓度下,肝肽分子质量越小,体外抗氧化能力越强,这是因为疏水性氨基酸和芳香族氨基酸含量增加,具有抗氧化性的氨基酸增加[33]。
清除率均达到了83.50%以上,显著高于其他肝肽组分;GSLP-Ⅲ肝肽还原力显著高于其他肝肽组分(P<0.05)。在相同质量浓度下,肝肽分子质量越小,体外抗氧化能力越强,这是因为疏水性氨基酸和芳香族氨基酸含量增加,具有抗氧化性的氨基酸增加[33]。
2.3 大鲵肝肽的溶解度
不同分子质量肝肽在不同酒精度白酒中的溶解度见表2。
表2 不同分子质量肝肽在不同酒精度白酒中的溶解度
Table 2 Solubility of liver peptides with different molecular mass in Baijiu with different alcohol content%
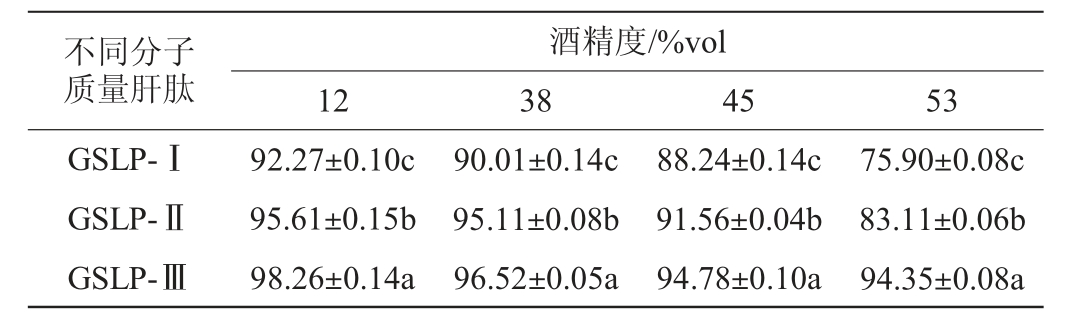
由表2可知,不同分子质量肝肽在不同酒精度白酒中的溶解度不同,在同一分子质量肝肽条件下,随着酒精度的增加,溶解度逐渐降低。在同一酒精度的条件下,分子质量小的肝肽在白酒中的溶解度显著高于分子质量大的肝肽(P<0.05)。GSLP-Ⅲ肝肽在12%vol~53%vol酒精中溶解度均>94.00%。不同分子质量肝肽,在不同酒精度中溶解度不同,究其原因可能是,肽的分子质量大小、肽的结构及端基极性基团决定了肽在酒中的溶解度[34]。
2.4 大鲵肝肽酒对小鼠血液乙醇含量及肝脏代谢酶活性的影响
饮酒后,大部分的酒精经胃肠道进入血液,使血液中乙醇含量升高,在60 min左右达到最高[35],最终进入肝脏进行分解代谢,酒精分解代谢与肝脏中的乙醇脱氢酶(ADH)和乙醛脱氢酶(ALDH)的活力有密切关系。小鼠饮酒后2 h血乙醇含量及肝脏中的乙醇脱氢酶(ADH)和乙醛脱氢酶(ALDH)的活性见表3。
表3 大鲵肝肽酒对小鼠血乙醇含量及肝脏代谢酶活性的影响
Table 3 Effect of Andrias davidianus liver peptide wine on ethanol concentration of blood and metabolic enzyme activity of mouse liver
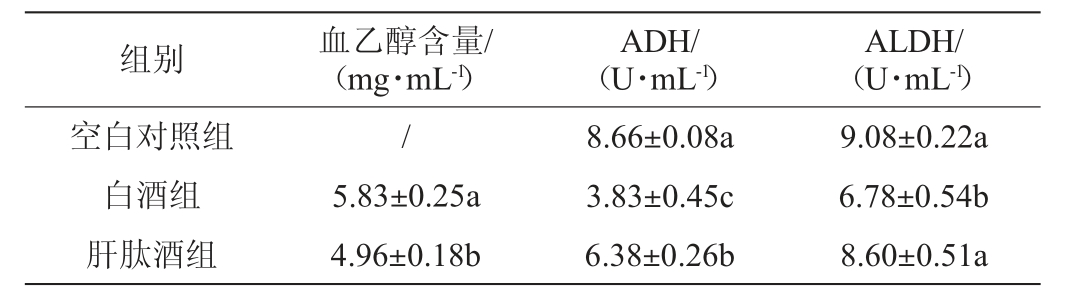
注:“/”表示未检出。
由表3可知,与空白对照组相比,白酒组、肝肽酒组的ADH活性分别降低55.77%、26.33%,ALDH活性分别降低25.33%、5.29%,白酒组、肝肽酒组ADH活力显著低于空白对照组(P<0.05),肝肽酒组ALDH活力与空白组无显著差异(P>0.05);与白酒组相比,肝肽酒组的ADH和ALDH活性分别显著升高66.58%、26.84%(P<0.05),血液乙醇含量显著降低14.29%(P<0.05),说明大鲵肝肽酒在一定程度上具有激活ADH和ALDH的活性,可以加速酒精代谢,降低血乙醇含量。
2.5 大鲵肝肽酒对小鼠肝脏氧化应激代谢酶活性的影响
氧化应激是体内氧化与抗氧化作用失衡,是由自由基在体内产生的一种负面作用。长期大量饮酒后,酒精在肝组织代谢会超过肝脏的正常生理代谢能力,使肝组织发生脂质过氧化,降低谷胱甘肽(GSH)含量和超氧化物歧化酶(SOD)酶活,增加丙二醛(MDA)和甘油三脂(TG)含量[36]。大鲵肝肽酒对小鼠肝脏氧化应激谢酶活性的影响见表4。
表4 大鲵肝肽酒对小鼠肝脏氧化应激代谢酶活性的影响
Table 4 Effect of Andrias davidianus liver peptide wine on oxidative stress metabolic enzyme activity of mouse liver
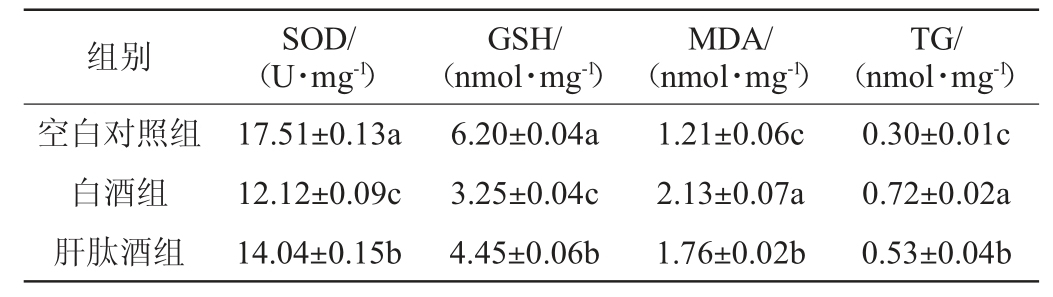
由表4可知,与空白组相比,白酒组、肝肽酒组的SOD活性分别显著降低30.78%、19.82%(P<0.05),GSH含量分别显著降低47.58%、28.23%,MDA含量分别显著升高76.03%、45.45%(P<0.05),TG含量分别显著升高140.00%、76.67%(P<0.05)。与白酒组相比,肝肽酒组的SOD活力和GSH含量分别显著升高15.84%、36.92%(P<0.05),MDA、TG含量分别显著降低17.37%、26.39%(P<0.05),说明大鲵肝肽酒在一定程度上可提高小鼠肝脏SOD活力和GSH含量,降低脂质过氧化物MDA和TG含量,减轻肝脏的氧化应激反应。
2.6 大鲵肝肽酒对小鼠血清转氨酶指标的影响
谷丙转氨酶(ALT)和谷草转氨酶(AST)是评价肝受损的重要指标[37],肝细胞发生异常时,可引起炎症反应和肝细胞坏死,细胞膜的通透性增加,使肝细胞ALT和AST进入血液。大鲵肝肽酒对小鼠血清ALT和AST活性的影响见图2。
由图2可知,与空白对照组相比,白酒组、肝肽酒组小鼠血清中ALT活性分别显著升高了107.33%、62.09%(P<0.05),AST活性分别显著升高108.46%、58.24%(P<0.05),白酒组和肝肽酒组小鼠血清中ALT和AST的活性均显著高于空白对照组(P<0.05);与白酒组相比,肝肽酒组小鼠血清中ALT和AST的活性分别显著降低21.82%、23.61%(P<0.05)。说明大鲵肝肽酒在一定程度上能降低灌胃酒精小鼠血清中ALT和AST活性。
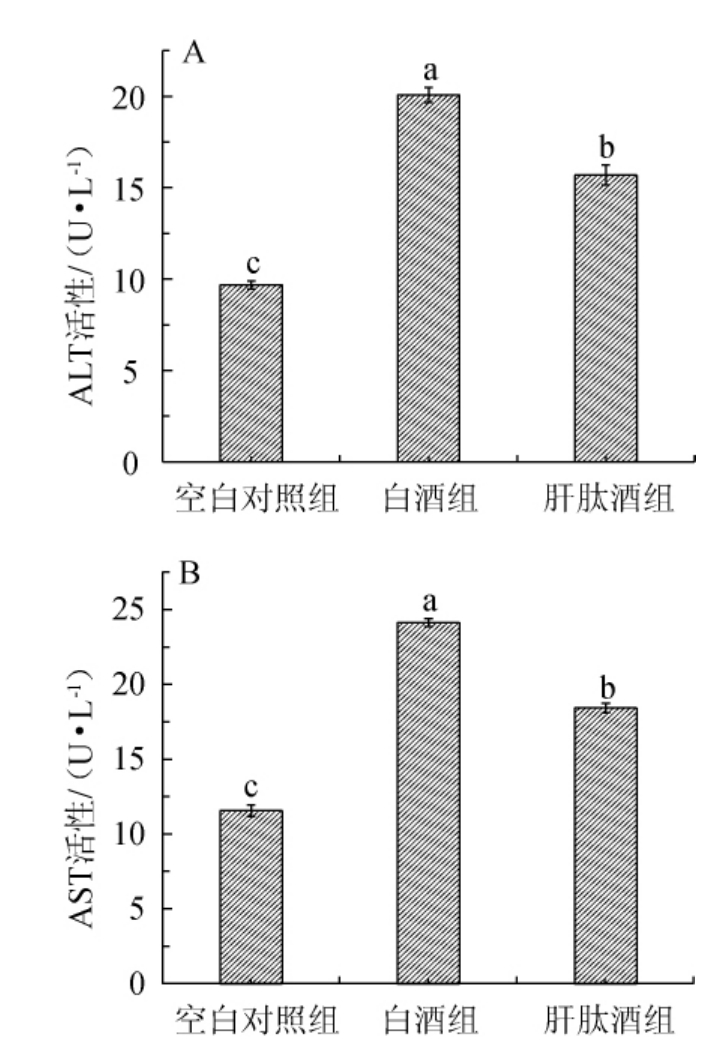
图2 大鲵肝肽酒对小鼠血清谷丙转氨酶(A)和谷草转氨酶(B)活性的影响
Fig.2 Effect of Andrias davidianus liver peptide wine on alanine aminotransferase (A) and aspartate aminotransferase (B)activity of mouse serum
3 结论
本研究以大鲵肝脏和白酒为原料制备大鲵肝肽酒。利用酶解法和膜分离法制备了不同分子质量的肝肽,研究了其体外抗氧化活性及其在不同酒精度白酒中的溶解度,并测定大鲵肝肽酒对小鼠肝脏损伤相关的各项生化指标的影响。结果表明,分子质量<3 000 Da(10 mg/mL)的大鲵肝肽体外对ADH激活率最高,为83.53%,对DPPH·、·OH和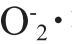 清除率均>83.50%,且具有较强的还原力(吸光度值0.440)。分子质量越小,在白酒中溶解度越大,其中分子质量<3 000 Da的肝肽溶解度均达到94%以上。与灌胃白酒组小鼠相比,大鲵肝肽酒组小鼠肝脏ADH、ALDH、SOD活力及GSH含量显著提高(P<0.05),分别提高66.58%、26.84%、15.84%,36.92%,肝脏MDA、TG含量显著降低(P<0.05),分别降低17.37%、26.39%,血清ALT和AST活性显著降低(P<0.05),分别降低21.82%、23.61%。大鲵肝肽酒能增强机体抗氧化能力,减轻肝脏的氧化应激反应;提高乙醇、乙醛代谢酶的活性,降低乙醇对肝细胞损伤。
清除率均>83.50%,且具有较强的还原力(吸光度值0.440)。分子质量越小,在白酒中溶解度越大,其中分子质量<3 000 Da的肝肽溶解度均达到94%以上。与灌胃白酒组小鼠相比,大鲵肝肽酒组小鼠肝脏ADH、ALDH、SOD活力及GSH含量显著提高(P<0.05),分别提高66.58%、26.84%、15.84%,36.92%,肝脏MDA、TG含量显著降低(P<0.05),分别降低17.37%、26.39%,血清ALT和AST活性显著降低(P<0.05),分别降低21.82%、23.61%。大鲵肝肽酒能增强机体抗氧化能力,减轻肝脏的氧化应激反应;提高乙醇、乙醛代谢酶的活性,降低乙醇对肝细胞损伤。
[1]CEDERBAUM A I.Alcohol metabolism[J].Clin Liver Dis,2012,16(4):667-685.
[2]TESCHKE R.Alcoholic liver disease: alcohol metabolism,cascade of molecular mechanisms,cellular targets,and clinical aspects[J].Biomedicines,2018,6(4):106.
[3]HYUN J,HAN J,LEE C,et al.Pathophysiological aspects of alcohol metabolism in the liver[J].Int J Mol Sci,2021,22(11):5717.
[4]李强武,朱质斌,戴炜.长期饮酒与乙肝病毒感染对肝脏功能影响的研究进展[J].内科,2020,15(1):64-66.
[5]KARLSEN T H,SHERON N,ZELBER-SAGI S,et al.The EASL-Lancet liver commission: protecting the next generation of Europeans against liver disease complications and premature mortality[J].Lancet,2022,399(10319):61-116.
[6]CHEN Y L,OUYANG X S,HOQUE R,et al.β-Hydroxybutyrate protects from alcohol-induced liver injury via a Hcar2-cAMP dependent pathway[J].J Hepatology,2018,69(3):687-696.
[7]SARMADI B H,ISMAIL A.Antioxidative peptides from food proteins:a review[J].Peptides,2010,31(10):1949-1956.
[8]肖楚乔.鸡肉蛋白源ADH激活肽的制备及对小鼠酒精性肝损伤的保护机制研究[D].广州:华南理工大学,2020.
[9]LI G M,LIU W Y,WANG Y Q,et al.Functions and applications of bioactive peptides from corn gluten meal[J].Adv Food Nutr Res,2019,87:1-41.
[10]陈頔,殷继永,黄建.鱼皮低聚肽对小鼠急性酒精性肝损伤的保护作用[J].中国食物与营养,2021,27(5):47-52.
[11]李斌,闫润堃,普畅畅,等.洛阳伊水大鲵肌肉营养成分分析[J].河北渔业,2021(2):12-17.
[12]赵萍,陈小华,刘俊霞,等.生姜/料酒脱腥过程中大鲵肝挥发性有机物动态变化[J].食品与发酵工业,2021,47(24):164-172.
[13]GENG X F,GUO J L,ZANG X Y,et al.Proteomic analysis of eleven tissues in the Chinese giant salamander(Andrias davidianus)[J].Sci Rep,2019,9(1):16415.
[14]胡代花.超声辅助提取大鲵肝脏油脂及其脂肪酸组成分析[J].中国油脂,2017,42(6):12-15.
[15]马东林,杨絮,郭全友,等.大鲵营养组成、功能成分及加工利用研究进展[J].食品与发酵工业,2020,46(24):242-248.
[16]李小强.山药蛋白酶解多肽液及多肽酒制备工艺研究[D].武汉:湖北工业大学,2012.
[17]胥霞.柠檬多肽制备及其多肽酒发酵工艺的研究[D].成都:西华大学,2019.
[18]杨希娟,党斌,耿贵工,等.酶解蚕豆蛋白制备多肽的工艺优化及多肽酒的发酵[J].中国农业大学学报,2013,18(2):158-166.
[19]董慧明,张月辉,陈玉威,等.海参酒中海参多肽的提取工艺研究[J].山东化工,2014,43(1):20-21,24.
[20]殷金莲,徐怀德.甲鱼多肽酒发酵工艺及抗氧化性分析[J].食品工业,2019,40(2):77-80.
[21]黄治国,罗惠波,卫春会,等.鹿茸血酒加工工艺研究[J].中国酿造,2009,28(7):166-168.
[22]陈娟,喻仕瑞,朱思洁,等.大鲵肽酱香酒酶解工艺优化及抗氧化活性研究[J].中国酿造,2020,39(7):101-106.
[23]车帅,刘楚怡,王长伟,等.一种含有牡蛎肽保健酒的功能评价[J].中国酿造,2021,40(5):97-10.
[24]刘鹏.低分子量促乙醇代谢玉米肽制备与蛋白成分对活性贡献关系研究[D].广州:华南理工大学,2015.
[25]罗敏,陈德经,韩豪,等.硒化米胚多糖的抗氧化性[J].食品科学,2018,39(19):58-63.
[26]杨慧,陈德经,陈海涛,等.大鲵皮肤色素的性质及功能研究[J].食品研究与开发,2019,40(9):39-45.
[27]ZENG N,ZHANG G W,HU X,et al.Mechanism of fisetin suppressing superoxide anion and xanthine oxidase activity[J].J Funct Foods,2019,11(58):1-10.
[28]SIDDHURAJU P,MOHAN P S,BECKER K.Studies on the antioxidant activity of Indian laburnum(Cassia fistula L.):a preliminary assessment of crude extracts from stem bark,leaves,flowers and fruit pulp[J].Food Chem,2002,79(1):61-67.
[29]韩建春,张敏.大豆多肽饮料的加工工艺[J].食品科学,2004,25(4):200-203.
[30]苗明三,康乐,方晓艳,等.酒精性肝损伤动物模型制备规范(草案)[J].中华中医药杂志,2018,33(3):1000-1003.
[31]ZHAO R J,HUO C Y,QIAN Y,et al.Ultra-high-pressure processing improves proteolysis and release of bioactive peptides with activation activities on alcohol metabolic enzymes in vitro from mushroom foot protein[J].Food Chem,2017,231:25-32.
[32]张帅.河蚬酶解产物解酒护肝活性的研究[D].湛江:广东海洋大学,2019.
[33]胡廷,青维,李美凤,等.大鲵多肽体外抗氧化活性研究[J].食品科技,2018,43(6):254-259.
[34]于泓鹏,陈运生,吴克刚,等.罗非鱼水解多肽的乳化性及乳化稳定性[J].食品科技,2015,40(2):328-333.
[35]SHI Y T,YU F J,WU Y,et al.Identification of a novel peptide that activates alcohol dehydrogenase from crucian carp swim bladder and how it protects against acute alcohol-induced liver injury in mice[J].J Pharmaceut Biomed,2022,207:114426.
[36]JING J,CUI Z,ZHANG X,et al.Protective Effect of extract of Corbicula fluminea on acute chemical-induced liver injury mice[J].China Pharmaceuticals,2009,18(1):6-7.
[37]ELISABETTA C,TOMMASO M,ANDREA G.Pathogenesis of alcoholic liver disease:role of oxidative metabolism[J].World J Gastroen,2014,20(47):17756-17772.