中国白酒酿造是一种传统的、古老的固态发酵技术,其多样的酿造原料,多菌复合的酒曲做糖化发酵剂、开放式固态发酵工艺造就了其独特的酒体风格[1-2]。白酒发酵过程中,微生物会代谢产生大量有机酸类物质[3]。这些酸类物质一方面增加酒醅中的酸度,可以一定程度上抑制杂菌生长[4];另一方面有机酸是白酒中重要的呈味物质,适量的有机酸使酒体丰满协调,其中乳酸、乙酸等也是重要的风味前体物质[5-6]。
乳酸是一种普遍存在的代谢物,也是一种生长抑制剂,经常出现在发酵食品和饮料的发酵过程中[7]。乳酸的非解离形式具有亲脂性,因此乳酸可以通过简单扩散透过细胞膜,流入细胞质[8]。在近中性的细胞质中,乳酸解离,释放氢离子和乳酸根离子。因为这些离子带有电荷,它们不能通过疏水的细胞膜脂质双层。这些离子在细胞内积累,导致细胞内pH的变化,嘌呤碱基的完整性受到影响,导致细胞内关键酶的变性,从而抑制了中国白酒发酵过程中乙醇的产生[9]。白酒发酵过程中有机酸含量具有一定的差异,研究表明,在贵州省酱香型白酒酒醅中检测出乳酸含量最高可达(36.20±6.2)g/kg[10],同时王雪山[11]通过超高效液相色谱(ultra-performance liquid chromatography,UPLC)技术研究发现,发酵过程中,清香型酒醅中有机酸含量最高的也是乳酸(50.24~297.84 mg/kg酒醅),其次是苹果酸、乙酸等,因此选用乳酸能较好模拟白酒发酵过程中的酸环境。
在白酒实际生产中多以配糟的方式控酸,初始酸度的范围也主要是根据长期的经验而得,然而酸度对发酵过程的影响往往是从发酵菌群演替和代谢及酶活等各个角度去作用的,目前并没有一个系统的科学阐述。有研究表明酸度推动着白酒发酵过程中微生物群落的演替[12],不同的pH环境条件下,由于各种菌群的复杂代谢以及相互作用,使得微生物体内的生理代谢发生变化以适应环境的生态因子的改变,其结果表现为代谢产物的组成和含量变化[13]。同时酿酒酵母是白酒发酵产酒阶段的主体微生物,在将糖转化成乙醇的过程中会面对各种胁迫和环境的变化,酵母也会对各种变化做出应答[14]。因此为揭示发酵过程中酸度对酿酒酵母发酵状况的影响,本研究以高粱糖化液模拟发酵环境,添加乳酸设置不同初始酸度,排除糟醅原料和其他微生物影响,考察了不同初始酸度条件下酿酒酵母的生长代谢情况,以期说明白酒发酵过程中初始酸度对发酵产酒的影响,为探究白酒生产的可控式发酵提供理论指导。
1 材料与方法
1.1 材料与试剂
粳高粱:市售;乳酸香精(食品级):河南燕康公司;糖化酶(50 000 U/g):江苏博立生物制品有限公司;酿酒酵母(Saccharomyces cerevisiae):安琪酵母股份有限公司。
麦芽汁琼脂(malt extract agar,MEA)培养基:蛋白胨4.0 g,葡萄糖10.0 g,酵母浸粉3.0 g,麦芽粉10.0 g,琼脂粉13.0 g,加水至1 000 mL,121 ℃高压蒸汽灭菌15 min,冷却至50 ℃,加入0.1 g氯霉素倒平板备用。
1.2 仪器与设备
Auper Alcomat高精度数显酒精浓度计:优莱博技术(北京)有限公司;1000A多功能粉碎机:永康市红太阳机电有限公司;发酵栓、UV-1200紫外分光光度计:上海美普达仪器有限公司;YQ-PJ-8B型自动糖化器:轻工业部西安轻机所光电公司;7890A-5975B气相色谱-质谱联用(gas chromatography-mass spectrometer,GC-MS)仪:安捷伦科技(中国)有限公司。
1.3 方法
1.3.1 高粱糖化液制备
取100 g粳高粱,粉碎至200目,加入200 mL沸水,搅拌均匀,置于100 ℃水浴锅中搅拌糊化2 h。取出后晾冷至30 ℃左右,加入糖化酶干粉,添加量以糖化酶活力300 U/g粮食干质量计,放于30 ℃恒温糖化24 h。糖化完成后用四层纱布过滤,得到滤液,121℃高压蒸汽灭菌15 min。冷却至常温后,添加乳酸到糖化液中,使高粱糖化液酸度分别为0(未调)、5 mmol/100 g、10 mmol/100 g、15 mmol/100 g、20 mmol/100 g、25 mmol/100 g、30 mmol/100 g。
1.3.2 不同初始酸度下酿酒酵母生长情况的测定
从活性干酵母中获得的酵母菌株在MEA培养基中培养至对数期(OD600nm值为1.2左右),离心(6 000 r/min、5 min),收集细胞,以磷酸缓冲液(100 mmol/L,pH 6.0)清洗两次,然后重悬于不同初始酸度(0、5 mmol/100 g、10 mmol/100 g、15 mmol/100 g、20 mmol/100 g、25 mmol/100 g、30 mmol/100 g)的MEA培养基中,接种量为1%,置于28 ℃、150 r/min有氧培养48 h。每3 h测定样品的OD600nm值,到24 h后再每6 h测定。以培养时间(x)为横坐标,OD600nm值(y)为纵坐标,绘制生长曲线。
1.3.3 不同初始酸度下酿酒酵母发酵质量损失的测定
分装100 mL高粱糖化液于发酵栓,接种1%的酵母菌培养液,振荡均匀,密封,静置培养,每隔12 h称质量一次,直到发酵结束,测定CO2质量损失。
1.3.4 发酵产物的测定
发酵结束(CO2质量损失恒定)后,取发酵液通过固相微萃取结合GC-MS法测定发酵产物。固相微萃取条件:取5 mL发酵液于顶空瓶中,加入1.5 g NaCl,20 μL 2-辛醇(内标,0.45 g/L),70 ℃预热10 min,萃取30 min,解吸10 min。
气相色谱条件:J&W 122-7062毛细管色谱柱(60 m×250 μm×0.25 μm);手动进样,不分流;进样口温度230 ℃;程序升温为初始温度50 ℃,维持2 min,然后以6 ℃/min升温至120 ℃,维持4 min,再以15 ℃/min升温至230 ℃,维持4 min;载气为高纯氦气(He),流速为1 mL/min。
质谱条件:电子电离(electron ionization,EI)源,电子能量70 eV,离子源温度230 ℃,四极杆温度150 ℃,全扫描,质量扫描范围为35~350 amu。
定性、定量:将色谱峰质谱结果与美国国家标准与技术研究院(national institute of standards and technology,NIST)2017谱库中数据比对,与谱库中某化合物匹配度达到700以上时,认为该峰代表此化学物质,实现定性。根据2-辛醇(内标)的峰面积和浓度可实现半定量。
1.3.5 酒精度的测定
取对数期的酿酒酵母,以1%的接种量接种到200 mL高粱糖化液中,静置密封,发酵直至质量损失不变。将全部发酵液用于蒸馏得100 mL馏出液,平衡至20 ℃,采用酒精浓度计测定酒精度。
1.3.6 数据分析
采用Excel 2019软件处理数据,使用SPSS 22.0软件对数据结果进行分析,采用Origin 2021软件绘图。
2 结果与分析
2.1 不同初始酸度对酿酒酵母生物量的影响
酿酒酵母是生产酒精的主要微生物,同时白酒生产的发酵环境中存在着多种影响因素,如温度、水分、氧气、pH等[15-16],随白酒酿造发酵生酸,酿酒酵母不可避免的受到弱有机酸引起的低pH胁迫,并对其生长代谢产生影响[14]。本试验研究了不同初始酸度对酿酒酵母生长的影响,结果见图1。
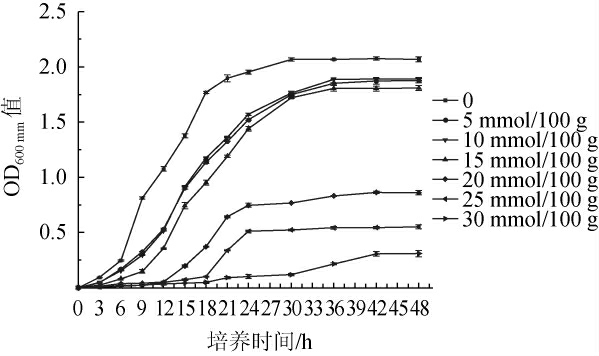
图1 不同初始酸度对酿酒酵母生长的影响
Fig.1 Effect of different initial acidity on the growth of Saccharomyces cerevisiae
由图1可知,对照组(0)在培养3h时进入对数期,15h进入对数中期,24 h进入稳定期;在初始酸度为5~15 mmol/100 g培养条件下酿酒酵母于30 h进入稳定期,相比于对照组,稳定期滞后6 h,且在该酸度范围内,酿酒酵母生长变化趋势大致相同,最终细胞生长量基本一致;初始酸度在20 mmol/100 g、25 mmol/100 g和30 mmol/100 g时延滞期明显延后,且最终细胞生长量显著低于对照组(P<0.05)。DENG N等[7]研究发现,白酒发酵中乳酸胁迫对毕赤酵母和酿酒酵母的生长均具有显著影响,与本研究结果相符。综上,初始酸度对酿酒酵母的生长有影响,随初始酸度的增加,酿酒酵母生长所受抑制作用逐渐增强。
2.2 初始酸度对酿酒酵母发酵质量损失的影响
酿酒酵母通过发酵糖类生成乙醇,然而一定酸度条件下会抑制酿酒酵母的发酵,从而影响乙醇的生成。以酿酒酵母发酵的累计质量损失来表征其发酵情况,不同初始酸度条件下发酵的质量损失结果见图2。由图2可知,在发酵前12 h,质量损失较小,在12~48 h内变化明显,当酿酒酵母处于较低初始酸度(5~15 mmol/100 g)时,样品质量损失变化比对照组略快,即代谢活动更强烈,但累计质量损失均在48 h时达到最大;处于较高初始酸度(25~30 mmol/100 g)时,样品质量损失变化较对照组更缓慢,且初始酸度达到30 mmol/100 g时,酵母的生命活动明显被抑制。说明较低的初始酸度(0~15 mmol/100 g)对酵母糖代谢有一定促进作用,在较高初始酸度下酵母生命活动受到抑制,发酵强度明显降低。最终酵母质量损失累计量降低,但仍有质量损失积累,猜测可能是在高酸度下酿酒酵母可能产生一定的应激反应以增强自身耐受性,如细胞质酸化,细胞质膜H+-腺嘌呤核苷三磷酸(adenosine 5'-triphosphate,ATP)酶活性增强[17],以保证酵母细胞的存活率,推测酵母代谢产物变化也会符合上述规律。
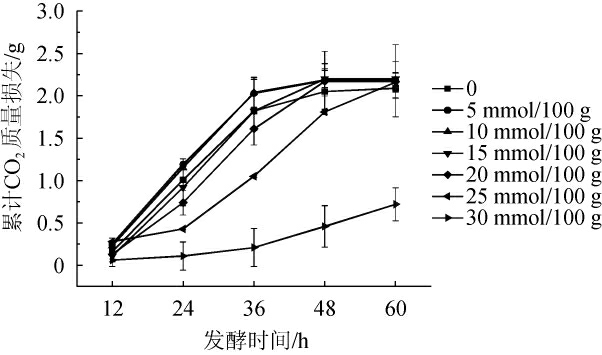
图2 不同初始酸度对酿酒酵母发酵质量损失的影响
Fig.2 Effect of different initial acidity on the mass loss of Saccharomyces cerevisiae fermentation
2.3 初始酸度对酿酒酵母发酵产风味物质的影响
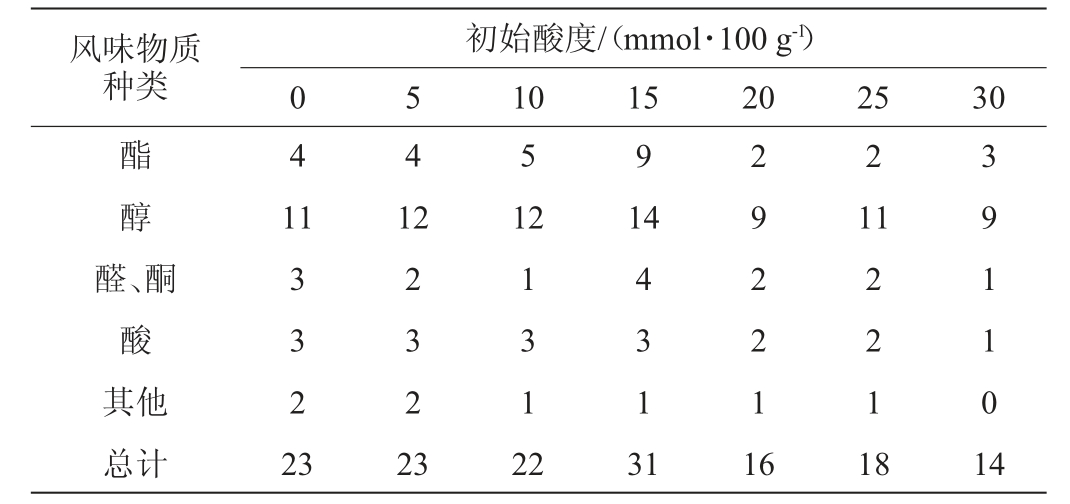
对酿酒酵母的发酵液进行挥发性风味物质的定性检测,检测结果见表1。由表1可知,随初始酸度的增加,发酵液中检测到的酯和醇的种类数量先增后减,在初始酸度为15 mmol/100 g时风味物质种类、酯类、醇类数量最多,表明低酸(0~15 mmol/100 g)环境可能会促进风味物质的生成。这可能是因为在酸性环境中,酵母的生理形态有一定变化,胞内代谢物质也会发生改变。尚磊[18]也对不同pH(3、5)条件下进行代谢的酵母胞内物质进行提取,发现低pH条件下生成的醇和酯的相对含量更高,加速了糖代谢,糖类物质减少。
表1 不同初始酸度下酵母发酵产物风味物质种类数量
Table 1 Number of flavor substance types in yeast fermentation products under different initial acidity
乙醇是酿酒酵母发酵的主要产物,也是白酒产量和品质的基础。不同初始酸度对酿酒酵母发酵产乙醇能力的影响见图3。由图3可知,随初始酸度增加,发酵液的酒精度呈先升后降的变化趋势,低初始酸度(0~10 mmol/100 g)发酵时的酒精度显著高于对照组,当初始酸度为5 mmol/100 g时达到最高,且与其他试验组呈现显著差异(P<0.05)。而初始酸度在(15~30)mmol/100 g条件下,酿酒酵母酒精度显著低于对照组(P<0.05),表明初始酸度影响着酿酒酵母的乙醇代谢,较高的初始酸度会抑制酿酒酵母的乙醇生成,调节适宜的初始酸度可能会促进白酒发酵产酒。刘兴艳等[14]以不同pH条件通过模拟合成培养基发酵体系中培养三株酿酒酵母,发现在低pH和高pH的乙醇得率具有显著差异,与本研究结果相符合。
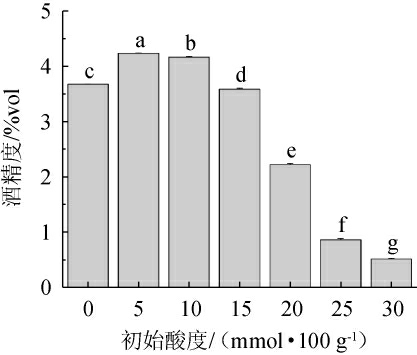
图3 不同初始酸度对酿酒酵母发酵液酒精度的影响
Fig.3 Effects of different initial acidity on alcohol content of fermentation broth of Saccharomyces cerevisiae
字母不同表示差异显著(P<0.05)。下同。
2.4 不同初始酸度对发酵结束时酿酒酵母关键风味成分的影响
风味物质是影响白酒质量的重要因素之一,根据相关文献[5,19-20]报道,选取乙酸乙酯、乳酸乙酯、乙酸苯乙酯、异丁醇、异戊醇和β-苯乙醇作为酿酒酵母发酵液风味成分的关键指标,研究了初始酸度对酿酒酵母发酵产主要香气成分的影响,结果见图4。
乙酸乙酯具有果香风味特征,其主要是由酿酒酵母产生的醇乙酰基转移酶和乙酰辅酶A(acetyl coenzyme A,Ac-CoA)共同催化合成的,对白酒风味的组成也有着重大影响,因此产乙酸酯的酿酒酵母选育也很重要[21-22]。由图4A可知,随着发酵初始酸度的增加,乙酸乙酯含量呈先升后降的变化趋势,在初始酸度为20 mmol/100 g培养条件下累积生成量达到最高为(4.49±0.04)mg/L,显著高于其他初始酸度条件(P<0.05)。
乙酸苯乙酯呈花香、蜂蜜味,作为乙酸酯类风味物质,与乙酸乙酯合成机制相似。由图4B可知,发酵结束时,其含量随酸度增加整体呈现逐渐降低的变化趋势,当初始酸度为25~30 mmol/100 g时检测不到乙酸苯乙酯。
乳酸乙酯呈水果香,是白酒中酯类最基础的重要化合物,也是清香型白酒的基本骨架。由图4C可知,乳酸乙酯含量随初始酸度增加,呈先升后降的趋势,在5 mmol/100 g的初始酸度培养条件下含量达到最高(17.69±1.73)mg/L,显著高于其他初始酸度时的含量(P<0.05)。
异丁醇、异戊醇这些醇类是白酒重要的呈香物质,对于赋予白酒醇甜风味及酒体醇厚感具有重要作用[23]。由图4D及4E可知,发酵结束时异丁醇、异戊醇的含量变化趋势大致相同,随初始酸度增加呈现先升高后逐渐降低的变化趋势,在5 mmol/100 g初始酸度培养条件下含量达到最高分别为(4.72±0.29)mg/L、(48.49±12.7)mg/L。但也有研究表明,异丁醇、异戊醇也是高级醇的主要成分,占高级醇的40%~70%[24],如果含量过高会使人产生头痛、头晕等症状[19]。
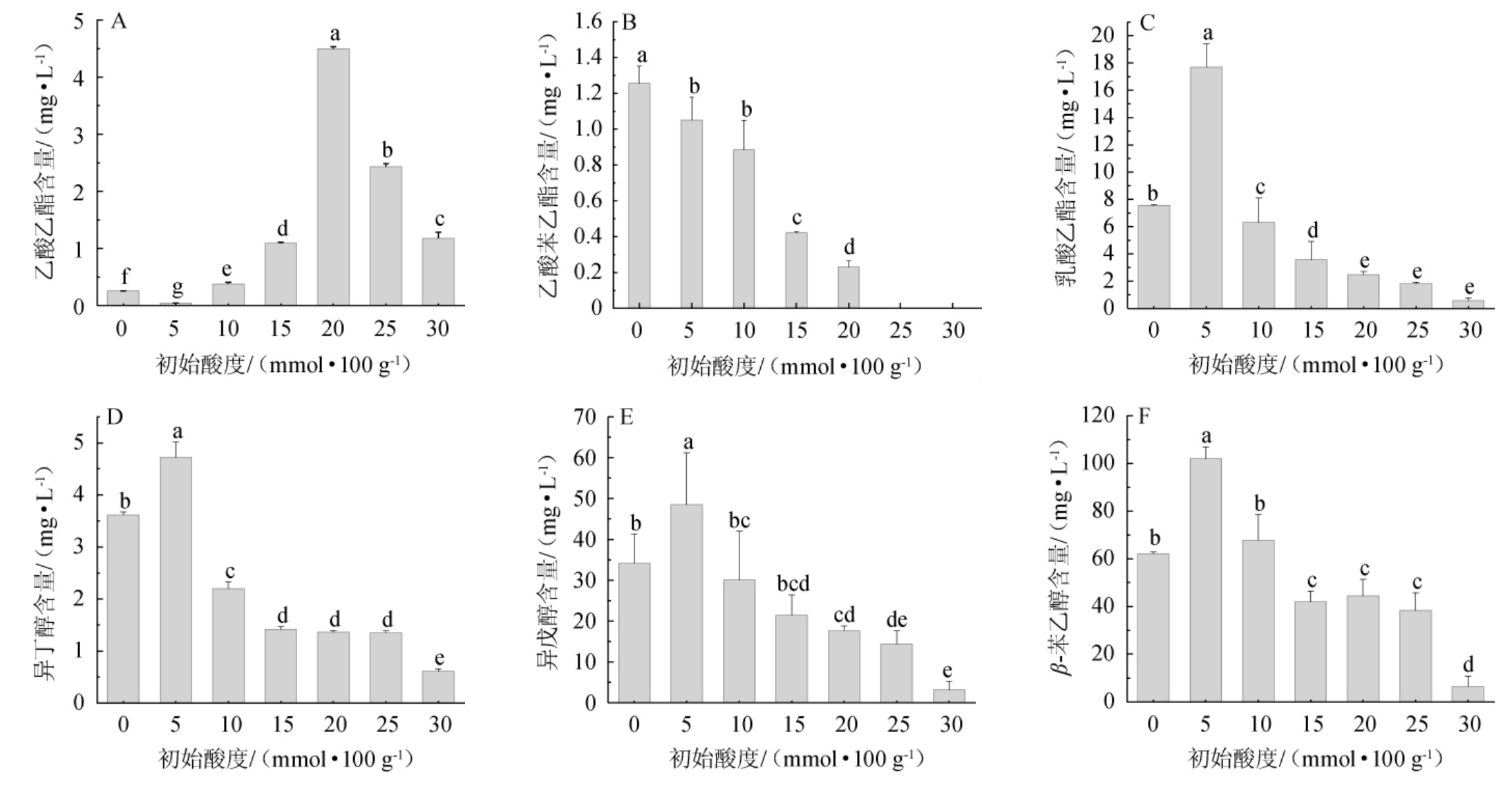
图4 不同初始酸度对发酵末期酿酒酵母关键风味物质生成的影响
Fig.4 Effects of different initial acidity on the formation of key flavor substances in Saccharomyces cerevisiae at the end of fermentation
β-苯乙醇是一种芳香族化合物,具有玫瑰花香,同时也是米香型的典型风味,是酿酒酵母合成的主要高级醇类物质[25],发酵过程中苯乙醇主要由酿酒酵母通过莽草酸途径或埃尔利希途径从头合成[26]。由图4F可知,β-苯乙醇含量整体呈现先升高后降低的变化趋势,在5 mmol/100 g的初始酸度培养条件下含量达到最高为(101.99±5.00)mg/L,显著高于其他初始酸度(P<0.05),酿酒酵母的β-苯乙醇合成在较高的初始酸度(10~30 mmol/100 g)培养条件下被抑制。
综上,初始酸度对发酵末期关键风味物质生成的影响具有一定差异,其中乳酸乙酯、苯乙醇、异丁醇和异戊醇含量随酸度增加呈现先增后减的变化趋势,在酸度为5 mmol/100 g时达到最高,在较高酸度时(20 mmol/100 g)更有利于乙酸乙酯的生成,乙酸苯乙酯的生成随酸度增加逐渐被抑制。
3 结论
本研究结果表明,初始酸度对酿酒酵母的生长代谢和乙醇生成存在影响,初始酸度的增加抑制了酿酒酵母的生长,低初始酸度(0~15 mmol/100 g)环境更利于酵母发酵产物的生成,此时酿酒酵母发酵力更强,加快了CO2释放和糖代谢速率,较高的初始酸度(15~30 mmol/100 g)会抑制酿酒酵母乙醇的生成;在初始酸度为15 mmol/100 g时的总挥发性物质种类、酯类、醇类最多。初始酸度对发酵末期关键风味物质生成的影响具有一定差异,其中乳酸乙酯、苯乙醇、异丁醇和异戊醇含量随酸度增加呈现先增后减的变化趋势,在酸度为5 mmol/100 g时达到最高,在较高酸度(20 mmol/100 g)时更有利于乙酸乙酯的生成,乙酸苯乙酯的生成随初始酸度增加逐渐被抑制。综上,控制初始酸度为15 mmol/100 g左右发酵效果较好。研究结果为白酒发酵中初始酸度范围的控制提供了理论依据,为解析酸度对白酒发酵产酒的影响机制做了初步研究,未来针对酿酒酵母的关键风味的代谢机理和调控还有待进一步探索。
[1]JIN G,ZHU Y,XU Y.Mystery behind Chinese liquor fermentation[J].Trend Food Sci Technol,2017,63:18-28.
[2]LIU H,SUN B.Effect of fermentation processing on the flavor of Baijiu[J].J Agr Food Chem,2018,66(22):5425-5432.
[3]XU Y,WANG D,FAN W L,et al.Traditional Chinese biotechnology[J].Adv Biochem Eng Biotechnol,2010,122:189-233.
[4]赵景龙,张红霞,张秀红.低酸环境对汾酒酿造的影响[J].中国酿造,2013,32(8):35-38.
[5]孙细珍,杜佳炜,黄盼,等.现代工艺和传统工艺酿造小曲清香型白酒感官表征及风味成分分析[J].食品科学,2021,42(6):282-290.
[6]孙鹏飞,张福艳,吴海静,等.衡水老白干酒中产酸微生物的分离鉴定及性能研究[J].中国酿造,2016,35(3):36-40.
[7]DENG N,DU H,XU Y.Cooperative response of Pichia kudriavzevii and Saccharomyces cerevisiae to lactic acid stress in Baijiu fermentation[J].J Agri Food Chem,2020,68(17):4903-4911.
[8]MIRA N P,TEIXEIRA M C,SÁ-CORREIA I.Adaptive response and tolerance to weak acids in Saccharomyces cerevisiae: a genome-wide view[J].Omics,2010,14(5):525-540.
[9]WARNECKE T,GILL R T.Organic acid toxicity,tolerance,and production in Escherichia coli biorefining applications[J].Microb Cell Fact,2005,4(1):1-8.
[10]SONG Z,DU H,ZHANG Y,et al.Unraveling core functional microbiota in traditional solid-state fermentation by high-throughput amplicons and metatranscriptomics sequencing[J].Front Microbiol,2017,8:1294.
[11]王雪山.不同环境清香类型白酒发酵微生物种群结构比较及溯源解析[D].无锡:江南大学,2018.
[12]李小龙,吴群,徐岩.乙醇与酸度协同作用推动芝麻香型白酒固态发酵过程的微生物群落演替[J].微生物学通报,2019,46(1):1-10.
[13]任南琪,王爱杰,马放著.产酸发酵微生物生理生态学[M].北京:科学出版社,2005:339.
[14]刘兴艳,贾博,赵芳,等.酿酒酵母对弱有机酸胁迫的应激机制研究进展[J].食品与发酵工业,2013,39(6):125-129.
[15]NUGROHO R H,YOSHIKAWA K,SHIMIZU H.Metabolomic analysis of acid stress response in Saccharomyces cerevisiae[J].J Biosci Bioeng,2015,120(4):396-404.
[16]肖辰,陆震鸣,张晓娟,等.泸型酒酒醅细菌群落的发酵演替规律[J].微生物学报,2019,59(1):195-204.
[17]ABBOTT D A,SUIR E,VAN MARIS A J,et al.Physiological and transcriptional responses to high concentrations of lactic acid in anaerobic chemostat cultures of Saccharomyces cerevisiae[J].Appl Environ Microbiol,2008,74(18):5759-5768.
[18]尚磊.低pH环境下酿酒酵母的生理差异性研究[D].杨凌:西北农林科技大学,2018.
[19]王喆,张梦思,孙细珍,等.小曲清香型白酒中关键风味成分分析[J].食品科学,2022,43(14):264-271.
[20]王震,叶宏,朱婷婷,等.清香型白酒风味成分的研究进展[J].食品科学,2022,43(7):232-244.
[21]范光森,吴秋华,刘朋肖,等.脂肪酶在白酒酯类化合物合成中的作用研究进展[J].中国食品学报,2021,21(1):351-360.
[22]张翠英,崔丹瑶,李维,等.高产乙酸酯酿酒酵母菌种的选育与提高白酒酯香物质含量的研究[J].酿酒科技,2018(7):92-97.
[23]QIAN Y L,AN Y,CHEN S,et al.Characterization of Qingke liquor aroma from Tibet[J].J Agr Food Chem,2019,67(50):13870-13881.
[24]CHRISTOPH N,BAUER-CHRISTOPH C.Flavour of spirit drinks:Raw materials,fermentation,distillation,and ageing[M]//Flavours and fragrances.Springer,Berlin,Heidelberg,2007:219-239.
[25]王光路,刘兰茜,郑颖,等.一株高产β-苯乙醇酵母菌的分离及产香特性研究[J].食品与发酵工业,2022,48(2):68-74.
[26]孙中贯,刘琳,王亚平,等.酿酒酵母高级醇代谢研究进展[J].生物工程学报,2021,37(2):429-447.