随着农业生产的发展,粮食产量大幅提高,导致秸秆数量增多,出现秸秆资源供给过剩的问题[1]。秸秆的主要成分为纤维素、半纤维素、木质素等,在自然条件下难以降解[2]。纤维素含量约占植物干质量的45%左右[3],秸秆中纤维素的降解成为了秸秆处理的关键。与传统的物理化学降解方式相比,生物降解具有条件温和、成本低、有害副产物少等优点[4]。因此,利用微生物降解秸秆成为国内外该领域研究热点。
目前,纤维素降解菌来源大多为腐败的树叶、昆虫肠道及反刍动物的粪便等,从山西老陈醋源中筛选产纤维素酶微生物的报道较少。山西老陈醋作为我国“四大名醋”之一,选用优质高粱、大麦、豌豆等五谷酿造而成[5],其酿造环境中具有丰富的微生物资源,是选育高效发酵菌株的天然宝库。近年来,关于单菌株降解秸秆纤维素的研究较多,但单菌株存在产酶单一,难以破坏木质素的网状结构导致降解酶接触纤维素困难等问题,无法达到秸秆纤维素的高效降解[6]。因此,越来越多的学者开始利用复合菌系的协同作用提高秸秆纤维素降解率。李静等[7]从土壤中分离筛选出由类芽孢杆菌属(Paenibacillus sp.)、芽孢杆菌属(Bacillus sp.)、不动杆菌属(Acinetobacter sp.)以及链霉菌属(Streptomyces sp.)组成的复合菌系对纤维素的降解能力优于其中任何单一菌株;CHU X D等[8]将黄孢原毛平革菌(Phane-rochaete chrysosporium)、变色栓菌(Trametes versicolor)和糙皮侧耳(Pleurotus ostreatus)组合构建成复合菌系,其对纤维素、半纤维素以及木质素都具有高效降解能力;GONG X J等[9]将筛选出的3株链霉菌(Streptomyces sp.)复合后分解能力明显增强,其中菌株G1、G2对纤维素、半纤维素分解能力较强;菌株G3对木质素分解能力较强。研究表明,与单菌株相比,复合菌系对于纤维素、半纤维素以及木质素的降解具有明显优势,且复合菌系多由真菌和放线菌组成,细菌组合构建的复合菌系的研究报道较少[10-11],尤其对复合菌系产酶条件优化的研究相对不足。细菌具有来源广、种类多、生长快等特点[12]。因此,筛选高效的秸秆纤维素降解细菌构建复合菌系具有重要意义。
本研究以羧甲基纤维素钠(carboxymethylcellulose sodium,CMC-Na)为唯一碳源,采用刚果红染色法及滤纸条崩解法从山西老陈醋源中分离筛选纤维素降解菌,通过形态观察及分子生物学技术对其进行菌种鉴定,并以滤纸酶活性为筛选指标,对无拮抗作用的菌株进行复配构建高效复合菌系。以滤纸酶活性为响应值,采用单因素试验及Box-Behnken响应面法优化复合菌系的产酶条件,并评估其在最佳条件下对不同秸秆的降解能力,以期证实该复合菌系在秸秆降解方面的实用性,为高效降解秸秆复合菌剂的研制和开发奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
醋糟、醋醅:山西省太原市清徐县某醋厂;玉米秸秆、小麦秸秆、高粱秸秆、大豆秸秆:河南省商丘市柘城县某农田;水稻秸秆:浙江省某农田。秸秆用无菌水冲洗后干燥,研磨过40目筛,置于阴凉干燥处储存备用。
1.1.2 试剂
CMC-Na(分析纯):国药集团化学试剂有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(分析纯):上海麦克林生化科技有限公司;酒石酸钾钠、刚果红(均为分析纯):上海阿拉丁生化科技股份有限公司;苯胺蓝(分析纯):生工生物工程(上海)股份有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
CMC-Na培养基[13]:CMC-Na 10 g,KH2PO42.5 g,Na2HPO4 1.5 g,蛋白胨2.5 g,NH4NO3 1.0 g,MgSO4·7H2O 0.5 g,酵母浸粉1.0 g,蒸馏水1 L,pH自然。
筛选培养基[13]:CMC-Na 10 g,KH2PO4 2.5 g,Na2HPO4 1.5 g,蛋白胨2.5 g,琼脂20 g,NH4NO3 1.0 g,MgSO4·7H2O 0.5 g,酵母浸粉1.0 g,蒸馏水1 L,pH自然。
LB培养基[14]:胰蛋白胨10 g,酵母浸粉5 g,NaCl 10 g,琼脂粉20 g,蒸馏水1 L,pH 7.0。
赫奇逊无机盐培养基[15]:KH2PO4 1.0 g,NaCl 0.1 g,MgSO4·7H2O 0.3 g,NaNO3 2.5 g,CaCl2 0.1 g,FeCl3 0.01 g,蒸馏水1 L,pH自然。
苯胺蓝培养基[16]:胰蛋白胨10 g,酵母浸粉5 g,NaCl 10 g,琼脂粉20 g,苯胺蓝0.4 g,蒸馏水1 L,pH自然。
以上培养基均在121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
BXM-30R型立式压力蒸汽灭菌器:上海博讯实业有限公司医疗设备厂;HZ-9511KB型台式恒温摇床:太仓市科教器材厂;SW-CJ-1F型洁净工作台:苏州安泰空气技术有限公司;MGC-350HP-2型人工气候箱:上海一恒科学仪器有限公司;UV-2100型紫外可见分光光度计:上海尤尼柯仪器有限公司;HC-3018型高速离心机:安徽中科中佳科学仪器有限公司;ABI-2720型聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Applied Biosystems公司;EM GP2共聚焦显微镜:德国徕卡公司。
1.3 方法
1.3.1 纤维素降解菌的分离纯化
将10 g醋糟、醋醅样品加入90 mL无菌水中,35 ℃振荡2 h,混匀。取5 mL上清液于CMC-Na培养基中,35 ℃、180 r/min培养2 d,重复3~4次。取富集液按10倍系列梯度稀释至10-7,取稀释度为10-1、10-3、10-5、10-7的稀释液涂布于筛选培养基上,35 ℃条件下培养3 d,挑取不同形态的菌落重复划线分离多次得到单菌株,编码,并置于LB斜面培养基于4 ℃保存。
1.3.2 纤维素降解菌的筛选
初筛:采用刚果红染色法[17]初筛。将分离得到的单菌株点种于筛选培养基上,35 ℃倒置培养3 d,采用1 mg/mL刚果红溶液染色后,采用l mol/L NaCl溶液脱色,测量透明圈直径和菌落直径,并计算水解值,水解值=透明圈直径/菌落直径。
复筛:选取水解值较大的菌株使用滤纸条崩解法[18]进行复筛。在40 mL赫奇逊无机盐培养基中加入2条1 cm×6 cm的滤纸条和2 mL菌液,35 ℃、180 r/min培养7 d,以添加等量无菌水作为空白对照,观察滤纸崩解情况。同时,采用苯胺蓝脱色法[16]检测筛选出的菌株是否具有木质素降解能力。
1.3.3 纤维素降解菌的鉴定
形态学观察:将筛选得到的菌株划线接种于LB培养基,35 ℃培养3 d后,观察菌落形态,使用共聚焦显微镜对菌体形态进行观察。
分子生物学鉴定:参照曾林等[19]的方法提取筛选菌株的基因组脱氧核糖核酸(deoxyribonucleic acid,DNA),以其为模板,采用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-CTACGGCTACCTTGTTACGA-3')PCR扩增16S rDNA基因序列。PCR扩增体系:DNA(20 ng/μL)1.0 μL,10×Buffer(含2.5 mmol/L Mg2+)5.0 μL,Taq聚合酶(5 U/μL)1.0 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)(10 mmol/L)1.0 μL,引物27F(10 μmol/L)1.5 μL,引物1492R(10 μmol/L)1.5 μL,双蒸水(ddH2O)39.0 μL。PCR扩增条件:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸90 s,共循环35次;72 ℃终延伸7 min。菌株的16S rDNA测序由上海派森诺生物科技有限公司完成。
将测序结果提交至美国国立生物技术信息中心(nationalcenterforbiotechnologyinformation,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对搜索,选取同源性较高的模式菌株的16S rDNA基因序列,利用MEGA 11.0软件中的邻接(neighbor-joining,NJ)法构建系统发育树[20]。
1.3.4 生长曲线的测定
采用比浊法[21]测定单菌株生长曲线。将过夜培养的菌液以5%(V/V)的接种量接种于CMC-Na培养基中,于35 ℃、180 r/min条件下培养至菌的平稳期,每隔2 h取样,采用紫外分光光度计在波长600 nm处测定吸光度值(OD600nm),以培养时间(x)为横坐标,OD600nm值(y)为纵坐标绘制生长曲线。
1.3.5 复合菌系的构建
参照嵇少泽等[22]的实验方法判断菌株间的拮抗关系。根据郝鹏等[23]方法制备菌悬液,将无拮抗作用的单菌株菌悬液(OD600nm值=0.5)以等体积随机配对的方式按5%(V/V)接种量接种至CMC-Na培养基中,35 ℃、180 r/min条件下培养5 d,发酵液经8 000 r/min离心10 min后,取上清液,采用DNS法[18]测定滤纸酶活性,选取酶活性最高的菌株组合进行后续优化试验。
1.3.6 复合菌系产酶发酵条件优化
单因素试验:初始发酵条件为初始pH 6.5、接种量5%、发酵温度35 ℃。采用控制变量法,在单一条件变量下分别考察初始pH值(5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0)、接种量(1%、3%、5%、7%、9%、11%、13%、15%)、发酵温度(25 ℃、30 ℃、35 ℃、40 ℃、45 ℃)对于复合菌系滤纸酶活性及OD600nm值的影响。
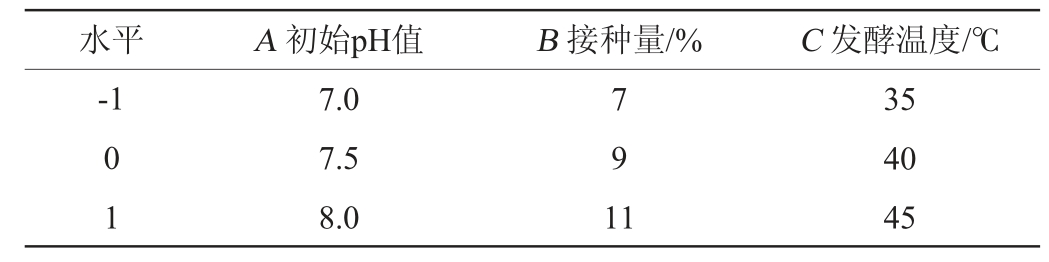
响应面试验:在单因素试验的基础上,以滤纸酶活性(Y)为响应值,选取初始pH值(A)、接种量(B)、发酵温度(C)为自变量,利用软件Design Expert 13.0中的Box Behnken模型设计3因素3水平响应面试验,试验因素及水平见表1。
表1 复合菌系产酶发酵条件优化响应面试验因素及水平
Table 1 Factors and levels of response surface tests for enzyme production fermentation conditions optimization of composite microbial system
1.3.7 秸秆降解效果评价
按9%(V/V)接种量将单菌株菌悬液与复合菌液分别接种于以10 g/L不同秸秆为唯一碳源的赫奇逊无机盐培养基中,以添加等量无菌水为空白对照,40 ℃、180 r/min培养7 d,培养后取出残渣用无菌水冲净,80 ℃烘干至恒质量,采用质量损失法计算秸秆降解率,其计算公式如下:
式中:η为降解率,%;W0为对照秸秆残渣干质量,g;W为降解后秸秆残渣干质量,g。
1.3.8 数据处理及统计分析
采用Origin 2021软件绘图,利用Design-Expert 13.0软件进行响应面试验数据分析,每组试验重复3次,取均值,结果用“平均值±标准差”表示。
2 结果与分析
2.1 纤维素降解菌的分离筛选
采用富集、分离培养后从醋糟和醋醅样品中共分离得到15株单菌株,通过刚果红染色法初筛及滤纸条崩解法复筛得到3株具有较高纤维素酶活性的菌株,分别命名为J1、J2、J3,其刚果红染色结果及滤纸条崩解情况见表2。由表2可知,菌株J1、J2、J3的水解值依次为5.33、4.00、8.33,培养7 d后均能将溶液中的滤纸条降解为白色糊状,表明筛选出的3株菌均具有较好的纤维素降解能力。秸秆中具有网状结构的木质素紧紧包围着纤维素,导致纤维素降解酶难以接触纤维素,因此兼具木质素降解能力的纤维素降解菌能够更好的降解秸秆中的纤维素[24]。进一步采用苯胺蓝脱色法检测3株菌株的木质素降解能力,结果发现只有菌株J2具有木质素降解能力,其对木质素的降解效果见图1。由图1可知,菌株J2在苯胺蓝培养基上表现出明显的脱色效果,表明其具有良好的木质素降解能力。
表2 筛选菌株的刚果红染色结果及滤纸条崩解情况
Table 2 Congo red staining results and filter paper strips disintegration situation of the screened strains
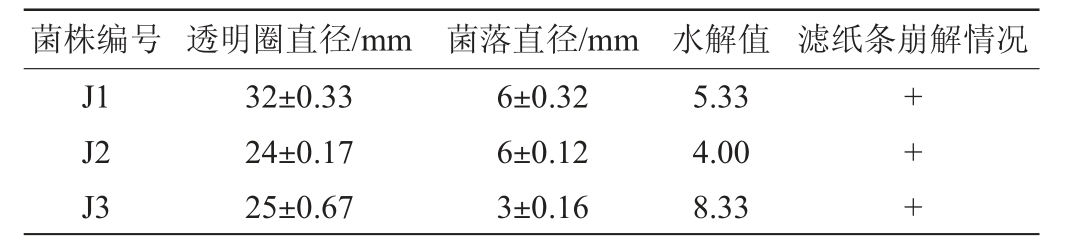
注:“+”表示能降解滤纸条。
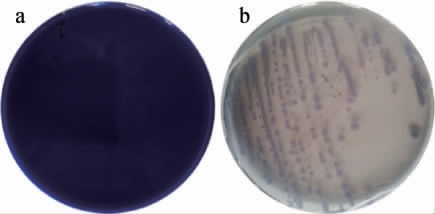
图1 菌株J2培养前(a)、后(b)的苯胺蓝脱色效果
Fig.1 Aniline blue decolorization effect of strain J2 before (a) and after incubation (b)
2.2 纤维素降解菌的鉴定
2.2.1 形态观察
菌株J1、J2、J3的形态学特征见图2。由图2可知,菌株J1、J2、J3的细胞均呈杆状,端圆。培养3 d后,菌株J1呈半透明圆形菌落,边缘粗糙且有褶皱透明边;菌株J2呈不透明乳白色,表面隆起有同心圆,边缘光滑;菌株J3呈较小的圆形菌落,边缘粗糙。根据菌体形态初步判断菌株J1、J2、J3均为杆菌。
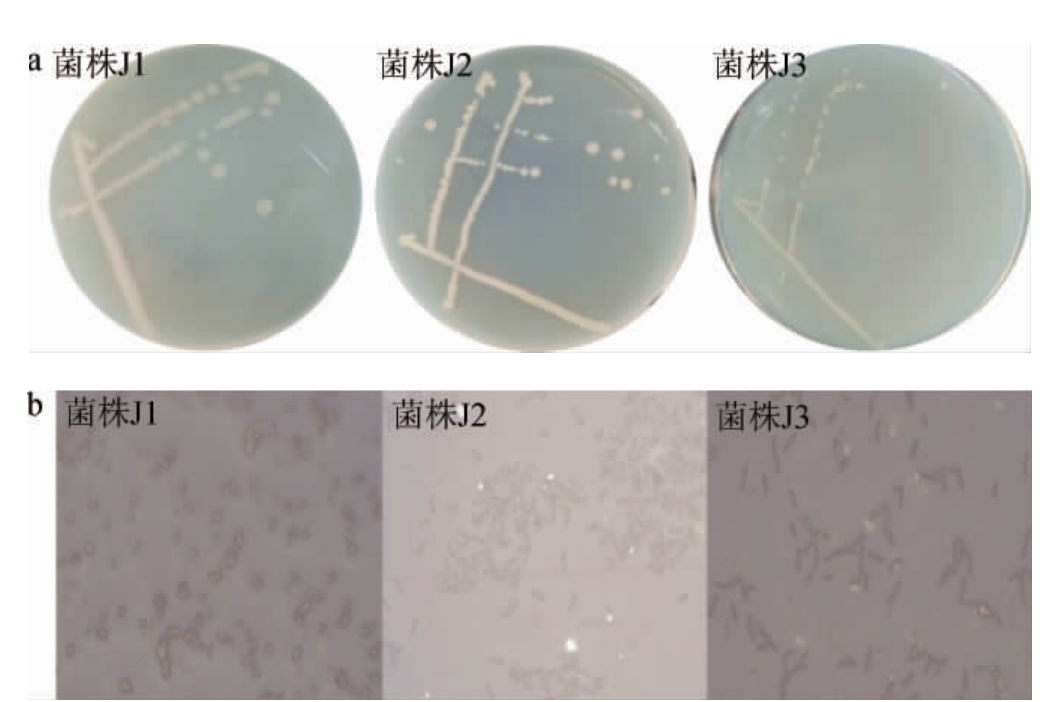
图2 菌株J1、J2及J3的细胞(a)及菌落(b)形态
Fig.2 Cell (a) and colony (b) morphology of strains J1,J2 and J3
2.2.2 分子生物学鉴定
基于16S rDNA序列构建菌株J1、J2、J3的系统发育树,结果见图3。由图3可知,菌株J1、J2、J3分别与灿烂类芽胞杆菌(Paenibacillus lautus)E7593-69、千叶类芽胞杆菌(Paenibacillus chibensis)JCM9905 16S、窖泥类芽胞杆菌(Paenibacillus vini)LAM0504 16S聚于一支,亲缘关系最近。结合形态观察,最终将菌株J1、J2、J3分别鉴定为灿烂类芽胞杆菌(Paenibacillus lautus)、千叶类芽胞杆菌(Paenibacillus chibensis)和窖泥类芽胞杆菌(Paenibacillus vini)。
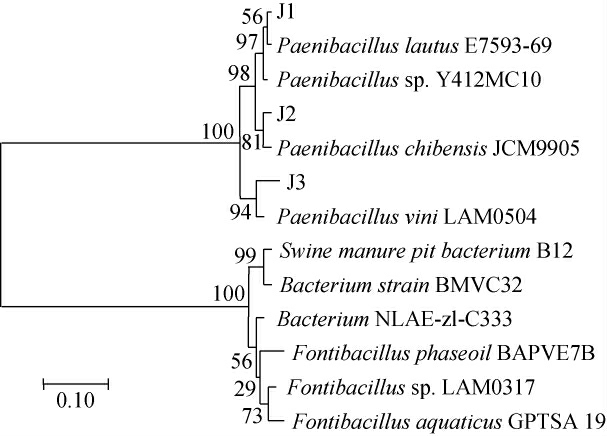
图3 基于16S rDNA基因序列菌株J1、J2和J3的系统发育树
Fig.3 Phylogenetic tree of strains J1,J2 and J3 based on 16S rDNA gene sequences
2.3 菌株的生长曲线
菌株J1、J2、J3的生长曲线见图4。由图4可知,菌株J1、J2、J3的生长速度较快且增长趋势与鲁雷震等[25-26]的研究结果基本保持一致。0~4 h为迟缓期,菌体数量增长极少;4 h后进入对数生长期,菌体大量繁殖,且生长速率较快,具有较强的适应能力和较高的繁殖速率[27];10 h后生长速率逐渐降低进入平稳期,菌体数量基本稳定。
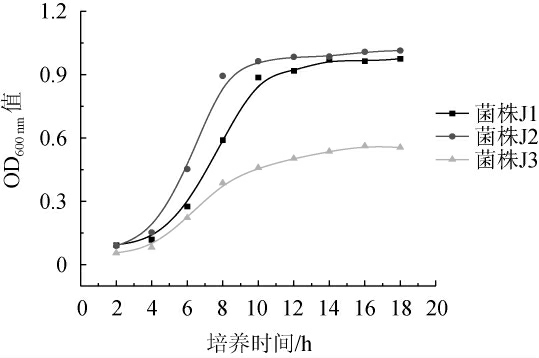
图4 菌株J1、J2及J3的生长曲线
Fig.4 Growth curve of strains J1,J2 and J3
2.4 最佳复合菌系的确定
由拮抗试验可知,3株菌两两相交处均无断开现象,不存在拮抗作用。根据菌株的筛选试验及拮抗关系构建了4组复合菌系,分别为A:J1+J2;B:J1+J3;C:J2+J3;D:J1+J2+J3。不同复合菌系的滤纸酶活性见图5。由图5可知,不同复合菌系的滤纸酶活性差别较大,其中复合菌系D的滤纸酶活性明显高于其他菌系,达到21.98 U/mL,相比单菌株J1、J2和J3,分别提高71.8%、171.1%和62.7%。与单菌株相比,菌株J1、J2和J3构建的复合菌系在纤维素分解方面具有互补能力,能够提高纤维素的降解效果。最终确定复合菌系D具有较高的纤维素降解能力,作为最优复合菌系进行后续的产酶条件研究及秸秆发酵试验。
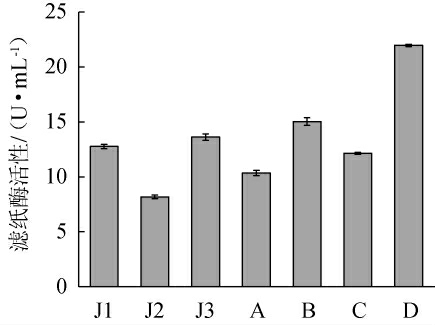
图5 菌株J1、J2及J3和复合菌系滤纸酶活性的测定结果
Fig.5 Determination results of filter paper enzyme activity of strains J1,J2 and J3 and composite microbial system
2.5 复合菌系D产酶条件优化
2.5.1 单因素试验
初始pH值、接种量和发酵温度对复合菌系D滤纸酶活性以及生长速率的影响见图6。
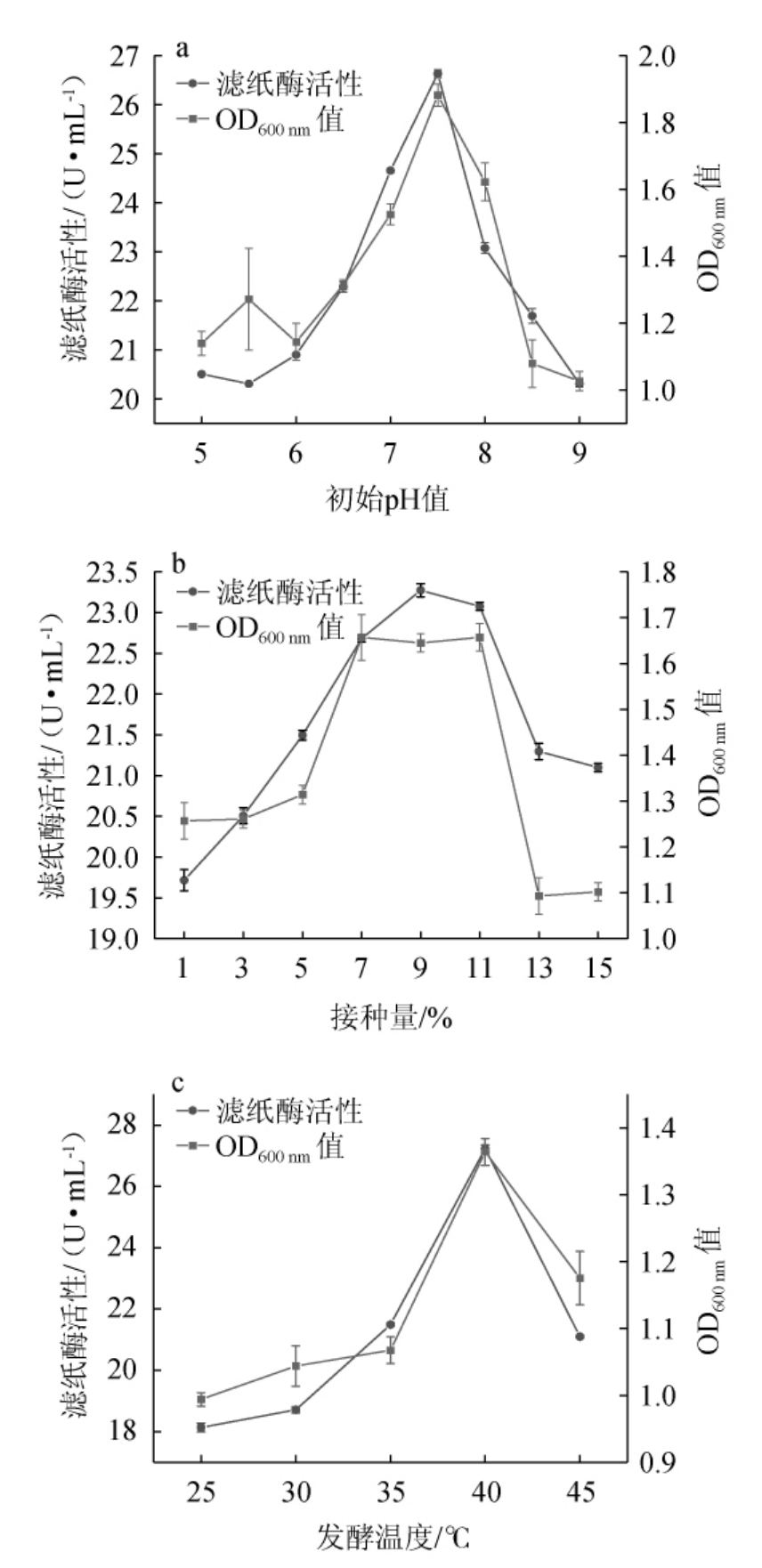
图6 复合菌系D产酶发酵条件优化单因素试验结果
Fig.6 Results of single-factor tests for enzyme production fermentation conditions optimization of composite microbial system D
初始pH值影响细菌的生长繁殖与产物积累[28]。由图6a可知,复合菌系D在初始pH 5~9范围内生长良好,表明其具有相对较广泛的pH适应性。随着初始pH值的升高,滤纸酶活性呈先升高后下降的趋势,当初始pH值达到7.5时,其滤纸酶活性最高,为26.67 U/mL,表明复合菌系D更适宜在中性环境中生长、繁殖和代谢,过酸、过碱的环境都不利于细菌产酶[29]。因此,确定最佳初始pH值为7.5。
由图6b可知,在接种量<7%之前,OD600nm值随接种量的增加而增大,滤纸酶活性呈上升趋势,表明在该范围内接种量越多,菌体数量越多,产酶量也随之增加;当接种量为7%~11%之间时,菌体生长良好,且在接种量为9%时,滤纸酶活性最高,为23.25 U/mL;在接种量>11%之后,OD600nm值减小,滤纸酶活性呈下降趋势,这可能是由于菌体生长速度过快,培养基内含氧量降低,后期营养不足所致[30]。因此,确定最佳接种量为9%。
由图6c可知,复合菌系D在25~45 ℃范围内生长良好,表明其具有一定的耐热性。随着发酵温度的升高,复合菌系D的滤纸酶活性呈现先升高后降低的趋势,分析原因可能是在较低温度下,细菌生长缓慢,产酶量较低,且酶与底物的结合能力也较弱[31];在较高温度下,容易引起酶蛋白变形,使酶的活性变低。当发酵温度为40 ℃时,滤纸酶活性最高,为27.21 U/mL。因此,确定最佳发酵温度为40 ℃。
2.5.2 响应面试验
响应面试验设计及结果见表3,方差分析结果见表4。
表3 复合菌系D产酶发酵条件优化响应面试验设计及结果
Table 3 Design and results of response surface tests for enzyme production fermentation conditions optimization of composite microbial system D
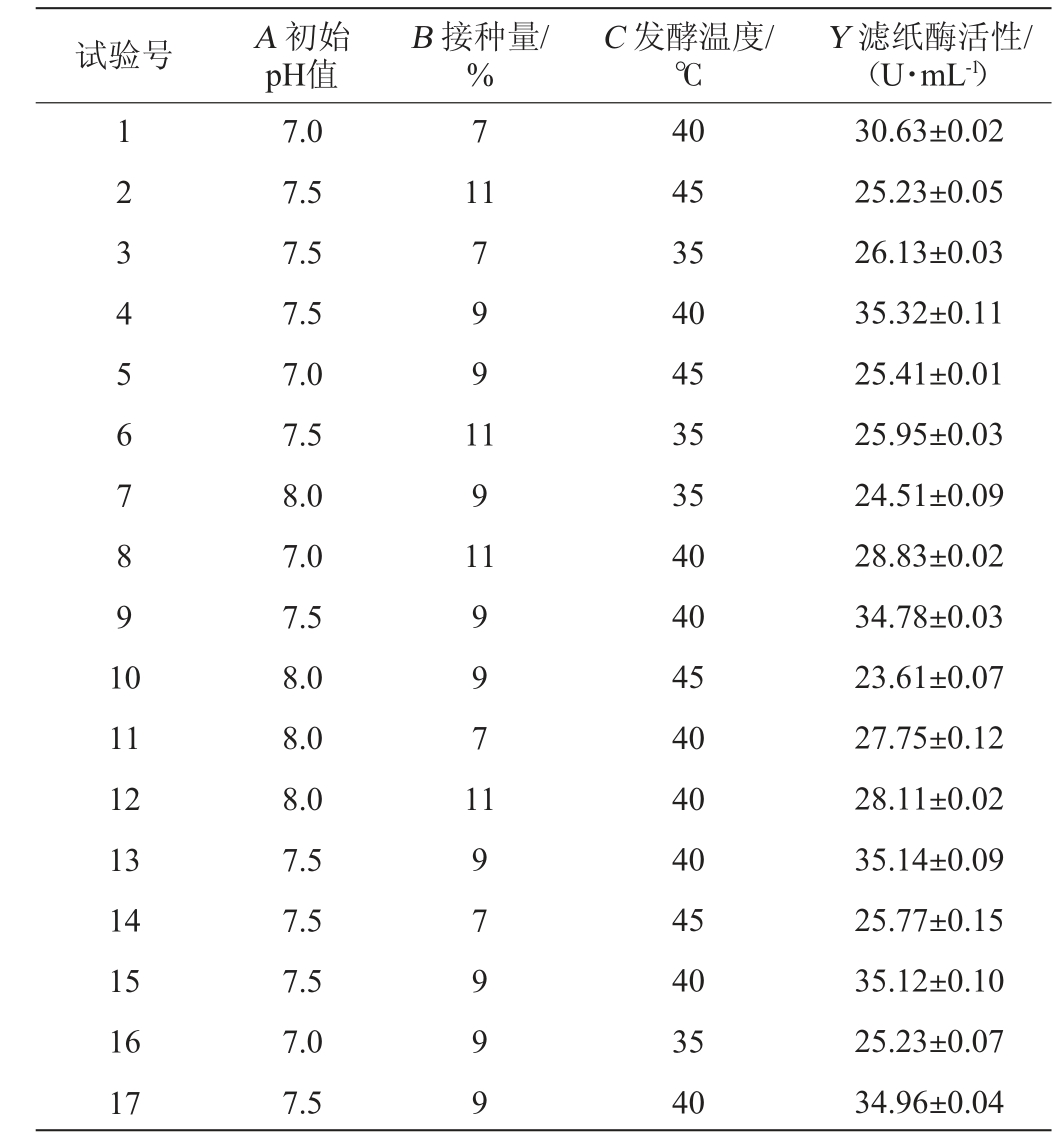
表4 回归模型方差分析
Table 4 Variance analysis of regression model
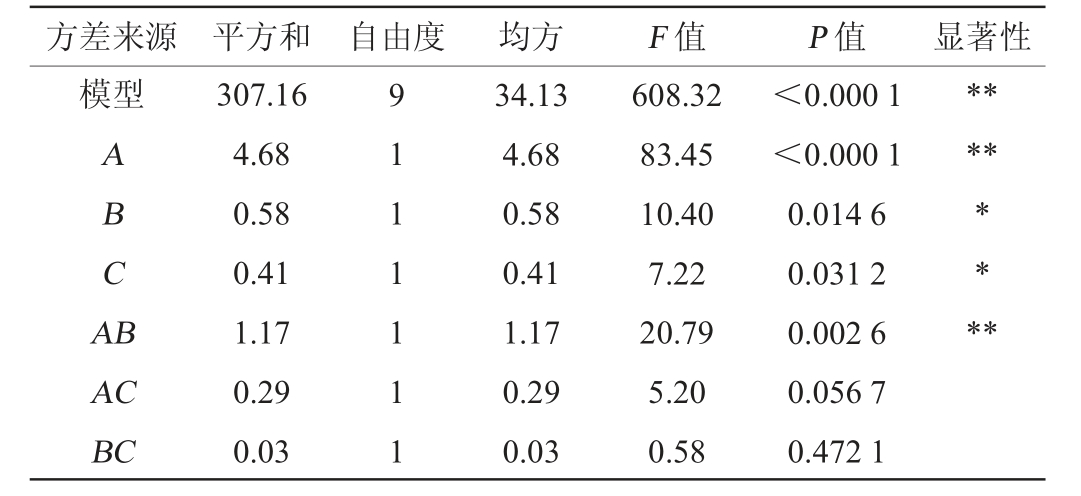
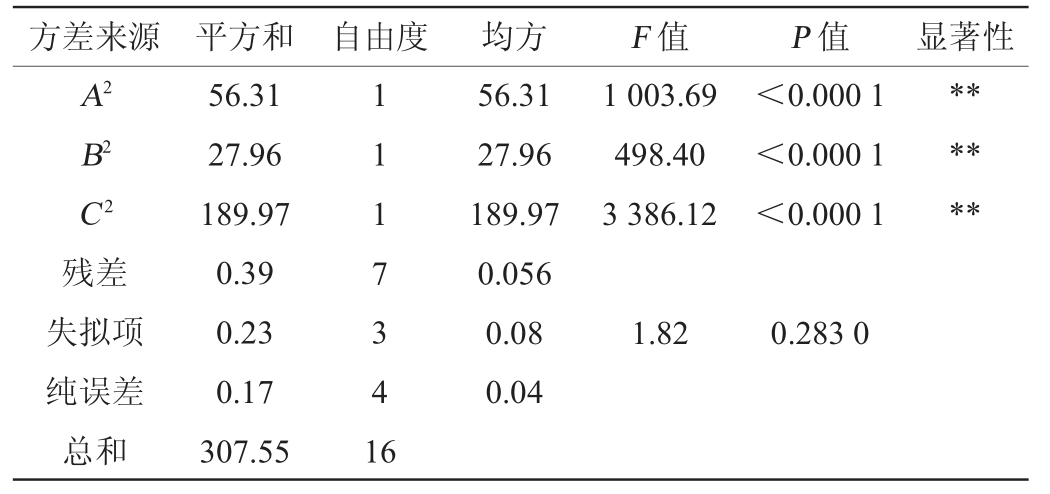
续表
注:“**”表示对结果影响极显著(P<0.01),“*”表示对结果影响显著
(P<0.05)。
采用Design Expert 13.0对表3数据进行多元二次回归拟合,得到滤纸酶活性(Y)的二次回归方程:Y=35.06-0.765A-0.27B-0.225C+0.54AB-0.27AC-0.09BC-3.66A2-2.58B2-6.72C2。
由表4可知,模型P<0.000 1,极显著;失拟项P=0.283>0.05,不显著,表明回归方程与试验结果拟合较好。模型的决定系数R2=0.998 7,调整决定系数R2Adj=0.997 1,两者差值<0.2,变异系数(coefficient of variation,CV)<10%,表明模型的可信度和精确度较高。由表4亦可知,一次项B、C对结果影响显著(P<0.05),一次项A、交互项AB及二次项A2、B2、C2对结果影响极显著(P<0.01),其他项对结果影响均不显著(P>0.05)。
初始pH值、接种量及发酵温度间交互作用对滤纸酶活性影响的响应曲面及等高线见图7。由图7可知,AB的响应曲面坡度较陡且颜色变化快,等高线呈椭圆形,较密集,说明AB间的交互作用影响显著(P<0.05);反之,AC、BC间的交互作用不显著(P>0.05)。结果与方差分析结果一致。
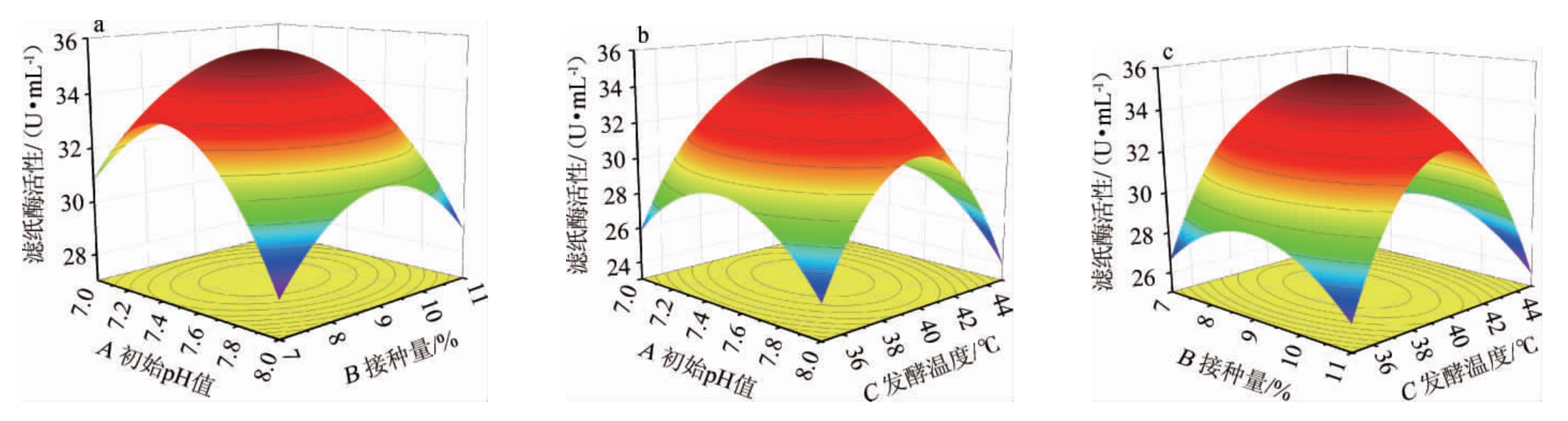
图7 各因素间交互作用对滤纸酶活性影响的响应面及等高线
Fig.7 Response surface plots and contour lines of the effects of interactions between each factors on the filter paper enzyme activity
利用Design Expert 13.0对影响滤纸酶活性的各项参数进行最优求解,得出最优工艺参数:初始pH值7.446,接种量8.874%,发酵温度39.930 ℃,滤纸酶活性预测值为35.116 U/mL。为便于实际操作,将最优产酶条件调整为:初始pH值7.4,接种量9%,发酵温度40 ℃。在此优化条件下进行3次验证试验,得到实际酶活性为(35.10±0.04)U/mL,相对误差<2%,证实响应面预测的优化数据可靠。
2.6 秸秆降解率测定
3株单菌株以及复合菌系D对水稻秸秆、玉米秸秆、小麦秸秆、大豆秸秆以及高粱秸秆发酵7 d的降解效果见图8。
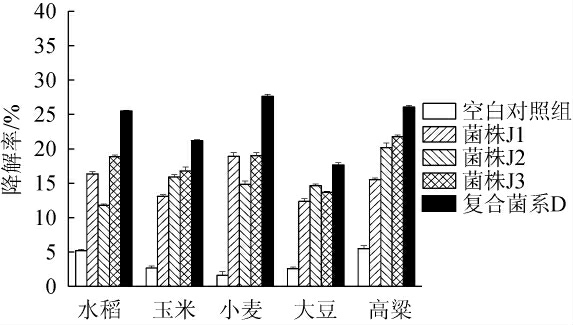
图8 菌株J1、J2、J3以及复合菌系D对不同秸秆的降解效果
Fig.8 Degradation effects of strains J1,J2,J3 and composite microbial system D on different straws
由图8可知,3株菌株及复合菌系D对不同秸秆均具有降解性,且复合菌系D的降解效果优于单菌株。复合菌系D对不同秸秆的降解效果排序为:小麦(27.63%)>高粱(26.1%)>水稻(25.5%)>玉米(21.2%)>大豆(17.67%)。其中,对小麦秸秆降解率最高,为27.63%,比对照组高26.03%,这与夏强[32]的研究结论相似。秸秆中木质素和半纤维素的包裹作用及木质素的难降解是制约纤维素降解率提高的重要因素,木质素含量越低,秸秆降解相对越容易。
在以往的研究中,梅新兰等[33]对筛选出的4株秸秆降解菌进行组合复配,其中2株和3株菌组合发酵8 d,稻草降解率达到20.20%~21.03%;QING G E等[34]构建了复合菌系GF-20,其发酵7 d,秸秆降解率约为20%;张秧等[35]将由枯草芽孢杆菌(Bacillus subtilis)、米根霉(Rhizopus oryzae)、毕赤酵母菌(Pichia pastoris)和戊糖片球菌(Pediococcus pentosaceus)等组成的菌剂DH接种于小麦秸秆中进行好氧堆肥,30 d降解率仅达到24.48%。本研究以复合菌系D为研究对象,相比目前已构建的复合菌系而言,对多种秸秆的降解效果较好,在降解秸秆方面具有更大的潜力。
3 结论
本研究以CMC-Na为唯一碳源,采用刚果红染色法和滤纸条崩解法从山西老陈醋源中筛选出3株纤维素降解菌,编号分别为J1、J2和J3,经形态观察及分子生物学技术分别鉴定为灿烂类芽胞杆菌(Paenibacillus lautus)、千叶类芽胞杆菌(Paenibacillus chibensis)和窖泥类芽胞杆菌(Paenibacillus vini)。通过无拮抗作用菌株间的复配得到一组高效降解秸秆纤维素菌系D(菌株J1、J2和J3等比例混合),其滤纸酶活性达到21.98 U/mL。通过单因素试验及响应面试验确定复合菌系D的最优产酶条件为:初始pH 7.4,接种量9%,发酵温度40 ℃。在此优化条件下,滤纸酶活性为35.10 U/mL,是优化前的1.6倍。此外,该复合菌系D对不同秸秆均具有较好的降解效果,其中对小麦秸秆的降解率最高可达到27.63%。与单菌株相比,复合菌系D在秸秆纤维素分解方面的互补能力能够有效提高其降解效果,表明该复合菌系有良好的秸秆降解潜力,可为木质纤维素类生物质的转化提供一定的理论指导。
[1]丛宏斌,姚宗路,赵立欣,等.中国农作物秸秆资源分布及其产业体系与利用路径[J].农业工程学报,2019,35(22):132-140.
[2]黄青盈,吕嘉昕,何秋愉,等.纤维素降解菌种的筛选测定及其对秸秆的降解[J].复旦学报(自然科学版),2022,61(1):34-42.
[3]谢婷,刘飞,李敏,等.粪产碱菌对阿魏酸厌氧降解的影响[J].中国酿造,2015,34(3):66-70.
[4]ASGHER M,WAHAB A,BILALM,et al.Delignification of lignocellulose biomasses by alginate-chitosan immobilized laccase produced from Trametes versicolor IBL-04[J].Waste Biomass Valor,2018,9:2071-2079.
[5]郭蕾,孙浩,宋来生,等.基于风味检测技术对四大名醋挥发性成分的研究进展[J].中国酿造,2022,41(6):12-17.
[6]管浩,王利妍,金梦灿,等.不同形态氮素对黑曲霉降解小麦秸秆的影响[J].农业环境科学学报,2022,41(10):2298-2306.
[7]李静,张瀚能,赵翀,等.高效纤维素降解菌分离筛选、复合菌系构建及秸秆降解效果分析[J].应用与环境生物学报,2016,22(4):689-696.
[8]CHU X D,AWASTHI M K,LIU Y Y N,et al.Studies on the degradation of corn straw by combined bacterial cultures[J].Bioresource Technol,2021,320(PA):124174.
[9]GONG X J,ZOU H T,QIAN C R,et al.Construction of in situ degradation bacteria of corn straw and analysis of its degradation efficiency[J].Ann Microbiol,2020,70:62.
[10]王新光,田磊,王恩泽,等.玉米秸秆高效降解微生物复合菌系的构建及降解效果评价[J].生物技术通报,2022,38(4):217-229.
[11]孟建宇,冀锦华,郭慧琴,等.常温纤维素降解细菌的筛选及其复合系的构建[J].生物学杂志,2020,37(3):86-90.
[12]郑秀成,陈泽裕,陈国庆,等.烟草废弃物中的难降解有机物的微生物降解研究进展[J].微生物学报,2020,60(12):2650-2663.
[13]王贤丰,单洪伟,张家松,等.从海水环境分离筛选甘蔗渣纤维素降解菌[J].微生物学通报,2015,42(6):981-989.
[14]陈志超,易弋,赵东玲,等.台湾乳白蚁纤维素降解菌的分离和鉴定[J].中国酿造,2019,38(1):54-58.
[15]王伟,郑大浩,杨超博,等.高效纤维素分解菌的分离及秸秆降解生物效应[J].中国农业科技导报,2019,21(8):36-46.
[16]韩东晶,王志花,周宁,等.白蚁菌圃中木质素降解菌的筛选及降解效果[J].生物技术通报,2022,38(3):113-120.
[17]DAR M A,PAWAR K D,PANDIT R S.Prospecting the gut fluid of giant African land snail, Achatina fulica for cellulose degrading bacteria[J].Int Biodeter Biodegr,2018,126:103-111.
[18]毛婷,魏亚琴,杨红建,等.牦牛粪便中纤维素降解菌的筛选及产酶优化[J].中国农业大学学报,2019,24(11):106-116.
[19]曾林,谭霄,袁春红,等.白酒黄水中纤维素降解菌的分离鉴定及产酶活性研究[J].中国酿造,2016,35(11):59-63.
[20]TSEGAYE B,BALOMAJUMDER C,ROY P.Biodegradation of wheat straw by Ochrobactrum oryzae BMP03 and Bacillus sp.BMP01 bacteria to enhance biofuel production by increasing total reducing sugars yield[J].Environ Sci Pollut Res,2018,25:30585-30596.
[21]胡锦俊,白红娟,宋雨,等.一株高效降解苯胺菌Q6的分离鉴定及其降解特性[J].含能材料,2022,30(10):004-1012.
[22]嵇少泽,勾长龙,张喜庆,等.病死猪堆肥高效降解复合菌系的构建及应用效果[J].应用与环境生物学报,2020,26(3):528-533.
[23]郝鹏,张喜庆,高云航,等.抗生素对复合菌系降解17β-雌二醇的影响[J].应用与环境生物学报,2021,27(5):1274-1280.
[24]杨艳红,刘旸,张浩铂,等.一株产纤维素酶细菌B4的鉴定及发酵条件优化[J].重庆理工大学学报(自然科学),2022,36(5):304-311.
[25]鲁雷震,宏丹,封成玲,等.产抗真菌肽的爱媛类芽孢杆菌HD的筛选、鉴定及发酵条件优化[J].中国食品学报,2022,22(3):212-224.
[26]陈莉,赵艺,周雨洁,等.一株耐高温硫氧化菌爱媛类芽孢杆菌的分离鉴定及其发酵条件优化[J].微生物学通报,2022,49(1):25-38.
[27]张宸瑞,薛桥丽,白彬阳,等.云南牟定酸浆水中优势产酸菌的分离鉴定及生长特性[J].食品科学,2021,42(20):75-82.
[28]LI D P,FENG L,LIU K R,et al.Optimization of cold-active CMCase production by psychrotrophic Sphingomonas sp.FLX-7 from the cold region of China[J].Cellulose,2016,23:1335-1347.
[29]依妮皮姑丽·麦麦提依明,艾麦尔江·麦提库尔班,阿依安·布胡达西,等.一株产α-淀粉酶芽孢杆菌的分离及产酶条件的优化[J].中山大学学报(自然科学版),2017,56(4):126-132.
[30]黄晓梅,赵红晓,范金霞,等.一株高产纤维素酶绿色木霉菌株诱变选育与发酵研究[J].东北农业大学学报,2018,49(6):22-31.
[31]李永博,李星,唐敏,等.浓香型大曲中产β-葡萄糖苷酶微生物的筛选鉴定及其产酶条件优化[J].食品科技,2017,42(12):17-22.
[32]夏强.纤维素降解混合菌剂的构建及降解效能[D].哈尔滨:哈尔滨工业大学,2018.
[33]梅新兰,郑海平,李水仙,等.降解水稻秸秆细菌-真菌复合菌系的构建与评价[J].农业环境科学学报,2021,40(10):2217-2225.
[34]QING G E,GAO J L,YU X F,et al.Screening of a microbial consortium with efficient corn stover degradation ability at low temperature[J].J Integr Agr,2016,15(10):2369-2379.
[35]张秧,艾为党,靳向丹,等.3种菌剂对小麦秸秆好氧堆肥降解效果比较[J].环境工程学报,2021,15(2):709-716.