中药材制曲具有悠久的历史,在北魏时期的著作《齐民要术》中便有“制曲入药”的记载,中药入曲是我国古代酿酒技术的一大创举[1],一直沿用至今。如董酒在其大小曲中加入百余种中药材进行发酵,形成了独特的董香型风格白酒[2-3],邛崃米曲中也加入了72味中药材[4]。中药制曲能够提升酒曲质量进而提升原酒质量。雷学俊等[5]发现,党参、红景天、白芍的添加对米曲糖化力和液化力的提高具有明显的促进作用。吴志等[6]在制曲过程中添加3%的石菖蒲、生地黄、白术等药材的醇提液发现,添加中草药酒曲的发酵力、糖化力、总微生物数量得到大幅提高。除此之外,中药制曲还能够提升白酒的风味。李保国等[7]研究发现,加入薄荷能够提升酒的风味物质含量。吴琼燕[8]在桂皮药曲中检测到更多的香气成分。许必晏[9]确定18种促进酿造微生物生长的中药材,制曲后酿造的清香型白酒质量得到提升,且降低杂醇油的效果较好。
清香型白酒清香纯正,柔和协调,可以与中药活性物质风味相融合,是制作配制酒和药酒重要基酒之一。根据劲牌有限公司保健酒中药材配方及相关研究报道[5-13]发现,茴香、薄荷、桂皮、陈皮、丁香、甘草具有提升白酒风味作用,茯苓、杏仁、人参、丹参、栀子、川芎、当归具有保健功能,红景天、白芍、地黄、白术、桑叶、辣蓼、黄芪能够提升酒曲性能,这些中药材具有提升原酒质量的潜能。而酿酒酵母(Saccharomyces cerevisiae)、异常威克汉姆酵母(Wickerhamomyces anomalus)和米根霉(Rhizopus oryzae)是清香型酒曲中的主要酿造微生物[14-15],分别具有提高出酒率、高产酯、高糖化力的性能。因此,探究清香型酒曲中中药材的添加对清香型白酒风味及原酒质量的提升具有重要意义,但中药材的添加对发酵微生物的生长是否有影响是判断其能否加入酒曲的前提条件,但目前中药材对清香型白酒功能微生物生长及品质的影响缺乏研究。
本研究采用微生物培养的方法分别探究20种中药材对清香型白酒中主要发酵微生物酿酒酵母(Saccharomyces cerevisiae)Y1、异常威克汉姆酵母(Wickerhamomyces anomalus)Y29和米根霉(Rhizopus oryzae)G1生长的影响,在绿衣观音土曲中添加中药材,模拟清香型白酒工艺进行固态发酵小试实验,对糖化醅中的微生物数量进行分析,通过气相色谱(gas chromatography,GC)仪对小试酒样中的乙酸乙酯、乳酸乙酯、杂醇油含量进行检测,以期明确中药材的添加对清香型白酒质量的影响,验证中药材在清香型酒曲中添加的可行性,为后续制曲中添加中药材提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
绿衣观音土曲:劲牌公司毛铺制曲车间;20种中药材:劲牌有限公司购于各产地的道地药材。酿酒酵母(Saccharomycescerevisiae)Y1、异常威克汉姆酵母(Wickerhamomyces anomalus)Y29、米根霉(Rhizopus oryzae)G1:劲牌有限公司劲牌研究院微生物研究室。
1.1.2 试剂
制霉素(分析纯):华北制药股份有限公司;葡萄糖、蛋白胨、酵母提取物、琼脂、氯化钠(均为分析纯或生化试剂):国药集团化学试剂有限公司;无水乙醇(色谱纯):美国SAFC Biosciences公司。
1.1.3 培养基
孟加拉红培养基:海博生物技术有限公司。
LB培养基:蛋白胨10 g、酵母提取物5 g、氯化钠10 g、琼脂20 g,溶解在1 L蒸馏水中,pH 7.0左右,115 ℃灭菌30 min,冷却至40 ℃后加入终质量浓度0.3 g/L的制霉素。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:葡萄糖20 g,蛋白胨20 g,酵母提取物10 g,溶解在1 L蒸馏水中,115 ℃灭菌30 min。
1.2 仪器与设备
YXQ-LS-75S蒸汽灭菌锅、SPX-100B-Z生化培养箱:上海博讯实业有限公司;BCM-1600A洁净工作台:苏州安泰空气技术有限公司;WFJ可见分光光度计:尤尼柯(上海)仪器有限公司;Agilent 7890A型气相色谱(GC)仪:美国安捷伦公司。
1.3 方法
1.3.1 酵母活化液及米根霉麸皮种的制备
酵母活化液的制备:将菌株Y1和Y29的甘油管保存液接种于YPD培养基中,于30 ℃、150 r/min摇床培养24 h,经10 mL无菌水试管梯度稀释至10-5,取10-5梯度稀释液200 μL均匀涂布于孟加拉红培养基中,于30 ℃培养2 d后,对酵母菌进行计数,获得酵母活化液。
米根霉麸皮种的制备:于100 g麸皮中加入80 mL蒸馏水,115 ℃灭菌30 min,用接种环从菌株G1保藏斜面中取出菌丝,接入麸皮中,30 ℃培养3 d后,将培养好的G1麸皮种取出放入托盘,在40 ℃烘箱中烘干24 h,常温下密封保藏备用。
1.3.2 中药材培养基的制备
分别称取20种中药材(桂皮、茴香、杏仁、甘草、当归、川芎、辣蓼、陈皮、茯苓、薄荷、人参、白术、栀子、桑叶、黄芪、白芍、丹参、地黄、丁香、红景天)20 g,清洗药材表面污垢后,置于清水中浸泡30 min后,加入约400 mL水小火煮沸1 h至200 mL容器中趁热过滤,4 ℃冷藏备用。以制备药汁替代相应的无菌水,配制成含10 g/L药汁的孟加拉红培养基和LB培养基。
1.3.3 中药材对微生物生长的影响
以不添加药汁的孟加拉红培养基为对照,将4~5个大小均匀的米根霉G1麸皮种接种在孟加拉红培养基平板,培养48 h,通过与对照比较菌落大小、菌丝蔓延情况及菌丝茂密程度,考察中药材是否对米根霉的生长有影响。将酵母活化液稀释至10-5,取200 μL的酵母Y1活化液(约1.2×108 CFU/mL)、酵母Y29活化液(约1.0×108 CFU/mL)均匀涂布于含药汁孟加拉红培养基,培养48 h,对酵母菌落进行计数。通过与对照比较微生物数量及菌落直径,考察中药材对酿酒酵母Y1和异常威克汉姆酵母Y29生长的影响[16]。
1.3.4 清香型白酒的小试生产及试验设计
在实验室水平模拟清香型白酒生产工艺[17]。称取适量糯高粱于65 ℃热水中浸泡过夜,115 ℃蒸粮10 min,65 ℃水中焖粮5 min,111 ℃复蒸10 min。将熟粮1 kg摊晾至30 ℃左右,对照组加入5.0 g绿衣观音土曲,实验组加入5.0 g绿衣观音土曲和1.0 g中药材(丁香和红景天添加量为熟粮的0.05%,即0.5 g),酒曲和熟粮均匀翻拌后于30 ℃糖化24 h。500 g糖化醅与500 g灭菌酒糟进行混合,30 ℃发酵7 d后,取酒醅小火慢蒸收集前100 mL酒样。
1.3.5 中药材对糖化醅中微生物的影响
在无菌条件下,取10 g糖化醅于90 mL无菌水中,置于150 r/min摇床,30 ℃活化30 min,再经10 mL无菌水试管将菌悬液梯度稀释至10-4,取10-4梯度稀释液200 μL均匀涂布于孟加拉红培养基中,酵母和霉菌在30 ℃下培养2 d,同时取10-4梯度稀释液200 μL均匀涂布于LB培养基中,细菌在37 ℃下培养1~2 d至单菌落长出,采用菌落记号方式对单菌落进行计数[17],测量4~6个菌落直径,并取平均值。
1.3.6 中药材对清香型白酒原酒风味物质的影响
采用气相色谱法检测酒样中乙酸乙酯、乳酸乙酯、杂醇油含量[18]。
酒样预处理:准确移取酒样1 mL于2 mL样品瓶中,加入10 μL内标(叔戊醇质量浓度为17 028.1 mg/L,乙酸正戊酯质量浓度为16 864.0 mg/L,2-乙基己醇质量浓度为12 104.2 mg/L),盖上瓶盖,摇匀。
气相色谱条件:载气为高纯氮气(N2),纯度为99.999%,进样口温度250 ℃,分流比30∶1;流速为1.0 mL/min,升温程序为初始温度35 ℃,保持1 min,以3 ℃/min升至70 ℃,再以3.5 ℃/min升至190 ℃,保持25 min;检测器为氢火焰离子化检测器(flame ionization detector,FID),温度260 ℃;尾吹气流速25 mL/min,氢气(H2)流速30 mL/min,空气流速350 mL/min。
定性与定量:采用保留时间定性及内标法定量。
1.3.7 出酒率的计算
出酒率的计算参考文献[19],在20 ℃条件下,先将样品实际酒精度折算酒精度为55时的比值,再计算乙醇质量,其与投粮量百分比值表示出酒率,出酒率计算数学式如下:
式中:0.92003为20℃条件下,乙醇体积分数为55%的原酒密度,g/mL;100为接酒体积,mL;225为投粮质量,g。
1.3.8 数据处理
采用EXCEL2019进行数据处理,采用Origin 9.0绘图。
2 结果与分析
2.1 中药材对清香型白酒中主要酿酒微生物生长的影响
2.1.1 中药材对酿酒酵母Y1和Y29生长的影响
20种中药材对酿酒酵母Y1和Y29的数量及菌落直径的影响见表1。
由表1可知,添加桂皮、茯苓、白芍、丁香、红景天药汁的培养基中,菌株Y1菌落直径均<2 mm,其中,质量浓度为10 g/L的丁香和红景天药汁对菌株Y1的大小抑制作用最明显,菌落直径仅0.6 mm。上述药材对菌落数量没有较大影响,说明上述药材成分对菌株Y1的生长速度起到一定的抑制作用。而添加了茴香、杏仁、甘草、陈皮、栀子、桑叶、黄芪的孟加拉红培养基中,菌株Y1的菌落直径相较于对照大,菌落直径在3.0~4.0 mm,增长了50%~100%,说明上述药材对酿酒酵母Y1的生长具有促进作用,其药材中成分能够被酿酒酵母Y1所利用,促进其增殖。薄荷、杏仁、桂皮的添加对菌株Y1的数量增长有促进作用,其中添加薄荷使菌株Y1的增长量达到18.72%,白术的添加对菌株Y1的菌落数量有抑制作用,其余6种药材对菌株Y1的生长没有明显的影响。菌株Y1是清香型白酒酒曲中重要的产醇菌株,茴香、杏仁、甘草等中药材对菌株Y1的生长具有促进作用,应用于酒曲则有望进一步提升酒曲的发酵力。
表1 中药材对酿酒酵母Y1和异常威克汉姆酵母Y29生长的影响
Table 1 Effect of Chinese medicinal materials on the growth of Saccharomyces cerevisiae Y1 and Wickerhamomyces anomalus Y29
由表1亦可知,添加了红景天和白芍的培养基中,菌株Y29的菌落直径较对照小,均<2 mm,说明其菌落生长速度慢,其中,白芍仅抑制菌落直径大小,对菌落数量没有明显影响。质量浓度为10 g/L的丁香汁完全抑制了菌株Y29的生长,平板中未见菌落长出。添加了茴香、杏仁、甘草、辣蓼、陈皮、人参、白术、栀子、桑叶、地黄的培养基中,菌株Y29菌落的直径大于对照,菌落直径在2.6~5.6 mm,其中,甘草和杏仁对菌落直径的促进作用最明显,分别达到4.0 mm和5.6 mm,说明甘草和杏仁中存在对菌株Y29生长有益的成分。添加桂皮、陈皮、茯苓、薄荷、人参、白术、栀子、黄芪的培养基中菌落数量少许增加,薄荷对菌株Y29的增殖也起到一定的促进作用,其菌落数量增长了23.28%。清香型白酒中以乙酸乙酯为主的酯类物质含量是白酒质量的重要指标之一,而菌株Y29是主要的酯化酶产生菌株,茴香、杏仁、甘草等中药有助于Y29的生长,在后期应用于酒曲中,具有提升原酒酯类风味物质的潜力。
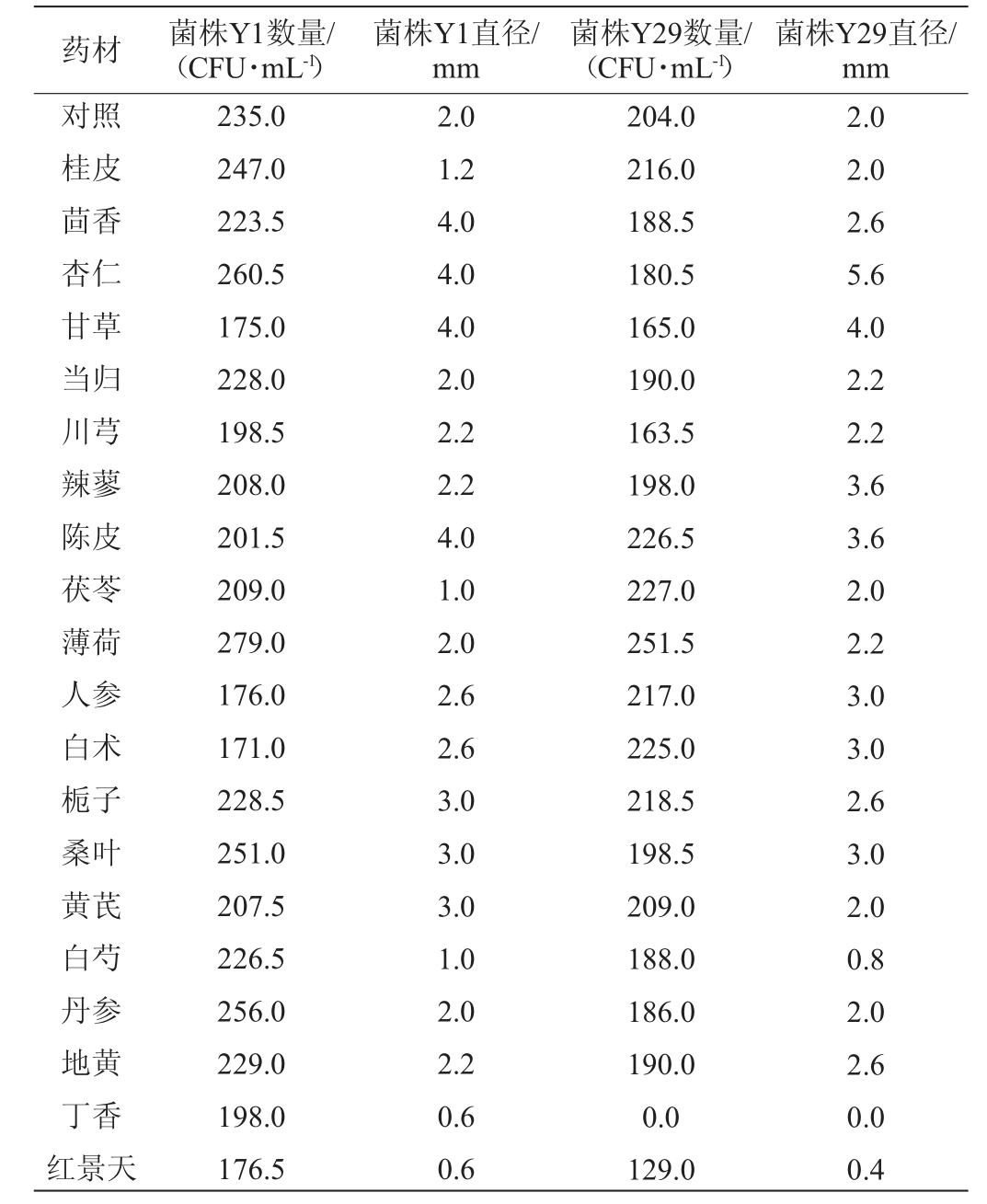
2.1.2 中药材对米根霉G1生长的影响
20种中药材对米根霉G1生长的影响见图1。由图1可知,质量浓度为10 g/L的丁香和红景天汁对米根霉的生长具有明显的抑制作用,且丁香的抑制作用更强,主要表现为菌株G1的菌落较小或菌丝稀疏。茯苓汁对米根霉的生长也具有抑制作用,主要表现为菌落比对照小,但菌丝比对照更长且浓密。20种药材中对米根霉G1生长具有促进作用的中药材有桂皮、杏仁、甘草、辣蓼、薄荷、人参、白术、桑叶、黄芪、白芍、丹参、地黄,主要表现为菌丝较蔓延、菌落较大、菌丝较长且相对更加浓密,说明上述药材对米根霉G1的生长具有促进作用,从而提升与糖化作用相关的酶类含量。将其添加到酒曲中,可促进糖化过程中淀粉转化为可发酵糖,进而提高酒曲的糖化力。
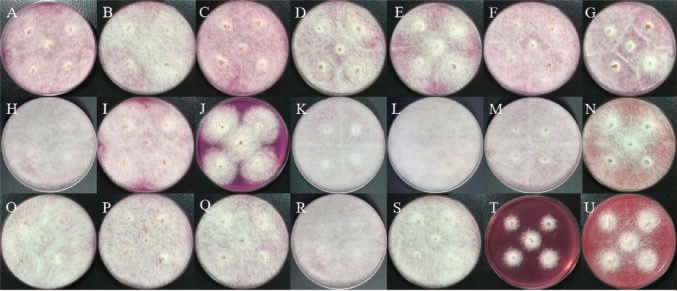
图1 中药材对米根霉G1生长的影响
Fig.1 Effect of Chinese medicinal materials on the growth of Rhizopus oryzae G1
A~U分别为对照(未添加药材)、桂皮、茴香、杏仁、甘草、当归、川芎、辣蓼、陈皮、茯苓、薄荷、人参、白术、栀子、桑叶、黄芪、白芍、丹参、地黄、丁香、红景天;下同。
由上述分析可知,丁香和红景天对菌株Y1、Y29和G1均表现出明显的抑制作用,这与丁香中存在丁香酚以及红景天中富含红景天甙有关[20-21],而中药材中富含糖、蛋白质、氨基酸、微量元素等,也是其他中药材对微生物增殖抑制不明显或促进生长的原因[22]。除丁香和红景天外,其他中药材可用于白酒的发酵过程中,丁香和红景天则需探究最佳添加量,以便于为后续两种中药材在清香型白酒酿造中的添加量提供参考。
2.2 红景天和丁香质量浓度对清香型白酒中主要酿酒微生物生长的影响
不同丁香质量浓度对菌株Y1、Y29和G1生长的影响见图2。由图2可知,随着丁香质量浓度的减小,对3种微生物的生长的抑制能力减弱,当丁香汁的质量浓度为0.5 g/L时,对酵母的菌落数量和米根霉的菌落大小、菌丝长度都有一定的促进作用,因此,培养基中的丁香汁最适质量浓度为0.5 g/L。
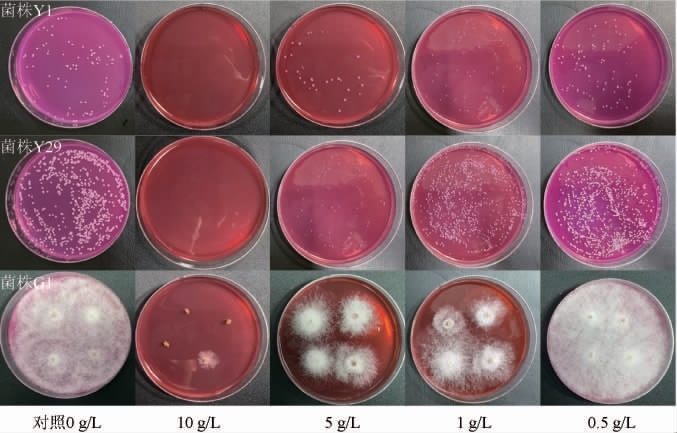
图2 丁香汁质量浓度对菌株Y1、Y29和G1生长的影响
Fig.2 Effect of mass concentration of clove juice on the growth of strains Y1,Y29 and G1
红景天汁质量浓度对菌株Y1、Y29和G1生长的影响见图3。由图3可知,红景天汁的质量浓度越低,对3种微生物的抑制效果越小,当质量浓度为1 g/L时,红景天对酿酒酵母Y1和异常威克汉姆酵母Y29的生长没有明显的影响,但对米根霉生长具有一定的抑制作用。当质量浓度为0.5 g/L时,红景天汁对两种酵母没有明显的抑制作用,且能促进米根霉菌丝生长。因此,培养基中的红景天汁的最适添加量为0.5 g/L。
图3 红景天汁质量浓度对菌株Y1、Y29和G1生长的影响
Fig.3 Effect of mass concentration of Rhodiola rosea juice on the growth of strains Y1、Y29 and G1
2.3 中药材对清香型白酒糖化醅微生物的影响
20种中药材对糖化醅中微生物数量的影响见图4。由图4可知,大部分中药材的加入对细菌、酵母和霉菌的数量均有一定的促进作用。其中,除添加了茯苓和白术的糖化酒醅中细菌数量分别下降2.08%和4.41%外,其余药材的加入均对细菌生长有较明显的促进作用,其中,川芎、甘草、当归、地黄对细菌生长的促进作用最明显,细菌数量分别增加了143.03%、127.55%、96.21%和90.79%。各中药材对酵母和霉菌生长具有一定促进作用,其中,辣蓼、杏仁和甘草对酵母的菌落数增加幅度较高,分别增加47.69%、43.07%和40.00%。人参、杏仁和桑叶则能显著增加糖化醅中霉菌的数量,分别增加73.47%、32.65%和32.57%。总体来看,杏仁、甘草、当归、川芎、地黄、陈皮、辣蓼、黄芪、人参、桑叶、桂皮、茴香和薄荷对3种微生物的生长均具有一定的促进作用。
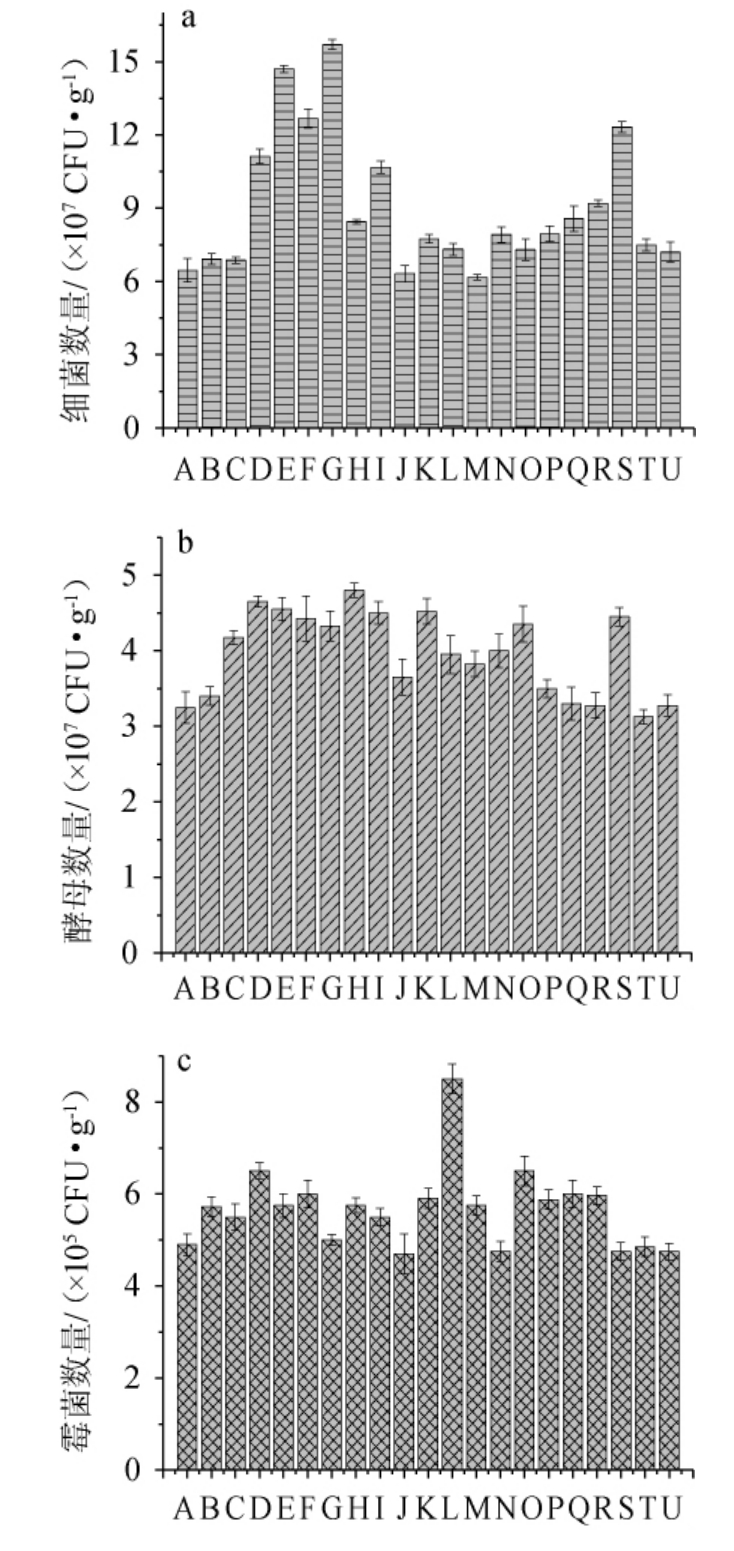
图4 中药材对糖化酒醅中细菌(a)、酵母(b)及霉菌(c)数量的影响
Fig.4 Effect of Chinese medicinal materials on the number of bacteria (a),yeast (b) and mold (c) in saccharified grains
2.4 中药材对清香型白酒质量的影响
乙酸乙酯、乳酸乙酯、杂醇油是表征清香型白酒中质量的主要色谱指标[23-26]。20种中药材对乙酸乙酯、乳酸乙酯、杂醇油的影响见图5。由图5a可知,9种中药材(桂皮、茴香、杏仁、当归、川芎、辣蓼、陈皮、桑叶、黄芪)可增加乙酸乙酯含量,其中茴香、陈皮和杏仁分别使乙酸乙酯含量增加32.44%、17.79%和15.09%;由图5b可知,8种中药材(桂皮、茴香、杏仁、甘草、当归、人参、白术、桑叶)可以增加乳酸乙酯含量,杏仁、茴香、桂皮和白术分别使乳酸乙酯含量增加45.14%、42.82%、38.41%和22.56%;由图5c可知,10种中药材(甘草、川芎、茯苓、薄荷、人参、白术、栀子、桑叶、黄芪、白芍)可以降低杂醇油含量,其中,茯苓、黄芪和人参在降低杂醇油含量方面作用较明显,分别降低了9.23%、7.35%和6.14%。由图5d可知,5种中药材(甘草、当归、川芎、辣蓼、陈皮)对出酒率具有少许提升,其中当归和川芎分别提升4.49%和3.45%,茯苓、人参、白术、薄荷则分别降低了7.51%、5.87%、4.49%和4.40%的出酒率。
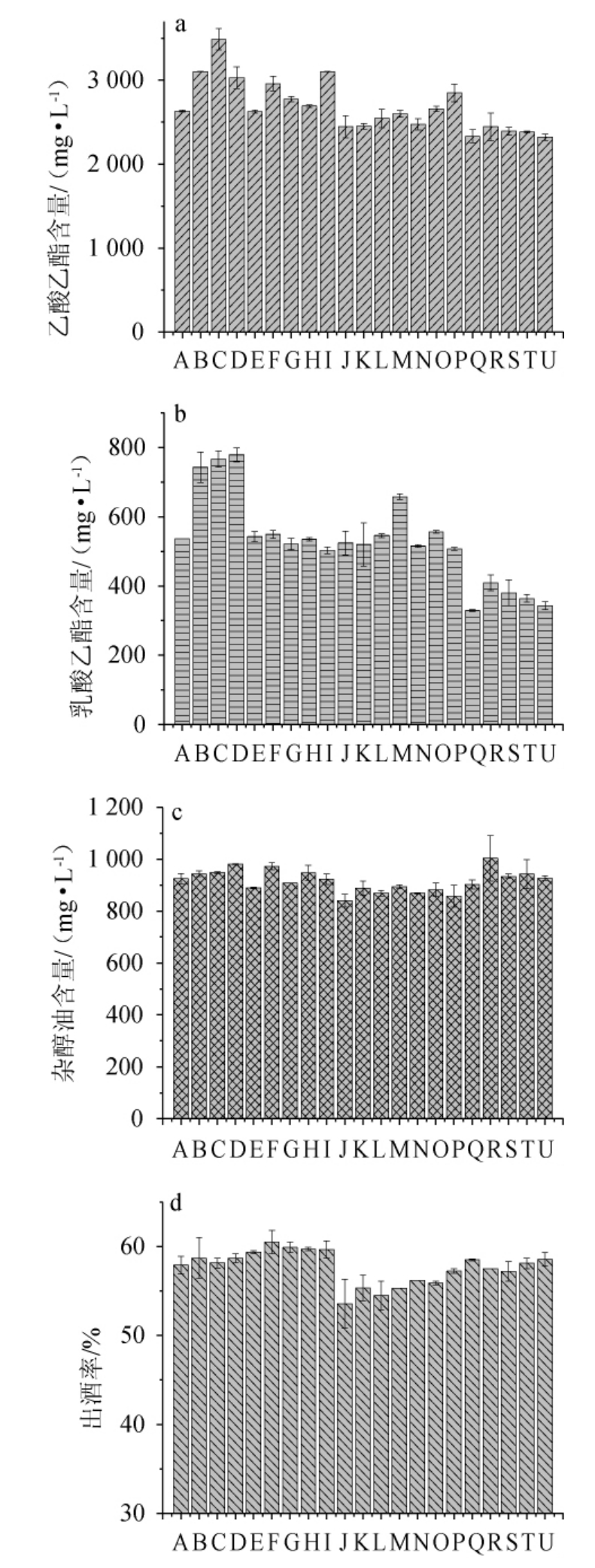
图5 20种中药材对清香型白酒中乙酸乙酯(a)、乳酸乙酯(b)、杂醇油(c)及出酒率(d)的影响
Fig.5 Effect of 20 Chinese medicinal materials on ethyl acetate (a),ethyl lactate (b),fusel oil (c) and liquor yield (d) in light-flavor Baijiu
3 结论
本研究探究了20种中药材对清香型白酒主要微生物生长和原酒质量的影响,结果显示,大部分药材对酿酒微生物的生长具有一定的促进作用,丁香和红景天则对微生物的生长具有较明显的抑制作用,其药汁添加质量浓度应控制在0.5 g/L左右。20种药材中,杏仁、甘草和当归等中药材具有促进酿造微生物增殖的作用;杏仁、茴香、当归和桂皮对原酒具有较好的提高乙酸乙酯和乳酸乙酯的效果,而茯苓、黄芪和人参则具有较好的降低杂醇油的效果。由于不同的药材其作用不同,在实际生产中应结合不同的酒质提升需求,设置不同的中药材添加种类以及添加比例,在避免中药材带来的负面影响的基础上提升清香型白酒酒质。
[1]于大猛.酒曲入药源流考[J].中国酿造,2020,39(9):220-224.
[2]李其书,范怀焰.董酒生产工艺及酒质感官特征[J].酿酒科技,2020(5):114-117,122.
[3]刘昕,刘洪波,曾荣妹,等.董酒风味香气特征研究进展[J].酿酒科技,2016(12):91-93.
[4]罗芳,李丽,罗颂,等.多种中药材制作纯种药曲的性能比较及优化研究[J].酿酒科技,2014(2):7-9,12.
[5]雷学俊,杨俊,李丽,等.添加中药材对米曲性能指标影响的规律性[J].食品研究与开发,2015,36(15):52-54.
[6]吴志,陈晓芸.甜酒曲主要微生物的分离、筛选及其中草药制曲工艺研究[J].轻工科技,2020,36(5):18-20.
[7]李保国,张颖超,刘震,等.薄荷柚子酒的酿造工艺探讨[J].中外葡萄与葡萄酒,2019(6):51-54.
[8]吴琼燕.中草药对甜酒曲微生物发酵性能及酒酿香气成分研究[D].广州:华南农业大学,2016.
[9]许必晏.川法小曲酒中药材入曲对小曲清香白酒酒质影响研究[J].酿酒,2020,47(3):97-98.
[10]张宇,吴正云,朱宇,等.制曲药材的选择及配方规律探讨[J].酿酒科技,2018(11):17-20.
[11]李丽,张文学,罗芳,等.红曲药曲的制备工艺及药曲清酒的研究[J].食品工业科技,2014,35(18):194-198,202.
[12]王都留,叶文斌,杨建东,等.麦淋酒酒曲配方与制曲工艺探究[J].中国酿造,2012,31(10):187-189.
[13]王都留,何九军,叶文斌,等.麦淋酒酒曲中“百草尖”配方的研究[J].酿酒科技,2015(6):38-40.
[14]唐洁,陈申习,张磊,等.绿衣观音土曲培养过程中微生物及酶系的动态变化[J].中国酿造,2020,39(5):97-104.
[15]DONG W W,YANG Q,LIAO Y X,et al.Characterisation and comparison of the microflora of traditional and pure culture Xiaoqu during the Baijiu liquor brewing process[J].J I Brewing,2020,126(2):213-220.
[16]HUANG X N,FAN Y,LU T,et al.Composition and metabolic functions of the microbiome in fermented grain during light-flavor Baijiu fermentation[J].Microorganisms,2020,8(9):1281.
[17]杨强,唐洁,杨生智,等.清香型小曲白酒产酯酵母的筛选及应用[J].酿酒科技,2016(1):78-80.
[18]孙细珍,杜佳炜,张帆,等.应用顶空固相微萃取-气相色谱质谱技术解析天龙泉米香型白酒风味成分[J].酿酒,2021,48(5):55-60.
[19]许银,杨强,张龙,等.高产乙酸乙酯酵母菌的筛选及其在清香型小曲白酒生产中的应用[J].中国酿造,2021,40(8):76-80.
[20]高新馨,赵成爱,孙西琳,等.高山红景天水提物活性组份对人参主要病菌抑制作用[J/OL].吉林农业大学学报:1-8[2022-10-18].http://kns.cnki.net/kcms/detail/22.1100.S.20210525.0907.002.html.
[21]JU J,XIE Y F,YU H,et al.Synergistic inhibition effect of citral and eugenol against Aspergillus niger and their application in bread preservation[J].Food Chem,2020,310:125974.
[22]谭文中.微生物发酵中草药及其活性物质的研究进展[J].现代盐化工,2021,48(2):12-13.
[23]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 10781.2—2006 清香型白酒[S].北京:中国标准出版社,2006.
[24]田学梅,张宿义,郑若欣,等.白酒上头效应分析及降低措施探究[J].中国酿造,2017,36(7):10-13.
[25]GAO W J,FAN W L,XU Y.Characterization of the key odorants in light aroma type Chinese liquor by gas chromatography-olfactometry,quantitative measurements,aroma recombination,and omission studies[J].J Agr Food Chem,2014,62(25):5796-5804.
[26]TANG J,LIU Y C,LIN B,et al.Effects of ultra-long fermentation time on the microbial community and flavor components of light-flavor Xiaoqu Baijiu based on fermentation tanks[J].World J Microbiol Biotechnol,2022,38(1):3.