肠道是重要的消化和解毒器官,同时也是与外界接触最大的器官之一,其具有营养吸收、传递信息、调节新陈代谢以及行使部分免疫的功能[1]。肠道微环境产生的先天性和获得性免疫,与中枢、外周免疫等免疫器官的机制不同,形成了肠道的区域性免疫[2]。肠道菌群及其产生的胆汁酸、短链脂肪酸、吲哚等多种代谢物,能使肠道免疫系统的结构和功能发生改变,使免疫微环境得到重塑,进而影响或干扰特定疾病的发展[3]。过去研究人员通常关注消化系统疾病与肠道微生物之间的关系,但目前研究表明,肠道微生物区系与其他身体主要系统的各种疾病也有关,如代谢疾病、肺部疾病、癌症等[4],许多肝脏类型疾病都被报道与肠道微生物区系的变化相关[5]。改善肠道微生物区系能够改善疾病,益生菌可通过增加双歧杆菌和乳杆菌等有益细菌来改善轻度酒精性肝损伤患者肠道微生物区系的组成,进而对酒精性肝损伤患者起到一定有益作用[6]。
葡萄酒是以新鲜葡萄或葡萄汁为原料经发酵后产生的天然酒精型饮品[7]。葡萄酒中含有丰富的多酚物质、益生菌、矿物质等活性物质,由于其较高的营养价值,在食品和营养科学领域引起了极大的关注[8-9]。研究表明,因葡萄酒含有丰富的多酚类化合物,机体适量摄入葡萄酒对心脑血管疾病、癌症、炎症、认知功能障碍以及骨质等具有一定程度的预防和保护作用[10-13]。酚类物质与肠道微生物之间的相互作用已有报道。多酚物质在肠道中分解、代谢、转化成活性代谢物的同时,对肠道菌群结构也起到一定有益调节作用[14-15]。如茶多酚通过调节肠道功能预防小鼠非酒精性脂肪性肝病[16],在人体健康中具有重要生理意义。
因此,本研究以新疆天山北麓、伊犁河谷、焉耆盆地产区主要种植品种赤霞珠酿造的干红葡萄酒和吐哈盆地主要种植品种霞多丽酿造的干白葡萄酒为研究对象,利用高通量测序技术,分析新疆不同产区葡萄酒灌胃健康雄性大鼠后肠道群落结构变化情况,以期为葡萄酒健康饮酒评价体系以及葡萄酒中生理活性物质筛选提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
葡萄酒样品:赤霞珠干红葡萄酒采于新疆焉耆盆地、伊犁河谷、天山北麓产区,霞多丽干白葡萄酒采于新疆吐哈盆地产区,每个产区采样5~6瓶葡萄酒;实验动物:健康雄性无特定病原体(specific pathogen free,SPF)级SD大鼠60只,6周龄,平均体质量为(195.6±9.26)g,购于斯贝福(北京)生物技术有限公司,动物许可证号为SCXK(京)2019-0010,动物的护理和使用程序得到了北京医学伦理委员会的批准,并遵守所有适用的有关动物伦理使用的机构和政府法规;脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:德国Omega Bio·Tek公司;AxyPrep DNA凝胶回收试剂盒:美国AXYGEN公司;聚合酶链式反应(polymerase chain reaction,PCR)扩增所用试剂:大连宝生生物公司。
1.2 仪器与设备
LDZX-50KBS高压灭菌锅:上海申安医疗器械厂;SpectraMax  iD3多功能酶标仪:美国Molecular Devices公司;Micro 21R小型台式离心机:美国Thermo公司;BG-sub-MIDI多用途水平电泳仪:上海珂淮仪器有限公司;BC-C57 PCR仪:上海天能科技有限公司;Tanon1600凝胶成像系统:上海天能科技有限公司。
iD3多功能酶标仪:美国Molecular Devices公司;Micro 21R小型台式离心机:美国Thermo公司;BG-sub-MIDI多用途水平电泳仪:上海珂淮仪器有限公司;BC-C57 PCR仪:上海天能科技有限公司;Tanon1600凝胶成像系统:上海天能科技有限公司。
1.3 实验方法
1.3.1 大鼠分组及灌胃
将大鼠适应性喂养7 d后,随机分为焉耆盆地干红葡萄酒组(A1)、伊犁河谷干红葡萄酒组(A2)、天山北麓干红葡萄酒组(A3)、吐哈盆地干白葡萄酒组(A4)及空白组(A5),每组10只。空白组灌胃蒸馏水,其他各组灌胃相应新疆不同产区干红、干白葡萄酒,共持续56 d,葡萄酒样品的灌胃剂量参照《实验生理科学》[17],干红葡萄酒组灌胃剂量为13.9 mL/kg体质量,干白葡萄酒组灌胃剂量为16.0 mL/kg体质量。灌胃样品及分组具体信息见表1。
表1 灌胃样品及分组信息
Table 1 Intragastric samples and grouping information

1.3.2 粪便收集
灌胃结束后禁食12 h,在无菌条件下收集各组大鼠粪便,随机分3个平行,收集到对应无菌EP管中,-80 ℃保存,备用。
1.3.3 DNA提取及测序
按照DNA提取试剂盒说明书提取粪便样品DNA后,将合格的DNA送至北京诺禾致源公司,采用IonS5TMXL高通量测序平台对实验大鼠粪便样本中细菌16S rDNA V4区基因序列进行测序分析。
1.3.4 数据处理
使用Trimmomatic软件对原始序列进行质控与过滤,舍去质量较低的序列,用FLASH软件对原始序列进行拼接,使用UCHIME软件剔除嵌合体。利用Uparse v7.0.1001软件对所有样品的全部Clean Reads进行聚类,以97%的一致性将序列聚类成为操作分类单元(operational taxonomic units,OTUs)。利用Silva v123的SSU rRNA数据库比对注释,得到每个OTU对应的物种信息,物种比对注释使用RDP classifier软件,保留置信区间>0.7的注释结果。使用Qime 1.9.1软件计算Chaol指数、Shannon指数、Simpson指数、Ace指数、Goods·coverage。再根据OTU结果,进行α、β(非度量多维尺度分析(non-metric multidimensional scaling,NMDS))多样性分析,采用Origin 2021绘制样品门、属水平下的群落结构图[18]、线性判别分析(linear discriminant analysis,LDA)值分布条形图和LDA效应值(LDA effect size,LEfSe)进化分支图,进行多级物种差异判别分析[19];运用软件SPSS 26.0进行差异显著性分析,多组均数间采用单因素方差分析(oneway analysis of variance,one-way ANOVA),样本均数的两两比较采用最小显著差(least significance difference,LSD)检验,P<0.05为差异显著。
2 结果与分析
2.1 大鼠肠道菌群的α多样性分析
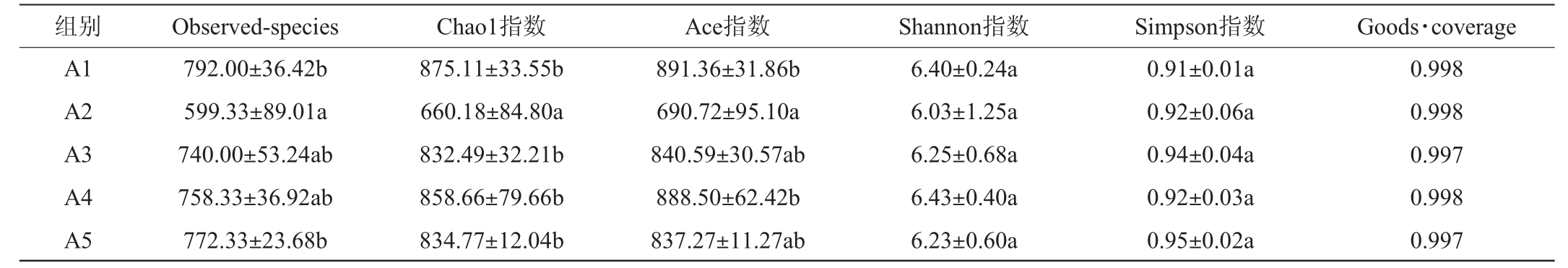
Chaol指数、Ace指数、Shannon指数、Simpsion指数是判断菌群物种丰富度、多样性的常用指数。Observed-species、Goods·coverage可反映物种数目及样品的测序深度[20]。不同处理大鼠肠道菌群的α多样性分析结果见表2。
表2 不同处理大鼠肠道菌群的α多样性分析结果
Table 2 Alpha diversity analysis results of intestinal flora in rats with different treatments
注:同列肩不同字母表示差异显著(P<0.05)。下同。
由表2可知,与空白组(A5)相比,A2组的Chaol指数、Ace指数显著降低(P<0.05),说明机体长期摄入一定量的A2干红葡萄酒能显著调节大鼠肠道菌群;A1、A3及A4组差异不显著(P>0.05)。所有样品的Goods·coverage均>0.99,说明样品序列未被检测到的几率较低,数据具有可靠性。因此,推测不同处理大鼠肠道菌群多样性的差异可能是由各产区的自然环境、葡萄酒的酿造工艺及各产区葡萄酒中酚类物质的种类和含量不同造成的[21]。
2.2 大鼠肠道菌群OTU数量分析
不同处理大鼠肠道菌群OTU的Venn图见图1。由图1可知,A1组大鼠肠道菌群OTU数为1 137个、A2组大鼠肠道菌群的OTU数为929个、A3组大鼠肠道菌群的OTU数为1 165个、A4组大鼠肠道菌群的OTU数为1 134个、A5空白组大鼠肠道菌群的OTU数为1 119个;其中A1组大鼠特有的肠道菌群OTU数为63个、A2组大鼠特有的肠道菌群OTU数为30个、A3组大鼠特有的肠道菌群OTU数为131个、A4组大鼠特有的肠道菌群OTU数为103个、A5空白组大鼠特有的肠道菌群OTU数为64个。各组OTU数量由高到低排序为:A3组、A1组、A4组、A5组、A2组,说明葡萄酒干预后,大鼠肠道菌群OTU数量有增加的趋势,且A3组增加较多。
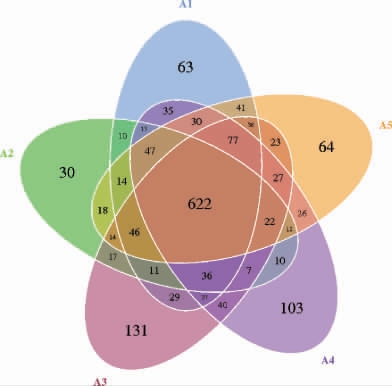
图1 不同处理大鼠肠道菌群的操作分类单元Venn图
Fig.1 Venn diagram of operational taxonomic units of intestinal flora in rats with different treatments
2.3 大鼠肠道菌群的β多样性分析
通过β多样性分析不同处理大鼠肠道菌群群落组成的差异性,对所有样品进行NMDS分析,结果见图2。图中各组间的差异程度用点与点间的距离表示,距离越远,差异越大[22]。
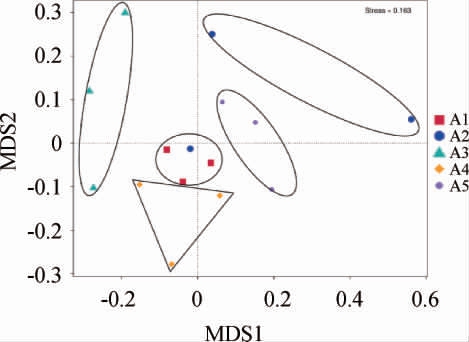
图2 不同处理大鼠肠道菌群非度量多维尺度分析
Fig.2 Non-metric multidimensional scaling analysis of intestinal flora in rats with different treatments
由图2可知,不同处理的大鼠肠道菌群被分为5个部分,说明机体长期摄入一定量葡萄酒可在一定程度上影响肠道菌群结构;摄入葡萄酒的A2、A3、A4组较空白组距离远,说明A2、A3、A4组大鼠肠道菌群组成与空白组差异较大,推测摄入A2、A3、A4葡萄酒对大鼠肠道菌群结构有一定影响;A3组与空白组相距最远,说明A3干红葡萄酒干预后,大鼠肠道菌群结构变化较为明显。
2.4 大鼠肠道菌群结构分析
2.4.1 基于门水平大鼠肠道菌群结构分析
不同处理大鼠肠道菌群在门水平上的群落组成见图3。由图3可知,从所有样本中共检测出9种优势细菌门(相对丰度>1%),分别为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、螺旋体门(Spirochaetes)、疣微菌门(Verrucomicrobia)、放线菌门(Actinobacterita)、广古菌门(Eur yarchaeota)、变形菌门(Proteobacteria)、放线菌门(Acidobacteriota)、脱硫菌门(Desulfobacterota)。与WANG K等[23-25]研究得到的葡萄酒对大鼠肠道菌群的影响中含量位居前列的菌群研究结论一致。不同处理大鼠肠道优势菌群存在差异。其中A1组9种,A2组7种,A3~A5组均为8种,共有的优势菌群主要为厚壁菌门和拟杆菌门,各组两个菌门的相对丰度之和均>80%,相对丰度之和由高到低排序为:A2组、A4组、A3组、A1组、A5组。另外,与空白组相比,A1、A2、A3、A4组中变形菌门(Proteobacteria)、脱硫菌门(Desulfobacterota)相对丰度显著降低(P<0.05)。研究表明,长期摄入过量酒精的人群,通过显著增加肠道菌群中变形菌门的相对丰度和显著降低拟杆菌门的相对丰度,给机体带来一些疾病[26],然而本研究中,大鼠摄入一定量葡萄酒后,变形菌门相对丰度显著降低,说明葡萄酒不同于酒精,对机体有一定程度的健康作用。变形菌门对肠道疾病具有一定程度的调节作用[27],并且当这类菌群数量异常升高时,可能会引发机体的某些炎症反应[28]。脱硫菌门具有穿过肠道粘液层,在肠道定植的能力,肠道中脱硫菌门菌群丰度较高时,可能会引发溃疡性结肠炎[29]。各葡萄酒组间相比较,A1组中螺旋体门、A2组中疣微菌门(Verrucomicrobia)相对丰度显著升高(P<0.05)。疣微菌门(Verrucomicrobia)的代谢产物之一丁酸盐,可通过降低机体食欲,进而减少机体进食,从而对肥胖相关疾病起到一定的调节作用[30]。结果表明,机体适量摄入一定量的葡萄酒可以调节肠道菌群结构,对一些病征的改善具有一定的潜力,实际效果与具体机制需要进一步试验深入研究。
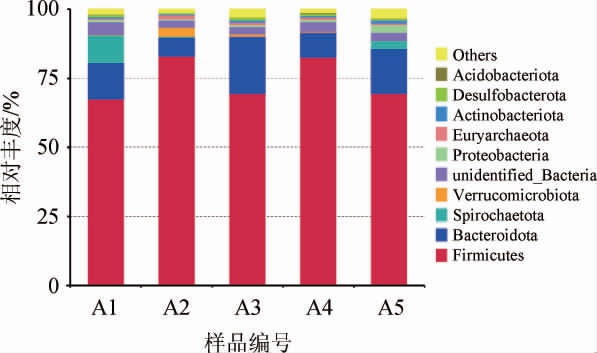
图3 基于门水平不同处理大鼠肠道菌群的组成
Fig.3 Intestinal microflora composition of rats with different treatments based on phylum level
Others:相对丰度<1%的其他菌门。
2.4.2 基于属水平大鼠肠道菌群组成分析
在属水平上,不同处理大鼠肠道菌群的组成见图4。由图4可知,所有样品中共检出10种优势细菌属(相对丰度>1%),分别为乳杆菌属(Lactobacillus)、罗姆布茨菌(Romboutsia)、密螺旋体属(Treponema)、Lachnospiraceae NK4A136-group、粪杆菌(Faecalibaculum)、普雷沃氏菌属(Prevotella)、瘤胃球菌属(Ruminococcus)、艾克蔓菌属(Akkermansia)、Turicibacter、Clostridium_sensu_stricto_1。不同处理大鼠肠道优势菌群存在差异,其中A1组8种,A2~A4组均为7种,A5组6种,共有的优势菌群主要为乳杆菌属,平均相对丰度为33.5%,各组相对丰度由高到低排序为:A2组、A4组、A1组、A3组、A5组。另外,与空白组相比,A1组密螺旋体属相对丰度显著升高(P<0.05);A2、A3、A4组密螺旋体属相对丰度显著降低(P<0.05);A1、A2、A3组罗姆布茨菌属相对丰度显著升高(P<0.05);A2组艾克蔓菌属(Akkermansia)和乳杆菌属相对丰度显著升高(P<0.05)。研究表明,乳杆菌属与维持肠道系统的微生态平衡、pH值和肠道上皮完整性有关,可预防Ⅱ型糖尿病、非酒精性脂肪肝等与肥胖相关的疾病[31]。艾克蔓菌属可通过改善人体肠道黏液和肠道屏障状态,降低机体的糖分吸收率,从而控制机体肥胖相关指标[32]。A3组粪杆菌(Faecalibaculum)和普雷沃氏菌属(Prevotella)显著升高(P<0.05)。粪杆菌和普雷沃氏菌属相对丰度增高,可促进甘油的分解、改善胆固醇代谢相关蛋白信使核糖核酸(messenger ribonucleic acid,mRNA)表达水平,从而降低动脉粥样硬化、高脂高糖的风险[33],这也与OJELABI O A等[34]葡萄酒存在一定降血糖作用的研究结论一致。因此,以上各菌属相对丰度的增加可对于宿主发挥一定的益生功能。综上所述,机体适量摄入一定葡萄酒可能具有优化宿主肠道菌群结构,发挥益生功能的潜力。
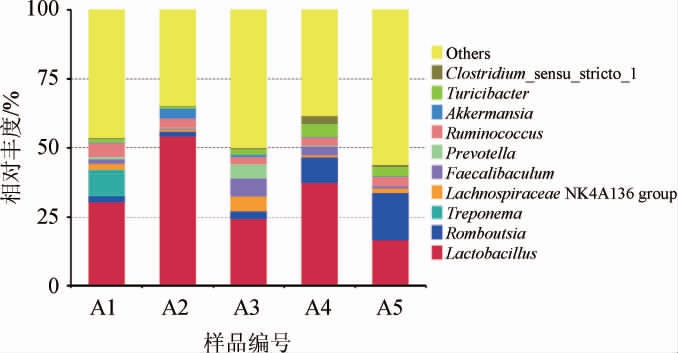
图4 基于属水平不同处理大鼠肠道菌群的组成
Fig.4 Intestinal microflora composition of rats with different treatments based on genera level
Others:相对丰度<1%的其他菌属。
2.5 各处理组大鼠肠道菌群的物种差异分析
LEFSe常用于分析对样品划分产生统计学差异影响的群落或物种;LDA常用来计算产生差异影响的群落或物种对差异效果的贡献值[35]。从门到种水平下大鼠粪便样本的LDA及LEfSe分析结果见图5。
由图5可知,摄入葡萄酒后,不同处理大鼠肠道差异性富集的菌群存在差异。A1组肠道菌群中螺旋体纲(Spirochaetia)、螺旋体科(Spirochaetales)、螺旋体目(Spirochaetaceae)的富集最具差异性(P<0.05);A2组肠道菌群中肠乳杆菌(Lactobacillus intestinalis)的富集最具差异性(P<0.05);A3组肠道菌群中迪茨氏菌科(Dietziaceae)的富集最具差异性(P<0.05);A4组肠道菌群中微多毛目(Microtrichales)、丛毛单胞菌科(Comamonadaceae)富集最具差异性(P<0.05);A5组肠道菌群中消化链球菌科(Peptostreptococcaceae)富集最具差异性(P<0.05)。乳杆菌属与维持肠道系统的微生态平衡、pH值和肠道上皮完整性有关[31],因此,推测适量摄入A2葡萄酒后一定程度上能促进肠道菌群良性发展。
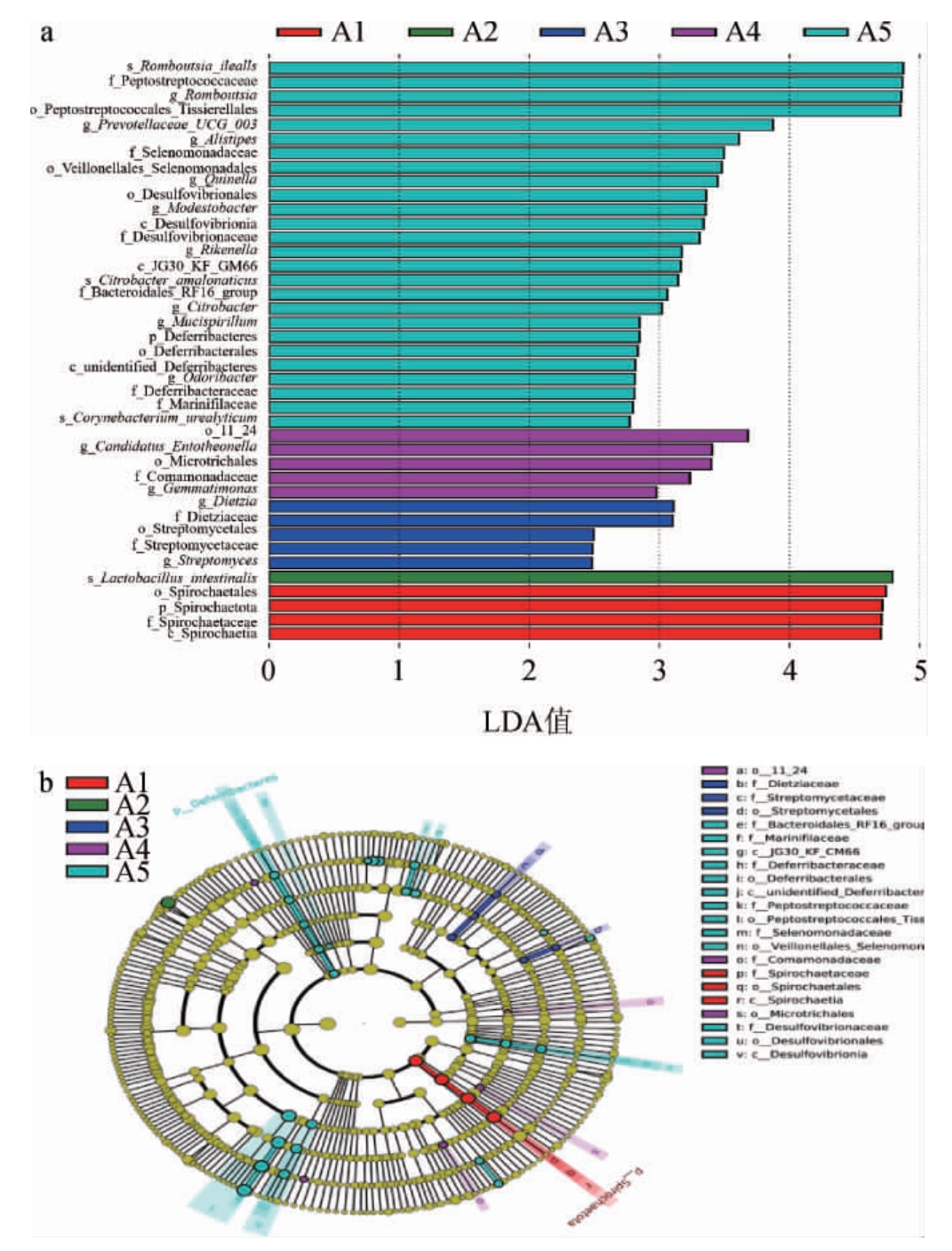
图5 不同处理大鼠粪便样本线性判别分析条形图(a)及LDA效应大小进化分支图(b)
Fig.5 Bar chart of linear discriminant analysis (a) and evolution branch chart of LDA effect size (b) of fecal samples of rats with different treatments
图a中LDA值越大,代表群落或物种在对应分组中的影响程度越大,LDA值>3的物种为具有统计学差异的biomarker。图b中圆环:由内到外的多层圆环代表由门至种的分类级别;各分类级别上的小圆代表该水平下的不同分类,小圆的直径越大,代表该菌群或物种的相对丰度越大。颜色:黄色代表无显著差异的物种(P>0.05);差异显著的物种对应组别进行着色,代表组别中起到重要作用的群落或物种。
3 讨论
肠道菌群的组成及代谢物与人体健康状况密切相关,在人体中发挥重要作用[31]。肠道菌群能影响葡萄酒中多酚的代谢,并且葡萄酒多酚及其代谢产物如表儿茶素、儿茶素、没食子酸等,还可以改变肠道微生物的组成,发挥益生元作用,促进有益菌生长,抑制病原菌的繁殖[15]。本研究中,各葡萄酒处理组大鼠肠道中主要的共有优势菌门厚壁菌门、拟杆菌门较空白组相对丰度之和升高;主要的共有优势菌属乳杆菌属较空白组相对丰度显著升高,这与张文慧等[36]对葡萄酒的肠道菌群作用研究结果一致。赵昊等[21]研究发现,干红葡萄酒的酚类物质含量较干白葡萄酒高,本研究中,在门、属水平上,各组优势菌群厚壁菌门、拟杆菌门、乳杆菌属相对丰度由高到低排序为:A2组、A4组、A3组、A1组、A5组,A2组在门、属水平上优势菌群相对丰度增加幅度较大,说明A2干红葡萄酒较好,推测这与不同产区、不同品种葡萄酒的酿造工艺及酚类物质的含量和种类差异有一定关系,且不同浓度的酚类物质具有不同的作用效果,不同酚类物质之间存在拮抗或协同作用,这也与WATERHOUSE A L等[37]对酚类物质的研究结果一致。因此,关于葡萄酒对肠道菌群的作用以及与酚类物质之间的关系,还需要进一步深入研究。
4 结论
通过高通量测序技术分析不同处理大鼠肠道菌群结构,结果表明,摄入葡萄酒后,不同处理大鼠肠道优势菌群存在差异。在门、属水平上,各组共有优势细菌门主要为厚壁菌门、拟杆菌门,共有优势细菌属主要为乳杆菌,各葡萄酒组其相对丰度之和均显著高于空白对照组(P<0.05),且A2组(伊犁河谷干红葡萄酒)升高幅度最大,其大鼠肠道菌群中有害菌门变形菌门、脱硫菌门相对丰度较空白组显著降低(P<0.05);有益菌属罗姆布茨菌、艾克蔓菌属及乳杆菌属相对丰度显著增加(P<0.05)。结合多级物种差异判别分析结果可知,A2组大鼠肠道菌群中肠乳杆菌(Lactobacillus intestinalis)的富集最具差异性(P<0.05),因此,推测机体适量摄入葡萄酒一定程度上能够改善肥胖相关菌群丰度、促进肠道菌群良性发展。
[1]李涛,李绮丽,张群,等.基于肠道菌群的黄酮类化合物生理功能研究进展[J].中国食品学报,2022,22(2):357-368.
[2]DEPOORTERE I.Taste receptors of the gut:emerging roles in health and disease[J].Gut,2014,63(1):179-190.
[3]ZHOU B L,YUAN Y T,ZHANNG S S,et al.Intestinal flora and disease mutually shape the regional immune system in the intestinal tract[J].Front Immunol,2020,11:575.
[4]DUDA-CHODAK A,TARKO T,SATORA P,et al.Interaction of dietary compounds,especially polyphenols,with the intestinal microbiota:a review[J].Eur J Nutr,2015,54(3):325-341.
[5]GUO X Y,JIAO Y M,SONG J W,et al.Gut microbiota alteration in hepatobiliary diseases:cause-and-effect relationship[J].Hepatol Int,2021,15(6):1305-1308.
[6]LECLERCQ S,STÄRKEL P,DELZENNE N M,et al.The gut microbiota:a new target in the management of alcohol dependence?[J].Alcohol,2019,74:105-111.
[7]BERTELLI A A E.Wine,research and cardiovascular disease:instructions for use[J].Atherosclerosis,2007,195(2):242-247.
[8]赵昊,王雪薇,宋晶晶,等.不同品种葡萄酒香气特征及成分分析[J].中外葡萄与葡萄酒,2020(6):28-33.
[9]CARIDI A,SIDARI R,PULVIRENTI A,et al.Genetic improvement of wine yeasts for opposite adsorption activity of phenolics and ochratoxin A during red winemaking[J].Food Biotechnol,2020,34(4):352-370.
[10]彭淼,毛曦,彭勃,等.刺葡萄酒对高脂饮食大鼠的降血脂作用[J].现代食品科技,2020,36(10):8-15.
[11]任俊庭,张今,张紫钰,等.葡萄酒及葡萄汁对小鼠急性酒精性肝损伤的作用[J].热带医学杂志,2015(12):1610-1613,1582.
[12]邓祖跃,匡荣,朱社敏,等.红葡萄酒对高脂血症大鼠血脂、血凝及抗氧化功能的影响[J].中国中医药科技,2011,18(5):416-417.
[13]李虎,杨悦,李婷婷,等.慕萨莱思葡萄酒对高脂血症SD大鼠血脂的影响[J].中国酿造,2019,38(11):71-74.
[14]陶勇,芮俊鹏,李家宝,等.浓香型白酒窖泥中细菌和古菌的组成与多样性[J].化工学报,2014,65(5):1800-1807.
[15]刘晓荻,薛惠文.红葡萄酒有利于肠道微生物群[J].基础医学与临床,2020,40(4):511.
[16]LIU B H,ZHANG J,SUN P,et al.Raw bowl tea(Tuocha) polyphenol prevention of nonalcoholic fatty liver disease by regulating intestinal function in mice[J].Biomolecules,2019,9(9):435.
[17]莫书荣.实验生理科学[M].北京:科学出版社,2001:21-26.
[18]刘蓉,栾春光,王德良,等.基于高通量测序分析黄酒对D-半乳糖致衰老小鼠模型肠道微生物菌群的影响[J].食品与发酵工业,2020,46(2):32-39.
[19]魏建敏,杨华连,陈莉,等.基于高通量测序分析果桑茶对2型糖尿病模型小鼠肠道菌群的影响[J].食品与发酵工业,2021,47(20):75-82.
[20]HILDEBRAND F,NGUYEN T L A,BRINKMAN B,et al.Inflammation-associated enterotypes,host geno-type,cage and inter-individual effects drive gut micro-biota variation in common laboratory mice[J].Genome Biol,2013,14(1):R4.
[21]赵昊,宋晶晶,于佳俊,等.不同产区葡萄酒多酚物质抗氧化活性差异及相关性分析[J].食品与发酵工业,2021,47(6):84-91.
[22]吕英杰,王帅珂,吴苹,等.雷公藤红素的肝肾毒性分析及其对高脂饮食小鼠肠道菌群的调节作用[J].现代食品科技,2020,36(5):35-41.
[23]WANG K,LIAO M F,ZHOU N,et al.Parabacteroides distasonis allevi-ates obesity and metabolic dysfunctions via production of succinate and secondary bile acids[J].Cell Rep,2019,26(1):222-235.
[24]DERRIN M,BELZER C,DE VOS W M.Akkermansia muciniphila,and its role in regulating host functions[J].Microb Pathog,2017,106:171-181.
[25]DEN B G,VAN,EUNEN N,et al.The role of short-chain fatty acids in the interplay between diet,gut microbiota,and host energy metabolism[J].J Lipid Res,2013,54(9):2325-2340.
[26]ZAHS A,BIRD M D,RAMIREZ L,et al.American journal of physiology Gastrointestinal and liver physiology[J].Am J Physiol Gastrointest Liver Physiol,2012,303:G705-712.
[27]EVANS N J,BROWN J M,MURRAY R D,et al.Characterization of novel bovine gastrointestinal tract treponema isolates and comparison with bovine digital dermatitis treponemes[J].Appl Environ Microbiol,2011,77(1):138-147.
[28]MOHAMMED G J,KADHIM M J,HAMEED I H.Proteus species:Characterization and herbal antibacterial: A review[J].Int J Pharm Phytochem Res,2016,8(11):1844-1854.
[29]李凌浩.不同禁食时间对健康小鼠肠道菌群的影响[D].兰州:西北民族大学,2020.
[30]SUDO N,CHI D,AIBA Y.Gut fellings:the enering biology of gut-brain communication[J].Nat Rev Neurosci,2011,12(8):453-466.
[31]胡博,陈雪梅,唐晓姝,等.基于高通量测序分析红枣枸杞浸泡酒对小鼠肠道菌群的影响[J].食品与发酵工业,2022,48(5):47-52.
[32]CAESER R,TREMAROLI V,KOVATCHEVA-DATCHARY P,et al.Crosstalk between gut microb and dietary lipids aggravates WAT inflammation through TLR signaling[J].Cell Metab,2015,22(4):658-668.
[33]ZHU W,GREGORY J C,ORG E,et al.Gut microbial metabolite TMAO enhances platelet hyperreactivity and thrombosis risk[J].Cell,2016,165(1):111-124.
[34]OJELABI O A,LLOYD K P,DE ZUTTER J K,et al.Red wine and green tea flavonoids are cis-allosteric activators and competitive inhibitors of glucose transporter 1(GLUT1)-mediated sugar uptake[J].J Biol Chem,2018,293(51):19823-19834.
[35]陈宏辉.不同肠道益生菌株治疗急性溃疡性结肠炎小鼠模型的作用及其机制[D].长沙:中南大学,2007.
[36]张文慧,李青林,黄丽辉,等.葡萄酒与健康关系的研究新进展[J].中国酿造,2019,38(2):11-15.
[37]WATERHOUSE A L.Wine phenolics[J].Ann NY Acad Sci,2002,957(1):21-36.