甜蜜素又名环己基氨基磺酸钠,是一种在食品工业中广泛使用的水溶性甜味剂。根据GB 2760—2014《食品安全国家标准食品添加剂使用标准》[1]规定,甜蜜素在配制酒中最大使用量为0.65 g/kg,在其他酒类中不得使用。目前,检测食品中甜蜜素含量的方法主要有液体进样-气相色谱法(gas chromatography,GC)[2-6]、顶空-气相色谱法(headspacegas chromatography,HS-GC)[7]、液体进样-气质联用法(gas chromatography-mass spectrometry,GC-MS)[8-10]、顶空-气质联用法(headspace gas chromatography-mass spectrometry,HS-GC-MS)[11]、液质联用法(high performance liquidchromatography mass spectrometry,HPLC-MS/MS)[12-14]、高效液相色谱法(high performance liquid chromatography,HPLC)[15-17]、紫外-可见分光光度法(ultraviolet visible spectrophotometry,UV-VIS)[18-19]。GC法适用于除酒类外其他食品的检测。因白酒中含有的环己醇会干扰甜蜜素的检测,因此GC法不适用于白酒中甜蜜素的检测[20]。HPLC-MS/MS适用于白酒、葡萄酒、黄酒和料酒的检测,但液质联用仪价格昂贵,使用和维护成本高,不利于方法的推广[21]。HPLC法因为检出限太高,仅适用于配制酒和其他食品的检测,不适用于白酒、葡萄酒、黄酒和料酒的检测[22],UV-VIS法也仅适用于高含量甜蜜素样品的检测[23]。目前,有相关学者研究了顶空-气相色谱法检测普通食品中甜蜜素的方法[7,11]。但李雨翡等[11]的研究中顶空-气相色谱法检出限太高(3.62 mg/kg),不适合白酒等产品中甜蜜素含量的检测。白酒中乙醇和其他小分子有机物含量很高,如果在样品衍生前不去除,由于杂质峰和目标峰保留时间较接近,在气相色谱测定甜蜜素衍生产物时会形成干扰。因此,在衍生前应将大部分有机物杂质去除掉。江丰等[24]的研究表明,顶空-气相色谱法检出限能达到要求,但该研究的相关系数较低,定量检测不够准确。现行国家标准检测白酒中甜蜜素的定量限为0.1 mg/kg[2]。目前,国内外暂未见顶空-气相色谱法检测各种饮用酒类中甜蜜素的方法,也未有适合各类饮用酒类检测的方法。因此,建立一种适合各种饮用酒类中甜蜜素检测的方法十分必要。本研究拟采用顶空-气相色谱法对各种饮用酒类进行检测,通过优化前处理条件和仪器参数等方式,期望方法检出限、线性范围等多项指标均能达到或优于现行国家标准[2],且期望本实验的方法比国家标准[2]更加高效、准确、快捷,降低检测成本,为食品安全监管提供技术支撑。
1 材料与方法
1.1 材料与试剂
浓香型白酒(42%vol):湖南某酒业有限公司;黄酒(12.0%vol):潮州某酿造有限公司;干红葡萄酒(13%vol):某酒业有限公司;威士忌(40%vol):青岛某酒业有限公司;药酒(42%vol):家庭自制;甜蜜素标准物质(纯度98.9%):美国Sigma-Aldrich公司;亚硝酸钠、硫酸(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
HS-20顶空进样器+GC-2030气相色谱仪(配备火焰离子化检测器(flame ionization detector,FID)):日本岛津公司;ElixEssential5+Milli-Q超纯水仪:法国Millipore公司。
1.3 方法
1.3.1 标准溶液的配制和标准曲线的制作
准确称取经纯度折算后的甜蜜素标准品100 mg(以环己基氨基磺酸计),用水溶解并定容至10.0 mL,配制成质量浓度为10.0 mg/mL的标准储备液。用水作为溶剂,每次稀释10倍,逐级稀释至1 μg/mL。在5个22 mL顶空瓶中各加入10.0 mL水,分别加入0.01 mL、0.05 mL、0.10 mL、0.50 mL、1.00 mL质量浓度为100 μg/mL的甜蜜素标准物质,再加入1.0 mL质量浓度为100 g/L的硫酸溶液,最后加入1.0 mL质量浓度为100 g/L的亚硝酸钠溶液,迅速封好顶空瓶盖,待检测。
1.3.2 样品前处理条件优化
分别考察超声(40 ℃,45 kHz、30 min)、振荡(室温,120 r/min、30 min)、加热煮沸(准确称量25.0 g酒类样品至100 mL烧杯中,加入3颗玻璃珠,在放有石英棉的电热炉上缓慢加热至沸腾,保持沸腾至烧杯中液体还剩5 mL左右,停止加热,自然冷却,将烧杯中样品处理液转移至250 mL容量瓶中,用水定容)3种前处理方式对酒中甜蜜素检测的影响。用移液枪准确移取10.0 mL待测溶液至22 mL顶空瓶中,加入1.0 mL质量浓度为100 g/L的硫酸溶液,再加入1.0 mL质量浓度为100 g/L的亚硝酸钠溶液,迅速封好顶空瓶盖,待检测。
1.3.3 仪器条件
(1)顶空条件
考察顶空温度在20~80 ℃条件下色谱图的峰面积变化情况。样品流路温度95.0 ℃;传输线温度150.0 ℃。
(2)色谱条件
安捷伦DB-1MS UI色谱柱(30 m×0.32 mm×0.25 μm);载气(氮气)、燃烧气(氢气)、助燃气(空气)均为钢瓶集中供气(纯度>99.999%);分流进样,分流比20∶1;色谱柱流量:2.00 mL/min;升温程序:80 ℃保持1 min;以40 ℃/min升温至100 ℃,保持2 min;以40 ℃/min升温至240 ℃,保持2 min;色谱分析时间共9.0 min。FID检测器温度300.0 ℃,氢气流量32.0 mL/min,空气流速200.0 mL/min,尾吹气流量24.0 mL/min。
1.3.4 定性定量方法
根据何浩等[7]的研究,顶空气相-色谱检测食品中的甜蜜素,目标产物为一系列衍生产物,但主要产物是环己烯,且环己烯的峰面积与样品中甜蜜素的含量成正比,因此用顶空-气相色谱-质谱对甜蜜素衍生产物进行全扫描,选取目标产物。根据保留时间进行定性,外标法定量。
1.3.5 线性范围、检出限、定量限
以标准物质的含量(X)为横坐标,以待测目标物的峰面积(Y)为纵坐标绘制标准曲线。如果样品中甜蜜素含量很高,可用水稀释10倍后再进行检测。在空白基质中添加甜蜜素标准物质,以3倍信噪比(S/N=3)确定检出限,以10倍信噪比(S/N=10)确定定量限。
2 结果与分析
2.1 样品前处理条件优化
实验结果表明,当反应在冰浴条件下进行时,生成的物质主要是环己基亚硝酸酯和环己醇[2];当反应温度在50 ℃时,生成的目标物质主要是环己烯[7]。50 ℃反应时,反应时间仅需30.0 min,且副产物较少[7]。
对白酒、黄酒、葡萄酒、威士忌、药酒分别进行样品和加标的测定,结果表明,药酒的基质最复杂。甜蜜素标准物质和药酒加标的气相色谱图见图1。由图1可知,目标物质环己烯色谱峰附近没有杂质峰,表明通过煮沸可将挥发性干扰物质去除。通过超声或振荡前处理后的样品溶液经顶空-气相色谱分析时,样品溶液还存在乙醇和各种挥发性物质,干扰目标物质的测定。而本实验采用加热煮沸的前处理方式能去掉绝大部分乙醇和挥发性物质,防止假阳性峰的出现。结果表明,25.0 mL待测样品加热浓缩至5 mL左右时,干扰物质大部分能够去除,且对定量结果不造成影响。浓缩体积更小或者至近干,加标回收率会显著降低。
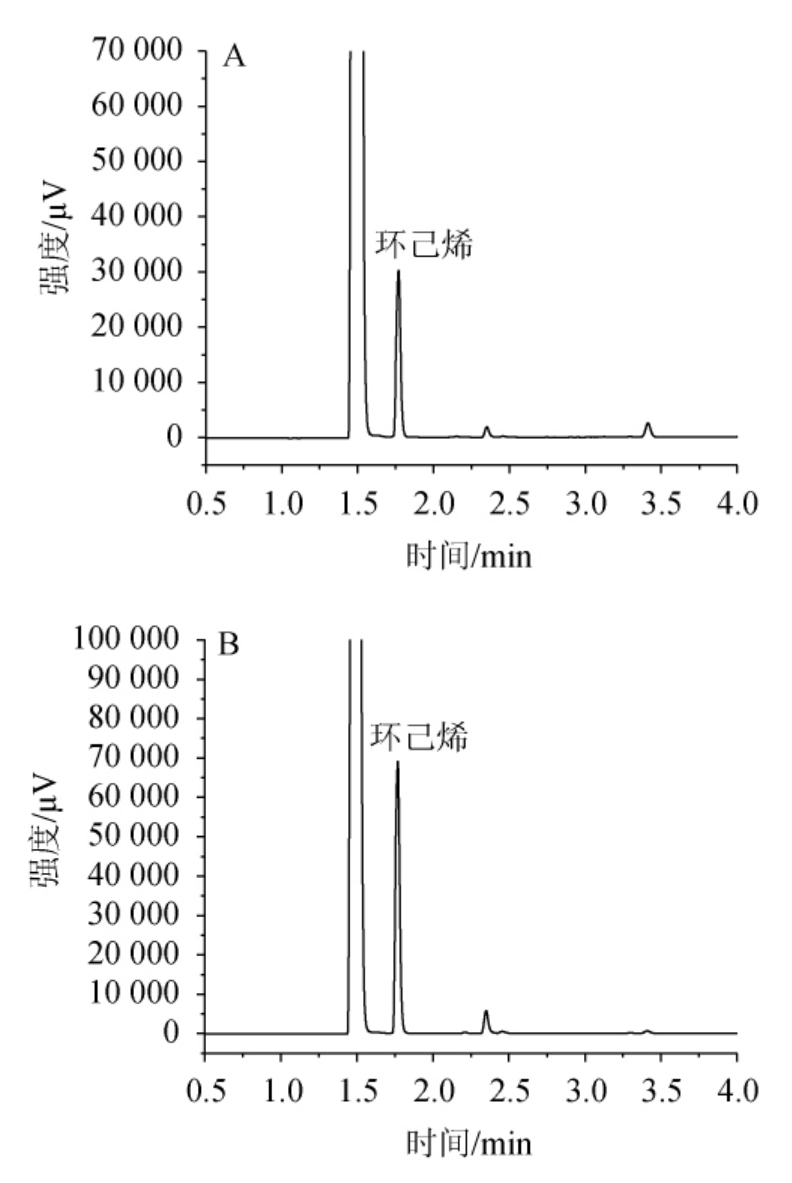
图1 甜蜜素标准物质衍生物(A)及药酒加标后衍生物(B)气相色谱图
Fig.1 Gas chromatogram of derivatives of sodium cyclamate standard substance (A) and derivatives of medicinal liquor after standard addition (B)
2.2 仪器条件
甜蜜素在酸性条件下与亚硝酸盐冰浴衍生,生成的目标物质是环己醇亚硝酸酯和环己醇[2]。在常温条件下,生成的是环己烯等一系列衍生产物[3]。顶空温度在20~80 ℃条件下目标物质峰面积变化情况见图2。由图2可知,顶空温度越高,目标物质的峰面积越大,但是,随着顶空温度的升高,衍生产生的副产物越来越多且峰面积越来越大。因此,本实验选用50 ℃作为顶空温度。
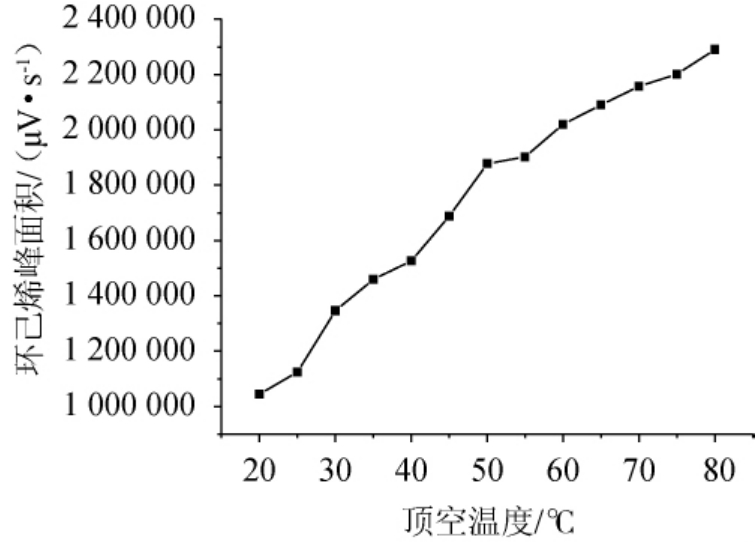
图2 甜蜜素衍生物峰面积随顶空温度变化曲线
Fig.2 Variation of peak area of sodium cyclamate derivatives with headspace temperature
2.3 方法的线性范围、检出限及定量限
在0.1~10 μg/mL(对应样品中甜蜜素含量为1~100 mg/kg)范围内,线性方程为Y=5 457.9X-730,线性关系良好,R2为0.998 9,以3倍信噪比(S/N=3)确定检出限为0.1 mg/kg,以10倍信噪比(S/N=10)确定定量限为0.3 mg/kg,检出限和定量限与GB 5009.97—2016《食品安全国家标准食品中环己基氨基磺酸钠的测定》[2]第三法液相色谱-质谱/质谱法相当,明显优于GB 5009.97—2016《食品安全国家标准食品中环己基氨基磺酸钠的测定》[2]第一法气相色谱法和第二法液相色谱法。本实验方法用到的仪器顶空-气相色谱仪价格明显低于液相色谱串联质谱仪,且本实验前处理步骤更加简单快捷,各项参数均符合GB/T 27404—2008《实验室质量控制规范食品理化检测》[25]要求。
2.4 方法的准确度
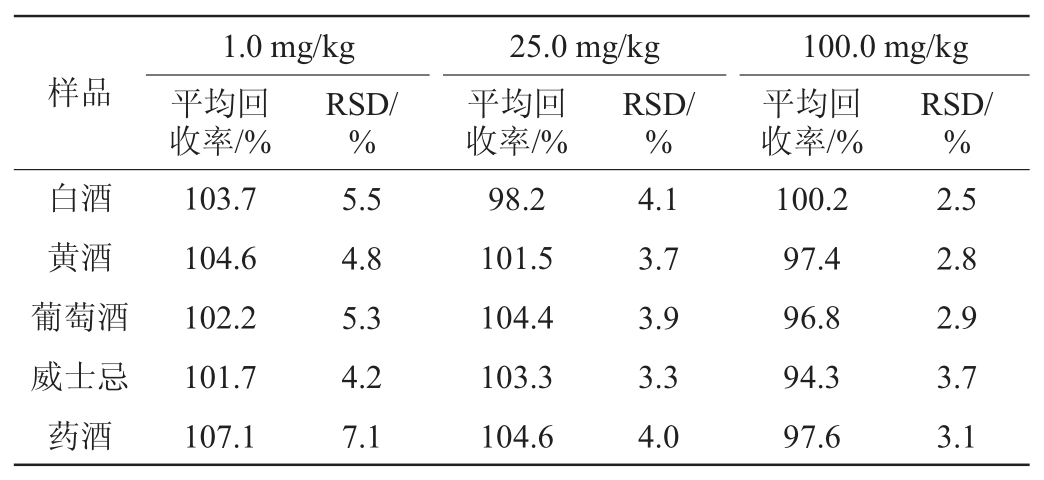
在不含甜蜜素的白酒、黄酒、葡萄酒、威士忌、药酒中进行3水平标准添加回收试验,添加水平分别为1.0 mg/kg、25.0 mg/kg、100.0 mg/kg,每个水平重复测定6次,通过加标回收率考察该方法的准确度。不同酒样中甜蜜素平均回收率及相对标准偏差(relative standard deviation,RSD)见表1。由表1可知,在以上5种不同样品基质中,做6次平行的加标回收率试验,甜蜜素的平均回收率在94.3%~107.1%,相对标准偏差(RSD)在2.5%~7.1%,均符合GB/T 27404—2008《实验室质量控制规范食品理化检测》[25]要求。
表1 不同饮用酒样中甜蜜素的平均加标回收率及准确度(n=6)
Table 1 Average standard recovery rate and accuracy degree of sodium cyclamate in different alcoholic drinks samples(n=6)
2.5 方法的精密度
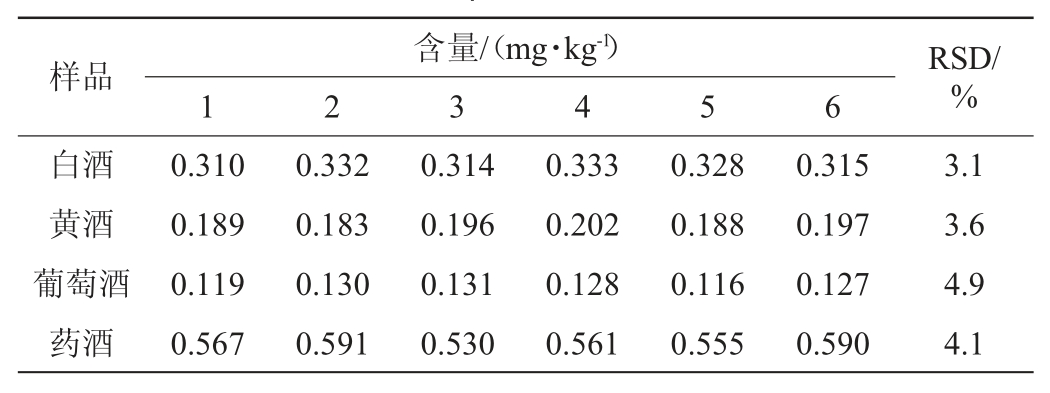
选取白酒、黄酒、葡萄酒和药酒甜蜜素阳性样品各一个,每个样品分别测定6次,考察方法的精密度,结果见表2。由表2可知,精密度试验结果的RSD为3.1%~4.9%,其结果符合GB/T 27404—2008《实验室质量控制规范食品理化检测》[25]要求。结果表明,本试验测定结果稳定、精密度良好,能满足酒中甜蜜素含量的检测要求。
表2 不同饮用酒样中甜蜜素含量测定的精密度试验结果
Table 2 Precision tests results of cyclamate detection in different alcoholic drinks samples
2.6 实际样品的测定
运用该方法对市售蒸馏酒、发酵酒、配制酒每个类别各取10个样品检测。由检验结果可知,待测的30个酒类样品中,蒸馏酒、发酵酒均未检出甜蜜素,1批次配制酒中检出了甜蜜素,含量为0.32 mg/kg,在国家标准GB 2760—2014《食品安全国家标准食品添加剂使用标准》[1]允许的范围内。
3 结论
本实验建立了顶空-气相色谱法快速测定酒类食品中甜蜜素的分析方法。样品经加热煮沸除杂、稀释定容、添加衍生试剂后衍生,衍生产物上机分析。甜蜜素在酒中对应含量为1~100 mg/kg时线性关系良好(R2=0.998 9),检出限和定量限分别为0.1 mg/kg和0.3 mg/kg,在低、中、高三个水平的回收率分别为94.3%~107.1%,相对标准偏差(RSD)为2.5%~7.1%(n=6),精密度试验结果RSD为3.1%~4.9%。该实验与已有的研究相比,简化了前处理步骤,检出限和标准曲线相关系数明显优于已有的研究。本实验通过顶空-气相色谱-质谱法对反应产物进行了验证。实验简单快捷,在前处理过程中未用到有机试剂,方法灵敏度、准确度、精密度均能满足检测要求,适合于饮用酒类中甜蜜素的大批量快速检测。
[1]中华人民共和国国家卫生和计划生育委员会.GB 2760—2014 食品安全国家标准食品添加剂使用标准[S].北京:中国标准出版社,2014.
[2]中华人民共和国国家卫生和计划生育委员会.GB 5009.97—2016 食品安全国家标准食品中环己基氨基磺酸钠的测定[S].北京:中国标准出版社,2016.
[3]YU S B,ZHU B H,LV F,et al.Rapid analysis of cyclamate in foods and beverages by gas chromatography-electron capture detector (GC-ECD)[J].Food Chem,2012,134(4):2424-2429.
[4]HASHEMI M,HABIBI A,JAHANSHAHI N.Determination of cyclamate in artificial sweeteners and beverages using headspace single-drop microextraction and gas chromatography flame-ionisation detection[J].Food Chem,2011,124(3):1258-1263.
[5]何亚芬,徐明生,黄道明,等.气相色谱法同时检测食品中9种常见食品添加剂[J].食品安全质量检测学报,2021,12(14):5684-5692.
[6]臧光楼,董明盛.白酒中甜蜜素检测方法的研究[J].食品科学,2009,30(10):261-264.
[7]何浩,吴海智,唐吉旺,等.顶空-气相色谱法快速测定食品中甜蜜素的含量[J].理化检验(化学分册),2020,56(1):112-115.
[8]马红,叶平,黄银波,等.气质联用法对食品中甜蜜素检测的定性定量分析[J].中国食品添加剂,2020,31(1):135-138.
[9]丁立平.气相色谱-质谱联用法测定酒类中的甜蜜素[J].酿酒科技,2011(12):101-103.
[10]王贵双,高丽华,赵俊平,等.气质联用技术测定食品中甜蜜素定性分析的探讨[J].中国酿造,2011,30(12):171-172.
[11]李羽翡,周春红.顶空气相色谱-质谱法测定甜蜜素初探[J].食品与发酵科技,2012,48(2):101-103.
[12]王菲.基于电喷雾质谱对白酒中甜蜜素检测技术的研究[D].银川:宁夏大学,2019.
[13]刘国英,胡艳丽,万春环,等.超高效液相色谱-三重四级杆串联质谱仪(UPLC-MS/MS)同时测定白酒中4种微量甜味剂[J].酿酒科技,2015(6):92-94.
[14]毛琼丽,李先芝,严玲,等.HPLC和HPLC-MS法检测配制酒中甜蜜素含量测量不确定度的比较研究[J].酿酒科技,2022(2):111-116.
[15]刘刚,雷激,钟红霞,等.高效液相色谱蒸发光散射法测定白酒中8种甜味剂的研究[J].食品科技,2017(7):300-304.
[16]吴小娟,刘芯韵,胡中海,等.柱前衍生-超高效液相色谱测定果酒中甜蜜素含量[J].食品与发酵科技,2018,54(6):105-108.
[17]王秀玲,叶升锋,桑华春.食品中甜蜜素的快速测定[J].食品研究与开发,2015(7):98-99.
[18]黄会秋.分光光度法间接测定白酒中甜蜜素[J].中国卫生检验杂志,2006,16(9):1073-1074.
[19]陈桐,丁晓静,李一正,等.毛细管区带电泳-间接紫外法快速测定食品中的甜蜜素[J].色谱,2014,32(6):666-671.
[20]刘志鹏,杨李胜,王小鹏,等.基于气相色谱法测定食品中甜蜜素的碱性水解法研究[J].食品研究与开发,2021,42(10):154-158.
[21]唐吉旺,袁列江,肖泳,等.固相萃取-高效液相色谱-质谱联用法同时测定食品中9种人工合成甜味剂[J].色谱,2019,37(6):619-625.
[22]杨小玉,王玉红,王彦,等.核壳型色谱柱-反相高效液相色谱-蒸发光散射检测法同时测定饮料中5种人工合成甜味剂[J].食品工业科技,2016,37(3):312-316,322.
[23]李秀勇.色谱法在食品分析中的应用研究[D].兰州:兰州大学,2008.
[24]江丰,彭青枝,汪志慧,等.顶空-气相色谱法测定食品中的甜蜜素[J].食品研究与开发,2014(23):104-107,108.
[25]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 27404—2008 实验室质量控制规范食品理化检测[S].北京:中国标准出版社,2008.