细菌纤维素(bacterial cellulose,BC)是一种由β-1,4葡萄糖苷键连接而成的生物高分子聚合物。BC与植物纤维结构相似,因其具有高纯度、高聚合度、高结晶度、高持水性、高抗张强度和生物相容性好等特点[1],已被广泛应用于食品[2-3]、造纸[4]、生物医药[5-6]和纺织品[7-8]等领域。常见的细菌纤维素发酵菌属有醋酸菌属(Acetobacter)[9]、根瘤菌属(Rhizobium)[10]和土壤杆菌属(Agrobacterium)[11]等。目前,已有大量文献采用优良菌株选育[12-14]、发酵工艺优化[15]、生物合成调控[16]等方法来提高细菌纤维素产量,但细菌纤维素产量仍然偏低,生产成本较高,难以满足工业化生产的要求,而静态培养法有培养方法简单、产品性能优异、产品形状可控等优点,是细菌纤维素制备的首选方法[17]。
我国的烟叶种植面积超过100万hm2,年均产生的烟草废弃物(低次烟叶、茎秆、杈烟等)多达400万t[18],其处理方式大多为随意丢弃或者集中焚烧销毁,造成了较大的环境污染和资源浪费[19]。因此,开发利用废弃烟末进行细菌纤维素生产,对其培养基组分及发酵条件进行优化是提高细菌纤维素产量、降低生产成本的有效途径[20]。张婷婷等[21]开发了利用废弃烟末发酵制备细菌纤维素的技术,并对接种量、温度、pH和发酵时间等条件进行优化。由烟草废弃物制备细菌纤维素虽然已经实现,但烟草原料中烟碱等物质对菌体生长及BC合成有一定的抑制作用,使其产量较低,烟草废弃物的利用率仅为2%左右。因此,提高烟草废弃物的利用率,对环境保护具有重要意义。
本研究以木醋杆菌(Acetobacter xylinum)为试验菌株,采用静态发酵的方式,对烟草废弃物进行发酵制备细菌纤维素,通过单因素试验和Box-Behnken试验对烟草发酵培养基组分进行优化,以期提高细菌纤维素产量,为后续细菌纤维素的放大生产奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与材料
木醋杆菌(Acetobacter xylinum)ATCC 23767:由郑州轻工业大学食品与生物工程学院生物催化与转化实验室保藏;烟末废弃物:由贵州中烟工业有限公司提供。
1.1.2 试剂
酵母浸粉(生化试剂):北京奥博星生物技术有限责任公司;无水葡萄糖(分析纯):天津市致远化学试剂有限责任公司;无水乙醇、乳酸(均为分析纯):天津市富宇精细化工有限责任公司;蛋白胨(生化试剂)、水杨酸、草酸、苹果酸、延胡索酸(均为分析纯):上海麦克林生化科技有限公司;氢氧化钠、硫酸铵、硝酸铵、柠檬酸(均为分析纯):天津市登科化学试剂有限公司。
1.1.3 培养基
种子培养基:葡萄糖70 g/L、酵母粉10 g/L、磷酸二氢钾1 g/L,115 ℃灭菌20 min,冷却后添加1%(V/V)无水乙醇。
烟草发酵培养基:烟末100 g,以固液比为1∶10(g∶mL)加水,60 ℃浸提1.5 h后过滤,取滤液,于121 ℃灭菌20 min。
1.2 仪器与设备
SW-CJ-ID超净工作台:苏州净化有限公司;UV-1800PC型紫外可见分光光度计:上海美谱达仪器有限公司;GR85DA高压蒸汽灭菌锅:致微(厦门)仪器有限公司;ZQWY-200S卧式全温振荡培养箱:上海知楚仪器有限公司;SHP-150生化培养箱:上海森信实验仪器有限公司。
1.3 方法
1.3.1 细菌纤维素的制备
从-80 ℃冰箱中取保藏的菌液100 μL,接种至装液量为50 mL/250 mL的种子培养基中,于30 ℃、200 r/min条件下培养24 h,制成种子液。将种子液以10%(V/V)的接种量接种于装液量为150 mL/500 mL的烟草发酵培养基中,30 ℃恒温静置培养7 d后即可制得细菌纤维素膜。
1.3.2 细菌纤维素的纯化处理
将静置发酵7 d后获得的BC膜取出,浸泡至0.1 mol/L的NaOH溶液中,于沸水浴加热1 h,以除去残留在纤维素膜表面的菌体及发酵液,然后用蒸馏水反复洗涤至BC膜至中性。经过纯化处理的BC用于产量测定及持水性能分析。
1.3.3 发酵培养基组分优化单因素试验
以细菌纤维素产量为评价指标,分别选择培养基的氮源种类(蛋白胨、酵母粉、硫酸铵和硝酸铵)及氮源添加量(0、1 g/L、2 g/L、3 g/L和4 g/L)、乙醇体积分数(0、0.5%、1.0%、1.5%、2.0%、3.0%和4.0%)、有机酸种类(柠檬酸、水杨酸、草酸、苹果酸、延胡索酸、乳酸)及有机酸添加量(0、0.25 g/L、0.50 g/L、0.75 g/L、1.00 g/L和1.25 g/L)进行单因素试验优化。培养基组分优化单因素试验中,所有试验因素空白组均为未添加该因素的烟草发酵培养基,试验组为添加该因素的烟草发酵培养基。
1.3.4 发酵培养基组分优化Box-Behnken试验
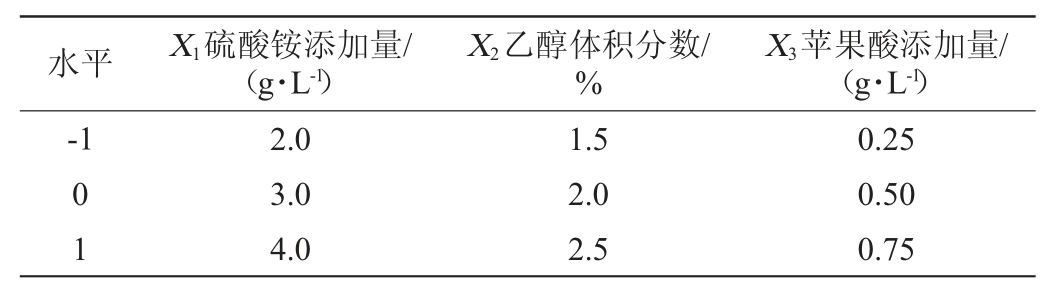
在单因素试验的基础上,选择硫酸铵添加量(A)、乙醇体积分数(B)和苹果酸添加量(C)3个对细菌纤维素产量影响明显的因素为自变量,以细菌纤维素产量(Y)为响应值,采用Design Expert 10.0.8软件设计3因素3水平的Box-Behnken试验,试验因素及水平见表1。
表1 培养基组分优化Box-Behnken试验因素与水平
Table 1 Factors and levels of Box Behnken tests for medium components optimization
1.3.5 细菌纤维素产量计算及持水性能的测定
纯化处理后的BC膜经4 000 r/min离心20 min,定义为湿膜,记为W湿;将80℃下烘干至恒质量的细菌纤维素膜定义为干膜,记为W干;在常温环境下将干膜浸入去离子水中,浸泡48h后用滤纸吸干表面水分,所得膜定义为复水膜,记为W复。
按公式(1)计算BC的产量,分别按公式(2)~(4)计算BC的含水率、复水率和溶胀率。
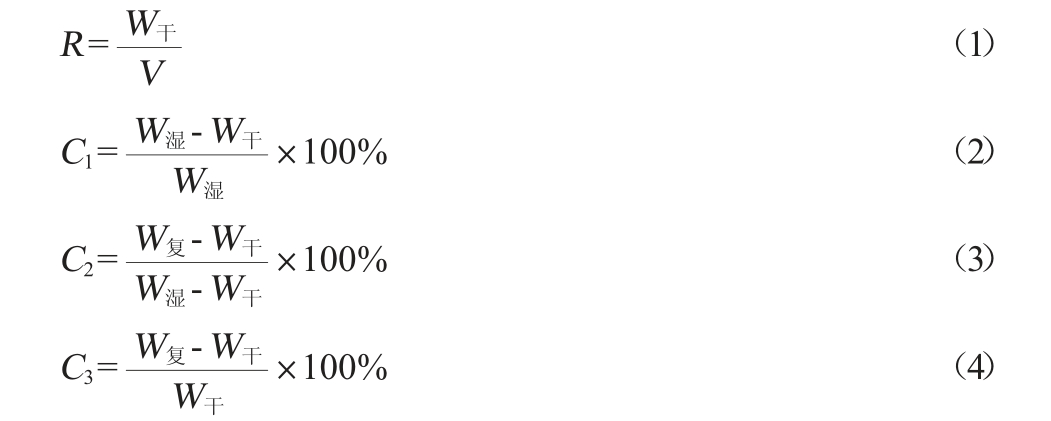
式中:R为细菌纤维素产量,g/L;V为发酵液体积,L;C1为湿膜含水率,%;C2为干膜复水率,%;C3为溶胀率,%。
1.3.6 数据处理
所有试验均重复3次,数据采用SPSS19.0和Origin2019进行分析和作图。
2 结果与分析
2.1 发酵培养基组分优化单因素试验结果
2.1.1 氮源种类及添加量对细菌纤维素产量的影响
氮源是菌体合成蛋白质、氨基酸及核酸等含氮物质的来源。菌株发酵生产细菌纤维素的过程中,充足的氮源不仅能够为菌体生长提供氮元素,还能够作为细菌纤维素合成相关酶的辅助因子[22]。本试验考察了外源添加蛋白胨、酵母粉、硫酸铵和硝酸铵4种氮源对细菌纤维素产量的影响,氮源种类及添加量对细菌纤维素产量的影响见图1。
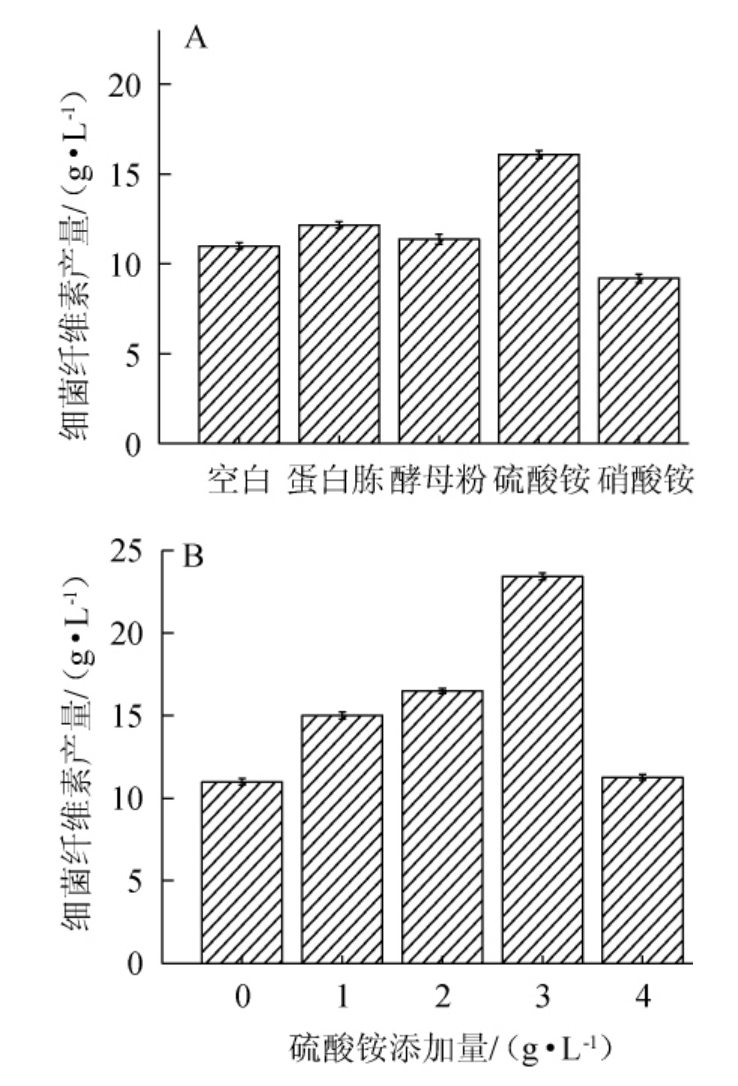
图1 氮源种类(A)及硫酸铵添加量(B)对细菌纤维素产量的影响
Fig.1 Effect of nitrogen sources (A) and ammonium sulfate addition(B) on bacterial cellulose production
由图1A可知,硫酸铵对细菌纤维素的产量提升效果最明显,细菌纤维素产量为16.09g/L。因此,选择硫酸铵为最佳氮源。由图1B可知,随着硫酸铵添加量在0~3 g/L范围内不断增加,细菌纤维素产量逐渐上升;当硫酸铵添加量达到3 g/L时,细菌纤维素产量最高,为23.44 g/L;随着硫酸铵添加量在3~4 g/L范围继续增加,细菌纤维素产量降低。因此,选择硫酸铵的最适添加量为3 g/L。
2.1.2 乙醇体积分数对细菌纤维素产量的影响
在添加乙醇的情况下,乙醇作为额外碳源,会使微生物对葡萄糖的消耗减少,使得更多的葡萄糖可以用于BC的合成[23],从而提高BC的产量。许燕娜等[24]认为,木醋杆菌可以将乙醇转化为乙酸,再将乙酸分解为二氧化碳和水,从而提高三磷酸腺苷水平,进而提高细菌纤维素的产量。乙醇体积分数对细菌纤维素产量的影响见图2。
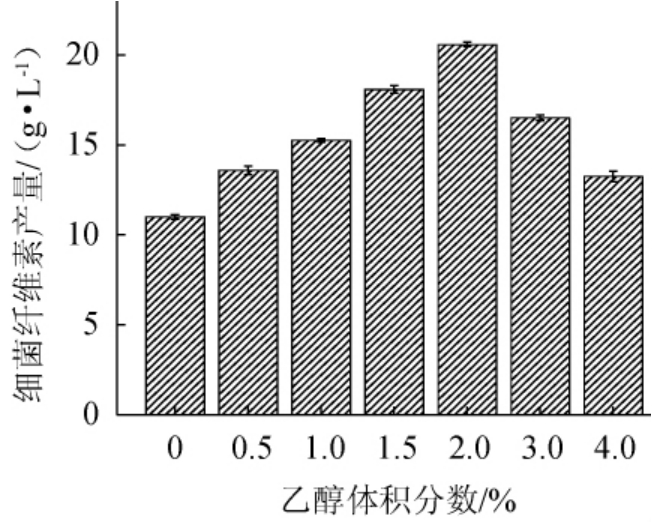
图2 乙醇体积分数对细菌纤维素产量的影响
Fig.2 Effect of ethanol volume fraction on bacterial cellulose production
由图2可知,随着乙醇体积分数在0~2%范围内的增加,细菌纤维素产量逐渐增加;当乙醇体积分数为2%时,细菌纤维素产量达到最大值,达到20.58 g/L,促进效果较为明显;但当乙醇体积分数继续增加,细菌纤维素产量降低。因此,选择最佳乙醇体积分数为2%。
2.1.3 有机酸种类及添加量对细菌纤维素产量的影响
有机酸种类及添加量对细菌纤维素产量的影响见图3。
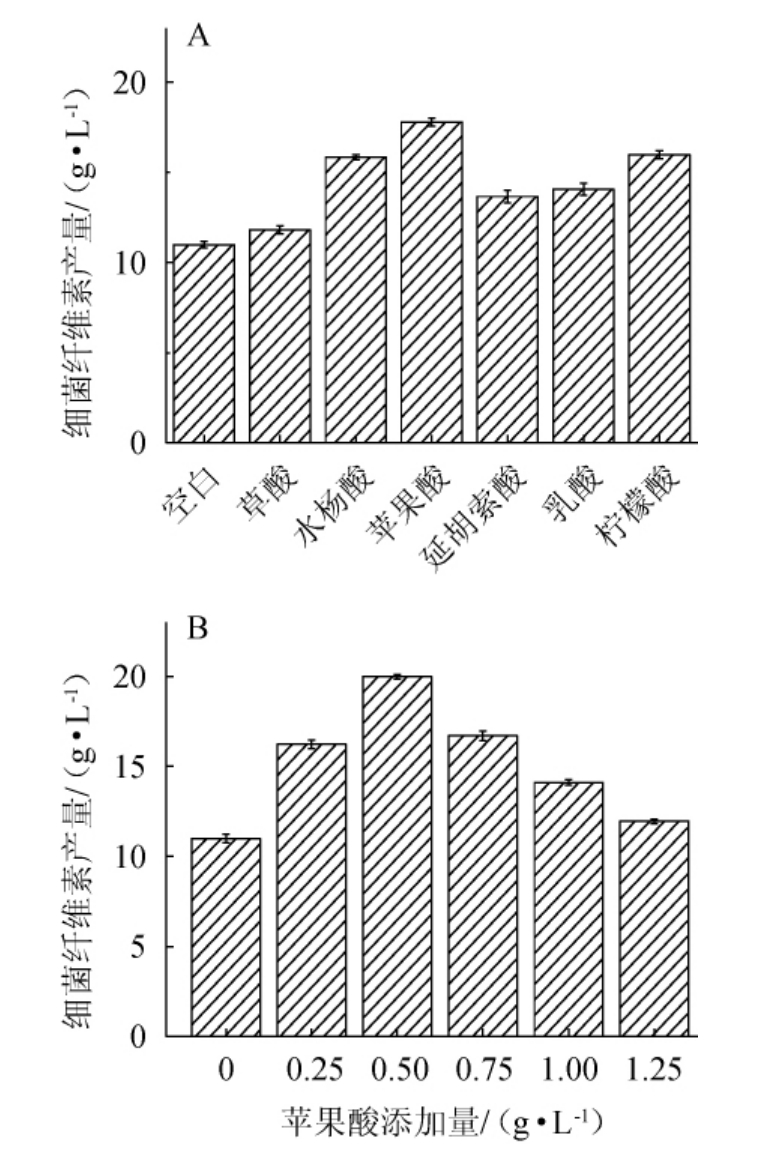
图3 有机酸种类(A)及苹果酸添加量(B)对细菌纤维素产量的影响
Fig.3 Effect of types of organic acids (A) and malic acid addition (B)on bacterial cellulose production
由图3A可知,添加有机酸类物质对木醋杆菌生产BC都有促进作用,其中苹果酸促进作用最强,其BC产量为17.79 g/L。贾青慧等[25]研究发现,发酵过程中葡萄糖酸和乙酸在一定范围内有利于木醋杆菌合成BC;钱子俊等[26]研究发现,柠檬酸对BC产量具有一定促进作用;李珏等[27]研究发现,乙酸代替柠檬酸作为有机酸成分加入发酵培养基时,可提高BC合成量。可见,有机酸是BC合成过程中常见的发酵促进因子,但由于菌种等不同,各种有机酸的效果存在较大差异。由图3B可知,随着苹果酸添加量在0~0.5 g/L范围内增加,细菌纤维素产量逐渐增加;当苹果酸添加量为0.5 g/L时,细菌纤维素产量达到最高值,为19.98 g/L;当苹果酸添加量>0.5 g/L,细菌纤维素产量逐渐下降。BC的合成过程中需要大量能量,有机酸类物质可通过氧化生成丙酮酸,参与细胞代谢并产生能量,较多的能量可以促进BC的合成[28]。随着苹果酸添加量持续增加,反馈抑制增强,菌体的生长受到抑制,使细菌纤维素产量有所降低[29]。
2.2 发酵培养基组分优化响应面试验结果
2.2.1 响应面试验设计及结果
在单因素试验结果的基础上,以细菌纤维素产量(Y)为响应值,以对细菌纤维素产量有明显影响的3个因素硫酸铵添加量(X1)、乙醇体积分数(X2)和苹果酸添加量(X3)为自变量,采用Design Expert 10.0.8软件进行Box-Behnken试验,试验设计及结果见表2,方差分析结果见表3。
表2 培养基组分优化Box-Behnken试验设计及结果
Table 2 Design and results of Box Behnken tests for medium component optimization

表3 回归模型方差分析
Table 3 Variance analysis of regression model
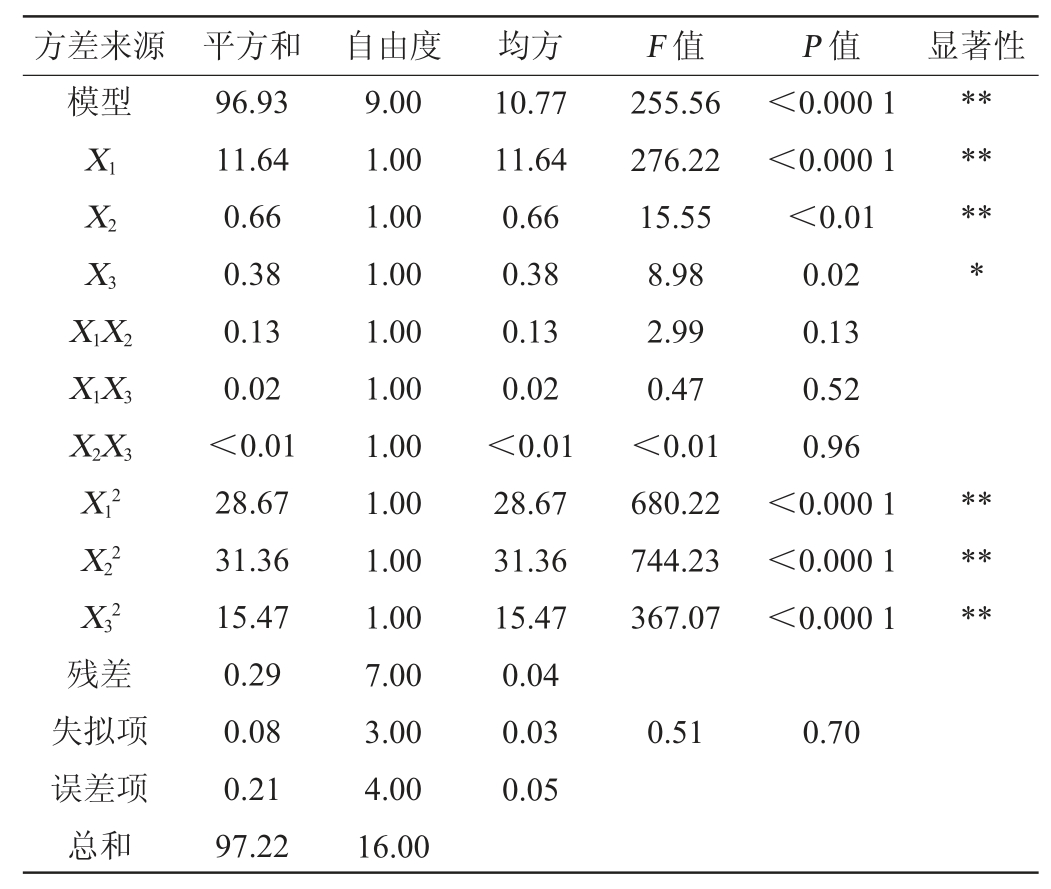
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
运用Design Expert 10.0.8软件对表2的数据进行二次多项拟合,得到响应值与各因素之间的回归方程:Y=33.86+1.21X1+0.29X2+0.22X3+0.18X1X2+0.07X1X3-0.005X2X3-2.61X12-2.73X22-1.92X32
由表3可知,回归模型极显著(P<0.01);失拟项不显著(P值=0.7>0.05),表明该模型具有较高可靠性,与实际情况拟合程度良好。该模型的决定系数R2=0.993 0,调整决定系数R2Adj=0.993 0,表明此模型方程是可靠的,用该方程进行分析和预测,预测值与实际测定值之间相关性较高。由表3亦可知,一次项X1、X2和二次项X12、X22和X32均对细菌纤维素产量有极显著影响(P<0.01),一次项X3对细菌纤维素产量有显著影响(P<0.05),其他项对结果影响不显著(P>0.05)。由F值可知,各因素对细菌纤维素产量影响强弱顺序依次为X1(硫酸铵添加量)>X2(乙醇体积分数)>X3(苹果酸添加量)。
2.2.2 验证试验
通过Design Expert 10.0.8软件得到烟草发酵培养基组分的最佳配方为:硫酸铵添加量3.234 g/L,乙醇体积分数2.030%,苹果酸添加量0.515 g/L。在此优化条件下,细菌纤维素产量理论值为33.83 g/L。在实际发酵过程中,考虑到实际操作可行性,将烟草发酵培养基组分的最佳配方调整为:硫酸铵添加量3.2 g/L,乙醇体积分数2.0%,苹果酸添加量0.5 g/L。在此最优发酵培养基组合下进行3次平行试验,细菌纤维素产量实际值为32.27 g/L,实际值与理论值差异不大,充分证明该模型的准确性与实用性,细菌纤维素产量是优化前的2.74倍。
2.3 细菌纤维素的持水性能测定结果
细菌纤维素的持水性能经常用含水率和复水率来表示[30],将烟草发酵培养基优化前后的细菌纤维素进行持水性能测定,其含水率、复水率和溶胀率结果见表4。
表4 培养基优化前后细菌纤维素的持水性能测定结果
Table 4 Determination results of water holding capacity of bacterial cellulose before and after medium optimization

由表4可知,与优化前培养基相比,优化后培养基的细菌纤维素含水率(94.35%)相差不大,但复水率(40.30%)和溶胀率(673.56%)分别增加了8%和2%。
3 结论
以木醋杆菌(Acetobacter xylinum)为试验菌株,静态发酵烟草废弃物制备细菌纤维素,最佳烟草发酵培养基配方为:硫酸铵添加量3.2 g/L,苹果酸添加量0.5 g/L,体积分数2%的乙醇。在此最佳条件下,细菌纤维素的产量为32.27 g/L,是优化前烟草发酵培养基的2.74倍。优化后烟草发酵培养基制备的细菌纤维素含水率为94.35%,其复水率和溶胀率分别为40.30%和673.56%,与优化前培养基的细菌纤维素相比,含水率相差不大,而复水率和溶胀率均有所增加。
[1]刘新华,李永,储兆洋,等.细菌纤维素气凝胶ARGET ATRP接枝聚甲基丙烯酸缩水甘油酯[J].高分子材料科学与工程,2018,34(2):14-18.
[2]KUSWANDI B,ASIH N P N,PRATOKO D K,et al.Edible pH sensor based on immobilized red cabbage anthocyanins into bacterial cellulose membrane for intelligent food packaging[J].Packag Technol Sci,2020,33(8):321-332.
[3]CAO Y,LU S,YANG Y.Production of bacterial cellulose from byproduct of citrus juice processing(citrus pulp)by Gluconacetobacter hansenii[J].Cellulose,2018,25(12):6977-6988.
[4]韩国程,郭蕊,俞朝晖.细菌纳米纤维素在造纸工业中的应用[J].化工新型材料,2021,49(1):52-55.
[5]罗争辉,张家平.细菌纤维素复合抗菌敷料的研究进展[J].中华烧伤杂志,2018,34(5):314-317.
[6]GORGIEVA S.Bacterial cellulose as a versatile platform for research and development of biomedical materials[J].Processes,2020,8(5):624-650.
[7]张蒙,徐阳.细菌纤维素原位复合二醋酸纤维的制备及其表征[J].材料科学与工程学报,2021,39(1):130-134.
[8]陈嘉艾.细菌纤维素在服装设计中的应用与研究[D].大连:大连工业大学,2020.
[9]MACHADO R T A,GUTIERREZ J,TERCJAK A,et al.Komagataeibacter rhaeticus as an alternative bacteria for cellulose production[J].Carbohyd Polym,2016,152:841-849.
[10]LAUS M C,VAN BRUSSEL A A N,KIJNE J W.Role of cellulose fibrils and exopolysaccharides of Rhizobium leguminosarum in attachment to and infection of Vicia sativa root hairs[J].Mol Plant Microb Int,2005,18(6):533-538.
[11]郑梅霞,刘波,朱育菁,等.细菌纤维素的生物合成及在食品工业的应用[J].食品安全质量检测学报,2019,10(19):6412-6421.
[12]TANSKUL S,AMORNTHATREE K,JATURONLAK N.A new cellulose-producing bacterium, Rhodococcus sp.MI 2: Screening and optimization of culture conditions[J].Carbohyd Polym,2013,92(1):421-428.
[13]张晓敏.产细菌纤维素菌株选育及其发酵工艺优化和细菌纤维素的应用研究[D].福州:福建师范大学,2014.
[14]SETO A,KOJIMA Y,TONOUCHI N,et al.Screening of bacterial cel-lulose-producing Acetobacter strains suitable for sucrose as a carbon source[J].Biosci Biotechnol Biochem,1997,61(4):735-736.
[15]CHAWLA P R,BAJAJ I B,SURVASE S A,et al.Microbial cellulose:fermentative production and applications[J].Food Technol Biotech,2009,47(2):107-124.
[16]LEE K Y,BULDUM G,MANTALARIS A,et al.More than meets the eye in bacterial cellulose: biosynthesis,bioprocessing,and applications in advanced fiber composites[J].Macromol Biosci,2014,14(1):10-32.
[17]APRIYANA A Y.Production of bacterial cellulose from tofu liquid waste and rice-washed water:morphological property and its functional groups analysis[C]//IOP Conference Series: Earth and Environmental Science.IOP Publishing,2020,483(1):012005.
[18]张豪洋,党炳俊,金依楠,等.烟草废弃物中烟碱生物调控的研究进展[J].环境污染与防治,2021,43(6):772-778.
[19]BORZANI W,DE SOUZA S J.Mechanism of the film thickness increasing during the bacterial production of cellulose on non-agitaded liquid media[J].Biotechnol Lett,1995,17(11):1271-1272.
[20]赵航,陈沙,张璇,等.葡糖醋杆菌J2-1静态发酵生产细菌纤维素的培养基优化[J].中国酿造,2020,39(5):152-156.
[21]张婷婷,冯颖杰,杨宗灿,等.利用废烟末发酵制备细菌纤维素[J].食品与机械,2020,36(6):198-202.
[22]RANI M U,APPAIAH K A.Production of bacterial cellulose by Gluconacetobacter hansenii UAC09 using coffee cherry husk[J].J Food Sci Tech Mys,2013,50(4):755-762.
[23]HYUN J Y,MAHANTY B,KIM C G.Utilization of makgeolli sludge filtrate(MSF)as low-cost substrate for bacterial cellulose production by Gluconacetobacter xylinus[J].Appl Biochem Biotech,2014,172(8):3748-3760.
[24]许燕娜,张剑恩,黎嘉惠,等.Acetobacter xylinum CGMCC5173发酵生产细菌纤维素的条件优化[J].现代食品科技,2012,28(11):1535-1540.
[25]贾青慧,卢红梅,陈莉,等.增效因子对木醋杆菌产细菌纤维素发酵液中物质变化的影响[J].中国酿造,2016,35(1):14-18.
[26]钱子俊,张一瞳,刘鹏,等.不同添加剂对木醋杆菌发酵细菌纤维素的影响[J].林业工程学报,2018,3(4):62-67.
[27]李珏,董梦娜,吴延鸽,等.葡糖酸醋杆菌JR-02产细菌纤维素发酵工艺优化[J].中国酿造,2018,37(3):42-48.
[28]YANG X Y,HUANG C,GUO H J,et al.Beneficial effect of acetic acid on the xylose utilization and bacterial cellulose production by Gluconacetobacter xylinus[J].Indian Microbiol,2014,54(3):268-273.
[29]尹园,马佳歌,倪春蕾,等.居间驹形氏杆菌发酵大豆糖蜜生产细菌纤维素条件的优化[J].食品科学,2017,38(18):8-16.
[30]CHENG K C,CATCHMARK J M,DEMIRCI A.Effect of different additives on bacterial cellulose production by Acetobacter xylinum and analysis of material property[J].Cellulose,2009,16(6):1033-1045.