玫瑰香葡萄(Muscat)属于麝香类葡萄,是昌黎产区特色葡萄品种之一,由其酿造的玫瑰香葡萄酒也因其特殊的麝香风味而广受欢迎[1]。基于健康和消费者的多元化需求,低酒度葡萄酒产品越来越备受关注。但目前采用常规脱醇或降醇方法生产的低酒度葡萄酒,品种香气损失严重,严重影响了葡萄酒的风味和品质[2]。已有研究表明,优选本土非酿酒酵母与酿酒酵母(Saccharomyces cerevisiae)混菌发酵,可突出葡萄酒的品种特色和区域特征,是改善葡萄酒风味特征的重要途径[3-5]。
目前,已有多种非酿酒酵母被用于葡萄酒降醇的研究[6-8],并获得了一定的降醇效果,例如泽姆普林假丝酵母(Candida zemplinina)[9]、美极梅奇酵母(Metschnikowia pul-cherrima)[10]、葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)[11]等。M.pulcherrima具有低产乙醇、增加葡萄酒甘油含量、降低乙酸产量、改善葡萄酒风味、提高葡萄酒品质等优良的酿造特性[10,12]。此外,M.pulcherrima具有丰富的胞外酶尤其是β-葡萄糖苷酶活性[13],有助于葡萄品种香气物质如萜烯、硫醇类物质的释放,对于改善葡萄酒的风味具有很大的积极作用[14]。但M.pulcherrima混菌发酵的降醇效果及其对葡萄酒风味的改善作用,具有较大的菌株差异,同时还取决于发酵条件[15-16]。因此,开展M.pulcherrima的优选、发酵条件的优化及其对葡萄酒风味的具体影响及其影响机制的研究,仍是目前M.pulcherrima菌剂资源开发和应用领域重点研究内容之一。
为获得品种特色突出的低酒度玫瑰香葡萄酒,本研究通过比较分析6株本土M.pulcherrima菌株单菌发酵动力学、降醇效果及其他理化指标,从中筛选降醇效果较好的菌株与商用酿酒酵母F33顺序发酵玫瑰香低酒精度葡萄酒,评估本土M.pulcherrima与商用酿酒酵母F33顺序发酵对玫瑰香葡萄酒酒精含量及香气的的影响,以期为特色低酒度玫瑰香葡萄酒的酿造提供菌剂资源。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
玫瑰香葡萄,2020年10月采自昌黎葡萄沟(中国),含糖量为169.80 g/L,可滴定酸含量为5.20 g/L(以酒石酸计),pH 3.21。
1.1.2 菌株
商业酿酒酵母ACTIFLORE F33:法国LAFFORT公司;本土美极梅奇酵母(M.pulcherrima)(Mp04、Mp07、Mp08、Mp09、Mp10、Mp17):均保藏于河北科技师范学院食品科技学院。
1.1.3 培养基
酵母浸出粉葡萄糖培养基(yeastextractpeptonedextrose,YPD)[17]:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸粉10 g/L。115 ℃高压蒸汽灭菌20 min。固体培养基中添加琼脂20 g/L。
模拟葡萄汁培养基:上海哈灵生物科技有限公司。
1.1.4 主要试剂
蛋白胨、酵母浸粉(均为生化试剂):北京奥博星生物技术有限责任公司;葡萄糖、果糖(均为分析纯):天津欧博凯化工有限公司;偏重亚硫酸钾、甘油、乙醇(均为分析纯):天津市风船化学试剂有限公司;酒石酸钾钠(分析纯):国药集团化学试剂有限公司;果胶酶(50 000 U/mL):河南万邦实业有限公司;2-辛醇(纯度≥98%):上海易恩化学技术有限公司。
1.2 仪器与设备
V1800紫外可见分光光度计:尤尼柯(上海)仪器有限公司;YXQ-LS50S立式压力蒸汽灭菌器、SPX-250B-Z生化培养箱:上海博迅实业有限公司;BS-2F数显恒温振荡培养箱:金坛区水北科普实验仪器厂;Agilent 1200高效液相色谱(high performance liquid chromatography,HPLC)仪、7890B-5977气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)仪:美国Agilent公司;100 μm PDMS固相微萃取针头:美国Supelco公司。
1.3 试验方法
1.3.1 玫瑰香葡萄汁的制备
将玫瑰香葡萄分选、除杂、去梗、破碎后装瓶,经过巴氏灭菌(60 ℃灭菌30 min)后,待温度降至28 ℃,加入50 mg/L SO2和20 mg/L果胶酶,置于4 ℃冰箱静置12 h左右备用。
1.3.2 美极梅奇酵母单菌发酵
将斜面保藏的商业酿酒酵母F33(对照)和6株不同的本土M.pulcherrima(Mp07、Mp04、Mp17、Mp08、Mp09和Mp10)分别接种于YPD液体培养基中,于28 ℃、100 r/min条件下恒温振荡培养24 h后,以106 CFU/mL的接种量接入含有200 mL玫瑰香葡萄汁的带有橡胶塞和玻璃发酵栓的500 mL锥形瓶中,每个菌株设置3个生物学重复。25 ℃静置发酵,每天监测CO2的质量损失,若CO2质量损失连续2 d变化<0.2 g/100 mL,则视为发酵结束。发酵结束后,取发酵液4 ℃离心10 min(6 000 r/min),取上清液测定乙醇、果糖、葡萄糖、甘油含量。
1.3.3 美极梅奇酵母与商业酿酒酵母顺序接种发酵
取Mp04、Mp17和Mp08活化液,分别以107 CFU/mL的接种量接入含有3 L玫瑰香葡萄汁的5 L玻璃罐中,每个实验组设置3个生物学重复。25 ℃静置发酵3 d后,以106CFU/mL的接种量接种商业酿酒酵母F33,25 ℃静置发酵,以未接种美极梅奇酵母的样品为对照,当残糖量<4 g/L时视为发酵结束。发酵结束后,测定各玫瑰香葡萄原酒(F33、Mp04/F33、Mp08/F33、Mp17/F33)的理化指标,并采用GC-MS法测定玫瑰香葡萄酒的挥发性香气成分。
1.3.4 测定方法
乙醇、葡萄糖、果糖、甘油含量:采用HPLC法进行测定[18],并计算乙醇产量、产率、残糖量,其计算公式如下:

总酸、挥发酸、干浸出物、总硫含量:参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》测定;总酚含量:参考文献[19]进行测定;总糖含量:参考文献[20]进行测定。
1.3.5 玫瑰香葡萄原酒挥发性成分测定
使用GC-MS法测定玫瑰香葡萄原酒中的挥发性物质[21]。
GC条件:HP-5MS(5 m×0.25 mm×0.25 μm)毛细管色谱柱,载气为高纯氦气(He)(纯度99.999%),流速1 mL/min。进样口温度45 ℃。升温程序:45 ℃保持2 min,以3 ℃/min的速度升温至84 ℃,保持2 min;以3 ℃/min的速度升温至120 ℃,保持3 min,以3 ℃/min的速度升温至200 ℃,再以5 ℃/min的速度升温至230 ℃。
MS条件:质谱接口温度为280 ℃,离子源温度为230 ℃,电子电离(electron ionization,EI)源,电子能量70 eV,质量扫描范围为30~350 m/z。
定性定量方法:检测出的未知化合物经计算机检索与美国国家标准技术研究所(national institute of standards and technology,NIST)library、Wileylibrary相匹配,选择匹配度>85%的物质作为有效香气成分,结合文献中的保留指数进行香气物质的定性;以2-辛醇为内标(质量浓度0.2 mg/mL),按内标法计算各成分质量浓度实现定量。
1.3.6 数据处理
使用Excel 2019进行数据统计;使用SPSS 21.0进行数据的显著性分析;采用Origin 2019b进行主成分分析(principle component analysis,PCA)并作图;采用TBtools软件绘制样品中挥发性成分差异热图[22]。
2 结果与分析
2.1 美极梅奇酵母单菌发酵玫瑰香葡萄汁过程分析
不同单菌株发酵玫瑰香葡萄汁CO2质量损失曲线见图1。
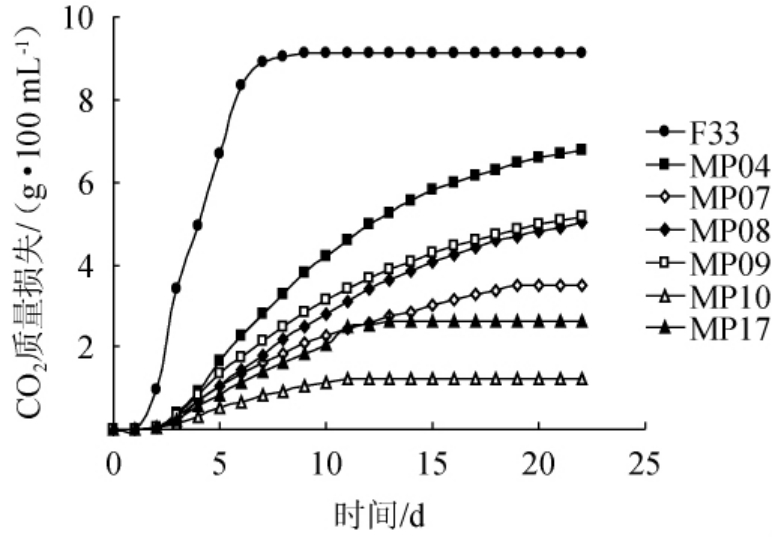
图1 不同单菌株发酵玫瑰香葡萄汁过程中CO2质量损失的变化
Fig.1 Changes of CO2 mass loss during Muscat juices fermentation by different single strains
由图1可知,商用酿酒酵母F33单菌发酵速度远高于M.pulcherrima,能在发酵第8天达到发酵终点,最高CO2质量损失为2.46 g/100 mL。不同M.pulcherrima发酵能力和发酵速度具有很大差异,其中,M.pulcherrima Mp04、Mp08和Mp09发酵速度最快,最大CO2质量损失在0.4~0.8 g/100 mL,且均在20 d左右完成发酵;M.pulcherrima Mp10发酵能力最弱,最大CO2质量损失为0.19 g/100 mL,发酵第12天停止发酵。
单菌株发酵玫瑰香葡萄汁结束后,测定各项理化指标,结果见表1。由表1可知,6株M.pulcherrima单菌发酵能力较弱,发酵停止时残糖量均>4 g/L,与图1结果和文献报道M.pulcherrima不能单独完成发酵的结果一致[19]。由于M.pulcherrima不能单独完成整个发酵,发酵液中仍有大量残糖,导致非酿酒酵母发酵液中酒精度较低,这不足以说明M.pulcherrima低产乙醇的酿造特性。因此,本研究参考文献[18]引入了乙醇产率,以评价非酿酒酵母产乙醇的特性。不同M.pulcherrima的甘油和乙醇合成能力不同,甘油含量为1.72~3.93 g/L,均低于商业酿酒酵母F33(6.05 g/L)。乙醇产率介于27.49%~36.37%,均低于商业酿酒酵母F33(45.51%),其中乙醇产率最低的4株M.pulcherrima依次为Mp10(27.49%)、Mp08(31.33%)、Mp17(32.80%)、Mp04(32.95%)。而菌株Mp10由于发酵能力较弱,残糖含量较高,故舍去。综合乙醇产率对比分析,认为菌株Mp04、Mp08和Mp17发酵能力较强,降醇效果较好。
表1 不同单菌株发酵玫瑰香葡萄汁前后理化指标的测定结果
Table 1 Determination results of physicochemical indexes Muscat juice before and after fermentation by different single strains

注:同列肩不同小写字母表示差异显著(P<0.05)。
2.2 美极梅奇酵母与商业酿酒酵母F33顺序发酵玫瑰香葡萄原酒分析
2.2.1 玫瑰香葡萄原酒的理化指标
玫瑰香葡萄原酒的理化指标见表2。由表2可知,与商业酿酒酵母F33单菌发酵相比,M.pulcherrima与商业酿酒酵母F33顺序发酵,降低了玫瑰香葡萄原酒的甘油含量,这与部分文献报道不符[23-25],分析认为可能与菌株和发酵条件的差异有关。所有M.pulcherrima与商业酿酒酵母F33顺序发酵均具有一定降醇作用,乙醇含量降低了0.38%vol~1.93%vol,降醇效果差异显著(P<0.05),Mp17/F33酒样中乙醇含量最低(6.62%vol)。M.pulcherrima与商业酿酒酵母F33顺序发酵提高了挥发酸含量,与部分文献报道不符[2,10],分析可能与菌株和发酵条件有关。挥发酸含量均在国标GB/T15037—2006《葡萄酒》规定的范围内(≤1.2 g/L),对葡萄酒的风味不会产生不良影响。M.pulcherrima与商业酿酒酵母F33顺序发酵均显著增加了总酚含量,较商业酿酒酵母F33单菌发酵提高6.36%~24.12%,其中,Mp04/F33酒样中总酚含量增加最高,分析可能与M.pulcherrima具有丰富的胞外酶活性有关,增加了葡萄皮中酚类物质的浸出率[26]。M.pulcherrima与商业酿酒酵母F33顺序发酵对玫瑰香葡萄酒的干浸出物含量和总硫含量有显著性影响(P<0.05),具体原因需要进一步的研究分析。
表2 不同美极梅奇酵母与商业酿酒酵母F33顺序发酵玫瑰香葡萄原酒的理化指标
Table 2 Physicochemical indexes of Muscat wines sequential fermentation by different Metschnikowia pulcherrima and commercial Saccharomyces cerevisiae F33

注:同行肩不同小写字母表示差异显著(P<0.05)。
2.2.2 玫瑰香葡萄原酒挥发性成分的分析
采用GC-MS从玫瑰香葡萄原酒中共检测到55种挥发性香气物质,包括酯类22种,醇类7种,酸类11种,醛类4种,萜烯类11种,结果见表3和图2。
酯类物质可以为葡萄酒带来令人愉悦的花香和果香,是葡萄酒香气的重要组成部分[19]。由表3和图2可知,F33酒样中酯类物质种类最为丰富,共检测到16种,总含量为21 122.8 μg/L。M.pulcherrima与商业酿酒酵母F33顺序发酵玫瑰香葡萄原酒中酯类物质种类和含量明显不同于商业酿酒酵母F33单菌发酵。Mp17/F33酒样中共检测到9种,远低于F33酒样,但总含量(28 557.5 μg/L)却高于F33单菌发酵,主要表现为正己酸乙酯、甲酸香草酯、癸酸乙酯、月桂酸乙酯和棕榈酸乙酯含量的增加。然而,Mp08/F33和Mp04/F33酒样中酯类物质的种类和含量均远低于F33和Mp17/F33酒样。这与VARELA C等[13]提出的酿酒酵母与美极梅奇酵母混合发酵导致乙酯类物质减少的结论相似。以上结果说明,不同M.pulcherrima菌株对玫瑰香葡萄原酒酯类物质的影响不同,分析原因可能是不同M.pulcherrima菌株细胞内酯类物质合成相关关键酶活性具有差异。

图2 不同美极梅奇酵母与商业酿酒酵母F33顺序发酵玫瑰香葡萄原酒挥发性成分差异分析热图
Fig.2 Differences analysis heat map of volatile components of Muscat wines with sequential fermentation by different Metschnikowia pulcherrima and commercial Saccharomyces cerevisiae F33
表3 不同美极梅奇酵母与商业酿酒酵母F33顺序发酵葡萄原酒挥发性成分GC-MS分析结果
Table 3 GC-MS analysis results of volatile compounds of Muscat wines with sequential fermentation by different Metschnikowia pulcherrima and commercial Saccharomyces cerevisiae F33
续表

注:“-”表示未检出。
F33酒样中醇类物质的种类和总含量均高于M.pul cherrima与商业酿酒酵母F33顺序发酵的玫瑰香葡萄原酒。不同M.pulcherrima菌株对玫瑰香葡萄原酒中酸类物质种类和含量的影响不同。与F33酒样相比,Mp17/F33酒样中酸类物质含量增加212.08%,而Mp04/F33和Mp08/F33酒样酸类物质含量则有所降低。醛类感官阈值较低,风味特征明显,也是葡萄酒香气的重要组成部分[19]。结果发现,M.pulcherrima与商业酿酒酵母F33顺序发酵降低了醛类物质的种类及含量。不同M.pulcherrima菌株与商业酿酒酵母F33顺序发酵的玫瑰香葡萄原酒中的萜烯类物质种类和含量不同。其中M.pulcherrim Mp08增加了萜烯类物质含量。香叶醇、橙花醇、α-松油醇和玫瑰醚仅在Mp08/F33酒样中检测到,这几种物质是玫瑰香葡萄的重要品种香气物质[20]。由此可见,M.pulcherrim Mp08与商业酿酒酵母F33顺序发酵可促进以上萜烯类物质的合成和释放,有利于突出玫瑰香葡萄酒的品种香气。
萜烯类为玫瑰香类葡萄特征性香气物质[28],因此,对不同玫瑰香葡萄原酒样品中的萜烯类物质和含量进行聚类分析,并绘制热图,结果见图3。
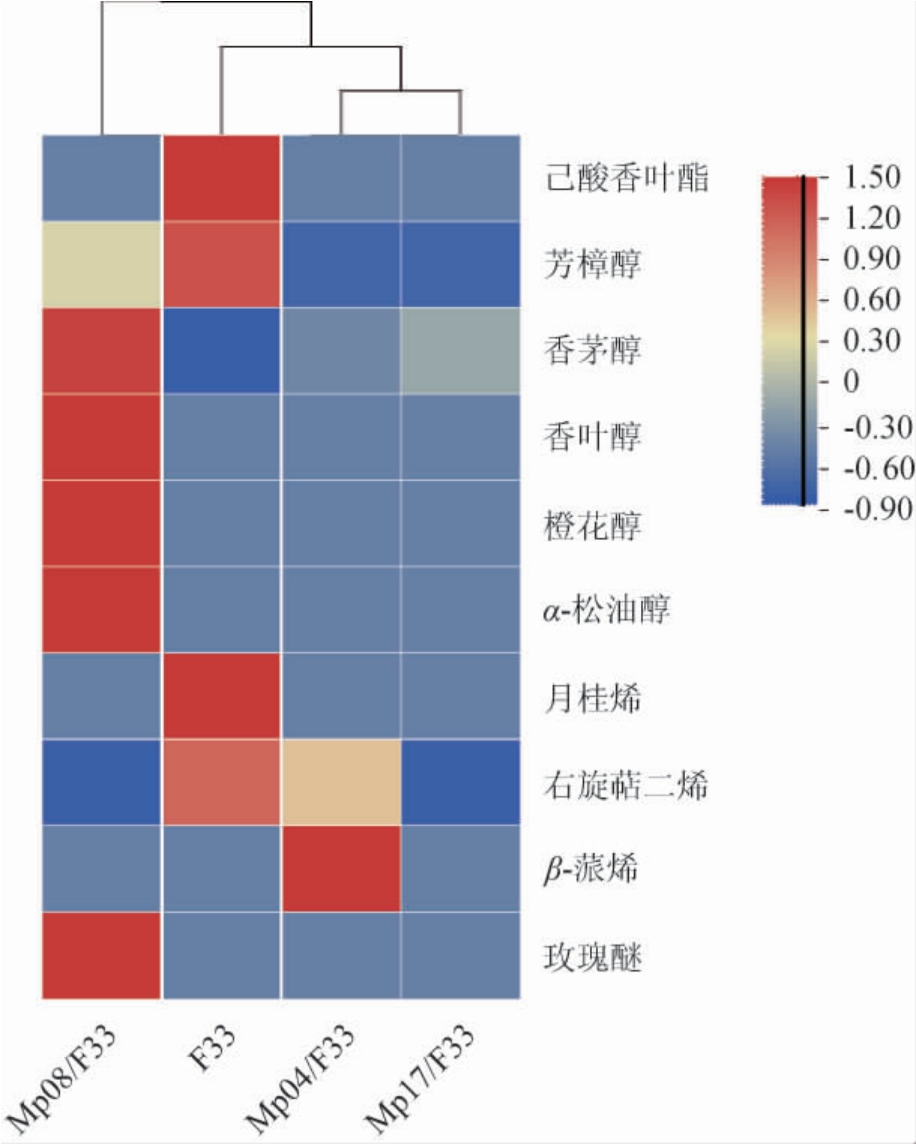
图3 不同美极梅奇酵母与商业酿酒酵母F33顺序发酵玫瑰香葡萄原酒中萜烯类物质的差异分析热图
Fig.3 Differences analysis heat map of terpenoid components of Muscat wines with sequential fermentation by different Metschnikowia pulcherrima and commercial Saccharomyces cerevisiae F33
由图3可知,不同玫瑰香葡萄原酒样品聚为3类:Mp08/F33和F33酒样分别单独聚为一类,Mp04/F33和Mp17/F33酒样聚为一类。Mp08/F33酒样中的萜烯类物质总含量最高(11 468.9 μg/L),较F33酒样增加113.07%,表现出优良的增香潜力。Mp04/F33和Mp17/F33酒样聚为一类,与F33和Mp08/F33酒样距离较远,萜烯类物质种类和含量远不及F33和Mp08/F33酒样。
为进一步分析不同M.pulcherrima与商业酿酒酵母F33顺序发酵玫瑰香葡萄原酒在香气物质组成上的差异,对气味活度值(odor activity value,OAV)>0.1的16种香气物质进行主成分分析,结果见图4。
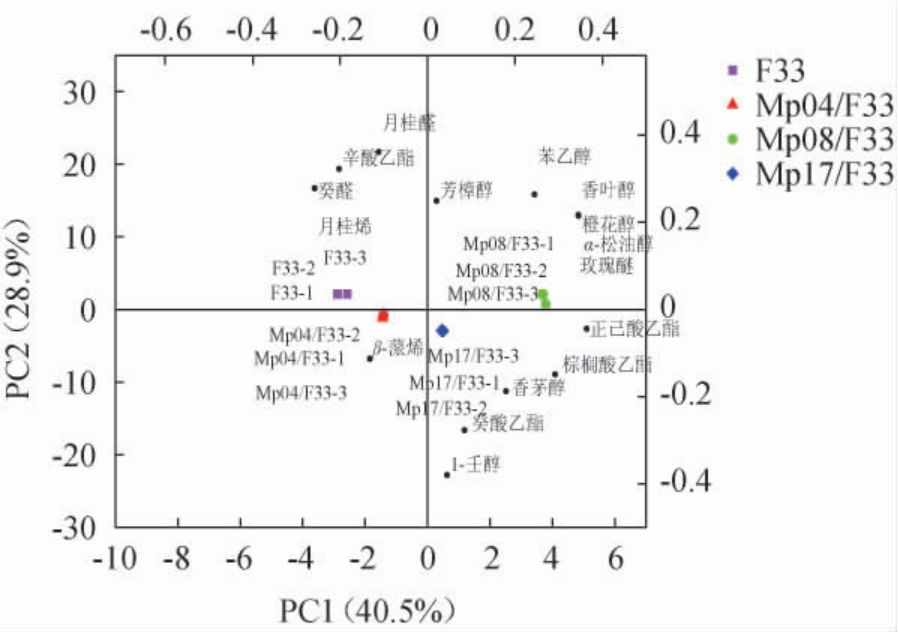
图4 OAV>0.1的不同美极梅奇酵母与商业酿酒酵母F33顺序发酵玫瑰香葡萄原酒香气物质主成分分析结果
Fig.4 Principal compounds analysis results of aroma compounds(OAV>0.1) in Muscat wines with sequential fermentation by different Metschnikowia pulcherrima and commercial Saccharomyces cerevisiae F33
由图4可知,PC1和PC2的方差贡献率分别为40.5%和28.9%,累计方差贡献率为69.4%,说明两个主成分基本反应原数据的全部变异。4种玫瑰香葡萄原酒被完全区分开,说明不同M.pulcherrima对葡萄原酒的香气成分影响不同,其中萜烯类物质占绝大多数,该类物质也被认为是品种香气的主要成分[27-28]。Mp08/F33酒样位于第一象限,标志性香气物质主要为芳樟醇、苯乙醇、香叶醇、橙花醇、α-松油醇和玫瑰醚。说明Mp08/F33顺序发酵的玫瑰香葡萄酒样品种特征显著。F33酒样位于第二象限,标志性香气物质主要为癸醛、辛酸乙酯、月桂烯和月桂醛。Mp04/F33酒样位于第三象限,标志性香气物质主要为β-蒎烯;Mp17/F33酒样位于第四象限,标志性香气物质主要为1-壬醇、香茅醇、癸酸乙酯、棕榈酸乙酯和正己酸乙酯。由此可见,M.pulcherrima对玫瑰香葡萄原酒香气物质的影响具有显著的菌株差异。
3 讨论
本研究考察了本土M.pulcherrima在玫瑰香葡萄酒降醇和增香方面的作用。结果发现,M.pulcherrima Mp04、Mp08和Mp17分别与商业酿酒酵母F33顺序发酵,乙醇含量比F33单菌发酵分别降低0.38%vol、1.26%vol和1.93%vol,降醇效果较好。这一结果与GARCÍA M等[29]的研究报道一致。目前,已有文献报道,M.pulcherrima降醇效果范围在0.9%vol~2.5%vol[30],绝大多数降醇效果<1.5%vol[29],少数能达到2.0%vol以上[31]。本试验中M.pulcherrima Mp08降醇效果达到1.26%vol,处于中等水平,在葡萄酒的降醇方面具有一定的应用潜力。研究表明,发酵条件对菌株的生长和代谢具有不同影响,例如酿酒酵母的菌种来源,发酵过程的溶氧或通风水平等[32]。因此,通过酿酒酵母的选择及相应混菌发酵条件的调控,将有望进一步提高Mp08的降醇效果。
本研究对比分析了M.pulcherrima Mp04、Mp17和Mp08与商业酿酒酵母F33顺序发酵对玫瑰香葡萄原酒香气物质的影响。结果发现,3株M.pulcherrima对葡萄酒香气物质的影响具有较大差异,在酯类、醇类、萜烯类等物质种类和含量方面具有不同影响。ZHANG B Q等[33]对不同M.pulcherrima顺序发酵对酯类物质影响的研究中,也得到了与本研究类似的结果。由此说明,菌株的差异可能是影响酯类物质合成的关键因素,可能与不同菌株细胞内酯类物质合成关键酶的活性的高低直接相关[34-35]。目前,有关M.pulcherrima与酿酒酵母混菌发酵对香气物质代谢的影响机制尚未明晰。因此,亟待开展相关研究,以便对M.pulcherrima混菌发酵对香气物质的合成进行精准调控。
本研究还发现,3株M.pulcherrima均可降低醇类物质尤其是高级醇的含量,这一结果与部分文献报道一致[14,36]。HRANILOVIC A等[31]的研究也得到了相似的结果。研究发现,发酵基质中的氮源对高级醇合成的影响可能起关键作用[37]。当发酵基质含有过多的M.pulcherrima偏好的氮源时,会导致相应高级醇含量的增加。同时,当基质中酵母可利用氮源含量为180~195 mg/L时,可生成适量的高级醇[38]。由此可见,M.pulcherrima与酿酒酵母的混菌发酵过程中,氮源的调控可能是实现高级醇精准调控的有效途径。
此外,结果表明,M.pulcherrima Mp08与商业酿酒酵母F33的顺序发酵能显著增加萜烯类物质的含量。萜烯类及硫醇类物质为葡萄酒的品种香气物质,该类物质在葡萄果实中多以结合态形式存在,葡萄酒发酵过程中产生的β-葡萄糖苷酶可以使其水解,从而释放可以呈香的游离态萜烯类物质,增加葡萄酒的品种香气[39-42]。由此说明,Mp08/F33酒样萜烯类物质的含量显著升高,不仅与其β-葡萄糖苷酶活性有关,可能也由Mp08具有优良的萜类物质合成能力所致。此外,在本试验中,Mp08/F33酒样中的苯乙醇含量也是最高的。苯乙醇可赋予葡萄酒玫瑰花香气,也是玫瑰香葡萄酒的特征香气物质之一,可为葡萄酒带来令人愉悦的淡雅、细腻而持久的玫瑰花香气[43]。同时,苯乙醇也是酵母交互作用中非常重要的群体感应信号分子之一[44-45],具有抗菌保鲜作用[46]。综上,虽然M.pulcherrima Mp08的降醇效果不是最好的,但M.pulcherrima Mp08表现出了较为突出的降醇和葡萄酒增香能力,该菌株可能在生产香气浓郁的低酒度葡萄酒产品中具有重要的应用价值。
4 结论
本研究通过比较不同本土M.pulcherrima单菌发酵玫瑰香葡萄汁发现,M.pulcherrima Mp04、Mp08和Mp17的糖发酵能力较强,降醇效果较好,与S.cerevisiae F33顺序接种发酵玫瑰香葡萄汁后,可使玫瑰香葡萄原酒中的乙醇含量分别降低0.38%vol、1.26%vol和1.93%vol。不同M.pulcherrima对挥发性物质、种类和含量影响不同。其中,M.pulcherrima Mp08与S.cerevisiae F33顺序发酵可使乙醇含量降低1.26%vol,苯乙醇含量增加165.49%,萜烯类物质总量增加113.07%,增加新的香气物质香叶醇、橙花醇、松油醇和玫瑰醚,含量分别为108.3 μg/L、4 166.7 μg/L、99.6 μg/L和4 927.5 μg/L。综上,M.pulcherrima Mp08具有较好的降醇效果和突出玫瑰香葡萄酒特征香气的能力,在酿造品种香气浓郁的低酒精度葡萄酒中具有重要的应用潜力。
[1]阎贺静,张鸣宇,孙康,等.野生酿酒酵母和葡萄汁有孢汉逊酵母混菌发酵对玫瑰香葡萄酒香气的影响[J].食品与发酵工业,2020,46(11):165-171.
[2]郑永丽,张军翔.低(无)醇葡萄酒研发进展[J].中国酿造,2021,40(7):12-16.
[3]JOHNSON E A.Biotechnology of non-Saccharomyces yeasts-the ascomycetes[J].Appl Microbiol Biotechnol,2013,97(17):7563-7577.
[4]ASSIS M O,SANTOS A P C,ROSA C A,et al.Impact of a non-Saccharomyces yeast isolated in the equatorial region in the acceptance of wine aroma[J].Food Nutr Sci,2014,5(9):759-769.
[5]CIANI M,COMITINI F,MANNAZZU I,et al.Controlled mixed culture fermentation:a new perspective on the use of non-Saccharomyces yeasts in winemaking[J].Fems Yeast Res,2010,10(2):123-133.
[6]MAGYAR I,TÓTH T.Comparative evaluation of some oenological properties in wine strains of Candida stellata, Candida zemplinina, Saccharomyces uvarum and Saccharomyces cerevisiae[J].Food Microbiol,2011,28(1):94-100.
[7]GONZALEZ R,QUIRÓS M,MORALES P.Yeast respiration of sugars by non-Saccharomyces yeast species: A promising and barely explored approach to lowering alcohol content of wines[J].Trends Food Sci Tech,2013,29(1):55-61.
[8]CIANI M,BECO L,COMITINI F.Fermentation behaviour and metabolic interactions of multistarter wine yeast fermentations[J].Int J Food Microbiol,2006,108(2):239-45.
[9]RÖCKER J,STRUB S,EBERT K,et al.Usage of different aerobic non-Saccharomyces yeasts and experimental conditions as a tool for reducing the potential ethanol content in wines[J].Eur Food Res Technol,2016,242:2051-2070.
[10]SADINENI V,KONDAPALLI N,OBULAM V S R.Effect of co-fermentation with Saccharomyces cerevisiae and Torulaspora delbrueckii or Metschnikowia pulcherrima on the aroma and sensory properties of mango wine[J].Ann Microbiol,2012,62(4):1353-1360.
[11]LANGENBERG A K,BINK F J,WOLFF L,et al.Glycolytic functions are conserved in the genome of the wine yeast Hanseniaspora uvarum,and pyruvate kinase limits its capacity for alcoholic fermentation[J].Appl Environ Microbiol,2017,83(22):e01580-17.
[12]MORATA A,LOIRA I,ESCOTT C,et al.Applications of Metschnikowia pulcherrima in wine biotechnology[J].Fermentation,2019,5(3):63.
[13]VARELA C,SENGLER F,SOLOMON M,et al.Volatile flavour profile of reduced alcohol wines fermented with the non-conventional yeast species Metschnikowia pulcherrima and Saccharomyces uvarum[J].Food Chem,2016,209:57-64.
[14]VARELA C,BARTEL C,ESPINASE N D,et al.Volatile aroma composition and sensory profile of Shiraz and Cabernet Sauvignon wines produced with novel Metschnikowia pulcherrima yeast starter cultures[J].Aust J Grape Wine Res,2021,27(3):406-418.
[15]杨华峰,曾新安,李坚,等.橡木桶微氧陈酿技术对葡萄酒品质的影响[J].食品工业,2019,40(7):160-163.
[16]杨宁,王伟明,姚琳,等.3,5-二硝基水杨酸法测定发酵型果露酒中总糖含量[J].中国酿造,2018,37(1):181-4.
[17]齐白羽,洪梦楠,陈誉文,等.优良本土戴尔有孢圆酵母的筛选及其在冰葡萄酒酿造中的应用[J].中国酿造,2021,40(10):118-122.
[18]张博钦,方梓庄,成池芳,等.5株低产乙醇的非酿酒酵母筛选及其酿造特性[J].食品科学,2021,42(8):114-121.
[19]PUŠKAŠ V S,MILJIC′ U D,DJURAN J J,et al.The aptitude of commercial yeast strains for lowering the ethanol content of wine[J].Food Sci Nutr,2020,8(3):1489-1498.
[20]BEATRIZ P,GIL J V,PALOMA M.Past and future of non-Saccharomyces yeasts:from spoilage microorganisms to biotechnological tools for improving wine aroma complexity[J].Front Microbiol,2016,7:411.
[21]曹有芳,刘丹,徐俊南,等.基于电子鼻和气相色谱-质谱联用技术分析不同品种苹果酒香气物质[J].中国酿造,2020,39(2):182-188.
[22]CHEN C J,XIA R,CHEN H,et al.TBtools,a toolkit for biologists integrating various HTS-data handling tools with a user-friendly interface[J].bioRxiv,2018:289660.
[23]MENCHER A,MORALES P,CURIEL J A,et al. Metschnikowia pulcherrima represses aerobic respiration in Saccharomyces cerevisiae suggesting a direct response to co-cultivation[J].Food Microbiol,2021,94:103670.
[24]GONZALEZ R,GUNINDAL A M,TRONCHONI J,et al.Biotechnological approaches to lowering the ethanol yield during wine fermentation[J].Biomolecules,2021,11(11):1569.
[25]SADOUDI M,ROUSSEAUX S,DAVID V,et al. Metschnikowia pulberrima influences the expression of genes involved in PDH bypass and glyceropyruvic fermentation in Saccharomyces cerevisiae[J].Front Microbiol,2017,8:1137.
[26]侯晓瑞,王婧,杨学山,等.甘肃河西走廊葡萄酒产区高产β-葡萄糖苷酶酵母菌株筛选[J].食品科学,2014,35(23):139-143.
[27]RUIZ J,BELDA I,BEISERT B,et al.Analytical impact of Metschnikowia pulcherrima in the volatile profile of Verdejo white wines[J].Appl Microbiol Biotechnol,2018,102(19):8501-8509.
[28]李华.葡萄的芳香物质[J].中外葡萄与葡萄酒,2001(6):43-44.
[29]GARCÍA M,ESTEVE-ZARZOSO B,CABELLOS J M,et al.Sequential non-Saccharomyces and Saccharomyces cerevisiae fermentations to reduce the alcohol content in wine[J].Fermentation,2020,6(2):60.
[30]APLIN J J,PAUP V D,ROSS C F,et al.Chemical and sensory profiles of merlot wines produced by sequential inoculation of Metschnikowia pulcherrima or Meyerzyma guilliermondii[J].Fermentation,2021,7(3):126.
[31]HRANILOVIC A,GAMBETTA J M,JEFFERY D W,et al.Lower-alcohol wines produced by Metschnikowia pulcherrima and Saccharomyces cerevisiae co-fermentations:The effect of sequential inoculation timing[J].Int J Food Microbiol,2020,329:108651.
[32]CANONICO L,COMITINI F,ORO L,et al.Sequential fermentation with selected immobilized non-Saccharomyces yeast for reduction of ethanol content in wine[J].Front Microbiol,2016,7:278.
[33]ZHANG B Q,SHEN J Y,DUAN C Q,et al.Use of indigenous Hanseniaspora vineae and Metschnikowia pulcherrima co-fermentation with Saccharomyces cerevisiae to improve the aroma diversity of Vidal Blanc icewine[J].Front Microbiol,2018,9:2303.
[34]VARELA C,BARKER A,TRAN T,et al.Sensory profile and volatile aroma composition of reduced alcohol Merlot wines fermented with Metschnikowia pulcherrima and Saccharomyces uvarum[J].Int J Food Microbiol,2017,252:1-9.
[35]ROSSOUW D,BAUER F F.Exploring the phenotypic space of non-Saccharomyces wine yeast biodiversity[J].Food Microbiol,2016,55:32-46.
[36]PARAPOULI M,HATZILOUKAS E,DRAINAS C,et al.The effect of Debina grapevine indigenous yeast strains of Metschnikowia and Saccharomyces on wine flavor[J].J Ind Microbiol Biotechnol,2010,37(1):85.
[37]赵新节,姜凯凯,孙玉霞,等.氮源对葡萄酒中挥发性化合物含量的影响研究[J].酿酒科技,2016(8):44-48.
[38]程军,秦伟帅,赵新节.葡萄酒酿造中高级醇的形成机制与调节[J].中国酿造,2011,30(12):9-11.
[39]李爱华,王凌云,粟俊,等.混合酵母发酵对刺葡萄酒香气成分气味活性的调整作用[J].食品科学,2020,41(6):72-78.
[40]GONZÁLEZ-POMBOP,PÉREZG,CARRAUF,etal.One-steppurification and characterization of an intracellular β-glucosidase from Metschnikowia pulcherrima[J].Biotechnol Lett,2008,30(8):1469-1475.
[41]BARBOSA C,LAGE P,ESTEVES M,et al.Molecular and phenotypic characterization of Metschnikowia pulcherrima strains from Douro Wine region[J].Fermentation,2018,4(1):8.
[42]高特.本土美极梅奇酵母混菌发酵分析及其对挥发性成分的影响[D].秦皇岛:河北科技师范学院,2022.
[43]刘品何,刘胜,秦伟帅,等.疏果方式对赤霞珠葡萄酒中挥发性物质的影响[J].酿酒科技,2014(10):32-36,40.
[44]AVBELJ M,ZUPAN J,KRANJC L,et al.Quorum-sensing kinetics in Saccharomyces cerevisiae: a symphony of ARO genes and aromatic alcohols[J].J Agr Food Chem,2015,63(38):8544-8550.
[45]AVBELJ M,ZUPAN J,RASPOR P.Quorum-sensing in yeast and its potential in wine making[J].Appl Microbiol Biotechnol,2016,100(18):7841-7852.
[46]杨晓,陈芳,李景明.植物中2-苯乙醇的合成研究进展[J].园艺学报,2010,37(10):1690-1694.