羊肚菌(Morchella)是一种珍稀食药用菌,富含氨基酸、多糖、矿质元素等多种营养成分,具有抗肿瘤、抗菌、保护心血管、增强免疫力等功效[1]。近年来,我国羊肚菌人工栽培技术取得重要进展,在“外营养袋”栽培模式引领下,我国易出菇羊肚菌品种,如梯棱羊肚菌(Morchella importuna)、六妹羊肚菌(Morchella sextelata)和七妹羊肚菌(Morchella eximia)的商业化栽培迅猛发展,栽培面积已超过8 000 hm2且仍在不断增加,然而在羊肚菌产业快速发展的同时,每年有50%~70%的种植者无法稳定盈利、重返贫困或负债[2-4]。其原因是,羊肚菌菌种不稳定、易老化退化(如异核体中交配型丢失、线粒体氧化功能衰退等)以及管理不当带来商业化栽培时产量不稳定(0~500 kg鲜菇/亩)是制约我国羊肚菌栽培成败的关键因素[5-7]。
羊肚菌是一种单极性异宗结合子囊菌,其菌丝细胞的细胞核数量在15~42个不等,其子囊孢子内含有18~32个细胞核,子囊孢子刚萌发芽管菌丝细胞也含有4~22个细胞核,无性孢子(暨分生孢子)大多单核,然而,在目前实验室条件下,无法诱导无性孢子稳定产生和有效萌发[8-10],这些情况不利于羊肚菌遗传育种工作的深入开展。植物原生质体技术在食药用菌遗传育种中的应用显示出独特优势,如实验室易于操作、试验周期短、不受子实体栽培季节限制、可以进行单交配型菌株或单核体的快速分离、诱变、杂交及细胞融合等。利用原生质体技术分离交配型及单核体的分析研究,在担子菌类食药用菌中研究较多,如应用原生质体单核化技术分别分离到香菇(Lentinus edodes)[11-13]、大球盖菇(Stropharia rugosoannulata)[14]、斑玉蕈(Hypsizygus marmoreus)[15-16]、金针菇(Flammulina velutipes)[17]、猴头菇(Hericium erinaceus)[18]等不同食药用菌的单交配型菌株,并开展了不同交配型单核体的生理生化差异性、遗传诱变和杂交育种等分析研究;而子囊菌类食药用菌中利用原生质体技术进行交配型及同核体分离的研究报道较少,刘伟等[19]利用原生质体单细胞技术可分离到梯棱羊肚菌(M.importuna)的单交配型同核体,目前还未见采用原生质体技术对六妹羊肚菌交配型(mating type,MAT)进行分离的研究报道。
本研究对六妹羊肚菌(M.sextelata)原生质体进行制备及再生,且对分离后的原生质体再生菌株的交配型进行分子生物学鉴定,并对其交配型稳定性进行验证试验,以期实现羊肚菌交配型的有效分离,对六妹羊肚菌的遗传育种具有重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与引物
栽培种分离的六妹羊肚菌(Morchella sextelata):河南省微生物工程重点实验室分离、保存。交配型基因的上游引物(P6-1F、P8-4F)及下游引物(P6-1R、P8-4R)参照文献[20]的序列,由华大基因公司提供合成服务。其中引物对P6-1F/P6-1R用于检测交配型MAT1-2-1基因,引物对P8-4F/P8-4R用于扩增交配型MAT1-1-1基因。
1.1.2 试剂
琼脂糖、葡萄糖、蔗糖、胰蛋白胨、酵母提取物(粉)(均为生化试剂):天津市致远化学试剂有限公司;溶壁酶(18 000 U/g):广东省微生物所;纤维素酶(7 000 U/g)、蜗牛酶(破壁率90%)、亚硝基胍(nitrosoguanidine,NTG)、4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)、GenSTAR Stain RED核酸染料:北京康润诚业生物科技有限公司;2×ES Taq Master Mix试剂盒:北京天根生化科技有限公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)Marker:上海莱枫生物科技有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
完全酵母提取物培养基(complete yeast extract medium,CYM)(CYM再生培养基):葡萄糖2%、蛋白胨0.2%、酵母粉0.1%、硫酸镁0.05%、磷酸二氢钾0.046%、磷酸氢二钾0.1%、琼脂1.5%(液体培养基不添加)、0.6 mol/L甘露醇(再生培养基中添加)、蒸馏水配制,pH值自然,121 ℃高压蒸汽灭菌20 min。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:土豆200 g,切片、煮沸10 min,3~4层纱布过滤取滤液,加入葡萄糖2%、琼脂1.5%,蒸馏水配制,pH值自然,121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
SW-CJ-2D型双人净化工作台:上海沪净净化设备有限公司;TCYQ型全温摇瓶柜:太仓市豪诚实验仪器制造有限公司;DDY-6C型电泳仪:北京市六一仪器厂;Chemi DocTM XRS+化学发光凝胶成像系统:美国BIO-RAD公司;MIKRO 22R离心机:德国Hettich公司;MULTIFUGE X1R离心机:美国Thermo scientific 公司;Tpersonal聚合酶链式反应(polymerase chain reaction,PCR)仪:法国Biometra公司;UV8C18/2HJ型紫外诱变箱:北京赛百奥科技有限公司;BMXSP-10CA显微镜:上海彼爱姆公司;ZEISS Axio Imager M2型全电动正置荧光显微镜:德国ZEISS公司。
1.3 方法
1.3.1 原生质体的制备
(1)CYM液态培养法
将六妹羊肚菌等菌株接种于置有玻璃纸(直径8.5~9.0 cm)的CYM平板上,24 ℃倒置培养72 h,长刀片刮下转接于CYM液体培养基中,24 ℃静置培养3~4 d,过滤收集幼嫩菌丝体,用无菌水、甘露醇洗涤4次;加入混合酶液中(2%溶壁酶+1%纤维素酶+1%蜗牛酶,0.22 μm滤膜过滤灭菌),于30 ℃、60 r/min条件下酶解2.5~3.5 h,酶解后的原生质体粗酶液通过G2烧结玻璃漏斗过滤分离原生质体和菌丝片段,原生质体滤液用0.6 mol/L甘露醇进行离心(4 000 r/min、10 min)、洗涤和浓缩(重复2~3次,离心前在离心管中预先加入60%蔗糖垫在离心管底部),得到纯净的原生质体浓缩液,采用血球计数板对酶解液和浓缩液中的原生质体进行计数。
(2)玻璃纸CYM平板培养法
挑取六妹羊肚菌等菌株2块,接种于置有玻璃纸(直径8.5~9.0 cm)的CYM平板上,24 ℃倒置培养72 h,长刀片刮下幼嫩菌丝,采用上述方法制备原生质体浓缩液。
1.3.2 原生质体的再生
原生质体浓缩液用0.6 mol/L甘露醇适当稀释后取100~200 μL涂布于CYM再生培养基平板进行再生培养,或对涂布于CYM再生培养基平板上的原生质体进行紫外线(ultraviolet,UV)诱变后再进行再生培养(紫外诱变条件:18 W紫外灯、距离32 cm、照射30 s,红光灯下操作);再生培养条件:CYM再生培养基平板正立静置30 min后封口膜封口、24 ℃倒置培养65~120 h,采用血球计数板进行原生质体计数,观察原生质体的再生情况并计算回收率及再生率,其计算公式如下:

1.3.3 原生质体再生菌株的分离及其交配型的鉴定
(1)原生质体再生菌株的分离
小心挑取CYM再生培养基平板上出现的单菌落至PDA培养基斜面上,编号后置于24 ℃生化培养箱中培养7~14 d,或对经紫外诱变(原生质体稀释溶液于18 W紫外灯下距离32 cm处照射30 s)原生质体再生单菌落进行编号,并将单菌落接种于PDA培养基斜面进行培养后,于4~12 ℃冰箱保藏。
(2)原生质体再生菌株的交配型鉴定
取斜面保藏菌株的少量菌丝于2 mL离心管内,加入300 μL细胞壁裂解液[1%十二烷基磺酸钠(sodium dodecyl sulfate,SDS)、2%乙酸锂]、少量玻璃珠,研磨2~3 min,75 ℃水浴20min,取上清100μL,加入无水乙醇300μL,12000r/min离心5 min,弃去上清液,沉淀加入400μL体积分数70%乙醇,12000r/min离心5min,弃去上清液,DNA沉淀风干20min;风干后的DNA用50 μL双蒸水(ddH2O)溶解、振荡悬浮,作为DNA模板,进行PCR扩增。
PCR扩增体系(15 μL):2×ES Taq Master Mix 7.5 μL,P8-4F/P8-4R引物对或P6-1F/P6-1R引物对(10 μmol/L)各0.5 μL,DNA模板1 μL,双蒸水(ddH2O)5.5 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸120 s,共35个循环;72 ℃再延伸5 min。PCR扩增产物的电泳:1.0%琼脂糖凝胶加热溶解,然后加入1 μL核酸染料,倒入电泳胶槽,凝固后进行点样和电泳检测,其条件为:130 V、160 A,20~25 min。
1.3.4 再生菌株的交配型稳定性验证
在完成原生质体再生菌株的分离和交配型鉴定的基础上,选取代表性的单交配型再生菌株(UV-31、UV-42和3PK-65)和双交配型再生菌株(6M2P-24),按照1.3.1的方法再次进行菌丝体培养、原生质体制备、浓缩,经理化诱变后对其“第二代”原生质体再生菌株进行分离及其交配型鉴定;期间开展紫外线辐照诱变和亚硝基胍化学诱变,其中原生质体的紫外线诱变处理:紫外灯功率18 W、照射距离32 cm、照射时间30 s;原生质体的亚硝基胍诱变方法:液体培养48 h的菌丝体中加入0.25 mg/mL亚硝基胍,诱变处理30 min(室温、间歇摇动),诱变后用无菌水洗涤4次;G2漏斗过滤收集菌丝体,0.6 mol/L甘露醇洗涤2次,挤去液体,菌丝体块转入50 mL三角瓶中,加入混合酶液进行原生质体制备、浓缩、再生等操作。
1.3.5 细胞核的荧光染色
制备的六妹羊肚菌原生质体及其再生菌丝体用质量浓度4 μg/mL的DAPI染料进行细胞核染色,室温下避光染色10~15 min,立刻进行显微观察(激发波长365 nm,发射波长420~470 nm)。
2 结果与分析
2.1 六妹羊肚菌原生质体的制备和再生
六妹羊肚菌原生质体浓度达(0.6~4.5)×105个/mL(CYM液体法)或(2.2~4.5)×106个/mL(玻璃纸CYM平板法),原生质体直径在2~6 μm之间;其中CYM液体法制备的原生质体回收率(60%~80%)和再生率(0.15%~9.00%)明显高于玻璃纸CYM平板法(5%~20%和0.05%~0.16%);可见六妹羊肚菌原生质体的酶解和再生参数与前人报道粗柄羊肚菌、尖顶羊肚菌等子囊菌、香菇、平菇、金针菇等担子菌的酶解条件基本一致,但产量偏低[21-25];同时实验发现,六妹羊肚菌液体培养法制备的原生质体在回收率、再生率等方面更有利于后续的遗传育种研究工作。
2.2 六妹羊肚菌原生质体再生菌株的分离及其交配型的鉴定
本实验共分离获得200余株六妹羊肚菌的原生质体再生单菌落,从中获得有效生长菌株182株,对菌株的交配型进行PCR鉴定,鉴定结果见表1。
表1 六妹羊肚菌原生质体再生菌株的交配型PCR鉴定结果
Table 1 PCR identification results of mating types of regenerated strains from protoplast of Morchella sextelata

注:“UV-”表示原生质体紫外线诱变实验中分离得到的再生菌株;“+”表示扩增出条带,“-”表示没有扩增出条带;“(微)”表示该再生菌落微小。
由表1可知,182株菌株中MAT1-1-1单交配型菌株共63株,占比34.62%;MAT1-2-1单交配型菌株共45株,占比24.73%;同时含有MAT1-2-1和MAT1-2-1两种交配型的双交配型菌株共66株,占比36.26%;同时还有8株未能扩增出交配型基因的“双阴性”菌落,占比4.40%,可能是菌株老化引起的细胞核自溶(观察到“双阴性”菌落大部分为产深褐色色素的菌株),具体原因有待进一步实验。
传统的羊肚菌单交配型同核体的获取多采用子囊果组织分离或毛细管显微操作的方法,如刘伟等[27]采用组织分离法从多个羊肚菌子囊果中分离到单一交配型基因的同核体菌株,并发现其子囊果组织中存在交配型缺失现象(交配型缺失比例达43.96%)。刘萍等[28]采取毛细管单孢分离法从多种羊肚菌子囊果中分离到子囊孢子单交配型及双交配型单孢菌株,并通过单孢菌株对峙培养实验发现羊肚菌中存在性亲和但营养体不亲和的现象。本实验研究证实,通过原生质体单核化的方法能有效实现羊肚菌交配型的分离。代表性的六妹羊肚菌原生质体再生菌落的交配型PCR检测的电泳结果见图1。
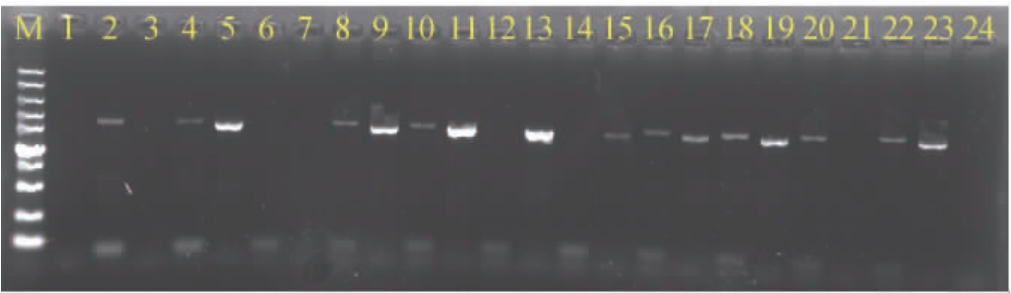
图1 六妹羊肚菌再生菌株交配型的PCR检测结果
Fig.1 PCR testing results of mating type of regenerated strains of Morchella sextelata
图中M为DNA Marker,泳道1和2为同一菌株的两组引物的PCR扩增产物,泳道3和4为第二个菌株的两组引物的PCR扩增产物,泳道5和6为第三个菌株的两组引物的PCR扩增产物,…依次类推。同一菌株的左侧泳道为P6-1F/P6-1R引物的扩增产物(MAT1-2-1交配型),右侧泳道为P8-4F/P8-4R引物的扩增产物(MAT1-1-1交配型)。
由图1可知,泳道1和2、3和4、7和8、21和22代表的4个菌株(UV-84、UV-85、UV-87和UV-5)只有P8-4F/P8-4R引物对扩增出条带,为MAT1-1-1单交配型菌株,泳道5和6、11和12、13和14、23和24代表的4个菌株(UV-86、UV-89、UV-90和UV-7)只有P6-1F/P6-1R引物对扩增出条带,为MAT1-2-1单交配型菌株,而泳道9和10、15和16、17和18、19和20代表的4个菌株(UV-88、UV-91、UV-92和UV-4)P6-1F/P6-1R、P8-4F/P8-4R两组引物对都扩增出条带,为交配型MAT1-1-1/MAT1-2-1的双极性菌株(异核体)。
2.3 原生质体再生菌株的交配型稳定性验证
本实验进一步测试了六妹羊肚菌原生质体再生菌落的交配型的稳定性,六妹羊肚菌原生质体再生菌株的“第二代”再生菌落的交配型的PCR检测结果见表2。
表2 六妹羊肚菌原生质体的“第二代”再生菌株交配型的PCR检测结果
Table 2 PCR testing results of mating types of "second generation"regenerated strains from protoplast of Morchella sextelata

注:“+”表示扩增出条带,“-”表示没有扩增出条带;“UV31-”、“UV42-”表示MAT1-1-1交配型菌株UV31、UV42 的F2原生质体再生菌株(期间经紫外线诱变处理);“3PK65-”表示MAT1-2-1交配型菌株3PK65的F2原生质体再生菌株;“6M2P245G-”表示双交配型菌株6M2P-24的F2原生质体再生菌株(期间经NTG诱变处理)。
由表2可知,六妹羊肚菌的“同核体”再生菌丝体,再次经过原生质体化过程、紫外线(UV)、亚硝基胍(NTG)等处理(诱变结果数据未列出),其交配型没有改变或丢失,与亲本菌株的交配型一致(其中六妹羊肚菌UV31系列19株,UV42系列10株的交配型均稳定表现为MAT1-1-1,六妹羊肚菌3PK65系列22株的交配型稳定表现为MAT1-2-1);同时由表2可知,六妹羊肚菌原生质体双极性再生菌株(6M2P245G系列,异核体)的“第二代”原生质体再生菌落中再次发生了两种交配型分离的现象。
2.4 六妹羊肚菌原生质体细胞核的染色观察
六妹羊肚菌原生质体中细胞核的显微观察见图2。
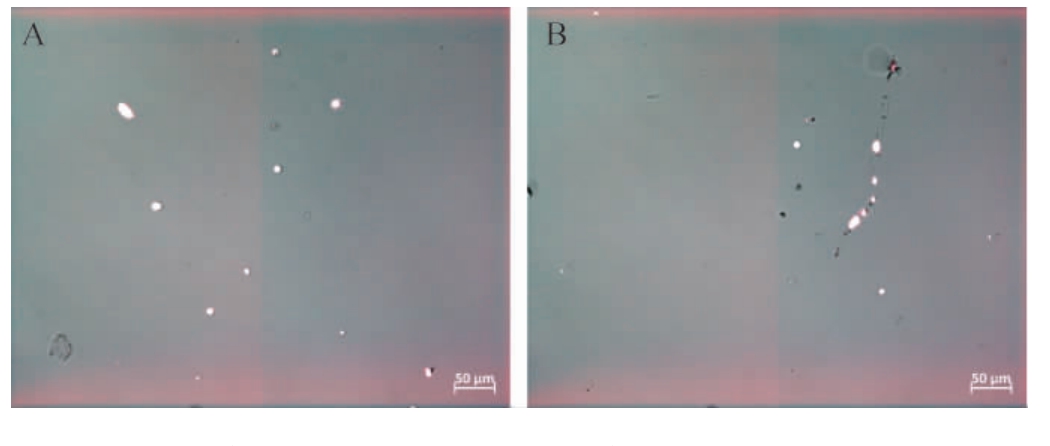
图2 六妹羊肚菌原生质体中细胞核的显微镜观察结果
Fig.2 Microscopic observation results of nuclei in protoplasts of Morchella sextelata
A为DAPI染色的原生质体;B为DAPI染色的原生质体及幼嫩菌丝。
由图2A可知,六妹羊肚菌原生质体形成过程中,每个原生质体细胞包裹的细胞核数量比菌丝细胞大幅减少,只有1个细胞核充盈整个原生质体,或少量的含有0~3个细胞核;由图2B可知,六妹羊肚菌的幼嫩菌丝或尖端菌丝细胞中细胞核是多核的。本实验对六妹羊肚菌的原生质体细胞核染色观察佐证了原生质体方法分离羊肚菌单核菌丝体或单交配型菌株的可行性。
3 结论
本研究对六妹羊肚菌原生质体再生菌株的交配型分离及稳定性情况进行了较为系统的分析研究,共获得182株有效生长菌株,妹羊肚菌原生质体再生菌株中MAT1-1-1交配型菌株达34.62%,MAT1-2-1交配型菌株24.73%,单交配型菌株比例近60%(59.35%);而且单交配型菌株经过理化诱变处理(紫外线、亚硝基胍等)的处理,交配型与亲本一致,具有很强的遗传稳定性。细胞核染色实验也证实六妹羊肚菌原生质体中只含有0~3个细胞核,这种单核或少核状态的原生质体十分有利于后续的羊肚菌单一背景遗传材料如交配型的获取、遗传诱变以及亲和性分析等研究。
[1]孙巧弟,张江萍,谢洋洋,等.羊肚菌营养素、功能成分和保健功能研究进展[J].食品科学,2019,40(5):323-328.
[2]谭方河.阐释我国羊肚菌外营养袋栽培技术的发展历程[J].食药用菌,2019,27(4):257-263.
[3]杜习慧,赵琪,杨祝良.羊肚菌的多样性、演化历史及栽培研究进展[J].菌物学报,2014,33(2):183-197.
[4]赵琪.我国羊肚菌产业发展现状、前景及建议[J].食药用菌,2018,26(3):148-151.
[5]刘伟,蔡英丽,何培新,等.羊肚菌组织分离物交配型基因缺失现象分析[J].食用菌学报,2020,27(3):1-6.
[6]刘璐,邓百万,兰阿峰,等.羊肚菌菌种退化机理研究[J].食品研究与开发,2020,41(10):57-61.
[7]刘伟,何培新,蔡英丽,等.羊肚菌衰老特征的测定分析[J].食药用菌,2021,29(1):44-49.
[8]刘伟,蔡英丽,何培新,等.粗腿羊肚菌子囊孢子萌发过程及其细胞核行为[J].食用菌学报,2017,24(1):18-20.
[8]刘伟,蔡英丽,何培新,等.梯棱羊肚菌无性孢子形态及其显微结构观察[J].菌物研究,2016,14(3):157-161.
[10]石建森,郭明慧,陈淑霞.尖顶羊肚茵菌丝、分生孢子及原基显微观察与分析[J].山西农业科学,2019,47(4):577-579,601.
[11]孙佳星,杨红,孙晓东,等.基于响应面法对香菇原生质体制备条件的优化[J].菌物学报,2022,41(5):837-846.
[12]刘娜,张敏,宋莹,等.香菇原生质体杂交后代的遗传分析[J].江苏农业科学,2018,46(17):106-109.
[13]宋莹,刘俊杰,张敏,等.采用原生质体单核体杂交技术创新香菇种质资源[J].北方园艺,2017(19):165-169.
[14]YAN P S,JIANG J H,CUI W S,et al.Characterization of protoplasts prepared from the edible fungus, Stropharia rugoso-annulata[J].World J Microbiol Biotechnol,2004,20:173-177.
[15]潘越,陈辉,冯志勇,等.斑玉蕈不同交配型的原生质体单核菌株差异分析[J].生物技术通报,2014(9):131-135.
[16]马丽娟,李晓玲,鲍大鹏,等.斑玉蕈交配型位点结构及其多态性分析[J].食用菌学报,2022,29(2):23-30.
[17]王波,祁丽萍,贾定洪,等.金针菇菌株单核原生质体交配型与菌丝生长分析[J].西南农业学报,2012,25(4):1407-1413.
[18]张琪,刘宏伟,陈娟,等.猴头菌原生质体制备及单核体鉴定研究[J].中国医药生物技术,2015(2):113-118.
[19]刘伟,张倩倩,舒芳,等.梯棱羊肚菌全基因组SNP/lndel分析及基于Indel标记的遗传连锁图谱构建[J].菌物学报,2019,8(12):2195-2204.
[20]贺国强.梯棱羊肚菌单孢分离、交配型基因鉴定及其菌丝融合杂交研究[J].中国种业,2021(2):58-62.
[21]王珂.羊肚菌菌核发育形态、IMV检测及原生质体融合技术研究[D].郑州:郑州轻工业大学,2019.
[22]刘士旺,毛建卫,尤玉如,等.粗柄羊肚菌原生质体制备和再生条件研究[J].中国酿造,2008,27(15):16-18.
[23]刘士旺,楼坚,柳永.一种羊肚菌原生质体的制备方法:CN201811404287.9[P].2019-03-15.
[24]努尔孜亚·亚力买买提,罗影,郝敬喆,等.新疆野生阿魏菇原生质体的再生与单核菌株交配型测定[J].新疆农业科学,2022,59(5):1245-1251.
[25]努尔孜亚·亚力买买提,赵梦然,罗影,等.平菇原生质体单核化菌株的制备及其培养特征分析[J].新疆农业科学,2019,56(4):731-739.
[26]陈鹏,郭成金.金针菇原生质体制备和再生探究[J].江苏农业科学,2014(9):200-204.
[27]刘伟,蔡英丽,何培新,等.梯棱羊肚菌单孢及杂交群体的栽培出菇试验和极性分析[J].菌物研究,2019,17(4):43-49.
[28]刘萍,马渊浩,赵永昌,等.羊肚茵单孢菌株的性亲和与营养体亲和特性[J].食用菌学报,2021,28(1):40-47.